1.1 物质的分类及转化 同步练习题(含解析)高一上学期人教版(2019)化学必修第一册
文档属性
| 名称 | 1.1 物质的分类及转化 同步练习题(含解析)高一上学期人教版(2019)化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 344.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 06:56:35 | ||
图片预览



文档简介
1.1 物质的分类及转化 同步练习题
一、选择题
1.当光束通过下列物质时,会出现丁达尔效应的是
A.水 B.云、雾 C.酒精 D.饱和溶液
2.下列关于胶体的认识中,错误的是
A.胶体在一定条件下可以稳定存在
B.实验室可用丁达尔效应区分胶体和溶液
C.NaCl溶液和淀粉胶体中的分散质粒子都能透过滤纸
D.能传播新冠病毒的气溶胶中分散质粒子直径小于
3.广东省海洋资源丰富。下列有关说法正确的是
A.海底石油经裂化和裂解可得不饱和烃 B.海带等藻类植物中富含
C.潮汐能属于生物质资源 D.“海水晒盐”时主要发生化学变化
4.下列物质的分类组合不正确的有
①海水、空气、胆矾、盐酸均为混合物;
②、、、均为酸;
③、NaOH、、、均为碱;
④干冰、过氧乙酸()、、均为氧化物;
⑤、AgCl、、均为盐;
⑥、、纯碱既为钠盐,同时又为含氧酸盐
A.①③④⑥ B.①③④ C.①②③⑤⑥ D.①③
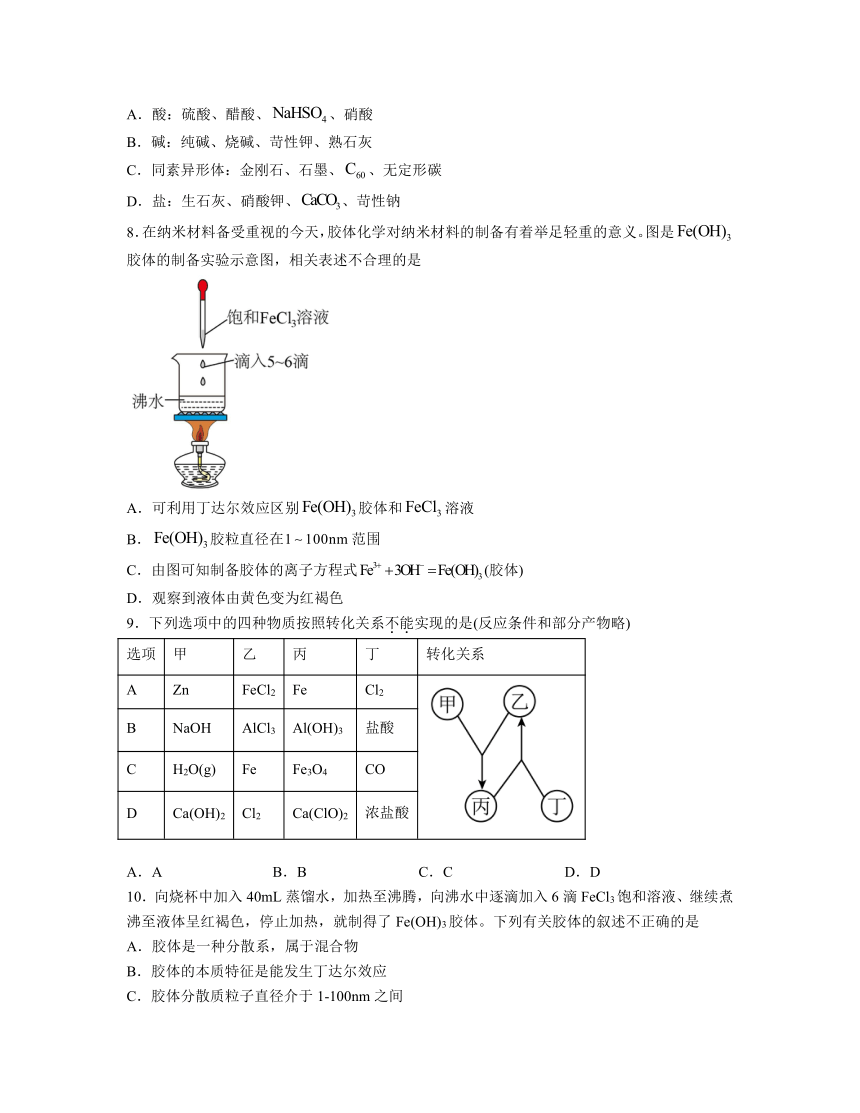
5.下列实验装置或操作正确的是
A.图1取用药品 B.图2处理废弃硫酸
C.图3检查气密性 D.图4滴加液体
6.下列物质所属的类别不正确的是
A.Na2CO3——盐 B.N2——单质 C.HClO——氧化物 D.H3PO4——含氧酸
7.将下列各组物质分类正确的是
A.酸:硫酸、醋酸、、硝酸
B.碱:纯碱、烧碱、苛性钾、熟石灰
C.同素异形体:金刚石、石墨、、无定形碳
D.盐:生石灰、硝酸钾、、苛性钠
8.在纳米材料备受重视的今天,胶体化学对纳米材料的制备有着举足轻重的意义。图是胶体的制备实验示意图,相关表述不合理的是
A.可利用丁达尔效应区别胶体和溶液
B.胶粒直径在范围
C.由图可知制备胶体的离子方程式(胶体)
D.观察到液体由黄色变为红褐色
9.下列选项中的四种物质按照转化关系不能实现的是(反应条件和部分产物略)
选项 甲 乙 丙 丁 转化关系
A Zn FeCl2 Fe Cl2
B NaOH AlCl3 Al(OH)3 盐酸
C H2O(g) Fe Fe3O4 CO
D Ca(OH)2 Cl2 Ca(ClO)2 浓盐酸
A.A B.B C.C D.D
10.向烧杯中加入40mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液、继续煮沸至液体呈红褐色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于1-100nm之间
D.利用丁达尔效应是区分胶体和溶液的一种常用方法
11.证据推理是化学学科核心素养的重要内容,下列说法正确的是
A.化合物由不同元素组成,因此含有不同种元素的物质一定是化合物
B.氢氧混合气体点燃会有爆炸声,因此点燃有爆鸣声现象的气体一定含有氢气
C.金刚石、石墨、足球烯(C60)都是由碳元素组成的单质,因此它们的性质相同
D.铜在空气中久置后表面生成铜绿(Cu2(OH)2CO3),说明铜的锈蚀和水、空气有关,这与铁的锈蚀原理相似
12.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化物有关
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
13.分类是认识和研究物质的一种常用的科学方法,下列有关物质的分类,正确的是
选项 类别 物质
A 纯净物 液氯、胆矾、漂白粉
B 合金 不锈钢、石墨、硬铝
C 碱性氧化物 Al2O3、Na2O2、Fe2O3
D 胶体 豆浆、雾、有色玻璃
A.A B.B C.C D.D
14.现有锌、四氧化三铁、碳酸钠和石灰石四种固体,小明参照二歧分类法制作了一个物质检索表。下列叙述不正确的是
1a只含种物质……21b含有多种物质……甲 2a只含一种元素……乙 2b含有多种元素……3 3a▲……丙 3b白色固体……丁
A.甲表示的是石灰石
B.乙表示的是锌
C.表中“▲”应该表示为“红色固体”
D.也可根据是否属于氧化物对丙、丁分类
15.图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是
甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO CuO C
D Cu CuCl2 Zn HCl
A.A B.B C.C D.D
二、填空题
16.无机化合物可根据其组成和性质进行分类:
(1)上述所示的物质分类方法名称是_______。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl② _______ ③ _______④Ba(OH)2 ⑤ Na2CO3⑥ _______ ⑦ CO2⑧ Na2O ⑨NH3⑩ H2O
(3)写出⑦转化为⑤的化学方程式:_______。
(4)写出①与③反应的离子方程式:_______。
17.请回答下列关于胶体的有关问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制备Fe(OH)3胶体的化学方程式为:_____。
(2)已知 Fe(OH)3胶粒和Al(OH)3胶粒带正电荷,H2SiO3胶粒带负电荷,则:
①Fe(OH)3胶体和H2SiO3胶体混合的现象是_____。
②已知Al(OH)3胶体能够净水,则Fe(OH)3胶体_____(填“能”或“不能”)净水。
(3)下列描述的分别是胶体的性质或现象,请按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔效应
①“卤水点豆腐,一物降一物”,这里说到的是豆腐的制作,利用的胶体性质是_____(填字母,下同)。
②工厂采用高压静电除尘,利用的胶体性质是_____。
③拍照时,清晨或者大雨过后拍到“耶稣光”的概率比较高_____。
(4)是否能用渗析的方法除尽Fe(OH)3胶体中的Cl-?若能。请设计实验证明:若不能,请说明理由。___________。
18.胶体粒子的大小在_______之间,鉴别溶液和胶体的主要方法为观察混合物是否具有_______效应。实验室制取Fe(OH)3胶体的方法是:取一个小烧杯加入25ml蒸馏水并加热到沸腾,向其加入5~6滴_______溶液,继续_______至溶液呈红褐色,停止加热,即制得Fe(OH)3胶体。
三、元素或物质推断题
19.物质的分类是化学研究的重要方法之一,根据物质的分类回答下列问题。
(1)将碳酸钙、稀盐酸、铁、氧气四种物质名称填写道下面的适当位置。
①_______,②_______,③_______,④_______。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:___________。
②化合反应:___________。
③置换反应:___________。
④复分解反应:___________。
四、实验题
20.将少量饱和溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和溶液滴加到冷水中;乙:饱和溶液滴加到溶液中;
丙:饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
(1)以上三种操作得到的分散系中,分散质粒子直径最大的是_______(填甲、乙、丙),名称是_______,乙中实验现象是:_______。
(2)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为_______。
(3)判断丙中成功制备胶体的操作方法是_______(描述操作过程)。
(4)可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入溶液,若_______(填实验现象),则说明该胶体中的杂质离子已经完全除去。
【参考答案】
一、选择题
1.B
解析:A.水是纯净物不是胶体,不具有丁达尔效应,A不符合题意;
B.雾是胶体,具有丁达尔效,B符合题意;
C.酒精为溶液,不是胶体,不具有丁达尔效应,C不符合题意;
D.饱和溶液属于溶液,不存在丁达尔效应,D不符合题意;
答案选B。
2.D
解析:A.胶体具有介稳性,胶粒所带的电性相同,相互间会发生排斥作用,所以胶体在一定条件下可以稳定存在,A正确;
B.胶体对光能产生散射作用,而溶液中的离子和分子不能,实验室可用丁达尔效应区分胶体和溶液,B正确;
C.NaCl溶液和淀粉胶体中的分散质粒子直径都小于滤纸的孔隙直径,它们都能透过滤纸,C正确;
D.能传播新冠病毒的气溶胶中分散质粒子直径大于1nm,小于100nm,D错误;
故选D。
3.A
解析:A.石油经裂化和裂解可以得到不饱和烃,故A正确;
B.海带、紫菜等海藻类植物中含有丰富的碘元素,不是碘单质,故B错误;
C.潮汐能是指海水周期性涨落运动中所具有的能量,其水位差表现为势能,其潮流的速度表现为动能,不属于生物质资源,故C错误;
D.海水晒盐是通过阳光和风力使水分蒸发,属于混合物的分离,没有新物质生成,属于物理变化,故D错误;
故选A。
4.B
解析:①胆矾只含有一种物质,属于纯净物,故①错误;
②、、、在水溶液中电离生成的阳离子全部是氢离子,均为酸,故②正确;
③电离产生金属阳离子和酸根阴离子,属于盐,故③错误;
④干冰是固体二氧化碳,CO2、、均由两种元素组成,其中一种为氧元素,均属于氧化物,过氧乙酸()三种元素组成,不是氧化物,故④错误;
⑤、AgCl、、都是金属阳离子和酸根阴离子构成的化合物,均属于盐,故⑤正确;
⑥、、纯碱均含有钠离子,属于钠盐,阴离子都是含氧酸根,均为含氧酸盐,故⑥正确;
故答案选B。
5.A
解析:A.氯化钠为粉末状,取用时应用药匙,瓶塞应倒放,故A正确;
B.废弃硫酸不能倒入下水道,应倒入专用指定容器中,故B错误;
C.不应选用长颈漏斗,故C错误;
D.向试管中滴加液体,胶头滴管不能伸入到试管中,应在试管口竖直上方,故D错误;
答案为A。
6.C
解析:A.Na2CO3是碳酸钠的化学式,属于盐,选项A正确;
B.N2为氮气的化学式,属于单质,选项B正确;
C.氧化物由两种元素组成,其中一种元素是氧元素的化合物,HClO属于酸类物质,不属于氧化物,选项C不正确;
D.H3PO4为磷酸的化学式,属于酸类物质,选项D正确;
答案选C。
7.C
解析:A.是盐不是酸,故A错误;
B.纯碱是碳酸钠,纯碱是盐不是碱,故B错误;
C.金刚石、石墨、、无定形碳是碳元素组成的不同单质,互为同素异形体,故C正确;
D.生石灰是氧化钙,属于氧化物;苛性钠是氢氧化钠,属于碱,故D错误;
选C。
8.C
解析:A.丁达尔效应可以区分胶体和溶液,A正确;
B.胶粒的分散质粒子直径在范围,B正确;
C.制备胶体的离子方程式,C错误;
D.溶液由黄色变为红褐色,立即停止加热即可制得氢氧化铁胶体,D正确;
故选C。
9.A
解析:A.丙与丁生成乙,Fe与Cl2生成FeCl3,不是,故A错误;
B.NaOH与AlCl3生成Al(OH)3,Al(OH)3与盐酸反应生成AlCl3,符合转化图,故B正确;
C.H2O(g)和Fe生成Fe3O4,Fe3O4被CO还原生成Fe,符合转化图,故C正确;
D.Ca(OH)2与Cl2溶液反应生成Ca(ClO)2,Ca(ClO)2与浓盐酸发生氧化还原反应,生成Cl2,符合上述转化图,故D正确;
故答案为A。
10.B
解析:A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9-10-7m之间,C正确;
D.丁达尔效应是胶体的特性,可用于区分胶体和溶液,D正确;
故选B。
11.D
解析:A.化合物是由不同种元素组成的纯净物,含有不同种元素的物质不一定是化合物,可能是混合物,如都有氢元素和氧元素形成的过氧化氢与水混合得到的是混合物,故A错误;
B.氢气和氧气混合气体点燃会有爆炸声,一氧化碳和氧气混合气体点燃也会有爆炸声,所以点燃有爆鸣声现象的气体不一定含有氢气,故B错误;
C.结构决定性质,金刚石、石墨、足球烯的结构不同,性质不同,故C错误;
D.由元素守恒可知,铜在空气中久置后表面生成铜绿说明铜的锈蚀与水和空气中氧气、二氧化碳有关,所以在空气中久置后表面生成铜绿与铁的锈蚀原理相似,故D正确;
故选D。
12.D
解析:A.雾霾中含有部分微粒直径在胶粒范围之内,故汽车车灯照出通路的现象属于丁达尔现象,A正确;
B.燃煤中加入生石灰可以使燃烧产生的二氧化硫转化为硫酸钙,减少二氧化硫的排放,B正确;
C.以一氧化氮和二氧化氮为主的氮氧化物是形成“光化学烟雾”“硝酸型酸雨”的形成的一个重要原因,C正确;
D.PM2.5是直径小于或等于2.5um的污染物颗粒,即粒子直径<2.5×10-6m,胶体是粒子大小介于10-9-10-7m,不完全属于胶体粒子的直径范围,D错误;
故选D。
13.D
解析:A.漂白粉主要成分是次氯酸钙和氯化钙,属于混合物,不是纯净物,故A错误;
B.石墨是由碳元素形成的单质,不属于合金,故B错误;
C.Al2O3是两性氧化物,Na2O2是过氧化物,不是碱性氧化物,故C错误;
D.豆浆是液溶胶、雾是气溶胶、有色玻璃是固溶胶,都属于胶体,故D正确;
答案选D。
14.C
解析:A.甲中含有多种物质,为混合物,四种固体中只有石灰石属于混合物,故A正确;
B.乙中只含有一-种元素,锌中只含有一种元素,故B正确;
C.丙和丁中含有多种元素,丁是白色固体,四氧化三铁、碳酸钠中含有多种元素,碳酸钠是白色固体,四氧化三铁是黑色固体,所以表中“▲”应该表示为“黑色固体”,故C错误;
D.氧化物只含两种元素,其中一种为氧元素,四氧化三铁是由两种元素组成的,且其中一种元素是氧元素,属于氧化物,碳酸钠中虽然含有氧元素,但它是由三种元素组成的,不属于氧化物,因此可根据是否属于氧化物对丙、丁分类,故D正确;
故选C。
15.C
解析:A.浓硫酸与氯化钠固体在加热条件下反应生成硫酸钠和HCl,但硫酸与硫酸钠、硫酸钠与氢氧化钠、氢氧化钠与氯化钠均不反应,故A不符合;
B.HCl与KOH发生中和反应,但不能与KCl反应,且KCl与K2CO3不反应,KOH与K2CO3不反应,故B不符合;
C.氧气与CO反应生成二氧化碳,CO还原CuO生成Cu和水,CuO和C加热反应生成Cu和二氧化碳,C与少量氧气反应生成CO,可实现图中转化,故C符合;
D.Zn与CuCl2反应置换出Cu,与HCl反应置换出氢气,但Cu与CuCl2、HCl均不反应,故D不符合;
故选C。
二、填空题
16.(1)树状分类法
(2) H2SO4或HNO3 NaOH、KOH或NH3H2O NaNO3、Na2SO4、KNO3、K2SO4(任写一种,其他合理也可以)
(3)CO2+Na2O= Na2CO3
(4)H++OH-=H2O或H++NH3H2O=H2O+NH
解析:(1)交叉分类法含义:根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法含义:对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法,故答案为:树状分类法;
(2)以Na、K、H、O、S、N中任两种或三种元素组成的酸有:H2SO4、HNO3,碱有:NaOH、KOH、NH3H2O,盐有:NaNO3、KNO3、Na2SO4、K2SO4、NH4NO3,故答案为:H2SO4 或HNO3;NaOH、KOH或NH3H2O;NaNO3、Na2SO4 (任写一种,其他合理也可以);
(3)CO2和Na2O反应生成碳酸钠,化学方程式为:CO2+Na2O= Na2CO3;
(4)HCl与NaOH或KOH反应的离子方程式为:H++OH-=H2O,HCl与NH3H2O反应的离子方程式为:H++NH3H2O=H2O+NH,故答案为:H++OH-=H2O或H++NH3H2O=H2O+NH。
17.(1)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2) 有沉淀生成 能
(3) A B C
(4)将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,便可除尽Fe(OH)3胶体中的Cl-。
解析:(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,FeCl3与水发生复分解反应,生成Fe(OH)3胶体和盐酸,反应的化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。答案为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(2)①Fe(OH)3胶粒带正电荷,H2SiO3胶粒带负电荷,Fe(OH)3胶体和H2SiO3胶体混合时,将发生电性的中和,从而使胶体发生凝聚,产生沉淀;②Al(OH)3胶体能够净水,是因为具有比较大的表面积,而Fe(OH)3胶体的表面积也较大,所以也能净水。答案为:有沉淀生成;能;
(3)①卤水中电解质电离产生的离子,能中和豆浆蛋白质的电性,使豆浆中的蛋白质胶体发生聚沉,从而制得豆腐;②工厂采用高压静电除尘,是利用高压电使矿尘胶体发生电泳的性质,将矿尘聚集到一起,从而进行去除;③清晨或者大雨过后,空气中充满水雾,能产生丁达尔效应,所以拍到“耶稣光”的概率比较高。答案为:A;B;C;
(4)胶粒的直径大于半透膜孔隙直径,而Cl-的直径小于半透膜孔隙直径,所以Fe(OH)3胶粒不能透过半透膜,Cl-可以透过半透膜,做渗析实验,即:将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,可除尽Fe(OH)3胶体中的Cl-。答案为:将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,便可除尽Fe(OH)3胶体中的Cl-。
18. 1~100nm 丁达尔 饱和氯化铁 煮沸
解析:胶体粒子的大小在1~100nm之间,丁达尔效应为胶体独有的特性,鉴别溶液和胶体的主要方法为观察混合物是否具有丁达尔效应。实验室制取Fe(OH)3胶体的原理为三价铁离子水解生成氢氧化铁胶体,方法是:取一个小烧杯加入25ml蒸馏水并加热到沸腾,向其加入5~6滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热,即制得Fe(OH)3胶体。
三、元素或物质推断题
19.(1) 碳酸钙 铁 氧气 稀盐酸
(2) CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑
解析:(1)(1)在题目已知的物质中,碳酸钙仅有一种微粒构成,是纯净物,由于由Ca、C、O三种元素组成,因此碳酸钙属于化合物;
Fe、O2仅有一种元素组成,属于单质,其中铁为金属单质,氧气是非金属单质;稀盐酸是HCl的水溶液,属于混合物,所以①是碳酸钙,②是铁,③是氧气,④是稀盐酸。
(2)①CaCO3在高温下分解产生CaO和CO2,反应方程式为:CaCO3 CaO+CO2↑,反应的基本类型是分解反应;
②Fe与O2在点燃时反应产生Fe3O4,反应方程式为:3Fe+2O2Fe3O4,反应的基本类型是化合反应;
③Fe与稀盐酸反应产生FeCl2和H2,反应方程式为:Fe+2HCl=FeCl2+H2↑,反应的基本类型为置换反应;
④CaCO3与HCl在溶液中发生反应产生CaCl2、H2O、CO2,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,反应类型是复分解反应。
四、实验题
20.(1) 乙 悬浊液 生成红褐色沉淀
(2)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3)用一束光照射所得的液体,从侧面观察分散系中有一条光亮的“通路”出现,就证明产生了胶体
(4)无白色沉淀生成
解析:(1)甲中饱和氯化铁溶液滴加到冷水中形成溶液;乙中饱和FeCl3溶液滴加到NaOH溶液中生成红褐色的氢氧化铁沉淀,为悬浊液;丙中饱和氯化铁溶液加到沸水中会形成胶体。三种分散系里,浊液的分散质粒子直径大于100nm,胶体中的胶粒直径在1nm~100nm,溶液中溶质微粒直径小于1nm,所以分散质粒子直径最大的是乙,得到的分散系为悬浊液,现象是生成红褐色沉淀。
(2)将氯化铁饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体为氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(3)胶体能够产生丁达尔效应,所以用最简单的方法判断丙中是否成功制备胶体的操作是:用一束光照射所得的液体,从侧面观察分散系中有一条光亮的“通路”出现,就证明产生了胶体。
(4)氢氧化铁胶体中混有Cl-,半透明允许溶液中的粒子通过,胶体粒子不能通过。取少量烧杯中的液体,向其中加入AgNO3溶液,若不产生白色沉淀,说明最后一次溶液中无Cl-,说明该Fe(OH)3胶体中的杂质离子已经完全除去。
一、选择题
1.当光束通过下列物质时,会出现丁达尔效应的是
A.水 B.云、雾 C.酒精 D.饱和溶液
2.下列关于胶体的认识中,错误的是
A.胶体在一定条件下可以稳定存在
B.实验室可用丁达尔效应区分胶体和溶液
C.NaCl溶液和淀粉胶体中的分散质粒子都能透过滤纸
D.能传播新冠病毒的气溶胶中分散质粒子直径小于
3.广东省海洋资源丰富。下列有关说法正确的是
A.海底石油经裂化和裂解可得不饱和烃 B.海带等藻类植物中富含
C.潮汐能属于生物质资源 D.“海水晒盐”时主要发生化学变化
4.下列物质的分类组合不正确的有
①海水、空气、胆矾、盐酸均为混合物;
②、、、均为酸;
③、NaOH、、、均为碱;
④干冰、过氧乙酸()、、均为氧化物;
⑤、AgCl、、均为盐;
⑥、、纯碱既为钠盐,同时又为含氧酸盐
A.①③④⑥ B.①③④ C.①②③⑤⑥ D.①③
5.下列实验装置或操作正确的是
A.图1取用药品 B.图2处理废弃硫酸
C.图3检查气密性 D.图4滴加液体
6.下列物质所属的类别不正确的是
A.Na2CO3——盐 B.N2——单质 C.HClO——氧化物 D.H3PO4——含氧酸
7.将下列各组物质分类正确的是
A.酸:硫酸、醋酸、、硝酸
B.碱:纯碱、烧碱、苛性钾、熟石灰
C.同素异形体:金刚石、石墨、、无定形碳
D.盐:生石灰、硝酸钾、、苛性钠
8.在纳米材料备受重视的今天,胶体化学对纳米材料的制备有着举足轻重的意义。图是胶体的制备实验示意图,相关表述不合理的是
A.可利用丁达尔效应区别胶体和溶液
B.胶粒直径在范围
C.由图可知制备胶体的离子方程式(胶体)
D.观察到液体由黄色变为红褐色
9.下列选项中的四种物质按照转化关系不能实现的是(反应条件和部分产物略)
选项 甲 乙 丙 丁 转化关系
A Zn FeCl2 Fe Cl2
B NaOH AlCl3 Al(OH)3 盐酸
C H2O(g) Fe Fe3O4 CO
D Ca(OH)2 Cl2 Ca(ClO)2 浓盐酸
A.A B.B C.C D.D
10.向烧杯中加入40mL蒸馏水,加热至沸腾,向沸水中逐滴加入6滴FeCl3饱和溶液、继续煮沸至液体呈红褐色,停止加热,就制得了Fe(OH)3胶体。下列有关胶体的叙述不正确的是
A.胶体是一种分散系,属于混合物
B.胶体的本质特征是能发生丁达尔效应
C.胶体分散质粒子直径介于1-100nm之间
D.利用丁达尔效应是区分胶体和溶液的一种常用方法
11.证据推理是化学学科核心素养的重要内容,下列说法正确的是
A.化合物由不同元素组成,因此含有不同种元素的物质一定是化合物
B.氢氧混合气体点燃会有爆炸声,因此点燃有爆鸣声现象的气体一定含有氢气
C.金刚石、石墨、足球烯(C60)都是由碳元素组成的单质,因此它们的性质相同
D.铜在空气中久置后表面生成铜绿(Cu2(OH)2CO3),说明铜的锈蚀和水、空气有关,这与铁的锈蚀原理相似
12.空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾的主要组成。以下说法不正确的是
A.雾霾天,汽车车灯照出“通路”的现象属于丁达尔效应
B.燃煤中加入生石灰可减少二氧化硫的排放
C.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化物有关
D.PM2.5是直径小于或等于2.5微米的污染物颗粒,完全属于胶体粒子的直径范围
13.分类是认识和研究物质的一种常用的科学方法,下列有关物质的分类,正确的是
选项 类别 物质
A 纯净物 液氯、胆矾、漂白粉
B 合金 不锈钢、石墨、硬铝
C 碱性氧化物 Al2O3、Na2O2、Fe2O3
D 胶体 豆浆、雾、有色玻璃
A.A B.B C.C D.D
14.现有锌、四氧化三铁、碳酸钠和石灰石四种固体,小明参照二歧分类法制作了一个物质检索表。下列叙述不正确的是
1a只含种物质……21b含有多种物质……甲 2a只含一种元素……乙 2b含有多种元素……3 3a▲……丙 3b白色固体……丁
A.甲表示的是石灰石
B.乙表示的是锌
C.表中“▲”应该表示为“红色固体”
D.也可根据是否属于氧化物对丙、丁分类
15.图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是
甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO CuO C
D Cu CuCl2 Zn HCl
A.A B.B C.C D.D
二、填空题
16.无机化合物可根据其组成和性质进行分类:
(1)上述所示的物质分类方法名称是_______。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl② _______ ③ _______④Ba(OH)2 ⑤ Na2CO3⑥ _______ ⑦ CO2⑧ Na2O ⑨NH3⑩ H2O
(3)写出⑦转化为⑤的化学方程式:_______。
(4)写出①与③反应的离子方程式:_______。
17.请回答下列关于胶体的有关问题
(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,制备Fe(OH)3胶体的化学方程式为:_____。
(2)已知 Fe(OH)3胶粒和Al(OH)3胶粒带正电荷,H2SiO3胶粒带负电荷,则:
①Fe(OH)3胶体和H2SiO3胶体混合的现象是_____。
②已知Al(OH)3胶体能够净水,则Fe(OH)3胶体_____(填“能”或“不能”)净水。
(3)下列描述的分别是胶体的性质或现象,请按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔效应
①“卤水点豆腐,一物降一物”,这里说到的是豆腐的制作,利用的胶体性质是_____(填字母,下同)。
②工厂采用高压静电除尘,利用的胶体性质是_____。
③拍照时,清晨或者大雨过后拍到“耶稣光”的概率比较高_____。
(4)是否能用渗析的方法除尽Fe(OH)3胶体中的Cl-?若能。请设计实验证明:若不能,请说明理由。___________。
18.胶体粒子的大小在_______之间,鉴别溶液和胶体的主要方法为观察混合物是否具有_______效应。实验室制取Fe(OH)3胶体的方法是:取一个小烧杯加入25ml蒸馏水并加热到沸腾,向其加入5~6滴_______溶液,继续_______至溶液呈红褐色,停止加热,即制得Fe(OH)3胶体。
三、元素或物质推断题
19.物质的分类是化学研究的重要方法之一,根据物质的分类回答下列问题。
(1)将碳酸钙、稀盐酸、铁、氧气四种物质名称填写道下面的适当位置。
①_______,②_______,③_______,④_______。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:___________。
②化合反应:___________。
③置换反应:___________。
④复分解反应:___________。
四、实验题
20.将少量饱和溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和溶液滴加到冷水中;乙:饱和溶液滴加到溶液中;
丙:饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
(1)以上三种操作得到的分散系中,分散质粒子直径最大的是_______(填甲、乙、丙),名称是_______,乙中实验现象是:_______。
(2)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为_______。
(3)判断丙中成功制备胶体的操作方法是_______(描述操作过程)。
(4)可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入溶液,若_______(填实验现象),则说明该胶体中的杂质离子已经完全除去。
【参考答案】
一、选择题
1.B
解析:A.水是纯净物不是胶体,不具有丁达尔效应,A不符合题意;
B.雾是胶体,具有丁达尔效,B符合题意;
C.酒精为溶液,不是胶体,不具有丁达尔效应,C不符合题意;
D.饱和溶液属于溶液,不存在丁达尔效应,D不符合题意;
答案选B。
2.D
解析:A.胶体具有介稳性,胶粒所带的电性相同,相互间会发生排斥作用,所以胶体在一定条件下可以稳定存在,A正确;
B.胶体对光能产生散射作用,而溶液中的离子和分子不能,实验室可用丁达尔效应区分胶体和溶液,B正确;
C.NaCl溶液和淀粉胶体中的分散质粒子直径都小于滤纸的孔隙直径,它们都能透过滤纸,C正确;
D.能传播新冠病毒的气溶胶中分散质粒子直径大于1nm,小于100nm,D错误;
故选D。
3.A
解析:A.石油经裂化和裂解可以得到不饱和烃,故A正确;
B.海带、紫菜等海藻类植物中含有丰富的碘元素,不是碘单质,故B错误;
C.潮汐能是指海水周期性涨落运动中所具有的能量,其水位差表现为势能,其潮流的速度表现为动能,不属于生物质资源,故C错误;
D.海水晒盐是通过阳光和风力使水分蒸发,属于混合物的分离,没有新物质生成,属于物理变化,故D错误;
故选A。
4.B
解析:①胆矾只含有一种物质,属于纯净物,故①错误;
②、、、在水溶液中电离生成的阳离子全部是氢离子,均为酸,故②正确;
③电离产生金属阳离子和酸根阴离子,属于盐,故③错误;
④干冰是固体二氧化碳,CO2、、均由两种元素组成,其中一种为氧元素,均属于氧化物,过氧乙酸()三种元素组成,不是氧化物,故④错误;
⑤、AgCl、、都是金属阳离子和酸根阴离子构成的化合物,均属于盐,故⑤正确;
⑥、、纯碱均含有钠离子,属于钠盐,阴离子都是含氧酸根,均为含氧酸盐,故⑥正确;
故答案选B。
5.A
解析:A.氯化钠为粉末状,取用时应用药匙,瓶塞应倒放,故A正确;
B.废弃硫酸不能倒入下水道,应倒入专用指定容器中,故B错误;
C.不应选用长颈漏斗,故C错误;
D.向试管中滴加液体,胶头滴管不能伸入到试管中,应在试管口竖直上方,故D错误;
答案为A。
6.C
解析:A.Na2CO3是碳酸钠的化学式,属于盐,选项A正确;
B.N2为氮气的化学式,属于单质,选项B正确;
C.氧化物由两种元素组成,其中一种元素是氧元素的化合物,HClO属于酸类物质,不属于氧化物,选项C不正确;
D.H3PO4为磷酸的化学式,属于酸类物质,选项D正确;
答案选C。
7.C
解析:A.是盐不是酸,故A错误;
B.纯碱是碳酸钠,纯碱是盐不是碱,故B错误;
C.金刚石、石墨、、无定形碳是碳元素组成的不同单质,互为同素异形体,故C正确;
D.生石灰是氧化钙,属于氧化物;苛性钠是氢氧化钠,属于碱,故D错误;
选C。
8.C
解析:A.丁达尔效应可以区分胶体和溶液,A正确;
B.胶粒的分散质粒子直径在范围,B正确;
C.制备胶体的离子方程式,C错误;
D.溶液由黄色变为红褐色,立即停止加热即可制得氢氧化铁胶体,D正确;
故选C。
9.A
解析:A.丙与丁生成乙,Fe与Cl2生成FeCl3,不是,故A错误;
B.NaOH与AlCl3生成Al(OH)3,Al(OH)3与盐酸反应生成AlCl3,符合转化图,故B正确;
C.H2O(g)和Fe生成Fe3O4,Fe3O4被CO还原生成Fe,符合转化图,故C正确;
D.Ca(OH)2与Cl2溶液反应生成Ca(ClO)2,Ca(ClO)2与浓盐酸发生氧化还原反应,生成Cl2,符合上述转化图,故D正确;
故答案为A。
10.B
解析:A.分散系由分散质和分散剂组成,胶体是一种分散系,属于混合物,A正确;
B.胶体的本质特征是胶体粒子直径在1-100nm之间,B错误;
C.胶体分散质粒子直径介于1-100nm之间,即10-9-10-7m之间,C正确;
D.丁达尔效应是胶体的特性,可用于区分胶体和溶液,D正确;
故选B。
11.D
解析:A.化合物是由不同种元素组成的纯净物,含有不同种元素的物质不一定是化合物,可能是混合物,如都有氢元素和氧元素形成的过氧化氢与水混合得到的是混合物,故A错误;
B.氢气和氧气混合气体点燃会有爆炸声,一氧化碳和氧气混合气体点燃也会有爆炸声,所以点燃有爆鸣声现象的气体不一定含有氢气,故B错误;
C.结构决定性质,金刚石、石墨、足球烯的结构不同,性质不同,故C错误;
D.由元素守恒可知,铜在空气中久置后表面生成铜绿说明铜的锈蚀与水和空气中氧气、二氧化碳有关,所以在空气中久置后表面生成铜绿与铁的锈蚀原理相似,故D正确;
故选D。
12.D
解析:A.雾霾中含有部分微粒直径在胶粒范围之内,故汽车车灯照出通路的现象属于丁达尔现象,A正确;
B.燃煤中加入生石灰可以使燃烧产生的二氧化硫转化为硫酸钙,减少二氧化硫的排放,B正确;
C.以一氧化氮和二氧化氮为主的氮氧化物是形成“光化学烟雾”“硝酸型酸雨”的形成的一个重要原因,C正确;
D.PM2.5是直径小于或等于2.5um的污染物颗粒,即粒子直径<2.5×10-6m,胶体是粒子大小介于10-9-10-7m,不完全属于胶体粒子的直径范围,D错误;
故选D。
13.D
解析:A.漂白粉主要成分是次氯酸钙和氯化钙,属于混合物,不是纯净物,故A错误;
B.石墨是由碳元素形成的单质,不属于合金,故B错误;
C.Al2O3是两性氧化物,Na2O2是过氧化物,不是碱性氧化物,故C错误;
D.豆浆是液溶胶、雾是气溶胶、有色玻璃是固溶胶,都属于胶体,故D正确;
答案选D。
14.C
解析:A.甲中含有多种物质,为混合物,四种固体中只有石灰石属于混合物,故A正确;
B.乙中只含有一-种元素,锌中只含有一种元素,故B正确;
C.丙和丁中含有多种元素,丁是白色固体,四氧化三铁、碳酸钠中含有多种元素,碳酸钠是白色固体,四氧化三铁是黑色固体,所以表中“▲”应该表示为“黑色固体”,故C错误;
D.氧化物只含两种元素,其中一种为氧元素,四氧化三铁是由两种元素组成的,且其中一种元素是氧元素,属于氧化物,碳酸钠中虽然含有氧元素,但它是由三种元素组成的,不属于氧化物,因此可根据是否属于氧化物对丙、丁分类,故D正确;
故选C。
15.C
解析:A.浓硫酸与氯化钠固体在加热条件下反应生成硫酸钠和HCl,但硫酸与硫酸钠、硫酸钠与氢氧化钠、氢氧化钠与氯化钠均不反应,故A不符合;
B.HCl与KOH发生中和反应,但不能与KCl反应,且KCl与K2CO3不反应,KOH与K2CO3不反应,故B不符合;
C.氧气与CO反应生成二氧化碳,CO还原CuO生成Cu和水,CuO和C加热反应生成Cu和二氧化碳,C与少量氧气反应生成CO,可实现图中转化,故C符合;
D.Zn与CuCl2反应置换出Cu,与HCl反应置换出氢气,但Cu与CuCl2、HCl均不反应,故D不符合;
故选C。
二、填空题
16.(1)树状分类法
(2) H2SO4或HNO3 NaOH、KOH或NH3H2O NaNO3、Na2SO4、KNO3、K2SO4(任写一种,其他合理也可以)
(3)CO2+Na2O= Na2CO3
(4)H++OH-=H2O或H++NH3H2O=H2O+NH
解析:(1)交叉分类法含义:根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法含义:对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法,故答案为:树状分类法;
(2)以Na、K、H、O、S、N中任两种或三种元素组成的酸有:H2SO4、HNO3,碱有:NaOH、KOH、NH3H2O,盐有:NaNO3、KNO3、Na2SO4、K2SO4、NH4NO3,故答案为:H2SO4 或HNO3;NaOH、KOH或NH3H2O;NaNO3、Na2SO4 (任写一种,其他合理也可以);
(3)CO2和Na2O反应生成碳酸钠,化学方程式为:CO2+Na2O= Na2CO3;
(4)HCl与NaOH或KOH反应的离子方程式为:H++OH-=H2O,HCl与NH3H2O反应的离子方程式为:H++NH3H2O=H2O+NH,故答案为:H++OH-=H2O或H++NH3H2O=H2O+NH。
17.(1)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2) 有沉淀生成 能
(3) A B C
(4)将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,便可除尽Fe(OH)3胶体中的Cl-。
解析:(1)向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,FeCl3与水发生复分解反应,生成Fe(OH)3胶体和盐酸,反应的化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。答案为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(2)①Fe(OH)3胶粒带正电荷,H2SiO3胶粒带负电荷,Fe(OH)3胶体和H2SiO3胶体混合时,将发生电性的中和,从而使胶体发生凝聚,产生沉淀;②Al(OH)3胶体能够净水,是因为具有比较大的表面积,而Fe(OH)3胶体的表面积也较大,所以也能净水。答案为:有沉淀生成;能;
(3)①卤水中电解质电离产生的离子,能中和豆浆蛋白质的电性,使豆浆中的蛋白质胶体发生聚沉,从而制得豆腐;②工厂采用高压静电除尘,是利用高压电使矿尘胶体发生电泳的性质,将矿尘聚集到一起,从而进行去除;③清晨或者大雨过后,空气中充满水雾,能产生丁达尔效应,所以拍到“耶稣光”的概率比较高。答案为:A;B;C;
(4)胶粒的直径大于半透膜孔隙直径,而Cl-的直径小于半透膜孔隙直径,所以Fe(OH)3胶粒不能透过半透膜,Cl-可以透过半透膜,做渗析实验,即:将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,可除尽Fe(OH)3胶体中的Cl-。答案为:将盛有含Cl-的Fe(OH)3胶体的半透膜袋放入盛有蒸馏水的烧杯中,一段时间后取出,重复操作2~3次,便可除尽Fe(OH)3胶体中的Cl-。
18. 1~100nm 丁达尔 饱和氯化铁 煮沸
解析:胶体粒子的大小在1~100nm之间,丁达尔效应为胶体独有的特性,鉴别溶液和胶体的主要方法为观察混合物是否具有丁达尔效应。实验室制取Fe(OH)3胶体的原理为三价铁离子水解生成氢氧化铁胶体,方法是:取一个小烧杯加入25ml蒸馏水并加热到沸腾,向其加入5~6滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,停止加热,即制得Fe(OH)3胶体。
三、元素或物质推断题
19.(1) 碳酸钙 铁 氧气 稀盐酸
(2) CaCO3 CaO+CO2↑ 3Fe+2O2Fe3O4 Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑
解析:(1)(1)在题目已知的物质中,碳酸钙仅有一种微粒构成,是纯净物,由于由Ca、C、O三种元素组成,因此碳酸钙属于化合物;
Fe、O2仅有一种元素组成,属于单质,其中铁为金属单质,氧气是非金属单质;稀盐酸是HCl的水溶液,属于混合物,所以①是碳酸钙,②是铁,③是氧气,④是稀盐酸。
(2)①CaCO3在高温下分解产生CaO和CO2,反应方程式为:CaCO3 CaO+CO2↑,反应的基本类型是分解反应;
②Fe与O2在点燃时反应产生Fe3O4,反应方程式为:3Fe+2O2Fe3O4,反应的基本类型是化合反应;
③Fe与稀盐酸反应产生FeCl2和H2,反应方程式为:Fe+2HCl=FeCl2+H2↑,反应的基本类型为置换反应;
④CaCO3与HCl在溶液中发生反应产生CaCl2、H2O、CO2,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,反应类型是复分解反应。
四、实验题
20.(1) 乙 悬浊液 生成红褐色沉淀
(2)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3)用一束光照射所得的液体,从侧面观察分散系中有一条光亮的“通路”出现,就证明产生了胶体
(4)无白色沉淀生成
解析:(1)甲中饱和氯化铁溶液滴加到冷水中形成溶液;乙中饱和FeCl3溶液滴加到NaOH溶液中生成红褐色的氢氧化铁沉淀,为悬浊液;丙中饱和氯化铁溶液加到沸水中会形成胶体。三种分散系里,浊液的分散质粒子直径大于100nm,胶体中的胶粒直径在1nm~100nm,溶液中溶质微粒直径小于1nm,所以分散质粒子直径最大的是乙,得到的分散系为悬浊液,现象是生成红褐色沉淀。
(2)将氯化铁饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体为氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(3)胶体能够产生丁达尔效应,所以用最简单的方法判断丙中是否成功制备胶体的操作是:用一束光照射所得的液体,从侧面观察分散系中有一条光亮的“通路”出现,就证明产生了胶体。
(4)氢氧化铁胶体中混有Cl-,半透明允许溶液中的粒子通过,胶体粒子不能通过。取少量烧杯中的液体,向其中加入AgNO3溶液,若不产生白色沉淀,说明最后一次溶液中无Cl-,说明该Fe(OH)3胶体中的杂质离子已经完全除去。
