2023年中考化学复习 主题六 题型突破第28讲 有关化学方程式的计算课件(共45张PPT)
文档属性
| 名称 | 2023年中考化学复习 主题六 题型突破第28讲 有关化学方程式的计算课件(共45张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 08:34:39 | ||
图片预览









文档简介
(共45张PPT)
主题六 题型突破
第28讲 有关化学方程式的计算
有关化学方程式的计算是中考必考题型。主要考查学生对化学方程式意义的正确理解、阅读提取信息和分析问题的能力。主要的知识点包括:化学方程式的书写、利用化学方程式计算的步骤、化学反应中纯净物质量的判断。根据题目呈现数据的方式,可分为:文字叙述型、表格数据型、图象型。一般思维方法如下:
第1步:读题。认真阅读题目中的每一部分,包括文字、表格、坐标图、实验过程图。
第2步:审题。找出关键词,正确书写出题中涉及的化学方程式,确定计算要用的化学方程式。
第3步:找出题中的待求物,并设其质量为x。
第4步:找出完全反应时,一种纯净物的质量。
第5步:按步骤解题,并注意解题格式的规范和计算的准确性。
类型1 文字叙述型
典例1:(2018.25)用煤直接作燃料,如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%。某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是多少?
解析:根据题意,本题计算涉及的化学反应是硫和氧气反应的化学方程式。利用煤的质量和煤中硫的质量分数可求出硫的质量,再通过化学方程式计算生成二氧化硫的质量。
32 64
8t x
x=16t
答:产生二氧化硫的质量为16t。
32 64
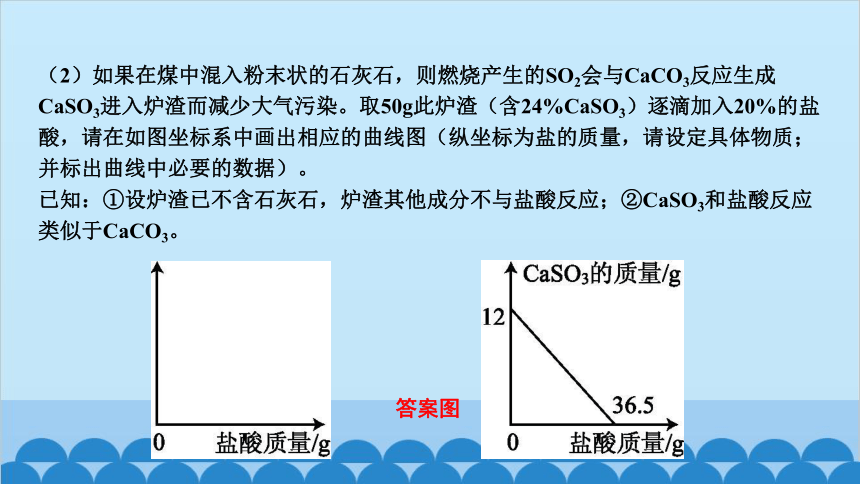
(2)如果在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在如图坐标系中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
已知:①设炉渣已不含石灰石,炉渣其他成分不与盐酸反应;②CaSO3和盐酸反应类似于CaCO3。
答案图
x=36.5g,y=11.1g
随着盐酸的加入,CaSO3的质量逐渐减小,最后变为0;CaCl2的质量逐渐增大,反应结束后不再变化。
最后在坐标系中画出图象,标出必要的数据(如图,合理即可)
变式训练
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)。
答:过氧化钙的纯度为96%。
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
答案图
(2)由上述计算可知,水的质量是36g,生成氧气的质量是32g,所以产生氧气的曲线图如答案图所示。
类型2 表格数据型
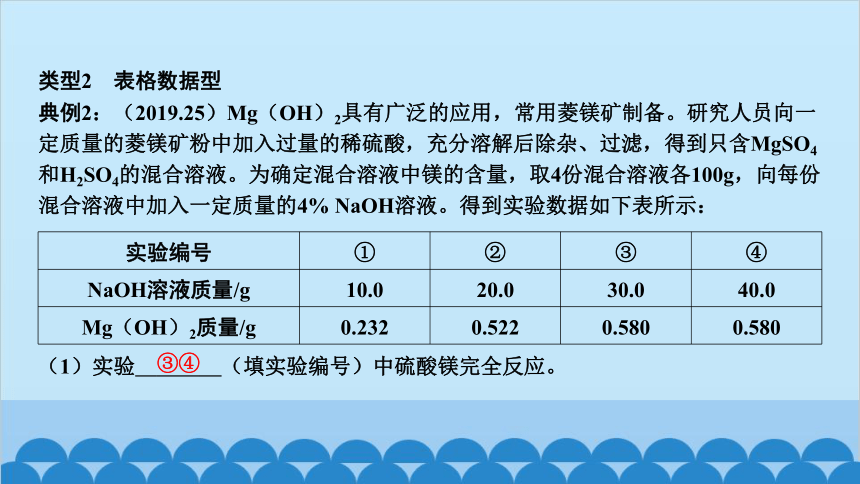
典例2:(2019.25)Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4% NaOH溶液。得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 ③④ (填实验编号)中硫酸镁完全反应。
③④
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
答案图
变式训练
变式2:(2021·潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的氯化钠杂质),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 m 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据m的值为 172.0 。
172.0
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
答案图
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
答:该食用碱样品中碳酸钠的质量分数为86.7%。
类型3 坐标图象型
典例3:(原创题)某化学兴趣小组取一定质量变质的Ca(OH)2(含杂质CaCO3)样品,滴入溶质质量分数为7.3%的稀盐酸,测得产生二氧化碳的质量与稀盐酸质量的关系如图所示。请回答下列问题:
(2)求图中m的值(写出计算过程)。
解析:(2)由图可知产生二氧化碳共消耗稀盐酸100 g,利用化学方程式可求出生成二氧化碳的质量,即是m的值。
100 g×7.3% m
答:m的值为4.4。
73 44
(3)样品的质量为 13.7 g。
解析:(3)样品包含氢氧化钙和碳酸钙。根据两步反应分别消耗的稀盐酸的质量可求出各自的量。
13.7
73 44
74 73
n 50 g×7.3%
n=3.7 g
即样品的质量为10 g+3.7 g=13.7 g
74 73
解: (3)根据(2)反应的数据可求出碳酸钙的质量为10 g。
设氢氧化钙的质量为n。
变式训练
变式3:(2022·南宁)往盛有4.0 g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图所示。请回答下列问题并计算:
(1)充分反应后,产生氢气的质量是 0.4 g 。
0.4 g
(2)刚开始滴加稀盐酸时,没有氢气放出的原因是 铝片的表面有一层致密的氧化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水 。
(3)该铝片中铝的质量分数(写出计算过程)。
铝片的表面有一层致密的氧
化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水
答:该铝片中铝的质量分数为90%。
54 6
x 0.4 g
x=3.6 g
该铝片中铝的质量分数为
类型4 实验—图象综合型
典例4:(2014.25)同学们做甲、乙两个中和反应实验的探究,如图所示:
(1)甲实验恰好中和,则该溶液中的溶质是 CaCl2 (填化学式)。
解析:(1)氢氧化钙与稀盐酸恰好完全反应,溶质是CaCl2。
CaCl2
(2)取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为 40 g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
40
解析:(2)根据图象可知,乙反应后的溶液中有氯化钙和HCl两种溶质,bc段表示氯化钙与碳酸钠反应,由此可知,与CaCl2反应的碳酸钠溶液的质量为40.0g。再利用化学方程式求出氯化钙的质量,最后求质量分数。
(3)画出曲线如图所示。
答:该CaCl2溶液的溶质质量分数为18.5%。
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
解析:(3)根据第(2)步的数据可知,当加入碳酸钠溶液的质量达到30.0g时才开始生成沉淀,计算出沉淀的质量画出图象即可。
答案图
(4)乙组的中和反应实验设计存在的不足是 没有加酚酞溶液,无法验证是否恰好中和 。
解析:(4)对于无明显现象的酸碱中和反应,要借助指示剂来判断是否恰好完全反应。
没有加酚酞溶液,无法验证是否恰
好中和
变式训练
变式4:(2021.21节选)胆矾(化学式CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(2)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 O2 。CuO完全分解时产生该气体的质量为 0.8 g。
答:x的值为16.0。
O2
0.8
①加热至 650 ℃时,CuSO4开始分解。
650
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 d (填字母)。
a.CuSO4·5H2O b.CuSO4
c.CuO d.Cu2O
d
(1)向空气中排放过多的二氧化硫易引发的环境问题是 酸雨 (填一种环境问题的名称)。
(2)m值是 2 。
酸雨
2
(3)若煤厂一次共加入含氧化钙80%的生石灰样品70 t,则理论上最大可吸收二氧化硫多少t?
解:设理论上最大可吸收二氧化硫的质量为x,
答:理论上最大可吸收64 t二氧化硫。
2.(2020·贺州)实验室中有一瓶已变质的氢氧化钠固体,化学兴趣小组为了检验该固体中氢氧化钠的纯度,取14.6g固体于烧杯中进行实验,分四次加入某浓度的盐酸,所得数据如表:
次数 1 2 3 4
加入盐酸的质量/g 14.6 14.6 14.6 14.6
烧杯中物质的质量/g 29.2 41.6 54.0 68.6
根据上表数据分析,回答下列问题:
(1)反应生成CO2的质量为 4.4 g。
4.4
(2)计算该瓶固体中氢氧化钠的质量分数(写出计算过程,结果保留到0.1%)。
答:该瓶固体中氢氧化钠的质量分数是27.4%。
(3)请你帮化学兴趣小组将表格中的数据转化为曲线。
答案图
3.(2022·东营)长久使用的花洒、热水壶底部和热水锅炉有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸溶液可以清除水垢。某兴趣小组的同学为测定水垢中碳酸钙的含量,向盛有不同质量水垢粉末的烧杯中均加入250 g等浓度的稀盐酸,充分反应后测得的实验数据如下:
实验组数 第一组 第二组 第三组 第四组
水垢的质量/g 10 20 30 40
烧杯中剩余物质总质量/g 256.7 263.4 272.3 282.3
(1)第一组实验中所得二氧化碳的质量为 3.3 g。
3.3
(2)求水垢中CaCO3的质量分数 (要求写出计算过程)。
答:水垢中碳酸钙的质量分数为75%。
(3)第三组实验所得溶液的溶质有 氯化钙和氯化镁 。
氯化钙和氯化镁
4.(2021·佛山模拟)在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。
已知:①该条件下,二氧化碳密度为1.98g/L。
②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是 甲 (填“甲”或“乙”)。
甲
(2)求大理石中碳酸钙的质量分数。(写出计算过程,结果保留1位小数)
答:大理石中碳酸钙的质量分数为90%。
(3)请你画出用块状大理石与6%的盐酸反应的大致曲线。
答案图
5.(2021·广东模拟)某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,实验小组用Ca(OH)2中和这些残余硫酸。请你计算:
(1)1000kg该石油产品中含有H2SO4的质量为 49 kg。每处理1000kg这种产品,需要用Ca(OH)2的质量是多少?请写出具体的计算过程。
74 98
x 49kg
x=37kg
答:每处理1 000 kg这种产品,需要用Ca(OH)2的质量是37 kg。
49
74 98
(2)请你在图中画出用氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线。(请注明具体的坐标) 如图
答案图
如图
(3)石油产品中的残余硫酸,经过清洗、回收、转化……等生产工艺,最终可生产出硫酸产品。若不考虑整个过程中硫元素的损失,1000kg该石油产品中的残余硫酸可生产出98%的硫酸产品的质量为 50 kg。
50
6.(2022苏州模拟)草酸钙晶体(CaC2O4·H2O,相对分子质量为146)在植物体内具有多种生理功能。某化学小组利用热分析仪对14.6 g草酸钙晶体进行热分解,获得相关数据,绘制成如图所示的固体质量——温度的关系曲线。
(1)草酸钙晶体由 四 种元素组成。
(2)温度为t1 ℃时,晶体全部失去结晶水,14.6 g草酸钙晶体中结晶水的质量为 1.8 g。
(3)加热至t2 ℃时,CaC2O4开始分解,生成CaCO3与一种有毒气体,该气体的名称是 一氧化碳 。
(4)温度在t0~t1之间时,剩余固体的成分为 CaC2O4·H2O、 CaC2O4 。
四
1.8
一氧化碳
CaC2O4·H2O、 CaC2O4
(5)加热至t4 ℃时,CaCO3开始分解,计算图中x的值。(写出计算过程)
答:x的值为5.6。
主题六 题型突破
第28讲 有关化学方程式的计算
有关化学方程式的计算是中考必考题型。主要考查学生对化学方程式意义的正确理解、阅读提取信息和分析问题的能力。主要的知识点包括:化学方程式的书写、利用化学方程式计算的步骤、化学反应中纯净物质量的判断。根据题目呈现数据的方式,可分为:文字叙述型、表格数据型、图象型。一般思维方法如下:
第1步:读题。认真阅读题目中的每一部分,包括文字、表格、坐标图、实验过程图。
第2步:审题。找出关键词,正确书写出题中涉及的化学方程式,确定计算要用的化学方程式。
第3步:找出题中的待求物,并设其质量为x。
第4步:找出完全反应时,一种纯净物的质量。
第5步:按步骤解题,并注意解题格式的规范和计算的准确性。
类型1 文字叙述型
典例1:(2018.25)用煤直接作燃料,如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。
(1)现有南方产的一种煤含硫8%。某火力发电厂燃烧100t这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是多少?
解析:根据题意,本题计算涉及的化学反应是硫和氧气反应的化学方程式。利用煤的质量和煤中硫的质量分数可求出硫的质量,再通过化学方程式计算生成二氧化硫的质量。
32 64
8t x
x=16t
答:产生二氧化硫的质量为16t。
32 64
(2)如果在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在如图坐标系中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。
已知:①设炉渣已不含石灰石,炉渣其他成分不与盐酸反应;②CaSO3和盐酸反应类似于CaCO3。
答案图
x=36.5g,y=11.1g
随着盐酸的加入,CaSO3的质量逐渐减小,最后变为0;CaCl2的质量逐渐增大,反应结束后不再变化。
最后在坐标系中画出图象,标出必要的数据(如图,合理即可)
变式训练
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)。
答:过氧化钙的纯度为96%。
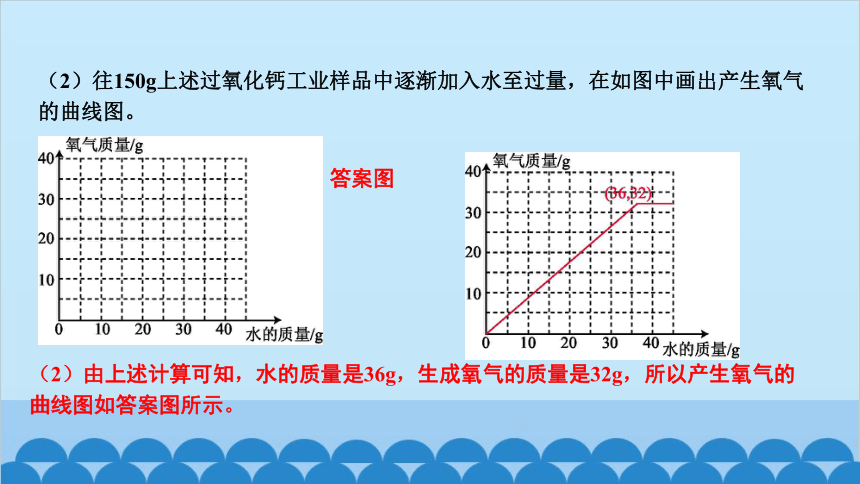
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在如图中画出产生氧气的曲线图。
答案图
(2)由上述计算可知,水的质量是36g,生成氧气的质量是32g,所以产生氧气的曲线图如答案图所示。
类型2 表格数据型
典例2:(2019.25)Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4% NaOH溶液。得到实验数据如下表所示:
实验编号 ① ② ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.232 0.522 0.580 0.580
(1)实验 ③④ (填实验编号)中硫酸镁完全反应。
③④
(2)计算100g混合溶液中含MgSO4的质量(写出计算过程)。
(3)分析实验数据,在图中,画出加入4% NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
答案图
变式训练
变式2:(2021·潍坊)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的氯化钠杂质),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 m 191.0 211.0
请根据实验数据分析解答下列问题:
(1)表中数据m的值为 172.0 。
172.0
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
答案图
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
答:该食用碱样品中碳酸钠的质量分数为86.7%。
类型3 坐标图象型
典例3:(原创题)某化学兴趣小组取一定质量变质的Ca(OH)2(含杂质CaCO3)样品,滴入溶质质量分数为7.3%的稀盐酸,测得产生二氧化碳的质量与稀盐酸质量的关系如图所示。请回答下列问题:
(2)求图中m的值(写出计算过程)。
解析:(2)由图可知产生二氧化碳共消耗稀盐酸100 g,利用化学方程式可求出生成二氧化碳的质量,即是m的值。
100 g×7.3% m
答:m的值为4.4。
73 44
(3)样品的质量为 13.7 g。
解析:(3)样品包含氢氧化钙和碳酸钙。根据两步反应分别消耗的稀盐酸的质量可求出各自的量。
13.7
73 44
74 73
n 50 g×7.3%
n=3.7 g
即样品的质量为10 g+3.7 g=13.7 g
74 73
解: (3)根据(2)反应的数据可求出碳酸钙的质量为10 g。
设氢氧化钙的质量为n。
变式训练
变式3:(2022·南宁)往盛有4.0 g久置的铝片的烧杯中滴加稀盐酸,让其充分反应,放出氢气的质量与所滴加稀盐酸的质量关系如图所示。请回答下列问题并计算:
(1)充分反应后,产生氢气的质量是 0.4 g 。
0.4 g
(2)刚开始滴加稀盐酸时,没有氢气放出的原因是 铝片的表面有一层致密的氧化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水 。
(3)该铝片中铝的质量分数(写出计算过程)。
铝片的表面有一层致密的氧
化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水
答:该铝片中铝的质量分数为90%。
54 6
x 0.4 g
x=3.6 g
该铝片中铝的质量分数为
类型4 实验—图象综合型
典例4:(2014.25)同学们做甲、乙两个中和反应实验的探究,如图所示:
(1)甲实验恰好中和,则该溶液中的溶质是 CaCl2 (填化学式)。
解析:(1)氢氧化钙与稀盐酸恰好完全反应,溶质是CaCl2。
CaCl2
(2)取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为 40 g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
40
解析:(2)根据图象可知,乙反应后的溶液中有氯化钙和HCl两种溶质,bc段表示氯化钙与碳酸钠反应,由此可知,与CaCl2反应的碳酸钠溶液的质量为40.0g。再利用化学方程式求出氯化钙的质量,最后求质量分数。
(3)画出曲线如图所示。
答:该CaCl2溶液的溶质质量分数为18.5%。
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
解析:(3)根据第(2)步的数据可知,当加入碳酸钠溶液的质量达到30.0g时才开始生成沉淀,计算出沉淀的质量画出图象即可。
答案图
(4)乙组的中和反应实验设计存在的不足是 没有加酚酞溶液,无法验证是否恰好中和 。
解析:(4)对于无明显现象的酸碱中和反应,要借助指示剂来判断是否恰好完全反应。
没有加酚酞溶液,无法验证是否恰
好中和
变式训练
变式4:(2021.21节选)胆矾(化学式CuSO4·5H2O,相对分子质量为250)广泛应用于生产生活中。
(2)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图。
②加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,该气体为 O2 。CuO完全分解时产生该气体的质量为 0.8 g。
答:x的值为16.0。
O2
0.8
①加热至 650 ℃时,CuSO4开始分解。
650
④下列物质均可作为炼铜的原料。理论上,冶炼等质量的下列物质得到铜最多的是 d (填字母)。
a.CuSO4·5H2O b.CuSO4
c.CuO d.Cu2O
d
(1)向空气中排放过多的二氧化硫易引发的环境问题是 酸雨 (填一种环境问题的名称)。
(2)m值是 2 。
酸雨
2
(3)若煤厂一次共加入含氧化钙80%的生石灰样品70 t,则理论上最大可吸收二氧化硫多少t?
解:设理论上最大可吸收二氧化硫的质量为x,
答:理论上最大可吸收64 t二氧化硫。
2.(2020·贺州)实验室中有一瓶已变质的氢氧化钠固体,化学兴趣小组为了检验该固体中氢氧化钠的纯度,取14.6g固体于烧杯中进行实验,分四次加入某浓度的盐酸,所得数据如表:
次数 1 2 3 4
加入盐酸的质量/g 14.6 14.6 14.6 14.6
烧杯中物质的质量/g 29.2 41.6 54.0 68.6
根据上表数据分析,回答下列问题:
(1)反应生成CO2的质量为 4.4 g。
4.4
(2)计算该瓶固体中氢氧化钠的质量分数(写出计算过程,结果保留到0.1%)。
答:该瓶固体中氢氧化钠的质量分数是27.4%。
(3)请你帮化学兴趣小组将表格中的数据转化为曲线。
答案图
3.(2022·东营)长久使用的花洒、热水壶底部和热水锅炉有一层水垢,主要成分是碳酸钙和氢氧化镁,用酸溶液可以清除水垢。某兴趣小组的同学为测定水垢中碳酸钙的含量,向盛有不同质量水垢粉末的烧杯中均加入250 g等浓度的稀盐酸,充分反应后测得的实验数据如下:
实验组数 第一组 第二组 第三组 第四组
水垢的质量/g 10 20 30 40
烧杯中剩余物质总质量/g 256.7 263.4 272.3 282.3
(1)第一组实验中所得二氧化碳的质量为 3.3 g。
3.3
(2)求水垢中CaCO3的质量分数 (要求写出计算过程)。
答:水垢中碳酸钙的质量分数为75%。
(3)第三组实验所得溶液的溶质有 氯化钙和氯化镁 。
氯化钙和氯化镁
4.(2021·佛山模拟)在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。
已知:①该条件下,二氧化碳密度为1.98g/L。
②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是 甲 (填“甲”或“乙”)。
甲
(2)求大理石中碳酸钙的质量分数。(写出计算过程,结果保留1位小数)
答:大理石中碳酸钙的质量分数为90%。
(3)请你画出用块状大理石与6%的盐酸反应的大致曲线。
答案图
5.(2021·广东模拟)某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,实验小组用Ca(OH)2中和这些残余硫酸。请你计算:
(1)1000kg该石油产品中含有H2SO4的质量为 49 kg。每处理1000kg这种产品,需要用Ca(OH)2的质量是多少?请写出具体的计算过程。
74 98
x 49kg
x=37kg
答:每处理1 000 kg这种产品,需要用Ca(OH)2的质量是37 kg。
49
74 98
(2)请你在图中画出用氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线。(请注明具体的坐标) 如图
答案图
如图
(3)石油产品中的残余硫酸,经过清洗、回收、转化……等生产工艺,最终可生产出硫酸产品。若不考虑整个过程中硫元素的损失,1000kg该石油产品中的残余硫酸可生产出98%的硫酸产品的质量为 50 kg。
50
6.(2022苏州模拟)草酸钙晶体(CaC2O4·H2O,相对分子质量为146)在植物体内具有多种生理功能。某化学小组利用热分析仪对14.6 g草酸钙晶体进行热分解,获得相关数据,绘制成如图所示的固体质量——温度的关系曲线。
(1)草酸钙晶体由 四 种元素组成。
(2)温度为t1 ℃时,晶体全部失去结晶水,14.6 g草酸钙晶体中结晶水的质量为 1.8 g。
(3)加热至t2 ℃时,CaC2O4开始分解,生成CaCO3与一种有毒气体,该气体的名称是 一氧化碳 。
(4)温度在t0~t1之间时,剩余固体的成分为 CaC2O4·H2O、 CaC2O4 。
四
1.8
一氧化碳
CaC2O4·H2O、 CaC2O4
(5)加热至t4 ℃时,CaCO3开始分解,计算图中x的值。(写出计算过程)
答:x的值为5.6。
同课章节目录
