2023年中考化学复习 主题三 物质的性质与应用第16讲 盐和化肥课件(共38张PPT)
文档属性
| 名称 | 2023年中考化学复习 主题三 物质的性质与应用第16讲 盐和化肥课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 08:13:21 | ||
图片预览











文档简介
(共38张PPT)
主题三 物质的性质与应用
第16讲 盐和化肥
1.了解食盐、纯碱、小苏打和碳酸钙等盐在日常生活中的应用。
2. 知道一些常用化肥及其在农业生产中的作用。
一、常见的盐
盐
盐
二、化肥
化肥
化肥
易错易混提醒:
1.盐的组成中不一定含有金属元素。比如铵盐。
2.盐溶液不一定显中性,如碳酸钠溶液显碱性,硫酸铜溶液显酸性。
3.尿素中不含铵根离子。
4.碳酸氢铵不稳定,易释放出氨气,故有氨气味。
5.铵态氮肥不能与碱性物质混用。如铵态氮肥不能与草木灰混用,会释放氨气,降低肥效。
7.固体中滴入酸溶液产生气体,固体可能是活泼金属也可能是碳酸盐。
8.有咸味的盐不一定是氯化钠,也可能是NaNO2(亚硝酸钠,有毒)。
三、构建物质网络
(一)盐的化学性质
(2)若A是氯化铵,碱是熟石灰,写出反应②的现象:
有刺激性气味产生 。
(3)若A俗称纯碱,盐B是氯化钙的溶液,写出反应③的化学方程式:
有刺激性气味产生
(4)反应④的基本类型是 置换反应 。
置换反应
(二)钠及其化合物之间的转化(按序号和要求写出对应的化学方程式)
图中还有两处物质可以逆向转化,它们分别是(填化学式): Na2SO4 → NaOH ; Na2CO3 → NaOH 。
Na2SO4
NaOH
Na2CO3
NaOH
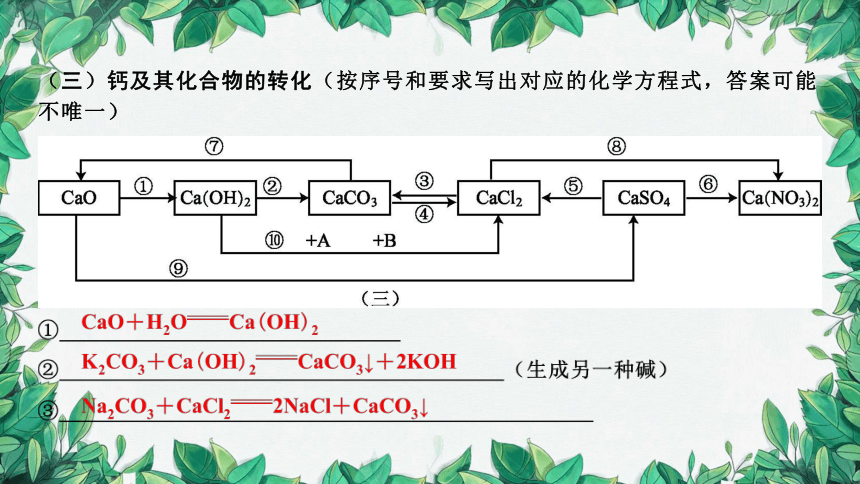
(三)钙及其化合物的转化(按序号和要求写出对应的化学方程式,答案可能不唯一)
⑩A、B是不同类别的物质
一、粗盐中难溶性杂质的去除
1.实验步骤
(1)溶解:把称量好的粗盐倒入烧杯,加适量的水并用 玻璃棒 搅拌,直到粗盐全部溶解。
(注意:粗盐的量不宜太多,一般为3~5g,水量以粗盐刚好全部溶解为宜,避免实验时间过长)
(2)过滤:把粗盐水用玻璃棒 引流 到准备好的过滤器中过滤。(若滤液浑浊需再次过滤)
(3)蒸发:将澄清的滤液倒入蒸发皿中,边加热边 搅拌 ,防止 液体飞溅 ,当 蒸发皿中出现大量固体 时,停止加热,利用余热把剩余水分蒸干。
(4)转移晶体:用 玻璃棒 把蒸发皿中的精盐转移到滤纸或小烧杯中,称量精盐的质量。
玻璃棒
引流
搅拌
液体飞
溅
蒸发皿中出现大量固体
玻璃棒
2.实验误差分析
下列实验操作中,会导致产率偏低的是 ①②③④⑦⑧ (填序号,下同),导致产率偏高的是 ⑤⑥ 。
①粗盐未完全溶解就过滤;②过滤时滤液有损失;③蒸发时有液体飞溅;④转移晶体时有部分精盐残留在蒸发皿或玻璃棒上;⑤滤液浑浊就进行蒸发;⑥精盐中有较多残留的水分;⑦过滤时,未清洗装溶液的烧杯和过滤器并将洗涤液过滤;⑧蒸发时,未用蒸馏水洗涤盛滤液的烧杯和玻璃棒
①②③④⑦⑧
⑤⑥
二、粗盐中可溶性杂质的去除
2.实验步骤
(1)除杂流程
除尽Na2SO4
BaCl2+
除尽MgCl2
MgCl2+
除尽CaCl2和过量的BaCl2
2NaCl
Na2CO3
NaOH
H2O
(2)流程分析
Ⅴ.图中沉淀包含 BaSO4、Mg(OH)2、CaCO3、BaCO3 。精盐中氯化钠的质量大于粗盐中的氯化钠,原因是 每一步除杂过程中都生成了氯化钠 。
BaSO4、Mg(OH)2、CaCO3、BaCO3
每一步除杂过程中都生成了氯化钠
典例1:盐是一类重要的化合物。小明从不同角度对盐的知识进行了归纳整理,请你一起帮助完成。
Ⅰ.知识分类的角度
下列两组盐中,有一种与组内其他三种不归为一类,请你挑选出来并说明理由。
A组:NaCl、Na2CO3、K2CO3、CaCO3;B组:CO(NH2)2、NH4NO3、KH2PO4、NH4HCO3
(1)A组: NaCl ;理由是 不含碳酸根 (或 CaCO3 ;理由是 不溶于水 。或 NaCl ;理由是 可作食用调味品 )。
(2)B组: KH2PO4 ;理由是 KH2PO4是复合肥其他是氮肥 [或 NH4HCO3 ;理由是 NH4HCO3有刺激性气味 。或 CO(NH2)2 ;理由是 CO(NH2)2是有机物,其他的是无机物 ]。
NaCl
不含碳酸根
CaCO3
不溶于
水
NaCl
可作食用调味品
KH2PO4
KH2PO4是复合肥其他是氮肥
NH4HCO3
NH4HCO3有刺激性气味
CO(NH2)2
CO(NH2)2是有机物,其他的是无机物
Ⅱ.知识归纳角度
如图是碳酸钠的知识网络图,请回答:
(1)碳酸钠俗称 苏打(或纯碱) ;
(2)碳酸钠溶液中滴入几滴紫色石蕊溶液,观察到的现象是 溶液变蓝色 ;
苏打(或纯碱)
溶液变蓝色
(4)工业上用价格低廉的熟石灰与碳酸钠反应制取烧碱,利用图中的性质 ③ (填序号);
A.KCl B.BaCl2 C.H2SO4 D.Ca(NO3)2
H2R+
③
BD
Ⅲ.知识应用角度
(1)利用盐的性质除杂。写出除去下列物质中杂质(括号中的是杂质)的试剂:
NaCl溶液(CaCl2) Na2CO3 K2SO4溶液(H2SO4) K2CO3
FeSO4溶液(CuSO4) Fe
NaOH溶液(Na2CO3) Ba(OH)2[或Ca(OH)2]
Na2CO3
K2CO3
Fe
Ba(OH)2[或Ca(OH)2]
(2)物质鉴别。有一包固态氮肥,可能由尿素、硝酸铵、碳酸氢铵、氯化铵、硫酸铵中的一种或几种组成,为探究其成分,进行了如下实验,请完成实验报告。
操作 现象 结论
步骤1.取样,闻气味 无明显现象 一定不含 碳酸氢铵
步骤2.另取样与熟石灰混合研磨 有刺激性气味
步骤3.取样溶于水后,滴入足量的 Ba(NO3)2 溶液 有 白色沉淀 样品中含硫酸根离子
步骤4.取步骤3中的上层清液,滴入适量的AgNO3溶液 有白色沉淀 样品中含 Cl-
综合以上信息,样品中一定含 硫酸铵、氯化铵 ,可能含 尿素、硝酸铵 。
碳酸氢铵
Ba(NO3)2
白色沉
淀
Cl-
硫酸铵、氯化铵
尿素、硝酸铵
典例2:化学兴趣小组的同学从海边取来一瓶略显浑浊的海水,打算制取较为纯净的氯化钠。制取过程如下:(查阅资料得知,该海水中还含有MgCl2、CaCl2等杂质)
(1)操作1和操作2的名称相同,使用到的玻璃仪器有 烧杯、玻璃棒和漏斗 ,操作1的目的是 除去海水中的泥沙等不溶性杂质 。
(3)操作3的名称是 蒸发结晶 。
烧杯、玻璃棒和漏斗
除去海水中的泥沙等不溶性杂质
CaCO3、Mg(OH)2
+H2O
蒸发结晶
考点1 常见的盐及其性质
1.(广东省真题组合)判断下列说法的正误。
(1)除去NaCl中的Na2CO3,加入足量稀硫酸,蒸发结晶(2019.11B) ( × )
(2)鉴别氯化钾与氯化铵,加熟石灰研磨(2018.10D) ( √ )
(3)除去NaOH中的Na2CO3,加入稀盐酸至不再产生气泡(2018.12C) ( × )
(4)向Na2CO3溶液中滴入酚酞溶液,溶液变红色,说明Na2CO3溶液呈碱性(2017.11A) ( √ )
×
√
×
√
×
2.(2021·鞍山)下列有关盐的用途说法不.正.确.的是( C )
A.氯化钠可用于配制生理盐水
B.碳酸钙可用作补钙剂
C.亚硝酸钠可用于腌制蔬菜
D.小苏打可用于焙制糕点
3.(2022·东莞模拟)下列各组固体物质,只用水作试剂不.能.鉴别的是( C )
A.CaCO3、CaCl2 B.NH4Cl、NaOH
C.NaCl、KCl D.CuSO4、FeCl2
C
C
4.(2021·株洲)下列选项中各溶质的溶液混合,无.明.显.现象的是( A )
A.NaCl、BaCl2、KNO3
B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl
D.CaCl2、Na2CO3、KNO3
5.(2022·广州模拟)下列实验中无.明.显.现象的是( B )
A.铜丝浸入AgNO3溶液中
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.向Ba(OH)2溶液中通入CO2
D.在盛有水的烧杯中加入NH4NO3固体
A
B
6.(2020·山西)课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( C )
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
C
7.(2021·宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请归纳有关知识。
(1)验证性质①时需满足的条件之一是金属比组成盐的金属的活动性 强 (填“强”或“弱”)。
(3)在性质④中,X代表 酸 类物质。
(4)在归纳性质③时,其中一种盐选取了硝酸银,写出与硝酸银反应的物质的化学式: NaCl (写一个)。
强
产生蓝色沉淀
Cu(OH)2↓+Na2SO4
酸
NaCl
8.(2017.23)某同学进行如图两个实验:
2NaOH
(2)乙实验观察到的现象是 镁条表面有红色固体析出 ,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
镁条表面有红色固体析出
【提出猜想】
白色沉淀为:Ⅰ. Mg(OH)2 ;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3。
Mg(OH)2
【实验方案】
实验操作 实验现象与结论
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量
沉淀部分溶解
且有气体生成
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时 碳酸钠溶液过量 ;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是 甲实验中碳酸钠和氢氧化钡不可能同时过量 。
碳酸钠溶液过
量
甲实验中碳酸钠和氢氧化钡不可能同时过量
考点2 化肥
9.(广东省真题组合)判断下列说法的正误。
(1)铵态氮肥不能与碱性的草木灰混合施用(2017.4B) ( √ )
(2)氮肥氯化铵与碱研磨可放出氨气,氮肥尿素与碱研磨也能放出氨气(2015.13B) ( × )
(3)施用农药造成污染,应禁止使用(2014.8C) ( × )
10.(2022·金昌)合理施肥是增产的保障。下列化肥属于复合肥的是( A )
A.KNO3 B.NH4HCO3
C.Ca3(PO4)2 D.K2SO4
√
×
×
A
11.(2022·邵阳)下列化肥中,从外观即可与其他化肥相区别的是( C )
A.氯化铵 B.硫酸钾
C.磷矿粉 D.硝酸钾
12.(2021·成都)为区分硫酸钾、氯化铵、硫酸铵、磷矿粉四种固体物质,以下方案及结论有.误.的是( C )
A.观察固体颜色能区分出磷矿粉
B.取样,加熟石灰研磨闻到氨味的物质有两种
C.取样,溶解后加硝酸钡溶液能区分出硫酸铵
D.用水和氢氧化钡溶液能区分出四种物质
C
C
考点3 粗盐的提纯
13.(2022·韶关模拟)粗盐提纯的实验中,蒸发不.需.要.用到的仪器是( C )
A.蒸发皿 B.酒精灯
C.烧杯 D.玻璃棒
14.(2022·苏州)在粗盐初步提纯实验中,下列有关装置和操作正确的是( B )
A.溶解粗盐 B.过滤粗盐水
C.蒸发结晶 D.趁热取下蒸发皿
C
B
15.(2022·东营模拟)东营海港的人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3,结合图1溶解度曲线,回答下列问题:
(1)30 ℃时,Na2CO3饱和溶液在s点的质量分数为 28.6% (保留一位小数)。如果把80 ℃的Na2CO3饱和溶液降温到20℃,该过程中溶质质量分数变化情况是 先保持不变,再变小 。
(2)这里的“碱”是指Na2CO3这种盐,它的水溶液呈 碱 性(填“酸”“碱”或“中”)。
28.6%
先保持不变,再变小
碱
(3)东营海港的粗盐样品中常含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如图2所示:
(ii)如果不进行第⑥步操作就直接进入第⑦步操作,会导致的后果是 部分沉淀溶解 。
除去CaCl2和过量的BaCl2
部分沉淀
溶解
A.生成物NaCl呈碱性
C.滴加盐酸时稀释了溶液
D.滤液中的OH-与H+结合而减少
(iv)第⑧步操作中,b的名称是 蒸发 ,该操作要用玻璃棒不断搅拌,目的是 防止局部温度过高,造成液滴飞溅 。
蒸发
防止局部温度过高,造成液滴飞溅
(iii)第⑦步操作中,在滴加足量盐酸时溶液的pH在减小的原因是 BCD (填字母)。
BCD
主题三 物质的性质与应用
第16讲 盐和化肥
1.了解食盐、纯碱、小苏打和碳酸钙等盐在日常生活中的应用。
2. 知道一些常用化肥及其在农业生产中的作用。
一、常见的盐
盐
盐
二、化肥
化肥
化肥
易错易混提醒:
1.盐的组成中不一定含有金属元素。比如铵盐。
2.盐溶液不一定显中性,如碳酸钠溶液显碱性,硫酸铜溶液显酸性。
3.尿素中不含铵根离子。
4.碳酸氢铵不稳定,易释放出氨气,故有氨气味。
5.铵态氮肥不能与碱性物质混用。如铵态氮肥不能与草木灰混用,会释放氨气,降低肥效。
7.固体中滴入酸溶液产生气体,固体可能是活泼金属也可能是碳酸盐。
8.有咸味的盐不一定是氯化钠,也可能是NaNO2(亚硝酸钠,有毒)。
三、构建物质网络
(一)盐的化学性质
(2)若A是氯化铵,碱是熟石灰,写出反应②的现象:
有刺激性气味产生 。
(3)若A俗称纯碱,盐B是氯化钙的溶液,写出反应③的化学方程式:
有刺激性气味产生
(4)反应④的基本类型是 置换反应 。
置换反应
(二)钠及其化合物之间的转化(按序号和要求写出对应的化学方程式)
图中还有两处物质可以逆向转化,它们分别是(填化学式): Na2SO4 → NaOH ; Na2CO3 → NaOH 。
Na2SO4
NaOH
Na2CO3
NaOH
(三)钙及其化合物的转化(按序号和要求写出对应的化学方程式,答案可能不唯一)
⑩A、B是不同类别的物质
一、粗盐中难溶性杂质的去除
1.实验步骤
(1)溶解:把称量好的粗盐倒入烧杯,加适量的水并用 玻璃棒 搅拌,直到粗盐全部溶解。
(注意:粗盐的量不宜太多,一般为3~5g,水量以粗盐刚好全部溶解为宜,避免实验时间过长)
(2)过滤:把粗盐水用玻璃棒 引流 到准备好的过滤器中过滤。(若滤液浑浊需再次过滤)
(3)蒸发:将澄清的滤液倒入蒸发皿中,边加热边 搅拌 ,防止 液体飞溅 ,当 蒸发皿中出现大量固体 时,停止加热,利用余热把剩余水分蒸干。
(4)转移晶体:用 玻璃棒 把蒸发皿中的精盐转移到滤纸或小烧杯中,称量精盐的质量。
玻璃棒
引流
搅拌
液体飞
溅
蒸发皿中出现大量固体
玻璃棒
2.实验误差分析
下列实验操作中,会导致产率偏低的是 ①②③④⑦⑧ (填序号,下同),导致产率偏高的是 ⑤⑥ 。
①粗盐未完全溶解就过滤;②过滤时滤液有损失;③蒸发时有液体飞溅;④转移晶体时有部分精盐残留在蒸发皿或玻璃棒上;⑤滤液浑浊就进行蒸发;⑥精盐中有较多残留的水分;⑦过滤时,未清洗装溶液的烧杯和过滤器并将洗涤液过滤;⑧蒸发时,未用蒸馏水洗涤盛滤液的烧杯和玻璃棒
①②③④⑦⑧
⑤⑥
二、粗盐中可溶性杂质的去除
2.实验步骤
(1)除杂流程
除尽Na2SO4
BaCl2+
除尽MgCl2
MgCl2+
除尽CaCl2和过量的BaCl2
2NaCl
Na2CO3
NaOH
H2O
(2)流程分析
Ⅴ.图中沉淀包含 BaSO4、Mg(OH)2、CaCO3、BaCO3 。精盐中氯化钠的质量大于粗盐中的氯化钠,原因是 每一步除杂过程中都生成了氯化钠 。
BaSO4、Mg(OH)2、CaCO3、BaCO3
每一步除杂过程中都生成了氯化钠
典例1:盐是一类重要的化合物。小明从不同角度对盐的知识进行了归纳整理,请你一起帮助完成。
Ⅰ.知识分类的角度
下列两组盐中,有一种与组内其他三种不归为一类,请你挑选出来并说明理由。
A组:NaCl、Na2CO3、K2CO3、CaCO3;B组:CO(NH2)2、NH4NO3、KH2PO4、NH4HCO3
(1)A组: NaCl ;理由是 不含碳酸根 (或 CaCO3 ;理由是 不溶于水 。或 NaCl ;理由是 可作食用调味品 )。
(2)B组: KH2PO4 ;理由是 KH2PO4是复合肥其他是氮肥 [或 NH4HCO3 ;理由是 NH4HCO3有刺激性气味 。或 CO(NH2)2 ;理由是 CO(NH2)2是有机物,其他的是无机物 ]。
NaCl
不含碳酸根
CaCO3
不溶于
水
NaCl
可作食用调味品
KH2PO4
KH2PO4是复合肥其他是氮肥
NH4HCO3
NH4HCO3有刺激性气味
CO(NH2)2
CO(NH2)2是有机物,其他的是无机物
Ⅱ.知识归纳角度
如图是碳酸钠的知识网络图,请回答:
(1)碳酸钠俗称 苏打(或纯碱) ;
(2)碳酸钠溶液中滴入几滴紫色石蕊溶液,观察到的现象是 溶液变蓝色 ;
苏打(或纯碱)
溶液变蓝色
(4)工业上用价格低廉的熟石灰与碳酸钠反应制取烧碱,利用图中的性质 ③ (填序号);
A.KCl B.BaCl2 C.H2SO4 D.Ca(NO3)2
H2R+
③
BD
Ⅲ.知识应用角度
(1)利用盐的性质除杂。写出除去下列物质中杂质(括号中的是杂质)的试剂:
NaCl溶液(CaCl2) Na2CO3 K2SO4溶液(H2SO4) K2CO3
FeSO4溶液(CuSO4) Fe
NaOH溶液(Na2CO3) Ba(OH)2[或Ca(OH)2]
Na2CO3
K2CO3
Fe
Ba(OH)2[或Ca(OH)2]
(2)物质鉴别。有一包固态氮肥,可能由尿素、硝酸铵、碳酸氢铵、氯化铵、硫酸铵中的一种或几种组成,为探究其成分,进行了如下实验,请完成实验报告。
操作 现象 结论
步骤1.取样,闻气味 无明显现象 一定不含 碳酸氢铵
步骤2.另取样与熟石灰混合研磨 有刺激性气味
步骤3.取样溶于水后,滴入足量的 Ba(NO3)2 溶液 有 白色沉淀 样品中含硫酸根离子
步骤4.取步骤3中的上层清液,滴入适量的AgNO3溶液 有白色沉淀 样品中含 Cl-
综合以上信息,样品中一定含 硫酸铵、氯化铵 ,可能含 尿素、硝酸铵 。
碳酸氢铵
Ba(NO3)2
白色沉
淀
Cl-
硫酸铵、氯化铵
尿素、硝酸铵
典例2:化学兴趣小组的同学从海边取来一瓶略显浑浊的海水,打算制取较为纯净的氯化钠。制取过程如下:(查阅资料得知,该海水中还含有MgCl2、CaCl2等杂质)
(1)操作1和操作2的名称相同,使用到的玻璃仪器有 烧杯、玻璃棒和漏斗 ,操作1的目的是 除去海水中的泥沙等不溶性杂质 。
(3)操作3的名称是 蒸发结晶 。
烧杯、玻璃棒和漏斗
除去海水中的泥沙等不溶性杂质
CaCO3、Mg(OH)2
+H2O
蒸发结晶
考点1 常见的盐及其性质
1.(广东省真题组合)判断下列说法的正误。
(1)除去NaCl中的Na2CO3,加入足量稀硫酸,蒸发结晶(2019.11B) ( × )
(2)鉴别氯化钾与氯化铵,加熟石灰研磨(2018.10D) ( √ )
(3)除去NaOH中的Na2CO3,加入稀盐酸至不再产生气泡(2018.12C) ( × )
(4)向Na2CO3溶液中滴入酚酞溶液,溶液变红色,说明Na2CO3溶液呈碱性(2017.11A) ( √ )
×
√
×
√
×
2.(2021·鞍山)下列有关盐的用途说法不.正.确.的是( C )
A.氯化钠可用于配制生理盐水
B.碳酸钙可用作补钙剂
C.亚硝酸钠可用于腌制蔬菜
D.小苏打可用于焙制糕点
3.(2022·东莞模拟)下列各组固体物质,只用水作试剂不.能.鉴别的是( C )
A.CaCO3、CaCl2 B.NH4Cl、NaOH
C.NaCl、KCl D.CuSO4、FeCl2
C
C
4.(2021·株洲)下列选项中各溶质的溶液混合,无.明.显.现象的是( A )
A.NaCl、BaCl2、KNO3
B.CuSO4、NaOH、KCl
C.BaCl2、Na2SO4、HCl
D.CaCl2、Na2CO3、KNO3
5.(2022·广州模拟)下列实验中无.明.显.现象的是( B )
A.铜丝浸入AgNO3溶液中
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.向Ba(OH)2溶液中通入CO2
D.在盛有水的烧杯中加入NH4NO3固体
A
B
6.(2020·山西)课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( C )
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
C
7.(2021·宁夏)及时归纳是学好化学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请归纳有关知识。
(1)验证性质①时需满足的条件之一是金属比组成盐的金属的活动性 强 (填“强”或“弱”)。
(3)在性质④中,X代表 酸 类物质。
(4)在归纳性质③时,其中一种盐选取了硝酸银,写出与硝酸银反应的物质的化学式: NaCl (写一个)。
强
产生蓝色沉淀
Cu(OH)2↓+Na2SO4
酸
NaCl
8.(2017.23)某同学进行如图两个实验:
2NaOH
(2)乙实验观察到的现象是 镁条表面有红色固体析出 ,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
镁条表面有红色固体析出
【提出猜想】
白色沉淀为:Ⅰ. Mg(OH)2 ;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3。
Mg(OH)2
【实验方案】
实验操作 实验现象与结论
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量
沉淀部分溶解
且有气体生成
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时 碳酸钠溶液过量 ;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是 甲实验中碳酸钠和氢氧化钡不可能同时过量 。
碳酸钠溶液过
量
甲实验中碳酸钠和氢氧化钡不可能同时过量
考点2 化肥
9.(广东省真题组合)判断下列说法的正误。
(1)铵态氮肥不能与碱性的草木灰混合施用(2017.4B) ( √ )
(2)氮肥氯化铵与碱研磨可放出氨气,氮肥尿素与碱研磨也能放出氨气(2015.13B) ( × )
(3)施用农药造成污染,应禁止使用(2014.8C) ( × )
10.(2022·金昌)合理施肥是增产的保障。下列化肥属于复合肥的是( A )
A.KNO3 B.NH4HCO3
C.Ca3(PO4)2 D.K2SO4
√
×
×
A
11.(2022·邵阳)下列化肥中,从外观即可与其他化肥相区别的是( C )
A.氯化铵 B.硫酸钾
C.磷矿粉 D.硝酸钾
12.(2021·成都)为区分硫酸钾、氯化铵、硫酸铵、磷矿粉四种固体物质,以下方案及结论有.误.的是( C )
A.观察固体颜色能区分出磷矿粉
B.取样,加熟石灰研磨闻到氨味的物质有两种
C.取样,溶解后加硝酸钡溶液能区分出硫酸铵
D.用水和氢氧化钡溶液能区分出四种物质
C
C
考点3 粗盐的提纯
13.(2022·韶关模拟)粗盐提纯的实验中,蒸发不.需.要.用到的仪器是( C )
A.蒸发皿 B.酒精灯
C.烧杯 D.玻璃棒
14.(2022·苏州)在粗盐初步提纯实验中,下列有关装置和操作正确的是( B )
A.溶解粗盐 B.过滤粗盐水
C.蒸发结晶 D.趁热取下蒸发皿
C
B
15.(2022·东营模拟)东营海港的人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3,结合图1溶解度曲线,回答下列问题:
(1)30 ℃时,Na2CO3饱和溶液在s点的质量分数为 28.6% (保留一位小数)。如果把80 ℃的Na2CO3饱和溶液降温到20℃,该过程中溶质质量分数变化情况是 先保持不变,再变小 。
(2)这里的“碱”是指Na2CO3这种盐,它的水溶液呈 碱 性(填“酸”“碱”或“中”)。
28.6%
先保持不变,再变小
碱
(3)东营海港的粗盐样品中常含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如图2所示:
(ii)如果不进行第⑥步操作就直接进入第⑦步操作,会导致的后果是 部分沉淀溶解 。
除去CaCl2和过量的BaCl2
部分沉淀
溶解
A.生成物NaCl呈碱性
C.滴加盐酸时稀释了溶液
D.滤液中的OH-与H+结合而减少
(iv)第⑧步操作中,b的名称是 蒸发 ,该操作要用玻璃棒不断搅拌,目的是 防止局部温度过高,造成液滴飞溅 。
蒸发
防止局部温度过高,造成液滴飞溅
(iii)第⑦步操作中,在滴加足量盐酸时溶液的pH在减小的原因是 BCD (填字母)。
BCD
同课章节目录
