2023年中考化学复习 主题三 物质的性质与应用第15讲 中和反应 溶液的酸碱性与pH课件(共19张PPT)
文档属性
| 名称 | 2023年中考化学复习 主题三 物质的性质与应用第15讲 中和反应 溶液的酸碱性与pH课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 08:09:35 | ||
图片预览






文档简介
(共19张PPT)
主题三 物质的性质与应用
第15讲 中和反应 溶液的酸碱性与pH
1.了解检验溶液酸碱性的基本方法。
2.知道酸碱性对人体健康和农作物生长的影响。
一、酸碱指示剂和pH
酸碱指示剂和pH
酸碱指示剂和pH
二、中和反应
易错易混提醒:
1.生成盐和水的反应不一定是中和反应。
2.酸性溶液pH越小,H+浓度越大;碱性溶液pH越大,OH-浓度越大。
3.改良酸性土壤不能用NaOH,因为NaOH具有强腐蚀性。
中和反应的探究
(一)探究过程
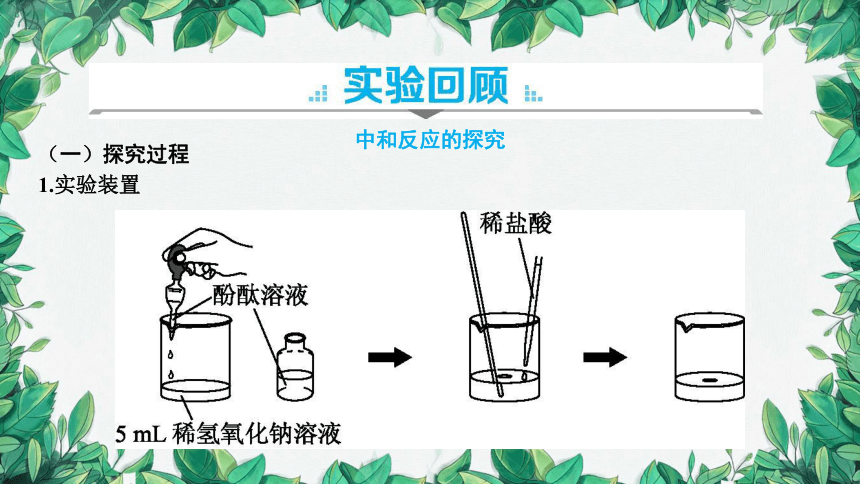
1.实验装置
2.实验操作及现象
烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,用玻璃棒搅拌,溶液变为 红 色;逐滴滴入稀盐酸,边滴边搅拌,至溶液恰好变成 无 色为止。
3.实验分析和结论
氢氧化钠溶液使酚酞溶液变红,滴加稀盐酸的过程中溶液颜色逐渐变浅,最后变为无色,说明氢氧化钠与稀盐酸发生了反应。
4.注意事项
(1)实验中用玻璃棒搅拌的目的是 使反应物充分接触 。
(2)稀盐酸要逐滴滴入,目的是 防止稀盐酸过量 。
(3)实验中滴入酚酞溶液的目的是 判断反应是否发生 。
红
无
使反应物充分接触
防止稀盐酸过量
判断反应是否发生
(二)实验过程分析
5.微观分析
如图是稀盐酸与氢氧化钠溶液反应的微观示意图。反应前后,没有变化的微粒是 Na+ 和 Cl- (写微粒符号,下同),减少的微粒是 H+ 和 OH- ,新生成的微粒是 H2O 。
Na+
Cl-
H+
OH-
H2O
6.溶液pH变化及成分分析
如图是氢氧化钠溶液和稀盐酸反应时,烧杯中溶液pH的变化图。
点A的溶液显 碱 性,溶液中的溶质有 NaOH 和 NaCl ;点B表示 恰好完全反应 ,溶液中的溶质有 NaCl ;点C的溶液显 酸 性,溶液中的溶质有 NaCl 和 HCl 。图象起点PH>7,表示是把 稀盐酸 滴入 NaOH溶液 中。
碱
NaOH
NaCl
恰好
完全反应
NaCl
酸
NaCl
HCl
稀盐酸
NaOH溶
液
典例:(2021·滨州)某同学做氢氧化钠溶液与稀硫酸的中和反应实验时,用pH传感器测得溶液的pH变化如图甲所示。试回答下列问题:
(1)实验是把 氢氧化钠 (填“氢氧化钠”或“稀硫酸”)溶液滴入另一种溶液中。
氢氧化钠
(3)在A点溶液中加入少量氧化铁粉末,现象为 红色固体慢慢消失,溶液由无色变黄色 。
(4)反应中溶液的微观粒子如图乙所示,则该溶液代表 B (填“A”或“B”)点溶液。
红色固体慢慢消失,溶液由无色
变黄色
B
考点1 溶液的酸碱性及pH
1.(2022·大连)下列是部分饮品的近似pH范围,其中酸性最强的是( D )
A.豆浆(7.4~7.9) B.番茄汁(4.0~4.4)
C.牛奶(6.3~6.6) D.苹果汁(2.9~3.3)
2.(2022·沈阳)下列为测得的某些物质的pH,其中呈碱性的是( D )
A.柠檬汁(pH=2.5) B.食醋(pH=3.5)
C.雨水(pH=5.8) D.肥皂水(pH=10.2)
D
D
3.(2022·张家界)一些常见食物的近似pH如表所示。下列说法中错.误.的是( B )
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
A.苹果汁和葡萄汁显酸性
B.牛奶和鸡蛋清显碱性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮苹果汁和葡萄汁
B
4.(2022·江西模拟)某校同学开展了如图所示“溶液酸碱性的检验”的实验活动。
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 滴瓶 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 红色 ,该汁液 能 (填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 碱性 (填“酸性”“中性”或“碱性”)溶液,白醋pH < (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 B (填“A”“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 C 。
滴瓶
红色
能
碱性
<
B
C
考点2 中和反应及其应用
5.(2022·包头)下列生产生活中的应用,利用了中和反应原理的是( D )
A.生石灰用作食品干燥剂
B.用熟石灰和硫酸铜制波尔多液
C.用小苏打做面点发酵剂
D.服用含Al(OH)3的药物治疗胃酸过多
6.(2022·河北)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是( B )
A.N点时的溶液一定呈红色
B.P点时的溶液能与纯碱发生反应
C.M→N过程中溶液的碱性逐渐增强
D.M→P过程中生成的硫酸钠不断增加
D
B
7.(2022·苏州)氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不.正.确.的是( A )
A.盐酸中存在的微粒有水分子和氯化氢分子
B.该反应的微观实质是H+和OH-结合生成水分子
C.Na+和Cl-在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
8.(2022·大连)化学小组在学习酸和碱的中和反应后,从不同角度开展实验活动,验证氢氧化钠和盐酸能发生反应。
(1)通过溶液酸碱性的变化进行验证。
在实验1中,用胶头滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是 酚酞溶液遇碱性溶液变红色 。用玻璃棒不断搅拌的作用是 使反应更充分 。反应后溶液中一定含有的粒子是 Na+、Cl-、H2O (写符号,不考虑酚酞)。
(2)利用中和反应放热进行验证。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。但有的同学不赞同,理由是 可能是氢氧化钠溶于水放热造成U形管的液面左低右高 (装置气密性良好,稀盐酸挥发忽略不计);他们认为仍利用此装置,再补充一个实验才能达成实验2目的,实验更换注射器中试剂及用量为 5 mL蒸馏水 。
酚酞溶液遇碱性溶液变红
色
使反应更充分
Na+、Cl-、H2O
可能是氢氧化钠溶于水放热造成U形管的液面左低右
高
5 mL蒸馏水
主题三 物质的性质与应用
第15讲 中和反应 溶液的酸碱性与pH
1.了解检验溶液酸碱性的基本方法。
2.知道酸碱性对人体健康和农作物生长的影响。
一、酸碱指示剂和pH
酸碱指示剂和pH
酸碱指示剂和pH
二、中和反应
易错易混提醒:
1.生成盐和水的反应不一定是中和反应。
2.酸性溶液pH越小,H+浓度越大;碱性溶液pH越大,OH-浓度越大。
3.改良酸性土壤不能用NaOH,因为NaOH具有强腐蚀性。
中和反应的探究
(一)探究过程
1.实验装置
2.实验操作及现象
烧杯中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,用玻璃棒搅拌,溶液变为 红 色;逐滴滴入稀盐酸,边滴边搅拌,至溶液恰好变成 无 色为止。
3.实验分析和结论
氢氧化钠溶液使酚酞溶液变红,滴加稀盐酸的过程中溶液颜色逐渐变浅,最后变为无色,说明氢氧化钠与稀盐酸发生了反应。
4.注意事项
(1)实验中用玻璃棒搅拌的目的是 使反应物充分接触 。
(2)稀盐酸要逐滴滴入,目的是 防止稀盐酸过量 。
(3)实验中滴入酚酞溶液的目的是 判断反应是否发生 。
红
无
使反应物充分接触
防止稀盐酸过量
判断反应是否发生
(二)实验过程分析
5.微观分析
如图是稀盐酸与氢氧化钠溶液反应的微观示意图。反应前后,没有变化的微粒是 Na+ 和 Cl- (写微粒符号,下同),减少的微粒是 H+ 和 OH- ,新生成的微粒是 H2O 。
Na+
Cl-
H+
OH-
H2O
6.溶液pH变化及成分分析
如图是氢氧化钠溶液和稀盐酸反应时,烧杯中溶液pH的变化图。
点A的溶液显 碱 性,溶液中的溶质有 NaOH 和 NaCl ;点B表示 恰好完全反应 ,溶液中的溶质有 NaCl ;点C的溶液显 酸 性,溶液中的溶质有 NaCl 和 HCl 。图象起点PH>7,表示是把 稀盐酸 滴入 NaOH溶液 中。
碱
NaOH
NaCl
恰好
完全反应
NaCl
酸
NaCl
HCl
稀盐酸
NaOH溶
液
典例:(2021·滨州)某同学做氢氧化钠溶液与稀硫酸的中和反应实验时,用pH传感器测得溶液的pH变化如图甲所示。试回答下列问题:
(1)实验是把 氢氧化钠 (填“氢氧化钠”或“稀硫酸”)溶液滴入另一种溶液中。
氢氧化钠
(3)在A点溶液中加入少量氧化铁粉末,现象为 红色固体慢慢消失,溶液由无色变黄色 。
(4)反应中溶液的微观粒子如图乙所示,则该溶液代表 B (填“A”或“B”)点溶液。
红色固体慢慢消失,溶液由无色
变黄色
B
考点1 溶液的酸碱性及pH
1.(2022·大连)下列是部分饮品的近似pH范围,其中酸性最强的是( D )
A.豆浆(7.4~7.9) B.番茄汁(4.0~4.4)
C.牛奶(6.3~6.6) D.苹果汁(2.9~3.3)
2.(2022·沈阳)下列为测得的某些物质的pH,其中呈碱性的是( D )
A.柠檬汁(pH=2.5) B.食醋(pH=3.5)
C.雨水(pH=5.8) D.肥皂水(pH=10.2)
D
D
3.(2022·张家界)一些常见食物的近似pH如表所示。下列说法中错.误.的是( B )
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
A.苹果汁和葡萄汁显酸性
B.牛奶和鸡蛋清显碱性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮苹果汁和葡萄汁
B
4.(2022·江西模拟)某校同学开展了如图所示“溶液酸碱性的检验”的实验活动。
(1)把自制的紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液 白醋 盐酸 蔗糖水 草木灰水 石灰水
加入紫薯汁之后的颜色 红色 红色 紫色 绿色 绿色
①图1中存放紫薯汁的仪器名称是 滴瓶 。
②据上表推测,紫薯汁遇到稀硫酸溶液可能显示的颜色是 红色 ,该汁液 能 (填“能”或“不能”)作酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 碱性 (填“酸性”“中性”或“碱性”)溶液,白醋pH < (填“>”“<”或“=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是 B (填“A”“B”或“C”,下同),可能导致被测溶液的pH数值发生改变的错误操作是 C 。
滴瓶
红色
能
碱性
<
B
C
考点2 中和反应及其应用
5.(2022·包头)下列生产生活中的应用,利用了中和反应原理的是( D )
A.生石灰用作食品干燥剂
B.用熟石灰和硫酸铜制波尔多液
C.用小苏打做面点发酵剂
D.服用含Al(OH)3的药物治疗胃酸过多
6.(2022·河北)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是( B )
A.N点时的溶液一定呈红色
B.P点时的溶液能与纯碱发生反应
C.M→N过程中溶液的碱性逐渐增强
D.M→P过程中生成的硫酸钠不断增加
D
B
7.(2022·苏州)氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不.正.确.的是( A )
A.盐酸中存在的微粒有水分子和氯化氢分子
B.该反应的微观实质是H+和OH-结合生成水分子
C.Na+和Cl-在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
8.(2022·大连)化学小组在学习酸和碱的中和反应后,从不同角度开展实验活动,验证氢氧化钠和盐酸能发生反应。
(1)通过溶液酸碱性的变化进行验证。
在实验1中,用胶头滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是 酚酞溶液遇碱性溶液变红色 。用玻璃棒不断搅拌的作用是 使反应更充分 。反应后溶液中一定含有的粒子是 Na+、Cl-、H2O (写符号,不考虑酚酞)。
(2)利用中和反应放热进行验证。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。但有的同学不赞同,理由是 可能是氢氧化钠溶于水放热造成U形管的液面左低右高 (装置气密性良好,稀盐酸挥发忽略不计);他们认为仍利用此装置,再补充一个实验才能达成实验2目的,实验更换注射器中试剂及用量为 5 mL蒸馏水 。
酚酞溶液遇碱性溶液变红
色
使反应更充分
Na+、Cl-、H2O
可能是氢氧化钠溶于水放热造成U形管的液面左低右
高
5 mL蒸馏水
同课章节目录
