1.2反应热的计算课件 (共22张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2反应热的计算课件 (共22张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 764.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 10:53:12 | ||
图片预览








文档简介
(共22张PPT)
高中化学 人教版(2019) 选择性必修1
第一章 化学反应的热效应
第二节 反应热的计算
学习目标
1.巩固化学反应热效应与反应的焓变之间的关系;
2.能用盖斯定律进行有关反应热的简单计算。
问题导引
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+ O2(g)=CO(g)
一、盖斯定律
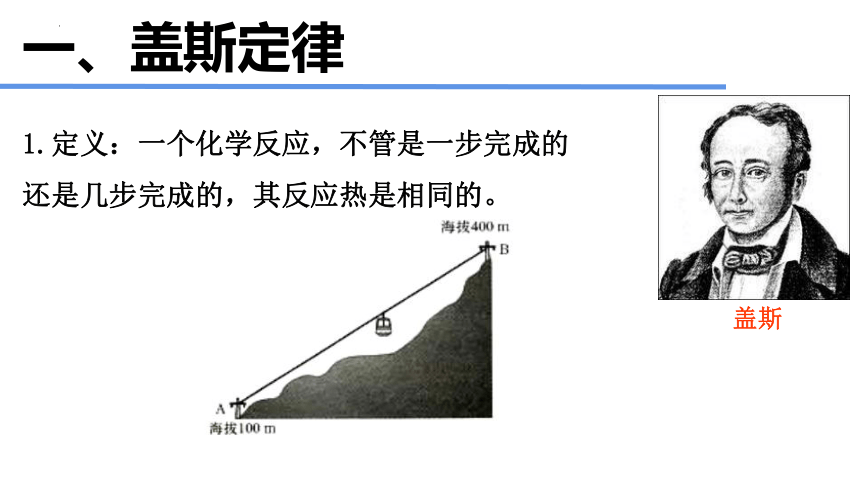
1.定义:一个化学反应,不管是一步完成的还是几步完成的,其反应热是相同的。
盖斯
一、盖斯定律
盖斯定律表明,在一定条件下化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
例如 C(s)+ O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+ O2(g)=CO2(g)
C(s)+ O2(g)=CO2(g)
ΔH1=-393.5 kJ/mol
ΔH2=-283.0 kJ/mol
一、盖斯定律
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol -(-283.0kJ/mol)
=-110.5 kJ/mol
即:C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
一、盖斯定律
2.计算原则
(1)若一个反应的焓变△H=a kJ·mol 1,
则其逆反 应的焓变△H=-a kJ·mol 1
(2)若一个化学反应方程式可由另外几个反应 的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而 得到。
课堂检测
例1: 同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
① P4(s,白磷)+5O2(g)=P4O10(s) ΔH1= -2983.2 kJ/mol
② P(s,红磷)+5/4O2(g)=1/4P4O10(s) ΔH2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
①- ②×4得
_________________________________。
P4(s,白磷)=4 P(s,红磷) = -29.2 kJ/mol
H
课堂检测
例2:已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH
所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
①×2 + ②×4 - ③ = ④
课堂检测
例3: 某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
②×2-①×2
二、反应热的计算
△H =E(生成物总能量)—E(反应物总能量)
△H =Σ(反应物总键能)—Σ(生成物总键能)
△H =E(反应物断裂化学键吸收的能量)—E(形成化学键放出的能量)
二、反应热的计算
例1.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
二、反应热的计算
例2.已知下列两个热化学方程式:
2H2(g)+O2(g)=H2O(l)
ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
ΔH=-2220.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ,则混合气体中氢气和丙烷的体积比约是____________ A.1∶3 B.3∶1
C.1∶4 D.5∶13
课堂检测
C
1.根据图中的信息得出的结论正确的是( )
A.2C(s)+O2(g)═2CO(g)△H=﹣110.0kJ/mol
B.C(s)+O2(g)═CO2(g)△H=393.5kJ/molC.CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ/molD.36g碳完全燃烧放出220.0kJ热量
课堂检测
A
2.在25℃、101kPa时,已知:2H2O(g)═O2(g)+2H2(g)△H1Cl2(g)+H2(g)═2HCl(g)△H22Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3则△H3与△H1和△H2间的关系正确的是( )A.△H3=△H1+2△H2 B.△H3=△H1+△H2C.△H3=△H1﹣2△H2 D.△H3=△H1﹣△H2
课堂检测
D
3.LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)═2LiH(s)△H=﹣182kJ mol﹣1
②2H2(g)+O2(g)═2H2O(1)△H=﹣572 kJ mol﹣1
③4Li(s)+O2(g)═2Li2O(s)△H=﹣1196 kJ mol﹣1
则反应2LiH(s)+O2(g)═Li2O(s)+H2O(l)的焓变为( )
A.+351 kJ mol﹣1 B.﹣351 kJ mol﹣1
C.+702 kJ mol﹣1 D.﹣702 kJ mol﹣1
课堂检测
A
4.已知:(1)2H2(g)+O2(g)═2H2O(g)△H1=akJ/mol(2)4H2(g)+2O2(g)═4H2O(g)△H2=bkJ/mol(3)2H2(g)+O2(g)═2H2O(l)△H3=ckJ/mol(4)4H2(g)+2O2(g)═4H2O(l)△H4=dkJ/mol则a、b、c、d的关系正确的是( )A.2a=b<0 B.2c=d>0 C.a<c<0 D.b>d>0
课堂检测
5.已知燃料丙烷(C3H8)完全燃烧后只有CO2和H2O不会造成环境污染,已知有以下四个热化学反应方程式:①C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=-a kJ/mol②C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-b kJ/mol③2C3H8(g)+9O2(g)===4CO2(g)+2CO(g)+8H2O(l) ΔH=-c kJ/mol④2(1)C3H8(g)+2(5)O2(g)===2(3)CO2(g)+2H2O(g) ΔH=-d kJ/mol其中a、b、c、d最大的是( )A.a B.b C.c D.d
课堂检测
6.在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1C.-191 kJ·mol-1 D.+191 kJ·mol-1
课堂检测
7.根据已知信息,按要求写出指定反应的热化学方程式(1)LiH可作飞船的燃料,已知下列反应:①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1试写出LiH在O2中燃烧的热化学方程式______________________________________。(2)工业上制取硝酸铵的流程图如下所示:
课堂检测
已知:4NO(g)+4NH3(g)+O2(g)===4N2(g)+6H2O(g) ΔH=-1 745.2 kJ·mol-1;6NO(g)+4NH3(g)==5N2(g)+6H2O(g) ΔH=-1 925.2 kJ·mol-1。则反应Ⅰ的热化学方程式可表示为___________________________________________。
课堂检测
(3)饮用水中的NO3(-)主要来自于NH4(+)。已知在微生物的作用下,NH4(+)经过两步反应被氧化成NO3(-)。两步反应的能量变化示意图如下:
1 mol NH4(+)全部被氧化成NO3(-)的热化学方程式为________________________________。
高中化学 人教版(2019) 选择性必修1
第一章 化学反应的热效应
第二节 反应热的计算
学习目标
1.巩固化学反应热效应与反应的焓变之间的关系;
2.能用盖斯定律进行有关反应热的简单计算。
问题导引
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,那么如何获得它们的反应热数据呢?
例:C燃烧生成CO,但却很难控制C的氧化只生成CO而不继续生成CO2,那么其反应热该如何获得呢?
C(g)+ O2(g)=CO(g)
一、盖斯定律
1.定义:一个化学反应,不管是一步完成的还是几步完成的,其反应热是相同的。
盖斯
一、盖斯定律
盖斯定律表明,在一定条件下化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
例如 C(s)+ O2(g)=CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
CO(g)+ O2(g)=CO2(g)
C(s)+ O2(g)=CO2(g)
ΔH1=-393.5 kJ/mol
ΔH2=-283.0 kJ/mol
一、盖斯定律
∵ΔH1=ΔH2+ΔH3
∴ΔH2=ΔH1-ΔH3
=-393.5kJ/mol -(-283.0kJ/mol)
=-110.5 kJ/mol
即:C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
一、盖斯定律
2.计算原则
(1)若一个反应的焓变△H=a kJ·mol 1,
则其逆反 应的焓变△H=-a kJ·mol 1
(2)若一个化学反应方程式可由另外几个反应 的化学方程式相加减而得到,则该反应的焓变亦可以由这几个反应的焓变相加减而 得到。
课堂检测
例1: 同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
① P4(s,白磷)+5O2(g)=P4O10(s) ΔH1= -2983.2 kJ/mol
② P(s,红磷)+5/4O2(g)=1/4P4O10(s) ΔH2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
①- ②×4得
_________________________________。
P4(s,白磷)=4 P(s,红磷) = -29.2 kJ/mol
H
课堂检测
例2:已知
① CO(g) + 1/2 O2(g) ====CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) ====H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3 H2O(l) ΔH3=-1370 kJ/mol
试计算④2CO(g)+ 4 H2(g)==== H2O(l)+ C2H5OH(l) 的ΔH
所以,ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
①×2 + ②×4 - ③ = ④
课堂检测
例3: 某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
① N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
② N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
②×2-①×2
二、反应热的计算
△H =E(生成物总能量)—E(反应物总能量)
△H =Σ(反应物总键能)—Σ(生成物总键能)
△H =E(反应物断裂化学键吸收的能量)—E(形成化学键放出的能量)
二、反应热的计算
例1.化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知P4(白磷)、P4O6的分子结构如图所示。现提供以下化学键的键能(kJ·mol-1):P—P 198、P—O 360、O=O 498,则反应P4(s)+3O2(g)=P4O6(g)的反应热ΔH为( )
A.1638 kJ·mol-1 B.-1638 kJ·mol-1
C.-126 kJ·mol-1 D.126 kJ·mol-1
二、反应热的计算
例2.已知下列两个热化学方程式:
2H2(g)+O2(g)=H2O(l)
ΔH=-571.6 kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
ΔH=-2220.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ,则混合气体中氢气和丙烷的体积比约是____________ A.1∶3 B.3∶1
C.1∶4 D.5∶13
课堂检测
C
1.根据图中的信息得出的结论正确的是( )
A.2C(s)+O2(g)═2CO(g)△H=﹣110.0kJ/mol
B.C(s)+O2(g)═CO2(g)△H=393.5kJ/molC.CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ/molD.36g碳完全燃烧放出220.0kJ热量
课堂检测
A
2.在25℃、101kPa时,已知:2H2O(g)═O2(g)+2H2(g)△H1Cl2(g)+H2(g)═2HCl(g)△H22Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3则△H3与△H1和△H2间的关系正确的是( )A.△H3=△H1+2△H2 B.△H3=△H1+△H2C.△H3=△H1﹣2△H2 D.△H3=△H1﹣△H2
课堂检测
D
3.LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)═2LiH(s)△H=﹣182kJ mol﹣1
②2H2(g)+O2(g)═2H2O(1)△H=﹣572 kJ mol﹣1
③4Li(s)+O2(g)═2Li2O(s)△H=﹣1196 kJ mol﹣1
则反应2LiH(s)+O2(g)═Li2O(s)+H2O(l)的焓变为( )
A.+351 kJ mol﹣1 B.﹣351 kJ mol﹣1
C.+702 kJ mol﹣1 D.﹣702 kJ mol﹣1
课堂检测
A
4.已知:(1)2H2(g)+O2(g)═2H2O(g)△H1=akJ/mol(2)4H2(g)+2O2(g)═4H2O(g)△H2=bkJ/mol(3)2H2(g)+O2(g)═2H2O(l)△H3=ckJ/mol(4)4H2(g)+2O2(g)═4H2O(l)△H4=dkJ/mol则a、b、c、d的关系正确的是( )A.2a=b<0 B.2c=d>0 C.a<c<0 D.b>d>0
课堂检测
5.已知燃料丙烷(C3H8)完全燃烧后只有CO2和H2O不会造成环境污染,已知有以下四个热化学反应方程式:①C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=-a kJ/mol②C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-b kJ/mol③2C3H8(g)+9O2(g)===4CO2(g)+2CO(g)+8H2O(l) ΔH=-c kJ/mol④2(1)C3H8(g)+2(5)O2(g)===2(3)CO2(g)+2H2O(g) ΔH=-d kJ/mol其中a、b、c、d最大的是( )A.a B.b C.c D.d
课堂检测
6.在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1C.-191 kJ·mol-1 D.+191 kJ·mol-1
课堂检测
7.根据已知信息,按要求写出指定反应的热化学方程式(1)LiH可作飞船的燃料,已知下列反应:①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1试写出LiH在O2中燃烧的热化学方程式______________________________________。(2)工业上制取硝酸铵的流程图如下所示:
课堂检测
已知:4NO(g)+4NH3(g)+O2(g)===4N2(g)+6H2O(g) ΔH=-1 745.2 kJ·mol-1;6NO(g)+4NH3(g)==5N2(g)+6H2O(g) ΔH=-1 925.2 kJ·mol-1。则反应Ⅰ的热化学方程式可表示为___________________________________________。
课堂检测
(3)饮用水中的NO3(-)主要来自于NH4(+)。已知在微生物的作用下,NH4(+)经过两步反应被氧化成NO3(-)。两步反应的能量变化示意图如下:
1 mol NH4(+)全部被氧化成NO3(-)的热化学方程式为________________________________。
