2023年中考化学复习 专题四 工艺流程题课件(共61张PPT)
文档属性
| 名称 | 2023年中考化学复习 专题四 工艺流程题课件(共61张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 12:26:18 | ||
图片预览










文档简介
(共61张PPT)
第二板块 专题复习
专题四 工艺流程题
01
题型解读
02
例题分析
03
题型加练
题型解读
化学工艺流程题是以化工生产中的真实情景为素材,与化工生产成本、产品提纯、环境保护等相融合,把生产流程用框图的形式表示出来,对生产流程中有关的化学知识进行设问。考查的内容涉及:实验步骤、实验注意事项、操作名称、物质的制备、检验、分离提纯等在化工生产中的实际应用,要求学生依据流程图分析原理,紧扣信息,抓住关键、准确答题。注重对考生综合化学思维能力的考查。
纵观近几年的广东中考试题可发现,工艺流程题的命题背景新颖,通常有以下几种类型:
类型 实例
物质的制备 2021、2022广东;2020、2022广州;2020、2021深圳
物质的回收与利用 2020广东;2021广州
物质的分离、提纯 2019广东
混合物成分的确定 2020广州
例题分析
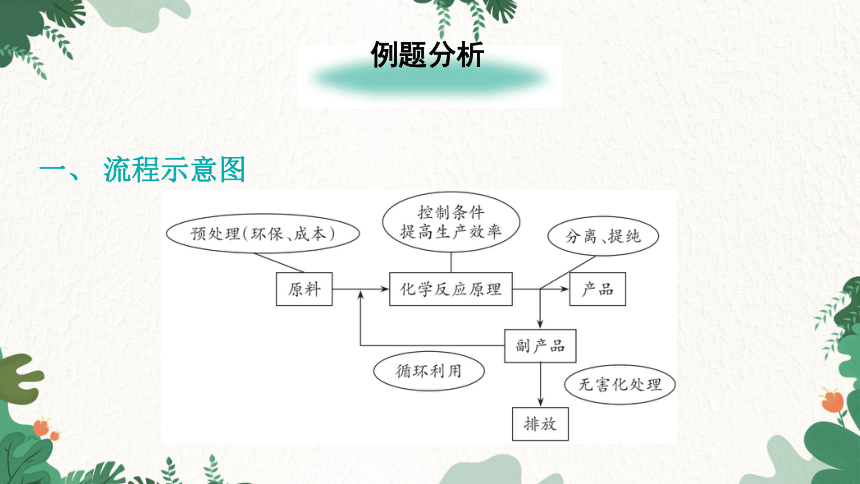
一、 流程示意图
操作 目的
研磨 增大反应物间的接触面积,使反应快速充分进行
水浸 分离可溶物与不溶物
酸或碱浸 通过加酸或碱溶液,使物质发生化学反应而溶解,与不溶物通过过滤分离
研磨;增大酸或碱的浓度;升高温度;搅拌等 提高化学反应速率
【注意】为了增大原料转化率,工业流程中所用的试剂往往过量,要注意过量的试剂进入了滤液还是滤渣里,回答物质成分时不要漏写
二、 流程分析
1. 流程中所用的原料通常要进行预处理,如研磨、水浸、酸或碱浸等。
2. 利用信息书写流程中的化学方程式
(1)根据箭头判断反应物和生成物。“物质→”代表的物质是反应物,“物质→ ”代表的物质是生成物。
(2)根据元素守恒与反应规律,判断没有给出的其他反应物或生成物。
(3)若用已知物书写的化学方程式未配平,可根据质量守恒定律(主要是原子守恒)进行配平,必要时可考虑添加氧气或水。如反应强调在空气中进行,要考虑空气中氧气是否参与反应;在溶液中进行要考虑水是否参与反应。
3. 流程中反应条件的控制
操作 目的
温度控制 通常防止某种物质在温度高时会分解、挥发、熔化等;防止某种副反应的发生
调节pH 控制溶液的酸碱度,在一定pH范围内,使某些金属离子开始沉淀或者沉淀完全
4. 提高原料利用率的问题
(1)箭头回转指向前面方框的是可循环利用的物质;前面反应的生成物进入后面流程中作为反应物反应,也是可循环利用的物质。可循环利用的物质不一定都有箭头显示,需根据具体反应判断。
(2)有些副产品在农业生产中可作肥料(看是否含有N、K、P元素)。
(3)反应释放的能量尽可能再利用。
5. 流程中的分离、提纯等操作
(1)“ ”必然是经过了过滤操作。
(2)从溶液中获得晶体的方法有两种:蒸发结晶、降温结晶。
得到溶解度受温度影响变化不大的物质(如从氯化钠与硝酸钾混合溶液中提纯氯化钠) 蒸发结晶,趁热过滤
得到溶解度随温度升高而增大的物质 蒸发浓缩→降温结晶→过滤→洗涤→干燥
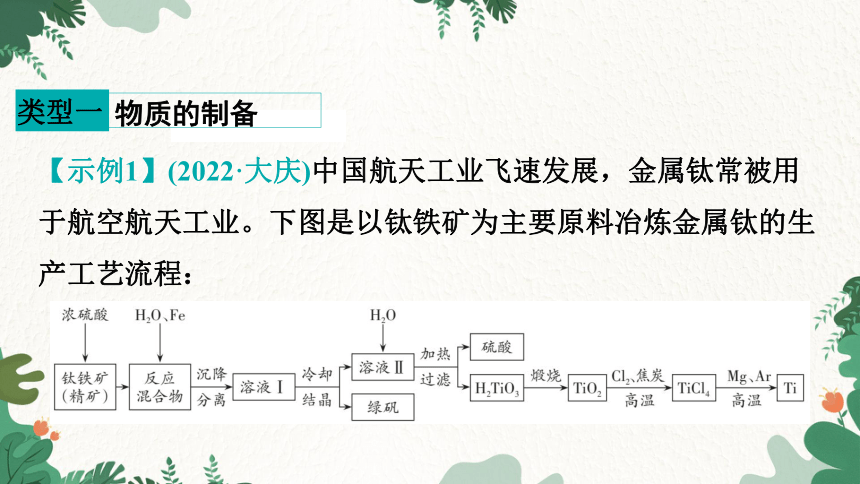
【示例1】(2022·大庆)中国航天工业飞速发展,金属钛常被用于航空航天工业。下图是以钛铁矿为主要原料冶炼金属钛的生产工艺流程:
类型一
物质的制备
已知:钛铁矿主要成分为钛酸亚铁(FeTiO3)。请回答下列问题:
(1)FeTiO3中钛元素的化合价为________。
(2)钛铁矿浸在浓硫酸中发生反应FeTiO3+2H2SO4(浓)== TiOSO4+FeSO4+2H2O,反应前需将钛铁矿粉碎的目的是__________________________________________________。
+4
增大反应物间的接触面积,加快反应速率
(3)溶液Ⅱ的主要溶质为TiOSO4,加热时和水发生反应,经过滤得到H2TiO3,请写出化学方程式:__________________
________________________________________________。
(4)TiO2、Cl2和焦炭发生反应TiO2 + 2C + 2Cl2 == TiCl4 + 2X,X的化学式为________。
TiOSO4+2H2O == H2TiO3↓+H2SO4
△
CO
高温
(5) TiCl4 + 2Mg == Ar2MgCl2 + Ti,此反应中气体Ar的作用是________________________________________。
(6)在流程中,可用Na代替Mg制取Ti,其原因是_____________
______________________________________________________。
作保护气,防止钛被氧化
高温
Ar
钠的金属活动性比镁强
【变式1】(2022·苏州)锰元素能形成MnO、MnO2、Mn2O3和Mn3O4等多种氧化物,其中Mn3O4是重要的结构材料。工业用硫酸锰(MnSO4)制备Mn3O4的流程如下:
(1)“沉淀”反应是MnSO4+2NH3·H2O == Mn(OH)2↓+ (NH4)2 SO4,该反应的基本类型为______________。
(2)写出“过滤”所得滤液的一种用途___________。
复分解反应
作氮肥
(3)将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是___________________________________。
(4)“氧化”时,Mn(OH)2与空气中的氧气在60 ℃条件下反应生成Mn3O4,该反应的化学方程式为______________________
_______________________________________________。
增大氢氧化锰与氧气的接触面积
6Mn(OH )2 + O2 == 2Mn3O4 + 6H2O
60 ℃
(5)通过测定固体产物中锰元素的质量分数来推断产物成分。“氧化”所得固体产物中锰元素的质量分数随通空气时间的变化如图所示。
①通空气8小时左右,所得固体几乎全部为Mn3O4。推出该结论的依据是____________________________________。
Mn3O4中锰元素的质量分数约为72%
②通空气超过8小时,产物中锰元素的质量分数减小的原因是__________________________________________________
_________________________________________________。
部分Mn3O4转化为更高价态的锰的氧化物(或部分Mn3O4转化为Mn2O3和MnO2等物质)
【示例2】(2022·广西北部湾经济区)某工厂生产硼砂产生的固体废料中,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3的质量分数为63%。用该固体废料回收镁的工艺流程如下:
类型二
物质的回收与利用
(1)操作I的名称是_________。
(2)“酸浸”时,试剂A的化学式是_________,为加快酸浸速率,可采取的措施是__________________________(写一条即可)。
过滤
H2SO4
将固体废料研磨(合理即可)
(3)滤液a中的阳离子是____________________。(填离子符号)
(4)“沉镁”时发生反应的化学方程式是______________________
__________________________________________________。
H+、Mg2+、Al3+、Fe3+
MgSO4 + 2NaOH == Mg(OH)2↓+ Na2SO4
(5)若流程中镁的总损耗为10%,则100 t的固体废料可回收镁的质量是________。
16.2 t
【变式2】(2021·广州)我国将力争2060年前实现碳中和,CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如左下图所示。
①捕捉室中NaOH溶液常喷成雾状,优点是________________
____________________________________________________。
②“反应分离”环节发生的复分解反应是___________________
__________________________________(写化学方程式)。
增大NaOH溶液与
CO2气体的接触面积,使吸收CO2更充分、更快速
Na2CO3+Ca(OH)2 == 2NaOH+CaCO3↓
③“反应分离”环节分离物质采用的方法是____________。
④CO2用途广泛,写出一种用途:________________________
___________________________________________________。
过滤
作气体肥料(或人工降雨等,
合理即可)
(2)CaO固体也可以捕捉回收CO2 。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如右上图。
①写出400~600 ℃范围内分解反应的化学方程式:__________
_____________________。(CaC2O4·H2O的相对分子质量:146)
CaC2O4 == CaCO3+CO↑
400~600 ℃
②据图分析,CaO捕捉CO2的反应温度应________(填“高于”或“低于”)800 ℃。
低于
【解析】(2)②固体质量从1.00 g降到0.56 g时,说明温度高于800 ℃时有利于CaCO3的分解,而不利于CaO吸收 CO2 ;而温度低于800 ℃时,则有利于CaO吸收CO2。
【示例3】(2022·福建)我国古代提纯焰硝(含KNO3和少量NaCl、CaCl2等)工艺的主要过程示意如下:
类型三
物质的分离、提纯
(1)步骤中,“搅拌”的作用是___________________(写一种)。
(2)步骤Ⅲ加小灰水(含K2CO3)时,发生反应的化学方程式为_________________________________________________。
加快溶解(或均匀受热)
K2CO3+CaCl2 == CaCO3↓+ 2KCl
(3)下图为硝酸钾、氯化钠的溶解度曲线。步骤Ⅳ在较高温度下过滤的目的是_______________________。
防止硝酸钾析出
(4)步骤V析出硝酸钾晶体的过程称之为________。
(5)“溶液2”一定含有的溶质有KCl、________和_____________
__________________________________________(填化学式)。
结晶
KNO3
NaCl(或NaNO3,两空答案可互换)
【解析】(5)根据碳酸钾除去了溶液中的氯化钙,但生成了氯化钾,故溶液中的离子有钾离子、钠离子、硝酸根离子、氯离子,虽有硝酸钾析出但溶液中仍会溶解部分硝酸钾,故“溶液2”一定含有的溶质有KCl、KNO3、NaCl(或NaNO3)。
【变式3】(2022·常德)某火力发电厂产生的固体废弃物粉煤灰中含有较多的氧化铝(Al2O3)。从粉煤灰中提取氧化铝的工艺流程如图,请回答下列问题:
(1)“操作a”的名称是________。
(2)加足量氨水能将Al3+全部转化成Al2O3 ,写出氨水的化学式_________________。
过滤
NH3·H2O
(3)“酸浸”时发生的主要反应的化学方程式为______________
_________________________________________________。
(4)写出“煅烧”时涉及的主要反应的化学方程式____________
____________________________________________________。
Al2O3+3H2SO4 == Al2 (SO4)3+3H2O
2Al(OH)3 == Al2O3+3H2O
煅烧
【示例4】(2022·包头)某食品包装袋中脱氧剂的成分可能含有铁粉、碳粉、碳酸钠、氯化钠、氧化铁中的几种,兴趣小组为确定其成分,进行如下实验。
回答下列问题:
类型四
混合物成分的确定
(1)固体A的化学式为________。
(2)操作I的名称是________。
(3)黄色溶液b中一定存在的阳离子是________(填离子符号)。
Fe
过滤
Fe3+、H+
(4)综合分析该脱氧剂中一定含有的成分是__________________。
(5)为验证该脱氧剂中还未确定的物质是否存在,应采用的实验方案是____________________________________________
________________________________________________________________________________________________________(写出实验操作、现象及结论)。
Fe、C、Na2CO3、Fe2O3
取少许滤液a于试管中,加入过量稀硝酸,再加入
AgNO3溶液,若产生白色沉淀,则证明脱氧剂中含有NaCl;若无白色沉淀产生,则证明脱氧剂中不含有NaCl
【解析】用磁铁吸引,得到固体A,说明含铁,则固体A为铁;向固体混合物B中加入足量水溶解,得到滤液a和固体混合物C,滤液a的pH = 9,显碱性,说明含碳酸钠;向固体混合物C中加入过量稀盐酸,得到黄色溶液b和黑色固体D,氧化铁能与稀盐酸反应生成氯化铁和水,形成黄色溶液,说明含氧化铁,碳粉和稀盐酸不反应,黑色固体D为碳粉,故脱氧剂中含碳粉,无法确定是否含氯化钠。
题型加练
1. (2022·广州)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_________________。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为________。
钾元素和氮元素
+3
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是___________________________________。
(4)步骤4的操作是____________、过滤。
氯化钠的溶解度受温度变化影响比较小
降温结晶
(5)KCl用量的估算依据是________(填标号)。
A. KCl与NaNO3的粒子个数比为1∶1
B. KCl与NaNO3的质量比为1∶1
C. KCl与NaNO3在溶液中的质量分数之比为1∶1
A
(6)该工艺所得农用KNO3混有一定量NaCl。取25 g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质量为14.35 g,则样品中杂质NaCl的质量是________g,样品含KNO3________%(质量分数)。(相对分子质量:KNO3 101 NaCl 58.5 AgNO3 170 AgCl 143.5)
5.85
76.6
2. (2021·广东)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如下图。
(1)反应①的化学方程式为_______________________________;操作Ⅰ的名称是________。
CaCO3 == CaO + CO2↑
高温
过滤
(2)反应②的化学方程式为___________________________,该反应属于_____________反应(填基本反应类型)。
MgO + 2HCl == MgCl2 + H2O
复分解
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由______________________________________
__________________________________________________。
有影响,氧化钙与稀硫酸反应生成微溶于
水的硫酸钙,从而降低碳酸钙的产率
(4)大气中CO2含量不断上升,会导致_________。我国在联合国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施:_________________________
_______________________。
温室效应
植树造林(或低碳出行等,
合理即可)
3. (2021·深圳)某科学兴趣小组,用废渣(主要为CaCO3,还含有C、Fe2O3、MgO等少量杂质)去制作CaCl2,反应过程如图所示。
(1)Ⅰ过程中加过量稀盐酸的目的是________________________
__________________________________________________。
(2)Ⅰ过程中MgO发生反应的化学方程式为_________________
___________,此反应为________反应(填基本反应类型)。
使废渣中的CaCO3、
Fe2O3、MgO完全反应
MgO + 2HCl ==
MgCl2 + H2O
复分解
(3)滤渣一的成分为________(填化学式)。
(4)X溶液为________(填化学式)。
(5)NaCl在生活中的用处:________________________(写一例)。
C
NaOH
作调味品(或配制生理盐水等)
(6)已知CaCl2与焦炭、BaSO4在高温下生成BaCl2和CO和CaS,写出该反应的化学方程式_____________________________
_________________________________________________。
CaCl2 + 4C + BaSO4 ==
BaCl2 + 4CO↑ + CaS
高温
4. (2020·广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:
(1)该废酸液的pH________7(填“<”或“>”)。操作Ⅰ的名称为________。
(2)电石渣转化为石灰乳的过程会________(填“吸收”或“放出”)热量。
<
过滤
放出
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成产物是________和________(填化学式)。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为________。
Fe(OH)2
CaSO4
Fe3O4
溶液的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰褐色
产率(%) 43.9 50.6 86.2 93.0 92.3 91.6
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为________。pH较低时产率较低的主要原因是______________________________。
7.5
pH较低时,Fe(OH)2不易生成
5. (2019·广东)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有________。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是_________________________________________________。此过程中Zn还能起到除铜作用,除铜的化学方程式为__________________________,此反应属于__________(填基本反应类型)。
Cu
反应过程中会产生氢气,氢气具有可燃性,防止发生爆炸
Zn + CuSO4 == Cu + ZnSO4
置换反应
(3)调节pH可用NaOH,但不能过量,其原因是_____________
_________________________________________________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为_____________
__________________________________________________。
Zn(OH)2溶于强碱形成可溶性盐,导致产率偏低
Zn(OH)2 == ZnO + H2O
焙烧
谢谢大家!
第二板块 专题复习
专题四 工艺流程题
01
题型解读
02
例题分析
03
题型加练
题型解读
化学工艺流程题是以化工生产中的真实情景为素材,与化工生产成本、产品提纯、环境保护等相融合,把生产流程用框图的形式表示出来,对生产流程中有关的化学知识进行设问。考查的内容涉及:实验步骤、实验注意事项、操作名称、物质的制备、检验、分离提纯等在化工生产中的实际应用,要求学生依据流程图分析原理,紧扣信息,抓住关键、准确答题。注重对考生综合化学思维能力的考查。
纵观近几年的广东中考试题可发现,工艺流程题的命题背景新颖,通常有以下几种类型:
类型 实例
物质的制备 2021、2022广东;2020、2022广州;2020、2021深圳
物质的回收与利用 2020广东;2021广州
物质的分离、提纯 2019广东
混合物成分的确定 2020广州
例题分析
一、 流程示意图
操作 目的
研磨 增大反应物间的接触面积,使反应快速充分进行
水浸 分离可溶物与不溶物
酸或碱浸 通过加酸或碱溶液,使物质发生化学反应而溶解,与不溶物通过过滤分离
研磨;增大酸或碱的浓度;升高温度;搅拌等 提高化学反应速率
【注意】为了增大原料转化率,工业流程中所用的试剂往往过量,要注意过量的试剂进入了滤液还是滤渣里,回答物质成分时不要漏写
二、 流程分析
1. 流程中所用的原料通常要进行预处理,如研磨、水浸、酸或碱浸等。
2. 利用信息书写流程中的化学方程式
(1)根据箭头判断反应物和生成物。“物质→”代表的物质是反应物,“物质→ ”代表的物质是生成物。
(2)根据元素守恒与反应规律,判断没有给出的其他反应物或生成物。
(3)若用已知物书写的化学方程式未配平,可根据质量守恒定律(主要是原子守恒)进行配平,必要时可考虑添加氧气或水。如反应强调在空气中进行,要考虑空气中氧气是否参与反应;在溶液中进行要考虑水是否参与反应。
3. 流程中反应条件的控制
操作 目的
温度控制 通常防止某种物质在温度高时会分解、挥发、熔化等;防止某种副反应的发生
调节pH 控制溶液的酸碱度,在一定pH范围内,使某些金属离子开始沉淀或者沉淀完全
4. 提高原料利用率的问题
(1)箭头回转指向前面方框的是可循环利用的物质;前面反应的生成物进入后面流程中作为反应物反应,也是可循环利用的物质。可循环利用的物质不一定都有箭头显示,需根据具体反应判断。
(2)有些副产品在农业生产中可作肥料(看是否含有N、K、P元素)。
(3)反应释放的能量尽可能再利用。
5. 流程中的分离、提纯等操作
(1)“ ”必然是经过了过滤操作。
(2)从溶液中获得晶体的方法有两种:蒸发结晶、降温结晶。
得到溶解度受温度影响变化不大的物质(如从氯化钠与硝酸钾混合溶液中提纯氯化钠) 蒸发结晶,趁热过滤
得到溶解度随温度升高而增大的物质 蒸发浓缩→降温结晶→过滤→洗涤→干燥
【示例1】(2022·大庆)中国航天工业飞速发展,金属钛常被用于航空航天工业。下图是以钛铁矿为主要原料冶炼金属钛的生产工艺流程:
类型一
物质的制备
已知:钛铁矿主要成分为钛酸亚铁(FeTiO3)。请回答下列问题:
(1)FeTiO3中钛元素的化合价为________。
(2)钛铁矿浸在浓硫酸中发生反应FeTiO3+2H2SO4(浓)== TiOSO4+FeSO4+2H2O,反应前需将钛铁矿粉碎的目的是__________________________________________________。
+4
增大反应物间的接触面积,加快反应速率
(3)溶液Ⅱ的主要溶质为TiOSO4,加热时和水发生反应,经过滤得到H2TiO3,请写出化学方程式:__________________
________________________________________________。
(4)TiO2、Cl2和焦炭发生反应TiO2 + 2C + 2Cl2 == TiCl4 + 2X,X的化学式为________。
TiOSO4+2H2O == H2TiO3↓+H2SO4
△
CO
高温
(5) TiCl4 + 2Mg == Ar2MgCl2 + Ti,此反应中气体Ar的作用是________________________________________。
(6)在流程中,可用Na代替Mg制取Ti,其原因是_____________
______________________________________________________。
作保护气,防止钛被氧化
高温
Ar
钠的金属活动性比镁强
【变式1】(2022·苏州)锰元素能形成MnO、MnO2、Mn2O3和Mn3O4等多种氧化物,其中Mn3O4是重要的结构材料。工业用硫酸锰(MnSO4)制备Mn3O4的流程如下:
(1)“沉淀”反应是MnSO4+2NH3·H2O == Mn(OH)2↓+ (NH4)2 SO4,该反应的基本类型为______________。
(2)写出“过滤”所得滤液的一种用途___________。
复分解反应
作氮肥
(3)将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是___________________________________。
(4)“氧化”时,Mn(OH)2与空气中的氧气在60 ℃条件下反应生成Mn3O4,该反应的化学方程式为______________________
_______________________________________________。
增大氢氧化锰与氧气的接触面积
6Mn(OH )2 + O2 == 2Mn3O4 + 6H2O
60 ℃
(5)通过测定固体产物中锰元素的质量分数来推断产物成分。“氧化”所得固体产物中锰元素的质量分数随通空气时间的变化如图所示。
①通空气8小时左右,所得固体几乎全部为Mn3O4。推出该结论的依据是____________________________________。
Mn3O4中锰元素的质量分数约为72%
②通空气超过8小时,产物中锰元素的质量分数减小的原因是__________________________________________________
_________________________________________________。
部分Mn3O4转化为更高价态的锰的氧化物(或部分Mn3O4转化为Mn2O3和MnO2等物质)
【示例2】(2022·广西北部湾经济区)某工厂生产硼砂产生的固体废料中,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3的质量分数为63%。用该固体废料回收镁的工艺流程如下:
类型二
物质的回收与利用
(1)操作I的名称是_________。
(2)“酸浸”时,试剂A的化学式是_________,为加快酸浸速率,可采取的措施是__________________________(写一条即可)。
过滤
H2SO4
将固体废料研磨(合理即可)
(3)滤液a中的阳离子是____________________。(填离子符号)
(4)“沉镁”时发生反应的化学方程式是______________________
__________________________________________________。
H+、Mg2+、Al3+、Fe3+
MgSO4 + 2NaOH == Mg(OH)2↓+ Na2SO4
(5)若流程中镁的总损耗为10%,则100 t的固体废料可回收镁的质量是________。
16.2 t
【变式2】(2021·广州)我国将力争2060年前实现碳中和,CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如左下图所示。
①捕捉室中NaOH溶液常喷成雾状,优点是________________
____________________________________________________。
②“反应分离”环节发生的复分解反应是___________________
__________________________________(写化学方程式)。
增大NaOH溶液与
CO2气体的接触面积,使吸收CO2更充分、更快速
Na2CO3+Ca(OH)2 == 2NaOH+CaCO3↓
③“反应分离”环节分离物质采用的方法是____________。
④CO2用途广泛,写出一种用途:________________________
___________________________________________________。
过滤
作气体肥料(或人工降雨等,
合理即可)
(2)CaO固体也可以捕捉回收CO2 。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如右上图。
①写出400~600 ℃范围内分解反应的化学方程式:__________
_____________________。(CaC2O4·H2O的相对分子质量:146)
CaC2O4 == CaCO3+CO↑
400~600 ℃
②据图分析,CaO捕捉CO2的反应温度应________(填“高于”或“低于”)800 ℃。
低于
【解析】(2)②固体质量从1.00 g降到0.56 g时,说明温度高于800 ℃时有利于CaCO3的分解,而不利于CaO吸收 CO2 ;而温度低于800 ℃时,则有利于CaO吸收CO2。
【示例3】(2022·福建)我国古代提纯焰硝(含KNO3和少量NaCl、CaCl2等)工艺的主要过程示意如下:
类型三
物质的分离、提纯
(1)步骤中,“搅拌”的作用是___________________(写一种)。
(2)步骤Ⅲ加小灰水(含K2CO3)时,发生反应的化学方程式为_________________________________________________。
加快溶解(或均匀受热)
K2CO3+CaCl2 == CaCO3↓+ 2KCl
(3)下图为硝酸钾、氯化钠的溶解度曲线。步骤Ⅳ在较高温度下过滤的目的是_______________________。
防止硝酸钾析出
(4)步骤V析出硝酸钾晶体的过程称之为________。
(5)“溶液2”一定含有的溶质有KCl、________和_____________
__________________________________________(填化学式)。
结晶
KNO3
NaCl(或NaNO3,两空答案可互换)
【解析】(5)根据碳酸钾除去了溶液中的氯化钙,但生成了氯化钾,故溶液中的离子有钾离子、钠离子、硝酸根离子、氯离子,虽有硝酸钾析出但溶液中仍会溶解部分硝酸钾,故“溶液2”一定含有的溶质有KCl、KNO3、NaCl(或NaNO3)。
【变式3】(2022·常德)某火力发电厂产生的固体废弃物粉煤灰中含有较多的氧化铝(Al2O3)。从粉煤灰中提取氧化铝的工艺流程如图,请回答下列问题:
(1)“操作a”的名称是________。
(2)加足量氨水能将Al3+全部转化成Al2O3 ,写出氨水的化学式_________________。
过滤
NH3·H2O
(3)“酸浸”时发生的主要反应的化学方程式为______________
_________________________________________________。
(4)写出“煅烧”时涉及的主要反应的化学方程式____________
____________________________________________________。
Al2O3+3H2SO4 == Al2 (SO4)3+3H2O
2Al(OH)3 == Al2O3+3H2O
煅烧
【示例4】(2022·包头)某食品包装袋中脱氧剂的成分可能含有铁粉、碳粉、碳酸钠、氯化钠、氧化铁中的几种,兴趣小组为确定其成分,进行如下实验。
回答下列问题:
类型四
混合物成分的确定
(1)固体A的化学式为________。
(2)操作I的名称是________。
(3)黄色溶液b中一定存在的阳离子是________(填离子符号)。
Fe
过滤
Fe3+、H+
(4)综合分析该脱氧剂中一定含有的成分是__________________。
(5)为验证该脱氧剂中还未确定的物质是否存在,应采用的实验方案是____________________________________________
________________________________________________________________________________________________________(写出实验操作、现象及结论)。
Fe、C、Na2CO3、Fe2O3
取少许滤液a于试管中,加入过量稀硝酸,再加入
AgNO3溶液,若产生白色沉淀,则证明脱氧剂中含有NaCl;若无白色沉淀产生,则证明脱氧剂中不含有NaCl
【解析】用磁铁吸引,得到固体A,说明含铁,则固体A为铁;向固体混合物B中加入足量水溶解,得到滤液a和固体混合物C,滤液a的pH = 9,显碱性,说明含碳酸钠;向固体混合物C中加入过量稀盐酸,得到黄色溶液b和黑色固体D,氧化铁能与稀盐酸反应生成氯化铁和水,形成黄色溶液,说明含氧化铁,碳粉和稀盐酸不反应,黑色固体D为碳粉,故脱氧剂中含碳粉,无法确定是否含氯化钠。
题型加练
1. (2022·广州)二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有_________________。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为________。
钾元素和氮元素
+3
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是___________________________________。
(4)步骤4的操作是____________、过滤。
氯化钠的溶解度受温度变化影响比较小
降温结晶
(5)KCl用量的估算依据是________(填标号)。
A. KCl与NaNO3的粒子个数比为1∶1
B. KCl与NaNO3的质量比为1∶1
C. KCl与NaNO3在溶液中的质量分数之比为1∶1
A
(6)该工艺所得农用KNO3混有一定量NaCl。取25 g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质量为14.35 g,则样品中杂质NaCl的质量是________g,样品含KNO3________%(质量分数)。(相对分子质量:KNO3 101 NaCl 58.5 AgNO3 170 AgCl 143.5)
5.85
76.6
2. (2021·广东)牙膏中常用碳酸钙粉末做摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如下图。
(1)反应①的化学方程式为_______________________________;操作Ⅰ的名称是________。
CaCO3 == CaO + CO2↑
高温
过滤
(2)反应②的化学方程式为___________________________,该反应属于_____________反应(填基本反应类型)。
MgO + 2HCl == MgCl2 + H2O
复分解
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由______________________________________
__________________________________________________。
有影响,氧化钙与稀硫酸反应生成微溶于
水的硫酸钙,从而降低碳酸钙的产率
(4)大气中CO2含量不断上升,会导致_________。我国在联合国大会上提出:努力争取2060年前实现“碳中和”,请提出一条实现“碳中和”的措施:_________________________
_______________________。
温室效应
植树造林(或低碳出行等,
合理即可)
3. (2021·深圳)某科学兴趣小组,用废渣(主要为CaCO3,还含有C、Fe2O3、MgO等少量杂质)去制作CaCl2,反应过程如图所示。
(1)Ⅰ过程中加过量稀盐酸的目的是________________________
__________________________________________________。
(2)Ⅰ过程中MgO发生反应的化学方程式为_________________
___________,此反应为________反应(填基本反应类型)。
使废渣中的CaCO3、
Fe2O3、MgO完全反应
MgO + 2HCl ==
MgCl2 + H2O
复分解
(3)滤渣一的成分为________(填化学式)。
(4)X溶液为________(填化学式)。
(5)NaCl在生活中的用处:________________________(写一例)。
C
NaOH
作调味品(或配制生理盐水等)
(6)已知CaCl2与焦炭、BaSO4在高温下生成BaCl2和CO和CaS,写出该反应的化学方程式_____________________________
_________________________________________________。
CaCl2 + 4C + BaSO4 ==
BaCl2 + 4CO↑ + CaS
高温
4. (2020·广东)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如下:
(1)该废酸液的pH________7(填“<”或“>”)。操作Ⅰ的名称为________。
(2)电石渣转化为石灰乳的过程会________(填“吸收”或“放出”)热量。
<
过滤
放出
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成产物是________和________(填化学式)。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为________。
Fe(OH)2
CaSO4
Fe3O4
溶液的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰褐色
产率(%) 43.9 50.6 86.2 93.0 92.3 91.6
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为________。pH较低时产率较低的主要原因是______________________________。
7.5
pH较低时,Fe(OH)2不易生成
5. (2019·广东)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有________。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是_________________________________________________。此过程中Zn还能起到除铜作用,除铜的化学方程式为__________________________,此反应属于__________(填基本反应类型)。
Cu
反应过程中会产生氢气,氢气具有可燃性,防止发生爆炸
Zn + CuSO4 == Cu + ZnSO4
置换反应
(3)调节pH可用NaOH,但不能过量,其原因是_____________
_________________________________________________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为_____________
__________________________________________________。
Zn(OH)2溶于强碱形成可溶性盐,导致产率偏低
Zn(OH)2 == ZnO + H2O
焙烧
谢谢大家!
同课章节目录
