专题8 有机化合物的获得与应用 复习教案(共一课时) 高一下学期化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题8 有机化合物的获得与应用 复习教案(共一课时) 高一下学期化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 593.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 16:45:25 | ||
图片预览


文档简介
课题: 8 有机物的获得与应用 复习
教学目的要求: 1.掌握常见有机物的分子式、结构及化学性质。2.掌握常见的有机反应类型。3.了解常见有机物的鉴别。4.巩固有机合成的方法。
教学重点: 有机反应类型、有机物的分子式、结构及化学性质
教学难点: 有机反应类型、有机物的分子式、结构及化学性质
教 学 过 程 教师活动 学生活动
【课前回顾】 知识点回顾 有机高分子化合物的概念及分类 有机高分子的合成方法 加聚反应 缩聚反应 3.判断单体的方法 作业问题评讲 引导回顾 提问旧知 要点讲解 巩固思考 回答问题 回顾 笔记批注
教 学 过 程 教师活动 学生活动
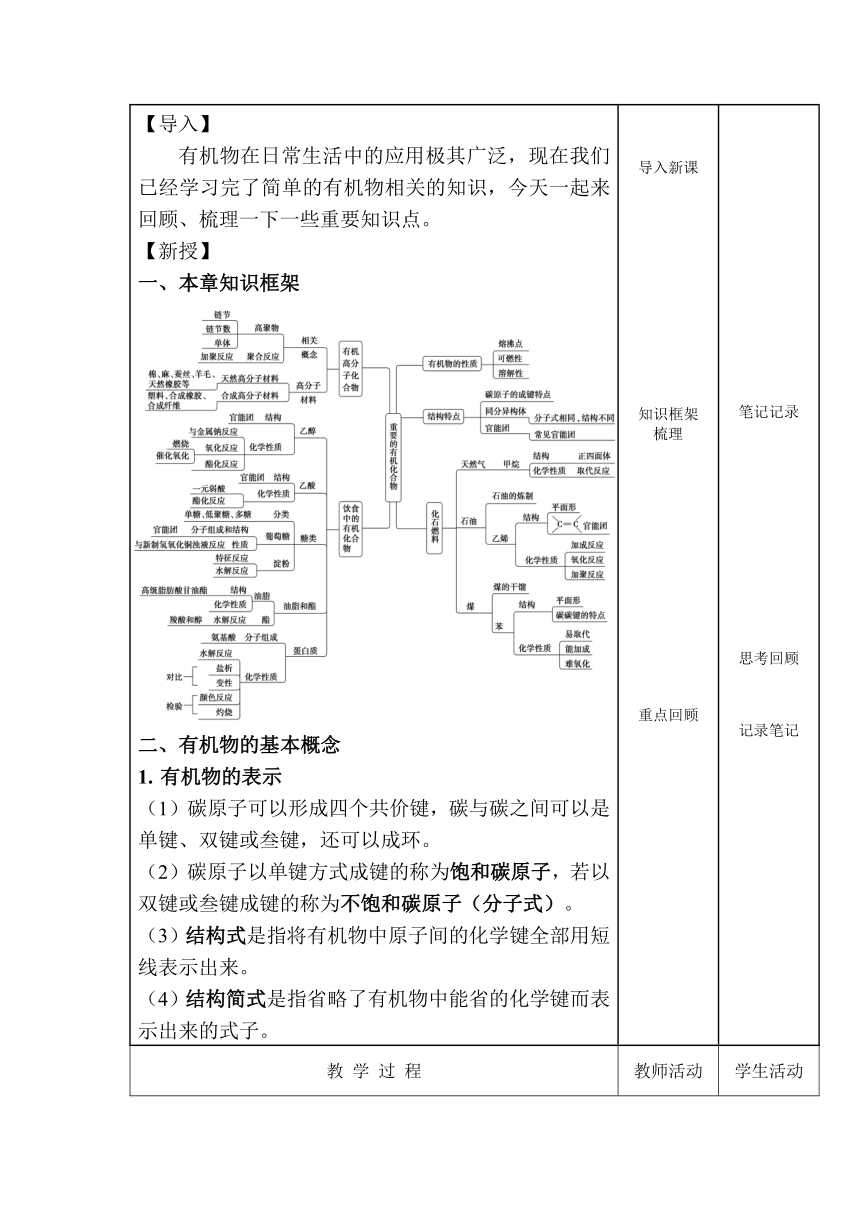
【导入】 有机物在日常生活中的应用极其广泛,现在我们已经学习完了简单的有机物相关的知识,今天一起来回顾、梳理一下一些重要知识点。 【新授】 本章知识框架 有机物的基本概念 有机物的表示 (1)碳原子可以形成四个共价键,碳与碳之间可以是单键、双键或叁键,还可以成环。 (2)碳原子以单键方式成键的称为饱和碳原子,若以双键或叁键成键的称为不饱和碳原子(分子式)。 (3)结构式是指将有机物中原子间的化学键全部用短线表示出来。 (4)结构简式是指省略了有机物中能省的化学键而表示出来的式子。 导入新课 知识框架 梳理 重点回顾 笔记记录 思考回顾 记录笔记
教 学 过 程 教师活动 学生活动
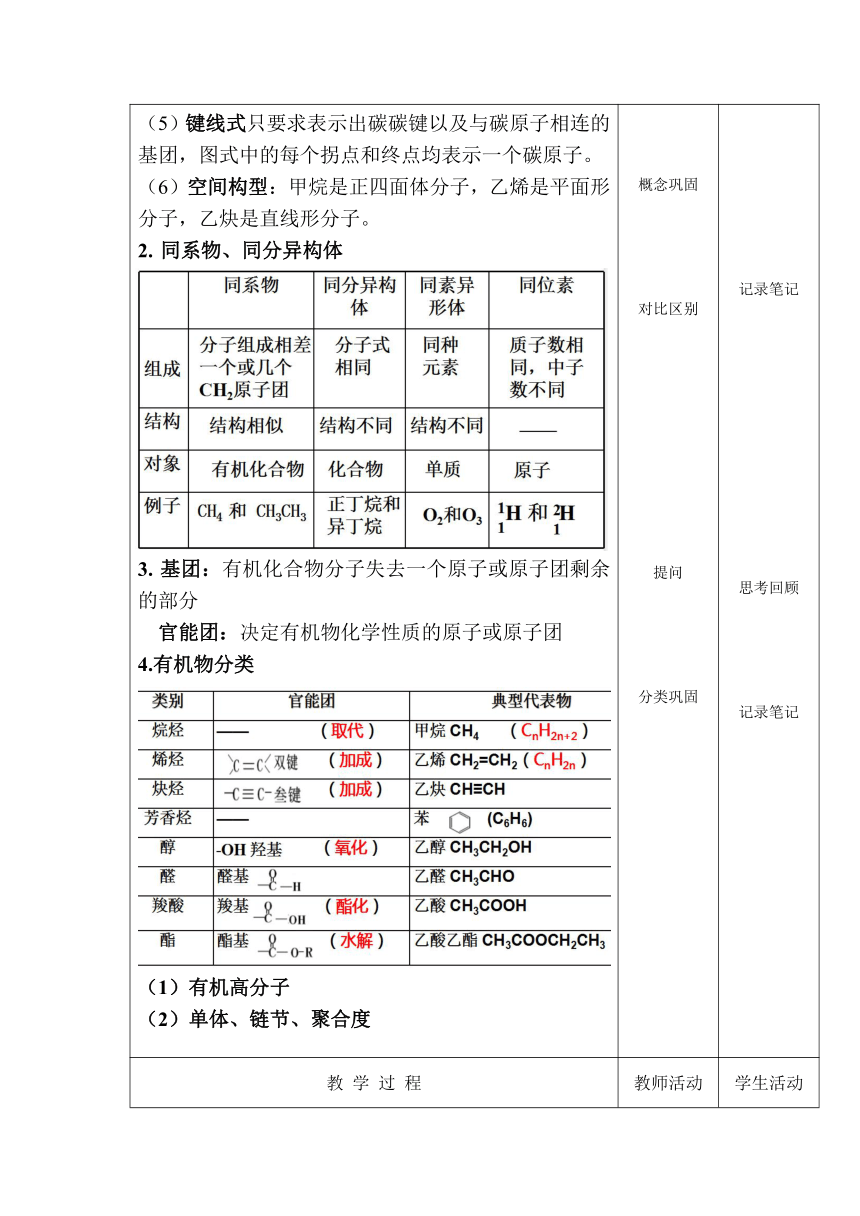
(5)键线式只要求表示出碳碳键以及与碳原子相连的基团,图式中的每个拐点和终点均表示一个碳原子。 (6)空间构型:甲烷是正四面体分子,乙烯是平面形分子,乙炔是直线形分子。 同系物、同分异构体 基团:有机化合物分子失去一个原子或原子团剩余的部分 官能团:决定有机物化学性质的原子或原子团 4.有机物分类 (1)有机高分子 (2)单体、链节、聚合度 概念巩固 对比区别 提问 分类巩固 记录笔记 思考回顾 记录笔记
教 学 过 程 教师活动 学生活动
三、常见的有机反应类型 1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。 (1)卤代反应:有机物分子中的氢原子被卤原子取代。 (2)硝化反应:有机物分子中的氢原子被硝基取代。 (3)其他:卤代烃的水解、酯化反应、酯的水解、醇分子间脱水等也属于取代反应。 2.加成反应:有机物分子中不饱和的碳原子跟其他原子或原子团直接结合生成新物质的反应。 (1)与氢气的加成反应(还原):在催化剂的作用下,含有不饱和碳原子的有机物与氢气发生加成反应: ①乙烯、乙炔的催化加氢; ②苯催化加氢; ③醛基化合物的催化加氢。 (2)与卤素单质的加成反应:含有不饱和碳原子的有机物很容易与卤素单质发生加成反应。 (3)与卤化氢的加成反应:含有不饱和碳原子的有机物能与卤化氢发生加成反应。例如:乙炔→氯乙烯。 (4)与水的加成反应:含有不饱和碳原子的有机物在催化剂作用下,可以与水发生加成反应。例如:乙烯水化法制备乙醇。 3.氧化反应:有机物加氧或去氢的反应。 (1)醇被氧化:羟基的O—H键断裂,与羟基相连的碳原子的C—H键断裂,去掉氢原子形成CO键。叔醇(羟基所在碳原子上无H)不能被氧化。 (2)有机物的燃烧、不饱和烃和一些芳香烃使酸性KMnO4溶液褪色等。 概念提问 重点巩固 板书 思考回顾 笔记记录 听讲 记录笔记
教 学 过 程 教师活动 学生活动
(3)葡萄糖、麦芽糖与新制碱性Cu(OH)2或银氨溶液的反应。 4.还原反应:有机物加氢或去氧的反应。 乙烯、苯等的催化加氢。 5.聚合反应:小分子互相发生反应生成高分子的反应。 (1)加聚反应:由不饱和的单体加成聚合成高分子化合物的反应。反应是通过单体的自聚或共聚完成的。 ●规律方法:一些重要的有机化学反应总结 (1)能发生取代反应的:烷烃、苯、乙醇、羧酸等; (2)能发生加成反应的:乙烯、苯、不饱和油脂等; (3)能发生酯化反应的:乙醇、乙酸、葡萄糖等; (4)能发生加聚反应的:乙烯等; (5)能被酸性高锰酸钾溶液氧化的:乙烯、乙醇、葡萄糖等。 (2)由高聚物推断单体的方法 1.单烯加聚:凡链节的主碳链全部为单键——每隔两个碳原子断开,单键变双键,即得单体。 2.双烯加聚或混烯加聚:链节的主碳链中有双键——把链节中主链上以双键为中心的4个碳原子与其他碳原子断开,这4个碳原子“单改双,双改单”即为相应的单体。 [练习]物质X的结构简式如图所示,它常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是 A.X的分子式为C6H7O7 B.X分子内所有原子均在同一平面内 C.1 mol物质X最多可以和3 mol氢气发生加成反应 D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 解析:X的分子式为C6H8O7,A错误;X分子中含有—CH2—,所以所有原子不可能在同一平面内,B错误;X分子结构中存 要点强调 知识小结 练习评讲 思考巩固 笔记记录 练习运用 思考回答
教 学 过 程 教师活动 学生活动
在羧基和羟基,羧基不能和氢气加成,C错误;X分子中能与NaHCO3、Na2CO3反应产生气体的官能团只有羧基,D正确。 四、有机物分子式和结构式的确定 (一)有机物分子式的确定 1.有机物组成元素的判断 一般有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。 欲判定该有机物中是否含氧元素,应先求出产物CO2中C元素的质量及H2O中H元素的质量,然后将C、H元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧,否则含氧。 2.确定分子式的方法 (1)实验法:由各元素的质量分数→求各元素的原子个数之比(实验式)→求相对分子质量→求分子式。 (2)物质的量关系法:由密度或其他条件→求摩尔质量→求1 mol分子中所含各种元素/原子的物质的量→求分子式。 (3)化学方程式法:利用化学方程式求分子式。 (4)燃烧通式法:利用燃烧通式和相对分子质量求分子式。 CxHyOz+O2―→xCO2+H2O 由于CxHyOz(y为偶数,且y≤2x+2)中的x、y、z独立,借助通式计算,解出x、y、z,最后求出分子式。若z=0,则不含氧元素。 (二)有机物结构式的确定 1.根据物质的结构决定物质的性质,物质的性质反映其结构。确定物质的结构,主要是利用物质所具有的特殊性质来确定该物质所具有的特殊结构,即主要确定该物质的官能团的种类和数目。 重点讲解 板书 听讲 记录笔记
教 学 过 程 教师活动 学生活动
2.确定有机物结构式的一般步骤 (1)根据分子式写出它可能具有的同分异构体。 (2)利用该物质的性质推测其可能含有的官能团,最后确定所写同分异构体中的一种结构式。 [练习]在标准状况下,某气态烃的密度是1.34 g/L,一定量的该烃完全燃烧生成8.8 g CO2和5.4 g H2O,该烃的分子式为____________,其结构式为_______。 解析:在标准状况下,某气态烃的密度是1.34 g/L,则气态烃的摩尔质量=1.34 g/L×22.4 L/mol≈30 g/mol,即该烃的相对分子质量为30。一定量的该烃完全燃烧生成水的物质的量为=0.3 mol,生成二氧化碳的物质的量为=0.2 mol,则n(C)∶n(H)=0.2 mol∶0.6 mol=1∶3,则该烃的最简式为CH3,又知其相对分子质量为30,所以分子式为C2H6。 五、有机物的检验与鉴别方法 1.检验有机物的溶解性:通常是加水检验,观察是否能溶于水。例如,用此法可以鉴别乙酸与乙酸乙酯、乙醇与溴乙烷、甘油与油脂等。 2.检查液态有机物的密度:观察不溶于水的有机物在水中的浮沉情况,可知其密度比水的密度小还是大。例如:用此法可以鉴别硝基苯与苯、四氯化碳与1 氯丁烷等。 3.检查有机物的燃烧情况:如观察是否可燃(大部分有机物可燃,四氯化碳和少数有机物不可燃)、燃烧时黑烟的多少(可区分乙烷、乙烯和乙炔,己烯和苯,聚乙烯和聚苯乙烯 )、燃烧时的气味(如识别聚氯乙烯和蛋白质)等。 4.检查有机化合物的特殊原子团。思维方式一般为:官能团―→性质―→方法的选择。 [练习]物质的鉴别有多种方法。下列能达到鉴别目的的是(B) ①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 练习讲解 重点讲解 板书 思考练习 听讲 记录笔记 练习运用
教 学 过 程 教师活动 学生活动
③点燃鉴别甲烷和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用石蕊试液鉴别酒精、醋酸、醋酸钠 A.①②④ B.①③⑤ C.②③④ D.①②③ 解析:①苯的密度比水小且与水不相溶。乙醇与水互溶。溴苯的密度比水的大且与水不相溶,故可用水鉴别。②Ca(OH)2与NaHCO3溶液相互滴加现象都是产生白色沉淀,故无法用相互滴加法鉴别。③甲烷燃烧火焰为蓝色,无黑烟,乙烯燃烧火焰明亮且有黑烟。④二氧化硫可使品红溶液褪色、CO2和CO不能。⑤中酒精溶液呈中性、醋酸溶液显酸性、醋酸钠溶液显碱性,故可用石蕊试液鉴别酒精、醋酸、醋酸钠。 【总结】 【作业】 分析讲解 课堂总结 作业布置 笔记批注 记录作业
板书设计 8有机物的获得与应用 复习 章节知识框架 五、有机物的鉴别 基本概念 重要的反应:取代、加成、氧化、还原、聚合 四、有机物的分子式、结构式确定
教学课后小结
教学目的要求: 1.掌握常见有机物的分子式、结构及化学性质。2.掌握常见的有机反应类型。3.了解常见有机物的鉴别。4.巩固有机合成的方法。
教学重点: 有机反应类型、有机物的分子式、结构及化学性质
教学难点: 有机反应类型、有机物的分子式、结构及化学性质
教 学 过 程 教师活动 学生活动
【课前回顾】 知识点回顾 有机高分子化合物的概念及分类 有机高分子的合成方法 加聚反应 缩聚反应 3.判断单体的方法 作业问题评讲 引导回顾 提问旧知 要点讲解 巩固思考 回答问题 回顾 笔记批注
教 学 过 程 教师活动 学生活动
【导入】 有机物在日常生活中的应用极其广泛,现在我们已经学习完了简单的有机物相关的知识,今天一起来回顾、梳理一下一些重要知识点。 【新授】 本章知识框架 有机物的基本概念 有机物的表示 (1)碳原子可以形成四个共价键,碳与碳之间可以是单键、双键或叁键,还可以成环。 (2)碳原子以单键方式成键的称为饱和碳原子,若以双键或叁键成键的称为不饱和碳原子(分子式)。 (3)结构式是指将有机物中原子间的化学键全部用短线表示出来。 (4)结构简式是指省略了有机物中能省的化学键而表示出来的式子。 导入新课 知识框架 梳理 重点回顾 笔记记录 思考回顾 记录笔记
教 学 过 程 教师活动 学生活动
(5)键线式只要求表示出碳碳键以及与碳原子相连的基团,图式中的每个拐点和终点均表示一个碳原子。 (6)空间构型:甲烷是正四面体分子,乙烯是平面形分子,乙炔是直线形分子。 同系物、同分异构体 基团:有机化合物分子失去一个原子或原子团剩余的部分 官能团:决定有机物化学性质的原子或原子团 4.有机物分类 (1)有机高分子 (2)单体、链节、聚合度 概念巩固 对比区别 提问 分类巩固 记录笔记 思考回顾 记录笔记
教 学 过 程 教师活动 学生活动
三、常见的有机反应类型 1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。 (1)卤代反应:有机物分子中的氢原子被卤原子取代。 (2)硝化反应:有机物分子中的氢原子被硝基取代。 (3)其他:卤代烃的水解、酯化反应、酯的水解、醇分子间脱水等也属于取代反应。 2.加成反应:有机物分子中不饱和的碳原子跟其他原子或原子团直接结合生成新物质的反应。 (1)与氢气的加成反应(还原):在催化剂的作用下,含有不饱和碳原子的有机物与氢气发生加成反应: ①乙烯、乙炔的催化加氢; ②苯催化加氢; ③醛基化合物的催化加氢。 (2)与卤素单质的加成反应:含有不饱和碳原子的有机物很容易与卤素单质发生加成反应。 (3)与卤化氢的加成反应:含有不饱和碳原子的有机物能与卤化氢发生加成反应。例如:乙炔→氯乙烯。 (4)与水的加成反应:含有不饱和碳原子的有机物在催化剂作用下,可以与水发生加成反应。例如:乙烯水化法制备乙醇。 3.氧化反应:有机物加氧或去氢的反应。 (1)醇被氧化:羟基的O—H键断裂,与羟基相连的碳原子的C—H键断裂,去掉氢原子形成CO键。叔醇(羟基所在碳原子上无H)不能被氧化。 (2)有机物的燃烧、不饱和烃和一些芳香烃使酸性KMnO4溶液褪色等。 概念提问 重点巩固 板书 思考回顾 笔记记录 听讲 记录笔记
教 学 过 程 教师活动 学生活动
(3)葡萄糖、麦芽糖与新制碱性Cu(OH)2或银氨溶液的反应。 4.还原反应:有机物加氢或去氧的反应。 乙烯、苯等的催化加氢。 5.聚合反应:小分子互相发生反应生成高分子的反应。 (1)加聚反应:由不饱和的单体加成聚合成高分子化合物的反应。反应是通过单体的自聚或共聚完成的。 ●规律方法:一些重要的有机化学反应总结 (1)能发生取代反应的:烷烃、苯、乙醇、羧酸等; (2)能发生加成反应的:乙烯、苯、不饱和油脂等; (3)能发生酯化反应的:乙醇、乙酸、葡萄糖等; (4)能发生加聚反应的:乙烯等; (5)能被酸性高锰酸钾溶液氧化的:乙烯、乙醇、葡萄糖等。 (2)由高聚物推断单体的方法 1.单烯加聚:凡链节的主碳链全部为单键——每隔两个碳原子断开,单键变双键,即得单体。 2.双烯加聚或混烯加聚:链节的主碳链中有双键——把链节中主链上以双键为中心的4个碳原子与其他碳原子断开,这4个碳原子“单改双,双改单”即为相应的单体。 [练习]物质X的结构简式如图所示,它常被用于制香料或作为饮料酸化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是 A.X的分子式为C6H7O7 B.X分子内所有原子均在同一平面内 C.1 mol物质X最多可以和3 mol氢气发生加成反应 D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同 解析:X的分子式为C6H8O7,A错误;X分子中含有—CH2—,所以所有原子不可能在同一平面内,B错误;X分子结构中存 要点强调 知识小结 练习评讲 思考巩固 笔记记录 练习运用 思考回答
教 学 过 程 教师活动 学生活动
在羧基和羟基,羧基不能和氢气加成,C错误;X分子中能与NaHCO3、Na2CO3反应产生气体的官能团只有羧基,D正确。 四、有机物分子式和结构式的确定 (一)有机物分子式的确定 1.有机物组成元素的判断 一般有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。 欲判定该有机物中是否含氧元素,应先求出产物CO2中C元素的质量及H2O中H元素的质量,然后将C、H元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧,否则含氧。 2.确定分子式的方法 (1)实验法:由各元素的质量分数→求各元素的原子个数之比(实验式)→求相对分子质量→求分子式。 (2)物质的量关系法:由密度或其他条件→求摩尔质量→求1 mol分子中所含各种元素/原子的物质的量→求分子式。 (3)化学方程式法:利用化学方程式求分子式。 (4)燃烧通式法:利用燃烧通式和相对分子质量求分子式。 CxHyOz+O2―→xCO2+H2O 由于CxHyOz(y为偶数,且y≤2x+2)中的x、y、z独立,借助通式计算,解出x、y、z,最后求出分子式。若z=0,则不含氧元素。 (二)有机物结构式的确定 1.根据物质的结构决定物质的性质,物质的性质反映其结构。确定物质的结构,主要是利用物质所具有的特殊性质来确定该物质所具有的特殊结构,即主要确定该物质的官能团的种类和数目。 重点讲解 板书 听讲 记录笔记
教 学 过 程 教师活动 学生活动
2.确定有机物结构式的一般步骤 (1)根据分子式写出它可能具有的同分异构体。 (2)利用该物质的性质推测其可能含有的官能团,最后确定所写同分异构体中的一种结构式。 [练习]在标准状况下,某气态烃的密度是1.34 g/L,一定量的该烃完全燃烧生成8.8 g CO2和5.4 g H2O,该烃的分子式为____________,其结构式为_______。 解析:在标准状况下,某气态烃的密度是1.34 g/L,则气态烃的摩尔质量=1.34 g/L×22.4 L/mol≈30 g/mol,即该烃的相对分子质量为30。一定量的该烃完全燃烧生成水的物质的量为=0.3 mol,生成二氧化碳的物质的量为=0.2 mol,则n(C)∶n(H)=0.2 mol∶0.6 mol=1∶3,则该烃的最简式为CH3,又知其相对分子质量为30,所以分子式为C2H6。 五、有机物的检验与鉴别方法 1.检验有机物的溶解性:通常是加水检验,观察是否能溶于水。例如,用此法可以鉴别乙酸与乙酸乙酯、乙醇与溴乙烷、甘油与油脂等。 2.检查液态有机物的密度:观察不溶于水的有机物在水中的浮沉情况,可知其密度比水的密度小还是大。例如:用此法可以鉴别硝基苯与苯、四氯化碳与1 氯丁烷等。 3.检查有机物的燃烧情况:如观察是否可燃(大部分有机物可燃,四氯化碳和少数有机物不可燃)、燃烧时黑烟的多少(可区分乙烷、乙烯和乙炔,己烯和苯,聚乙烯和聚苯乙烯 )、燃烧时的气味(如识别聚氯乙烯和蛋白质)等。 4.检查有机化合物的特殊原子团。思维方式一般为:官能团―→性质―→方法的选择。 [练习]物质的鉴别有多种方法。下列能达到鉴别目的的是(B) ①用水鉴别苯、乙醇、溴苯 ②用相互滴加的方法鉴别Ca(OH)2和NaHCO3溶液 练习讲解 重点讲解 板书 思考练习 听讲 记录笔记 练习运用
教 学 过 程 教师活动 学生活动
③点燃鉴别甲烷和乙烯 ④用品红溶液鉴别二氧化碳、二氧化硫、一氧化碳 ⑤用石蕊试液鉴别酒精、醋酸、醋酸钠 A.①②④ B.①③⑤ C.②③④ D.①②③ 解析:①苯的密度比水小且与水不相溶。乙醇与水互溶。溴苯的密度比水的大且与水不相溶,故可用水鉴别。②Ca(OH)2与NaHCO3溶液相互滴加现象都是产生白色沉淀,故无法用相互滴加法鉴别。③甲烷燃烧火焰为蓝色,无黑烟,乙烯燃烧火焰明亮且有黑烟。④二氧化硫可使品红溶液褪色、CO2和CO不能。⑤中酒精溶液呈中性、醋酸溶液显酸性、醋酸钠溶液显碱性,故可用石蕊试液鉴别酒精、醋酸、醋酸钠。 【总结】 【作业】 分析讲解 课堂总结 作业布置 笔记批注 记录作业
板书设计 8有机物的获得与应用 复习 章节知识框架 五、有机物的鉴别 基本概念 重要的反应:取代、加成、氧化、还原、聚合 四、有机物的分子式、结构式确定
教学课后小结
