专题2研究物质的基本方法检测题(含解析)高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题2研究物质的基本方法检测题(含解析)高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 931.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 20:02:01 | ||
图片预览



文档简介
专题2《研究物质的基本方法》检测题
一、单选题
1.中医产生于原始社会,春秋战国中医理论已基本形成,又称汉医,是中国汉族劳动人民创造的传统医学为主的医学。中药的煎制直接关系其疗效,下列中草药的煎制步骤中属于过滤操作的是
A.冷水浸泡 B.加热熬煮
C.箅渣取液 D.灌装保存
2.下列变化中,属于化学变化的是
A.瓷碗破碎 B.牛奶变酸 C.轮胎爆炸 D.冰雪融化
3.“凡酸坏之酒,皆可蒸烧”这里用到的实验操作不需要的仪器是
A.酒精灯 B.蒸发皿 C.铁架台 D.蒸馏烧瓶
4.中国文化源远流长,下列古诗文不涉及化学变化的是
A.丹砂(HgS)烧之成水银,积变又还成丹砂
B.熬胆矾铁釜,久之亦化为铜
C.日照香炉生紫烟,遥看瀑布挂前川
D.春蚕到死丝方尽,蜡炬成灰泪始干
5.对原子结构的认识经历了一个不断深入的过程,最早发现电子的科学家是( )
A.道尔顿 B.卢瑟福 C.玻尔 D.汤姆逊
6.下列溶液中的氯离子浓度与50mL1mol·L-1的MgCl2溶液中氯离子浓度相等的是
A.150mL1mol·L-1的NaCl B.75mL2mol·L-1的NH4Cl
C.150mL3mol·L-1的KCl D.75mL2mol·L-1的CaCl2
7.下列溶液中氯离子浓度最大的是
A.150mL1mol/LNaCl B.75mL2mol/LNH4Cl
C.150mL3mol/LKCl D.75mL2mol/LCaCl2
8.化学对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是
A.焰色反应、海带提碘、石油裂化都有化学变化的过程
B.嫦娥五号返回舱用到的高温结构陶瓷,属于传统硅酸盐材料
C.利用人工合成淀粉能有效促进“碳中和”目标的实现
D.我国发射的火星探测器,其使用的太阳能电池板的主要材料是二氧化硅
9.实施垃圾分类,节约使用资源是社会文明水平的重要体现,废旧电池属于
A B C D
有害垃圾 不可回收垃圾 厨余垃圾 可回收垃圾
A.A B.B C.C D.D
10.下列各组物质按酸、碱、盐分类顺次排列.正确的是( )
A.硫酸、纯碱、碳酸钙 B.冰醋酸、纯碱、醋酸钠
C.硝酸、烧碱、氯化钠 D.盐酸、熟石灰、苛性钠
11.下列溶液中Cl-的物质的量浓度与50mL1mol/LAlCl3溶液中Cl-的物质的量浓度相等的是
A.50mL1mol/LNaCl B.75mL2mol/LMgCl2
C.75mL2mol/LNH4Cl D.40mL1mol/LAlCl3
12.下列各项操作,错误的有
A.进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出
B.萃取、分液前需对分液漏斗检漏
C.蒸馏时,必须将温度计的水银球放在蒸馏烧瓶支管口附近
D.用乙醇萃取溴水中的溴单质的操作可选用分液漏斗
13.如图是按一定的方法给物质进行的分类,以下说法中错误的是
A.该种分类方法是交叉分类法 B.标准1是根据所含物质的种类
C.标准2是根据所含元素的种类 D.类别1是混合物,类别2是单质
14.下列叙述正确的是( )
A.金属氧化物一定是碱性氧化物
B.盐电离出的离子不一定有金属离子
C.含有金属元素的离子一定是阳离子
D.非金属氧化物都是酸性氧化物
15.下列溶液中的Cl-浓度与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是
A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl D.50 mL 1 mol·L-1的CaCl2
二、填空题
16.按要求对以下常见物质进行分类:铁红、胆矾、氢氧化钾、醋酸、酒精、金刚石.请按要求写出有关物质的化学式.
(1)属于单质的是__;属于盐的是____;属于酸的是______。
(2)Fe2O3俗称铁红,氧化物类型属于____。将其加入适量盐酸,反应的化学方程式:_______。
17.物质的量浓度和溶质质量分数的比较
物质的量浓度c 溶质质量分数w
概念 以单位体积溶液中所含溶质的_______来表示溶液组成的物理量 以溶质质量与溶液质量的_______来表示溶液组成的物理量
溶质的单位 _______ _______
溶液的单位 _______ _______
表达式 _______ _______
两者关系 (M:摩尔质量,单位:;:密度,单位:)
18.在0.2 L NaCl、MgCl2的混合溶液中,部分离子浓度大小如右图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为_________mol,MgCl2的物质的量为_________mol,Cl-的物质的量为_________mol。
(2)该混合溶液中含溶质的总质量为___________g 。
(3)将该混合溶液加水稀释至体积为 1 L,稀释后溶液中Cl-的物质的量浓度为_____mol·L-1。
三、实验题
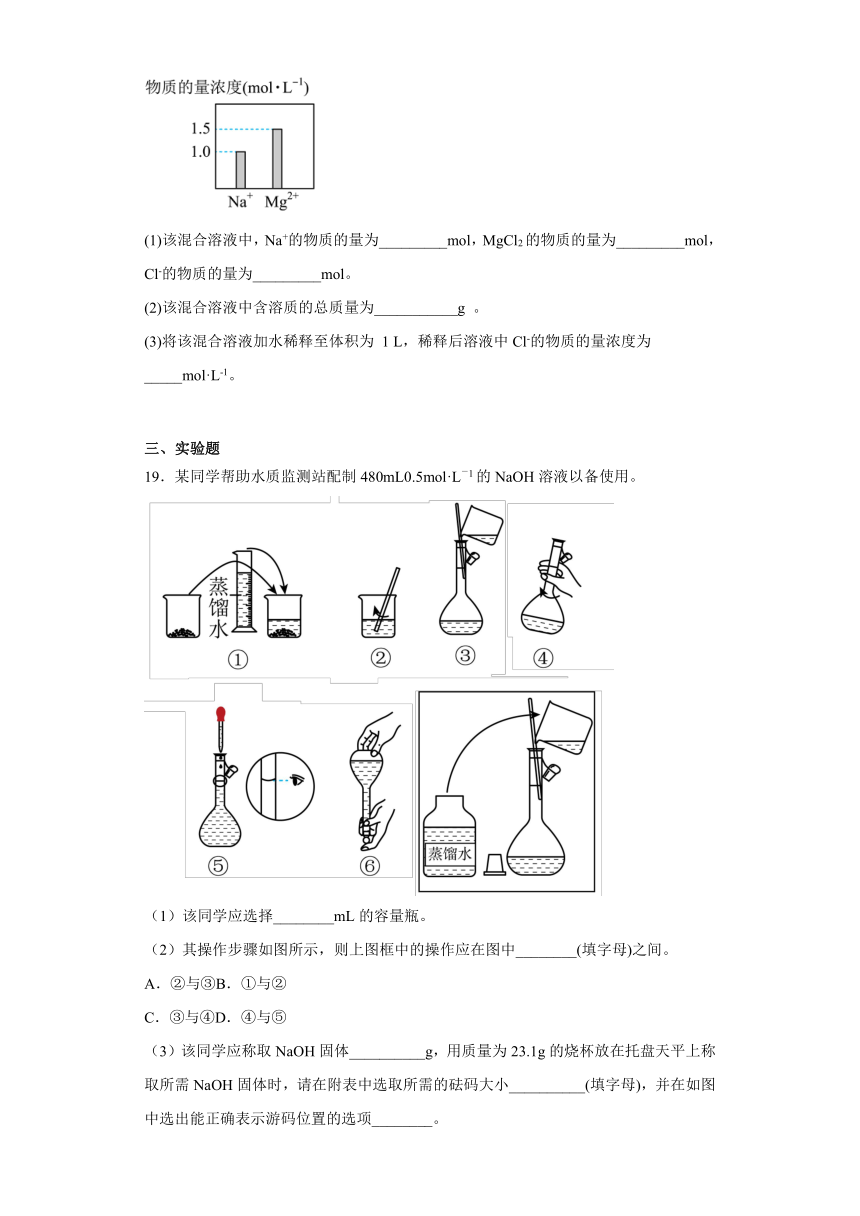
19.某同学帮助水质监测站配制480mL0.5mol·L-1的NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如图所示,则上图框中的操作应在图中________(填字母)之间。
A.②与③B.①与②
C.③与④D.④与⑤
(3)该同学应称取NaOH固体__________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母),并在如图中选出能正确表示游码位置的选项________。
附表:砝码规格
a b c d e
砝码大小/g 100 50 20 10 5
(4)下列操作对所配溶液的浓度大小有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视读数,浓度会__________;
②转移溶液的过程中,少量液体溅出来,浓度会________;
③容量瓶未干燥,浓度会________;
④定容摇匀后发现溶液的凹液面低于刻度线,浓度会______。
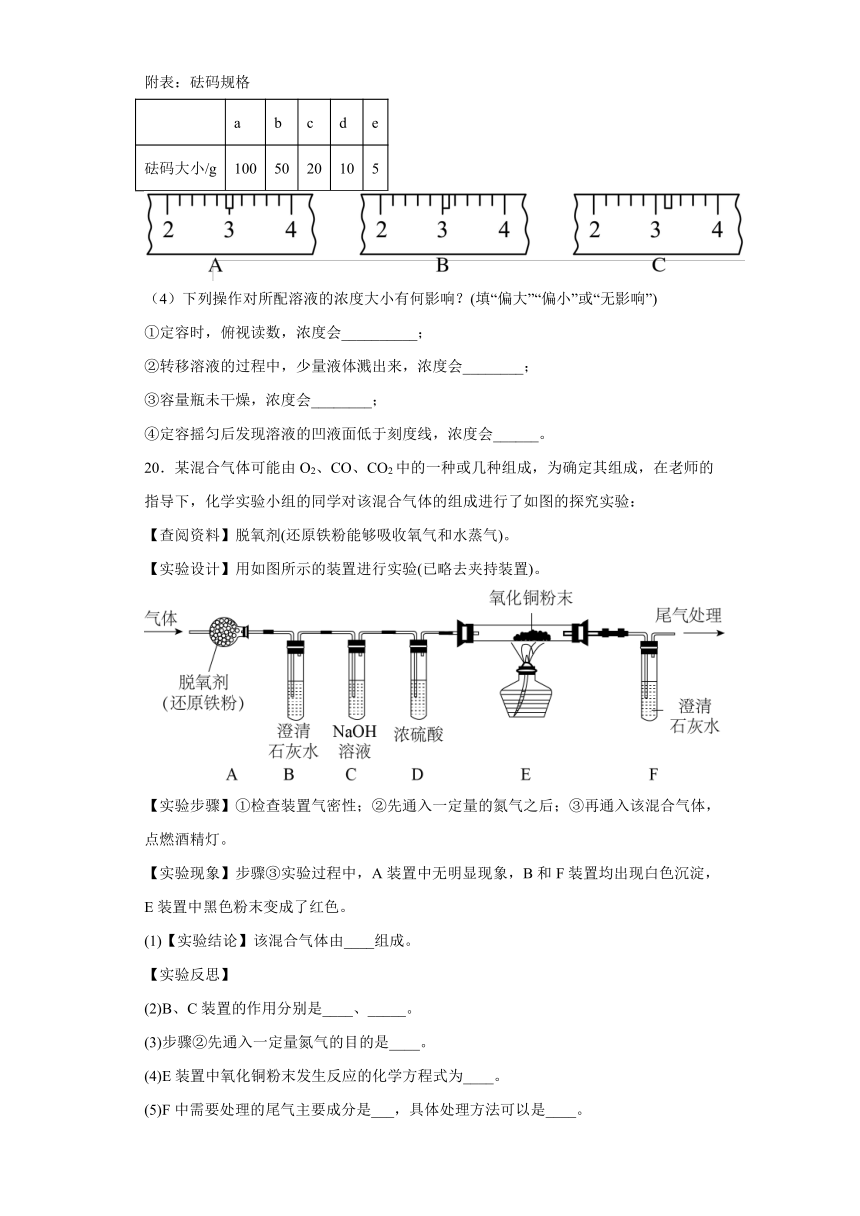
20.某混合气体可能由O2、CO、CO2中的一种或几种组成,为确定其组成,在老师的指导下,化学实验小组的同学对该混合气体的组成进行了如图的探究实验:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。
【实验步骤】①检查装置气密性;②先通入一定量的氮气之后;③再通入该混合气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置中无明显现象,B和F装置均出现白色沉淀,E装置中黑色粉末变成了红色。
(1)【实验结论】该混合气体由____组成。
【实验反思】
(2)B、C装置的作用分别是____、_____。
(3)步骤②先通入一定量氮气的目的是____。
(4)E装置中氧化铜粉末发生反应的化学方程式为____。
(5)F中需要处理的尾气主要成分是___,具体处理方法可以是____。
21.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)装置图1中A的名称是______,B的名称是______。A中一般要加入碎瓷片,其作用是______。下列关于以上实验操作说法一定正确的是______。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶X和Y的混合液,已知它们的性质如下表。
物质 熔点/℃ 沸点/℃ 密度/g·cm-3 溶解性
X -11.5 198 1.11 X、Y互溶,且均易溶于水和酒精
Y 17.9 290 1.26
据此分析,将X和Y相互分离可选用上图中的图______所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种最简便的实验操作_______。
四、计算题
22.标准状况下,22.4LHCl气体溶于水,制成500mL盐酸,所得溶液中氯化氢的物质的量浓度为_______。
参考答案:
1.C
【详解】A.冷水浸泡属于物质的溶解,不属于过滤操作,故A不符合题意;
B.加热煎制,属于加热,不属于过滤操作,故B不符合题意;
C.箅渣取液,是将液体与固体分离,属于过滤操作,故C符合题意;
D.灌装保存,是将溶液进行移液装瓶,不属于过滤操作,故D错误不符合题意;
故选C。
2.B
【详解】A.瓷碗破碎是物质形状改变,无新物质生成属于物理变化,A错误;
B.牛奶变酸过程中生成了新的物质,属于化学变化,B正确;
C.轮胎爆炸无新物质生成属于物理变化,C错误;
D.冰雪融化为水的状态改变,过程中无新物质生成属于物理变化,D错误;
故选B。
3.B
【详解】“凡酸坏之酒,皆可蒸烧”这里用到的实验操作是蒸馏,实验室进行蒸馏时,用到的仪器有酒精灯、石棉网、橡胶塞和冷却管、玻璃管和蒸馏瓶、铁支架、玻璃瓶,不需要蒸发皿,故选B。
4.C
【详解】A.“丹砂(HgS)烧之成水银,积变又还成丹砂”过程中丹砂(HgS)受热分解为贡和硫单质,汞与硫化合又生成红色的HgS,属于化学变化,故A错误;
B.“熬胆矾铁釜,久之亦化为铜”中胆矾为五水合硫酸铜,铁与其发生反应置换出铜,属于化学变化,故B错误;
C.“日照香炉生紫烟,遥看瀑布挂前川”描述的是香炉峰上光的散射现象,属于物理变化,故C正确;
D.“春蚕到死丝方尽,蜡炬成灰泪始干”描述了蜡烛的燃烧,是化学变化,故D错误;
故答案选C。
5.D
【详解】A. 道尔顿,最早提出原子的实心球形模型;
B. 卢瑟福,提出了带核的行星模型;
C. 玻尔,提出了电子分层排布的模型;
D. 汤姆逊,发现了电子并提出了葡萄干面包模型。
故选D。
6.B
【详解】50mL1mol·L-1的MgCl2溶液中氯离子浓度为:1mol·L-1×2=2 mol·L-1;
A. 150mL1mol·L-1的NaCl溶液中氯离子浓度为:1mol·L-1×1=1mol·L-1;
B. 75mL2mol·L-1的NH4Cl溶液中氯离子浓度为:2mol·L-1×1=2mol·L-1;
C. 150mL3mol·L-1的KCl溶液中氯离子浓度为:3mol·L-1×1=3mol·L-1;
D. 75mL2mol·L-1的CaCl2溶液中氯离子浓度为:2mol·L-1×2=4mol·L-1;
答案选B。
7.D
【分析】根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质分子中含有的离子的个数,与溶液的体积无关。
【详解】A.1mol/L NaCl溶液中氯离子浓度为1mol/L ×1=1 mol/L;
B.2mol/LNH4Cl溶液中氯离子浓度为2mol/L ×1=2 mol/L;
C.3mol/L KCl溶液中氯离子浓度为3mol/L ×1=3 mol/L;;
D.2mol/LCaCl2溶液中氯离子浓度为2mol/L ×2=4 mol/L;
故选D。
8.C
【详解】A.焰色反应是物理过程,A错误;
B.高温结构陶瓷属于新型无机非金属材料,B错误;
C.利用人工合成淀粉是我国最新科技,有利于的减少,是有效促进“碳中和”的高科技手段,C正确;
D.太阳能电池板的主要材料是单质硅,D错误;
答案选C。
9.D
【详解】废旧电池中的重金属颜色,如镉、汞等重金属溶出会污染地下水和土壤,再渗进鱼类、农作物中,破坏人类的生存环境,威胁人类的健康,不能随意丢弃,需要回收处理,故选D。
10.C
【详解】A.硫酸是酸,纯碱是碳酸钠,属于盐,碳酸钙也是盐,A不符合题意;
B.冰醋酸是酸,纯碱和醋酸钠都是盐,B不符合题意;
C.硝酸是酸,烧碱是氢氧化钠,属于碱,氯化钠是盐,C符合题意;
D.盐酸是混合物,而酸属于化合物,故盐酸不属于酸,熟石灰是氢氧化钙,苛性钠是氢氧化钠,二者都是碱,D不符合题意;
故选C。
11.D
【解析】1mol/LAlCl3溶液中Cl-的物质的量浓度是1mol/L×3=3mol/L。
【详解】A. 50mL 1mol/LNaCl溶液中Cl-的物质的量浓度是1mol/L×1=1mol/L,故不选A;
B. 75mL 2mol/LMgCl2溶液中Cl-的物质的量浓度是2mol/L×2=4mol/L,故不选B;
C. 75mL 2mol/LNH4Cl溶液中Cl-的物质的量浓度是2mol/L×1=2mol/L,故不选C;
D. 40mL 1mol/LAlCl3溶液中Cl-的物质的量浓度是1mol/L×3=3mol/L,故选D;
答案选D。
【点睛】本题考查了溶液中离子的物质的量浓度的计算,明确溶液中氯离子的物质的量浓度为盐的浓度与化学式中离子个数的积,与溶液体积无关。
12.D
【详解】A.进行分液时,为了避免试剂污染,下层液体从分液漏斗的下端流出,上层液体则从分液漏斗的上口倒出,故A正确;
B.有活塞或连接的装置使用前要检漏,分液漏斗含有活塞,所以使用前要检漏,故B正确;
C.蒸馏时,用温度计测量馏分的温度,则应使温度计水银球靠近蒸馏烧瓶的支管口附近,故C正确;
D.酒精和水互溶,所以不能用乙醇萃取溴水中的溴,故D错误;
故选D。
13.A
【详解】A.对同类物质按照某种标准进行分类,这种方法是树状分类法,A项错误,符合题意;
B.将物质分类纯净物和混合物,标准1是根据物质所含种类,B项正确,不符合题意;
C.将纯净物分为化合物和单质,标准2是纯净物中所含元素的种类,C项正确,不符合题意;
D.按照分类标准,可知类别1是混合物,类别2是单质,D项正确,不符合题意;
本题答案选A。
14.B
【详解】A.金属氧化物不一定是碱性氧化物,如Al2O3为两性氧化物,Mn2O7为酸性氧化物,A不正确;
B.盐电离出的离子不一定有金属离子,如铵盐,能够电离出铵根离子,不属于金属离子,B正确;
C.含有金属元素的离子不一定是阳离子,如,C不正确;
D.非金属氧化物不一定是酸性氧化物,如CO为中性氧化物,D不正确;
故选B。
15.C
【详解】50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度c(Cl-)=1 mol/L×3=3mol/L。
A.150 mL 1 mol·L-1的NaCl溶液中Cl-的浓度c(Cl-)=1 mol/L×1=1mol/L;
B.75 mL 2 mol·L-1的NH4Cl溶液中Cl-的浓度c(Cl-)=2mol/L×1=2mol/L;
C.150 mL 3 mol·L-1的KCl溶液中Cl-的浓度c(Cl-)=3mol/L×1=3mol/L;
D.50 mL 1 mol·L-1的CaCl2溶液中Cl-的浓度c(Cl-)=1mol/L×2=2mol/L;
可见:与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是150 mL 3 mol·L-1的KCl溶液,故合理选项是C。
16. 金刚石 胆矾 醋酸 碱性氧化物 Fe2O3+6HCl═2FeCl3+3H2O
【分析】单质是由同种元素组成的纯净物,酸是指在水溶液中电离时生成的阳离子全部是氢离子的化合物,碱是指在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,氧化物是由两种元素组成的化合物,其中一种是氧元素,盐是在水溶液中电离出金属离子或铵根离子和酸根离子的化合物。
【详解】铁红的主要成分是氧化铁,属于碱性氧化物;
胆矾的主要成分是五水硫酸铜,在水溶液中电离出铜离子和硫酸根离子,属于盐;
氢氧化钾在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,属于碱;
醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸;
金刚石是由碳元素组成的非金属单质;
(1)金刚石是由碳元素组成的非金属单质,则属于单质的是金刚石;胆矾在水溶液中电离出铜离子和硫酸根离子,属于盐,则属于盐的是胆矾;醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸,则属于酸的是醋酸,故答案为金刚石;胆矾;醋酸;
(2)氧化铁与盐酸反应生成氯化铁和水,属于碱性氧化物,反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,故答案为碱性氧化物;Fe2O3+6HCl═2FeCl3+3H2O。
17. 物质的量 比值 mol g L
【详解】物质的量浓度c是以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量,溶质的单位为mol,溶液的单位为L,表达式为;溶质质量分数w是以溶质质量与溶液质量的比值来表示溶液组成的物理量,溶质的单位为g,溶液的单位为g,表达式为。
18.(1) 0.2 0.3 0.8
(2)40.2
(3)0.8
【详解】(1)溶液中c(Na+)=1mol/L,c(Mg2+)=1.5mol/L,0.2L溶液中含有钠离子的物质的量为:n(Na+)=1mol/L×0.2L=0.2mol,n(Mg2+)=1.5mol/L×0.2L=0.3mol,根据电荷守恒可知:n(Cl-)=n(Na+)+2n(Mg2+)=0.2mol+0.3mol×2=0.8mol,故答案为0.2;0.3;0.8;
(2)溶液中溶质为NaCl、MgCl2,n(NaCl)= n(Na+)=1 mol/L × 0.2L = 0.2mol,n(MgCl2) = n(Mg2+) = 0.3mol,则溶质总质量为:0.2mol × 58.5 g/mol + 0.3mol × 95 g/mol = 40.2g,故答案为40.2;
(3)将该混合溶液加水稀释至体积为 1 L,稀释后溶液中Cl-的物质的量浓度为=0.8mol/L,故答案为0.8。
19. 500 D 10.0 c、d C 偏大 偏小 无影响 无影响
【分析】配制一定物质的量浓度溶液的主要步骤为:计算→称量→溶解→冷却→转移→洗涤→定容,结合相关知识解答。
【详解】(1)容量瓶的规格应等于或稍大于配制溶液的体积,实验室没有480mL容量瓶,所以应选500mL容量瓶,故答案为:500;
(2)框中的操作为将蒸馏水注入容量瓶,该操作应在使用胶头滴管定容之前,即应在④与⑤之间,故答案为:D;
(3)配制500mL0.5mol·L-1NaOH溶液需要NaOH的质量为0.5L×0.5mol·L-1×40g·mol-1=10.0g。NaOH具有腐蚀性且易潮解,应放在烧杯内称量,计算可得NaOH与烧杯的总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,即选择c、d。由表中数据可知,最小的砝码为5g,游码的最大刻度为5g,所以游码应在3.1g的位置,故答案为:10.0;c、d;C;
(4)①定容时,俯视读数,溶液的体积偏小,所配制溶液的浓度偏大,故答案为:偏大;
②转移溶液的过程中,少量液体溅出来,溶质的物质的量偏小,所配制溶液的浓度会偏小,故答案为:偏小;
③容量瓶使用时未干燥,溶质的物质的量和溶液的体积都不变,所以对配制溶液的浓度无影响,故答案为:无影响;
④定容摇匀后溶液的凹液面低于刻度线,是因为部分溶液附着在瓶壁上,对溶液的浓度无影响,故答案为:无影响。
20.(1)一氧化碳和二氧化碳
(2) 检验二氧化碳气体 除去CO2气体
(3)排尽装置中原有的空气
(4)CO+CuOCu+CO2
(5) 一氧化碳/CO 点燃或收集
【分析】根据资料,脱氧剂(还原铁粉)能够吸收氧气和水蒸气,如果该气体中含有氧气,氧气和还原铁粉会反应生成红棕色的氧化铁,而步骤③实验中A装置无明显现象,说明该气体中不含氧气;因为二氧化碳能使澄清石灰水变浑浊,所以步骤③中B装置出现白色沉淀,说明该气体中含有二氧化碳;气体经过C装置,二氧化碳被除去,再经过浓硫酸干燥,气体进入E装置,实验过程中F装置内的澄清石灰水中出现白色沉淀,E装置中出现黑色的氧化铜变成光亮的红色物质,说明反应中生成了二氧化碳和铜,因为一氧化碳和氧化铜在加热条件下能反应生成铜和二氧化碳,所以该气体中还含有一氧化碳。故该气体由一氧化碳和二氧化碳(CO和CO2)组成。
【详解】(1)由分析知该气体由一氧化碳和二氧化碳(CO和CO2)组成。
(2)二氧化碳能使澄清石灰水变浑浊, B装置作用为检验二氧化碳气体;氢氧化钠和二氧化碳反应,且氢氧化钠溶液浓度较大,能除去气体中的二氧化碳,故C装置的作用是:除去CO2气体。
(3)因为装置内含有空气,空气中含有氧气和二氧化碳等气体,如果不除去空气,会影响氧气和二氧化碳的检验,所以步骤②通入一定量氮气的目的是:排尽装置中原有的空气。
(4)E装置中,一氧化碳和氧化铜粉末在加热条件下反应生成铜和二氧化碳,反应的化学方程式为:CO+CuOCu+CO2。
(5)一氧化碳有毒,会污染空气,一氧化碳具有可燃性可以点燃或收集处理。
21. 蒸馏烧瓶 冷凝管 防止液体暴沸 D 1 继续向分液漏斗中加入少量水,体积增加的液层就是水层
【分析】(1)由图可知仪器的名称,加热时碎瓷片可防止暴沸;
A.发现未加入碎瓷片,应马上停止加热;
B.分液时避免上下层液体混合;
C.过滤时不能搅拌;
D.蒸发时利用余热加热;
(2)由表中信息可知,为互溶液体混合物,但沸点不同;
(3)水与水层互溶,与有机层分层。
【详解】(1)由装置图可知,图1中A的名称是蒸馏烧瓶;B的名称是冷凝管;A是分离沸点不同的液体混合物,A中一般要加入碎瓷片,其作用是防止液体暴沸;
A. 发现未加入碎瓷片,应马上停止加热,冷却至室温再添加,A错误;
B.若有机层在上层,分液时避免上下层液体混合,把下层液体放出后,有机层从上口倒出,B错误;
C.过滤时不能搅拌,以免捅破滤纸,应使水自然流下,C错误;
D.蒸发时出现大量固体时停止加热,利用余热将剩余液体蒸干,操作合理,D正确;
故合理选项是D;
(2)由表中信息可知,X、Y为互溶的液体混合物,但沸点不同,相差较大,可采用蒸馏方法分离,因此将物质X和Y进行分离可选用上图中的图1所示仪器;
(3)分层后不知道哪一层液体是“水层”,简便的判断方法为继续向分液漏斗中加入少量水,体积增加的液层就是水层。
【点睛】本题考查混合物分离提纯,把握物质的性质、混合物分离方法、实验技能为解答的关键,注意元素化合物知识的应用,侧重考查学生的分析与实验能力。
22.2mol/L
【详解】标准状况下,22.4LHCl气体的物质的量是=1mol,溶于水,制成500mL盐酸,根据c=,所得溶液中氯化氢的物质的量浓度为=2mol/L。
一、单选题
1.中医产生于原始社会,春秋战国中医理论已基本形成,又称汉医,是中国汉族劳动人民创造的传统医学为主的医学。中药的煎制直接关系其疗效,下列中草药的煎制步骤中属于过滤操作的是
A.冷水浸泡 B.加热熬煮
C.箅渣取液 D.灌装保存
2.下列变化中,属于化学变化的是
A.瓷碗破碎 B.牛奶变酸 C.轮胎爆炸 D.冰雪融化
3.“凡酸坏之酒,皆可蒸烧”这里用到的实验操作不需要的仪器是
A.酒精灯 B.蒸发皿 C.铁架台 D.蒸馏烧瓶
4.中国文化源远流长,下列古诗文不涉及化学变化的是
A.丹砂(HgS)烧之成水银,积变又还成丹砂
B.熬胆矾铁釜,久之亦化为铜
C.日照香炉生紫烟,遥看瀑布挂前川
D.春蚕到死丝方尽,蜡炬成灰泪始干
5.对原子结构的认识经历了一个不断深入的过程,最早发现电子的科学家是( )
A.道尔顿 B.卢瑟福 C.玻尔 D.汤姆逊
6.下列溶液中的氯离子浓度与50mL1mol·L-1的MgCl2溶液中氯离子浓度相等的是
A.150mL1mol·L-1的NaCl B.75mL2mol·L-1的NH4Cl
C.150mL3mol·L-1的KCl D.75mL2mol·L-1的CaCl2
7.下列溶液中氯离子浓度最大的是
A.150mL1mol/LNaCl B.75mL2mol/LNH4Cl
C.150mL3mol/LKCl D.75mL2mol/LCaCl2
8.化学对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是
A.焰色反应、海带提碘、石油裂化都有化学变化的过程
B.嫦娥五号返回舱用到的高温结构陶瓷,属于传统硅酸盐材料
C.利用人工合成淀粉能有效促进“碳中和”目标的实现
D.我国发射的火星探测器,其使用的太阳能电池板的主要材料是二氧化硅
9.实施垃圾分类,节约使用资源是社会文明水平的重要体现,废旧电池属于
A B C D
有害垃圾 不可回收垃圾 厨余垃圾 可回收垃圾
A.A B.B C.C D.D
10.下列各组物质按酸、碱、盐分类顺次排列.正确的是( )
A.硫酸、纯碱、碳酸钙 B.冰醋酸、纯碱、醋酸钠
C.硝酸、烧碱、氯化钠 D.盐酸、熟石灰、苛性钠
11.下列溶液中Cl-的物质的量浓度与50mL1mol/LAlCl3溶液中Cl-的物质的量浓度相等的是
A.50mL1mol/LNaCl B.75mL2mol/LMgCl2
C.75mL2mol/LNH4Cl D.40mL1mol/LAlCl3
12.下列各项操作,错误的有
A.进行分液时,分液漏斗中的下层液体,从下端流出,上层液体则从上口倒出
B.萃取、分液前需对分液漏斗检漏
C.蒸馏时,必须将温度计的水银球放在蒸馏烧瓶支管口附近
D.用乙醇萃取溴水中的溴单质的操作可选用分液漏斗
13.如图是按一定的方法给物质进行的分类,以下说法中错误的是
A.该种分类方法是交叉分类法 B.标准1是根据所含物质的种类
C.标准2是根据所含元素的种类 D.类别1是混合物,类别2是单质
14.下列叙述正确的是( )
A.金属氧化物一定是碱性氧化物
B.盐电离出的离子不一定有金属离子
C.含有金属元素的离子一定是阳离子
D.非金属氧化物都是酸性氧化物
15.下列溶液中的Cl-浓度与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是
A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl D.50 mL 1 mol·L-1的CaCl2
二、填空题
16.按要求对以下常见物质进行分类:铁红、胆矾、氢氧化钾、醋酸、酒精、金刚石.请按要求写出有关物质的化学式.
(1)属于单质的是__;属于盐的是____;属于酸的是______。
(2)Fe2O3俗称铁红,氧化物类型属于____。将其加入适量盐酸,反应的化学方程式:_______。
17.物质的量浓度和溶质质量分数的比较
物质的量浓度c 溶质质量分数w
概念 以单位体积溶液中所含溶质的_______来表示溶液组成的物理量 以溶质质量与溶液质量的_______来表示溶液组成的物理量
溶质的单位 _______ _______
溶液的单位 _______ _______
表达式 _______ _______
两者关系 (M:摩尔质量,单位:;:密度,单位:)
18.在0.2 L NaCl、MgCl2的混合溶液中,部分离子浓度大小如右图所示,回答下列问题:
(1)该混合溶液中,Na+的物质的量为_________mol,MgCl2的物质的量为_________mol,Cl-的物质的量为_________mol。
(2)该混合溶液中含溶质的总质量为___________g 。
(3)将该混合溶液加水稀释至体积为 1 L,稀释后溶液中Cl-的物质的量浓度为_____mol·L-1。
三、实验题
19.某同学帮助水质监测站配制480mL0.5mol·L-1的NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如图所示,则上图框中的操作应在图中________(填字母)之间。
A.②与③B.①与②
C.③与④D.④与⑤
(3)该同学应称取NaOH固体__________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母),并在如图中选出能正确表示游码位置的选项________。
附表:砝码规格
a b c d e
砝码大小/g 100 50 20 10 5
(4)下列操作对所配溶液的浓度大小有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视读数,浓度会__________;
②转移溶液的过程中,少量液体溅出来,浓度会________;
③容量瓶未干燥,浓度会________;
④定容摇匀后发现溶液的凹液面低于刻度线,浓度会______。
20.某混合气体可能由O2、CO、CO2中的一种或几种组成,为确定其组成,在老师的指导下,化学实验小组的同学对该混合气体的组成进行了如图的探究实验:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。
【实验步骤】①检查装置气密性;②先通入一定量的氮气之后;③再通入该混合气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置中无明显现象,B和F装置均出现白色沉淀,E装置中黑色粉末变成了红色。
(1)【实验结论】该混合气体由____组成。
【实验反思】
(2)B、C装置的作用分别是____、_____。
(3)步骤②先通入一定量氮气的目的是____。
(4)E装置中氧化铜粉末发生反应的化学方程式为____。
(5)F中需要处理的尾气主要成分是___,具体处理方法可以是____。
21.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)装置图1中A的名称是______,B的名称是______。A中一般要加入碎瓷片,其作用是______。下列关于以上实验操作说法一定正确的是______。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶X和Y的混合液,已知它们的性质如下表。
物质 熔点/℃ 沸点/℃ 密度/g·cm-3 溶解性
X -11.5 198 1.11 X、Y互溶,且均易溶于水和酒精
Y 17.9 290 1.26
据此分析,将X和Y相互分离可选用上图中的图______所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种最简便的实验操作_______。
四、计算题
22.标准状况下,22.4LHCl气体溶于水,制成500mL盐酸,所得溶液中氯化氢的物质的量浓度为_______。
参考答案:
1.C
【详解】A.冷水浸泡属于物质的溶解,不属于过滤操作,故A不符合题意;
B.加热煎制,属于加热,不属于过滤操作,故B不符合题意;
C.箅渣取液,是将液体与固体分离,属于过滤操作,故C符合题意;
D.灌装保存,是将溶液进行移液装瓶,不属于过滤操作,故D错误不符合题意;
故选C。
2.B
【详解】A.瓷碗破碎是物质形状改变,无新物质生成属于物理变化,A错误;
B.牛奶变酸过程中生成了新的物质,属于化学变化,B正确;
C.轮胎爆炸无新物质生成属于物理变化,C错误;
D.冰雪融化为水的状态改变,过程中无新物质生成属于物理变化,D错误;
故选B。
3.B
【详解】“凡酸坏之酒,皆可蒸烧”这里用到的实验操作是蒸馏,实验室进行蒸馏时,用到的仪器有酒精灯、石棉网、橡胶塞和冷却管、玻璃管和蒸馏瓶、铁支架、玻璃瓶,不需要蒸发皿,故选B。
4.C
【详解】A.“丹砂(HgS)烧之成水银,积变又还成丹砂”过程中丹砂(HgS)受热分解为贡和硫单质,汞与硫化合又生成红色的HgS,属于化学变化,故A错误;
B.“熬胆矾铁釜,久之亦化为铜”中胆矾为五水合硫酸铜,铁与其发生反应置换出铜,属于化学变化,故B错误;
C.“日照香炉生紫烟,遥看瀑布挂前川”描述的是香炉峰上光的散射现象,属于物理变化,故C正确;
D.“春蚕到死丝方尽,蜡炬成灰泪始干”描述了蜡烛的燃烧,是化学变化,故D错误;
故答案选C。
5.D
【详解】A. 道尔顿,最早提出原子的实心球形模型;
B. 卢瑟福,提出了带核的行星模型;
C. 玻尔,提出了电子分层排布的模型;
D. 汤姆逊,发现了电子并提出了葡萄干面包模型。
故选D。
6.B
【详解】50mL1mol·L-1的MgCl2溶液中氯离子浓度为:1mol·L-1×2=2 mol·L-1;
A. 150mL1mol·L-1的NaCl溶液中氯离子浓度为:1mol·L-1×1=1mol·L-1;
B. 75mL2mol·L-1的NH4Cl溶液中氯离子浓度为:2mol·L-1×1=2mol·L-1;
C. 150mL3mol·L-1的KCl溶液中氯离子浓度为:3mol·L-1×1=3mol·L-1;
D. 75mL2mol·L-1的CaCl2溶液中氯离子浓度为:2mol·L-1×2=4mol·L-1;
答案选B。
7.D
【分析】根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质分子中含有的离子的个数,与溶液的体积无关。
【详解】A.1mol/L NaCl溶液中氯离子浓度为1mol/L ×1=1 mol/L;
B.2mol/LNH4Cl溶液中氯离子浓度为2mol/L ×1=2 mol/L;
C.3mol/L KCl溶液中氯离子浓度为3mol/L ×1=3 mol/L;;
D.2mol/LCaCl2溶液中氯离子浓度为2mol/L ×2=4 mol/L;
故选D。
8.C
【详解】A.焰色反应是物理过程,A错误;
B.高温结构陶瓷属于新型无机非金属材料,B错误;
C.利用人工合成淀粉是我国最新科技,有利于的减少,是有效促进“碳中和”的高科技手段,C正确;
D.太阳能电池板的主要材料是单质硅,D错误;
答案选C。
9.D
【详解】废旧电池中的重金属颜色,如镉、汞等重金属溶出会污染地下水和土壤,再渗进鱼类、农作物中,破坏人类的生存环境,威胁人类的健康,不能随意丢弃,需要回收处理,故选D。
10.C
【详解】A.硫酸是酸,纯碱是碳酸钠,属于盐,碳酸钙也是盐,A不符合题意;
B.冰醋酸是酸,纯碱和醋酸钠都是盐,B不符合题意;
C.硝酸是酸,烧碱是氢氧化钠,属于碱,氯化钠是盐,C符合题意;
D.盐酸是混合物,而酸属于化合物,故盐酸不属于酸,熟石灰是氢氧化钙,苛性钠是氢氧化钠,二者都是碱,D不符合题意;
故选C。
11.D
【解析】1mol/LAlCl3溶液中Cl-的物质的量浓度是1mol/L×3=3mol/L。
【详解】A. 50mL 1mol/LNaCl溶液中Cl-的物质的量浓度是1mol/L×1=1mol/L,故不选A;
B. 75mL 2mol/LMgCl2溶液中Cl-的物质的量浓度是2mol/L×2=4mol/L,故不选B;
C. 75mL 2mol/LNH4Cl溶液中Cl-的物质的量浓度是2mol/L×1=2mol/L,故不选C;
D. 40mL 1mol/LAlCl3溶液中Cl-的物质的量浓度是1mol/L×3=3mol/L,故选D;
答案选D。
【点睛】本题考查了溶液中离子的物质的量浓度的计算,明确溶液中氯离子的物质的量浓度为盐的浓度与化学式中离子个数的积,与溶液体积无关。
12.D
【详解】A.进行分液时,为了避免试剂污染,下层液体从分液漏斗的下端流出,上层液体则从分液漏斗的上口倒出,故A正确;
B.有活塞或连接的装置使用前要检漏,分液漏斗含有活塞,所以使用前要检漏,故B正确;
C.蒸馏时,用温度计测量馏分的温度,则应使温度计水银球靠近蒸馏烧瓶的支管口附近,故C正确;
D.酒精和水互溶,所以不能用乙醇萃取溴水中的溴,故D错误;
故选D。
13.A
【详解】A.对同类物质按照某种标准进行分类,这种方法是树状分类法,A项错误,符合题意;
B.将物质分类纯净物和混合物,标准1是根据物质所含种类,B项正确,不符合题意;
C.将纯净物分为化合物和单质,标准2是纯净物中所含元素的种类,C项正确,不符合题意;
D.按照分类标准,可知类别1是混合物,类别2是单质,D项正确,不符合题意;
本题答案选A。
14.B
【详解】A.金属氧化物不一定是碱性氧化物,如Al2O3为两性氧化物,Mn2O7为酸性氧化物,A不正确;
B.盐电离出的离子不一定有金属离子,如铵盐,能够电离出铵根离子,不属于金属离子,B正确;
C.含有金属元素的离子不一定是阳离子,如,C不正确;
D.非金属氧化物不一定是酸性氧化物,如CO为中性氧化物,D不正确;
故选B。
15.C
【详解】50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度c(Cl-)=1 mol/L×3=3mol/L。
A.150 mL 1 mol·L-1的NaCl溶液中Cl-的浓度c(Cl-)=1 mol/L×1=1mol/L;
B.75 mL 2 mol·L-1的NH4Cl溶液中Cl-的浓度c(Cl-)=2mol/L×1=2mol/L;
C.150 mL 3 mol·L-1的KCl溶液中Cl-的浓度c(Cl-)=3mol/L×1=3mol/L;
D.50 mL 1 mol·L-1的CaCl2溶液中Cl-的浓度c(Cl-)=1mol/L×2=2mol/L;
可见:与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是150 mL 3 mol·L-1的KCl溶液,故合理选项是C。
16. 金刚石 胆矾 醋酸 碱性氧化物 Fe2O3+6HCl═2FeCl3+3H2O
【分析】单质是由同种元素组成的纯净物,酸是指在水溶液中电离时生成的阳离子全部是氢离子的化合物,碱是指在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,氧化物是由两种元素组成的化合物,其中一种是氧元素,盐是在水溶液中电离出金属离子或铵根离子和酸根离子的化合物。
【详解】铁红的主要成分是氧化铁,属于碱性氧化物;
胆矾的主要成分是五水硫酸铜,在水溶液中电离出铜离子和硫酸根离子,属于盐;
氢氧化钾在水溶液中电离时生成的阴离子全部是氢氧根离子的化合物,属于碱;
醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸;
金刚石是由碳元素组成的非金属单质;
(1)金刚石是由碳元素组成的非金属单质,则属于单质的是金刚石;胆矾在水溶液中电离出铜离子和硫酸根离子,属于盐,则属于盐的是胆矾;醋酸在水溶液中电离时生成的阳离子全部是氢离子,属于酸,则属于酸的是醋酸,故答案为金刚石;胆矾;醋酸;
(2)氧化铁与盐酸反应生成氯化铁和水,属于碱性氧化物,反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,故答案为碱性氧化物;Fe2O3+6HCl═2FeCl3+3H2O。
17. 物质的量 比值 mol g L
【详解】物质的量浓度c是以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量,溶质的单位为mol,溶液的单位为L,表达式为;溶质质量分数w是以溶质质量与溶液质量的比值来表示溶液组成的物理量,溶质的单位为g,溶液的单位为g,表达式为。
18.(1) 0.2 0.3 0.8
(2)40.2
(3)0.8
【详解】(1)溶液中c(Na+)=1mol/L,c(Mg2+)=1.5mol/L,0.2L溶液中含有钠离子的物质的量为:n(Na+)=1mol/L×0.2L=0.2mol,n(Mg2+)=1.5mol/L×0.2L=0.3mol,根据电荷守恒可知:n(Cl-)=n(Na+)+2n(Mg2+)=0.2mol+0.3mol×2=0.8mol,故答案为0.2;0.3;0.8;
(2)溶液中溶质为NaCl、MgCl2,n(NaCl)= n(Na+)=1 mol/L × 0.2L = 0.2mol,n(MgCl2) = n(Mg2+) = 0.3mol,则溶质总质量为:0.2mol × 58.5 g/mol + 0.3mol × 95 g/mol = 40.2g,故答案为40.2;
(3)将该混合溶液加水稀释至体积为 1 L,稀释后溶液中Cl-的物质的量浓度为=0.8mol/L,故答案为0.8。
19. 500 D 10.0 c、d C 偏大 偏小 无影响 无影响
【分析】配制一定物质的量浓度溶液的主要步骤为:计算→称量→溶解→冷却→转移→洗涤→定容,结合相关知识解答。
【详解】(1)容量瓶的规格应等于或稍大于配制溶液的体积,实验室没有480mL容量瓶,所以应选500mL容量瓶,故答案为:500;
(2)框中的操作为将蒸馏水注入容量瓶,该操作应在使用胶头滴管定容之前,即应在④与⑤之间,故答案为:D;
(3)配制500mL0.5mol·L-1NaOH溶液需要NaOH的质量为0.5L×0.5mol·L-1×40g·mol-1=10.0g。NaOH具有腐蚀性且易潮解,应放在烧杯内称量,计算可得NaOH与烧杯的总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,即选择c、d。由表中数据可知,最小的砝码为5g,游码的最大刻度为5g,所以游码应在3.1g的位置,故答案为:10.0;c、d;C;
(4)①定容时,俯视读数,溶液的体积偏小,所配制溶液的浓度偏大,故答案为:偏大;
②转移溶液的过程中,少量液体溅出来,溶质的物质的量偏小,所配制溶液的浓度会偏小,故答案为:偏小;
③容量瓶使用时未干燥,溶质的物质的量和溶液的体积都不变,所以对配制溶液的浓度无影响,故答案为:无影响;
④定容摇匀后溶液的凹液面低于刻度线,是因为部分溶液附着在瓶壁上,对溶液的浓度无影响,故答案为:无影响。
20.(1)一氧化碳和二氧化碳
(2) 检验二氧化碳气体 除去CO2气体
(3)排尽装置中原有的空气
(4)CO+CuOCu+CO2
(5) 一氧化碳/CO 点燃或收集
【分析】根据资料,脱氧剂(还原铁粉)能够吸收氧气和水蒸气,如果该气体中含有氧气,氧气和还原铁粉会反应生成红棕色的氧化铁,而步骤③实验中A装置无明显现象,说明该气体中不含氧气;因为二氧化碳能使澄清石灰水变浑浊,所以步骤③中B装置出现白色沉淀,说明该气体中含有二氧化碳;气体经过C装置,二氧化碳被除去,再经过浓硫酸干燥,气体进入E装置,实验过程中F装置内的澄清石灰水中出现白色沉淀,E装置中出现黑色的氧化铜变成光亮的红色物质,说明反应中生成了二氧化碳和铜,因为一氧化碳和氧化铜在加热条件下能反应生成铜和二氧化碳,所以该气体中还含有一氧化碳。故该气体由一氧化碳和二氧化碳(CO和CO2)组成。
【详解】(1)由分析知该气体由一氧化碳和二氧化碳(CO和CO2)组成。
(2)二氧化碳能使澄清石灰水变浑浊, B装置作用为检验二氧化碳气体;氢氧化钠和二氧化碳反应,且氢氧化钠溶液浓度较大,能除去气体中的二氧化碳,故C装置的作用是:除去CO2气体。
(3)因为装置内含有空气,空气中含有氧气和二氧化碳等气体,如果不除去空气,会影响氧气和二氧化碳的检验,所以步骤②通入一定量氮气的目的是:排尽装置中原有的空气。
(4)E装置中,一氧化碳和氧化铜粉末在加热条件下反应生成铜和二氧化碳,反应的化学方程式为:CO+CuOCu+CO2。
(5)一氧化碳有毒,会污染空气,一氧化碳具有可燃性可以点燃或收集处理。
21. 蒸馏烧瓶 冷凝管 防止液体暴沸 D 1 继续向分液漏斗中加入少量水,体积增加的液层就是水层
【分析】(1)由图可知仪器的名称,加热时碎瓷片可防止暴沸;
A.发现未加入碎瓷片,应马上停止加热;
B.分液时避免上下层液体混合;
C.过滤时不能搅拌;
D.蒸发时利用余热加热;
(2)由表中信息可知,为互溶液体混合物,但沸点不同;
(3)水与水层互溶,与有机层分层。
【详解】(1)由装置图可知,图1中A的名称是蒸馏烧瓶;B的名称是冷凝管;A是分离沸点不同的液体混合物,A中一般要加入碎瓷片,其作用是防止液体暴沸;
A. 发现未加入碎瓷片,应马上停止加热,冷却至室温再添加,A错误;
B.若有机层在上层,分液时避免上下层液体混合,把下层液体放出后,有机层从上口倒出,B错误;
C.过滤时不能搅拌,以免捅破滤纸,应使水自然流下,C错误;
D.蒸发时出现大量固体时停止加热,利用余热将剩余液体蒸干,操作合理,D正确;
故合理选项是D;
(2)由表中信息可知,X、Y为互溶的液体混合物,但沸点不同,相差较大,可采用蒸馏方法分离,因此将物质X和Y进行分离可选用上图中的图1所示仪器;
(3)分层后不知道哪一层液体是“水层”,简便的判断方法为继续向分液漏斗中加入少量水,体积增加的液层就是水层。
【点睛】本题考查混合物分离提纯,把握物质的性质、混合物分离方法、实验技能为解答的关键,注意元素化合物知识的应用,侧重考查学生的分析与实验能力。
22.2mol/L
【详解】标准状况下,22.4LHCl气体的物质的量是=1mol,溶于水,制成500mL盐酸,根据c=,所得溶液中氯化氢的物质的量浓度为=2mol/L。
