山东省菏泽市定陶区山大附中实验学校 2022-2023学年高二下学期6月月考(含解析)
文档属性
| 名称 | 山东省菏泽市定陶区山大附中实验学校 2022-2023学年高二下学期6月月考(含解析) |  | |
| 格式 | |||
| 文件大小 | 696.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 20:08:49 | ||
图片预览



文档简介
高二下学期第三次阶段性考试
化学试题
本试卷满分为 100 分,考试用时 90 分钟。
说明:
1.本试卷分为选择题和非选择题两部分,考试时间 90 分钟,满分 100 分。
2.选择题答案用 2B 铅笔涂在答题卡上,非选择题用黑色中性笔作答,答案必须写
在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量: H-1 Li-7 C-12 N-14 O-16 Co-59 Fe-56
Mg-24 Al-27 Si-28 Na-23 Br-80
一、选择题:本题共 10 小题,每小题 2 分,共 20 分,每小题只有一个选项符合题
目要求。
1. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆
油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸。”下列说法正确的是
A. “乌金纸”的“乌”与“纸”,其成分都是有机物
B. “巨竹膜”和豆油的主要成分都属于天然高分子化合物
C. 可以用热的氢氧化钠溶液鉴别豆油和直馏汽油
D. 豆油的主要成分为油脂,在酸性条件下可水解生成乙醇和不饱和高级脂肪酸
2.用图示的方法能够直观形象地将化学知识传授给学生。下列图示正确的是
A B C D
3. 2021 年 9 月,我国科学家团队首次在实验室中实现了二氧化碳到淀粉的全合成,
合成路径如图。下列有关微粒的化学用语不正确的是
A. CO2的填充模型:
化 学 试 题 第 1 页 共 8页
B. 基态碳原子的轨道表示式:
C. FADH 的电子式:
D. 淀粉的分子式: C6H10O5 n
4.下列说法正确的是
A.已知甲基的推电子能力强于氢原子,则 NH3的接受质子能力强于(CH3)3N
B.碳酸钠溶液、新制氢氧化铜悬浊液都可用于鉴别甲酸、甲酸钠、甲酸乙酯
C.聚乙烯材料的老化是因为发生了加成反应
D.苯和液溴的混合液中加入铁粉,将产生的气体通入硝酸酸化的硝酸银溶液中,
产生淡黄色沉淀,证明苯与液溴发生取代反应
5.有机物分子中原子(或原子团)间的相互影响会导致其化学性质发生变化。下
列事实不能说明上述观点的是
A.苯酚能与 NaOH 溶液反应,乙醇不能与 NaOH 溶液反应
B.乙苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色
C.乙醇能发生消去反应,甲醇不能发生消去反应
D.乙醛能与氢气发生加成反应,乙酸不能与氢气发生加成反应
6.D-苯基丁氨酸( )可用作氨基酸保护单体,也可用于多肽的合
成.它有多种同分异构体,其中同时符合下列条件的共有
①苯环上有两个取代基;②有一个硝基直接连接在苯环上;③分子中存在一个手性
碳原子
A.3种 B.6种 C.9种 D.12 种
7.合成高分子材料的使用彻底改变了世界面貌,对于人类的生产生活方式产生了
重要影响。下列说法正确的是
A.通过红外光谱法测定聚乙烯的平均相对分子质量可得其链节数
B. (聚碳酸酯)水解后得到的含有苯环的物质的分子中
最多 14 个碳原子共面
C. (聚乙炔)能做导电材料,主要原因是分子中存在大π键
D.有机玻璃(聚甲基丙烯酸甲酯)可通过缩聚反应制得
化 学 试 题 第 2 页 共 8页
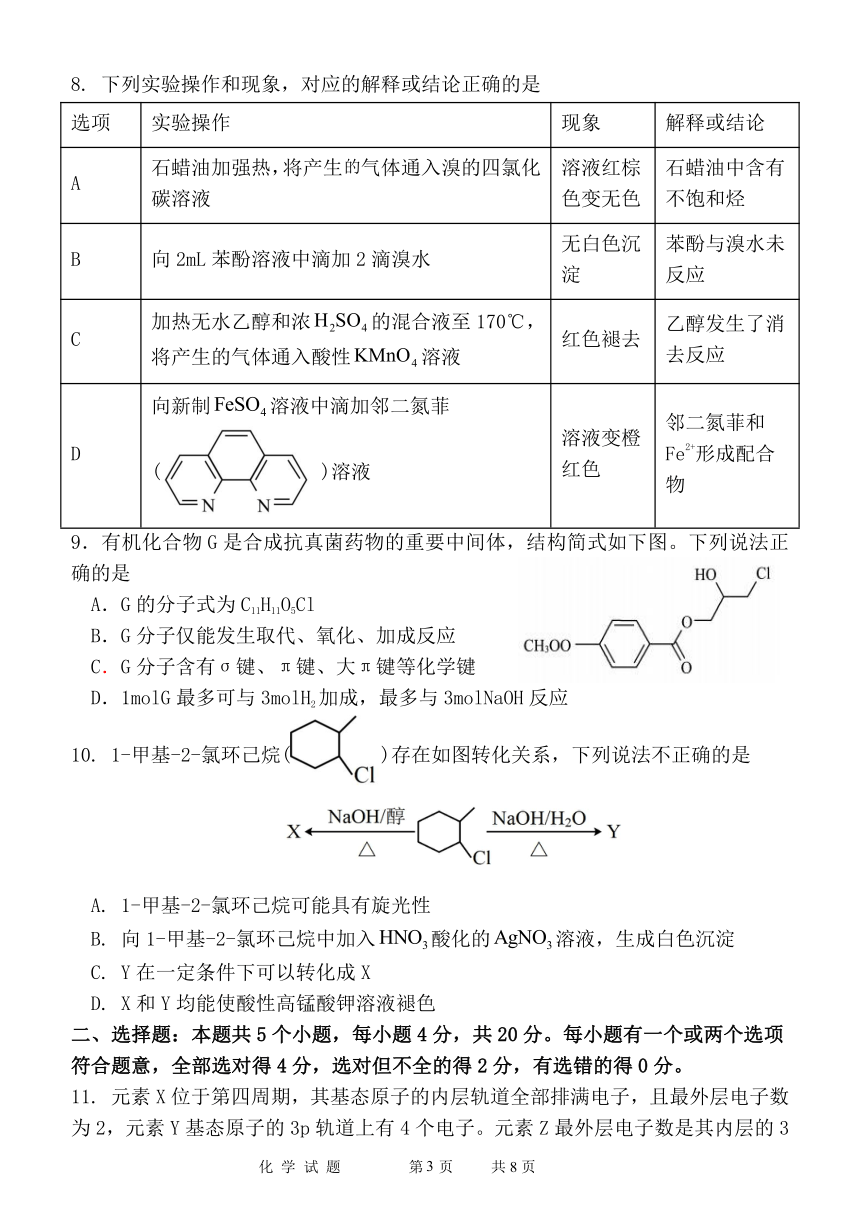
8. 下列实验操作和现象,对应的解释或结论正确的是
选项 实验操作 现象 解释或结论
石蜡油加强热,将产生的气体通入溴的四氯化 溶液红棕 石蜡油中含有
A
碳溶液 色变无色 不饱和烃
无白色沉 苯酚与溴水未
B 向 2mL 苯酚溶液中滴加 2滴溴水
淀 反应
加热无水乙醇和浓H2SO4的混合液至 170℃, 乙醇发生了消
C 红色褪去
将产生的气体通入酸性KMnO4溶液 去反应
向新制FeSO4溶液中滴加邻二氮菲
邻二氮菲和
溶液变橙
2+
D Fe 形成配合
( )溶液 红色
物
9.有机化合物 G 是合成抗真菌药物的重要中间体,结构简式如下图。下列说法正
确的是
A.G的分子式为 C11H11O5Cl
B.G 分子仅能发生取代、氧化、加成反应
C.G分子含有σ键、π键、大π键等化学键
D.1molG 最多可与 3molH2加成,最多与 3molNaOH 反应
10. 1-甲基-2-氯环己烷( )存在如图转化关系,下列说法不正确的是
A. 1-甲基-2-氯环己烷可能具有旋光性
B. 向 1-甲基-2-氯环己烷中加入HNO3酸化的AgNO3溶液,生成白色沉淀
C. Y 在一定条件下可以转化成 X
D. X 和 Y 均能使酸性高锰酸钾溶液褪色
二、选择题:本题共 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题意,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11. 元素 X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数
为 2,元素 Y基态原子的 3p 轨道上有 4个电子。元素 Z最外层电子数是其内层的 3
化 学 试 题 第 3 页 共 8页
倍。下列说法正确的是
A. 基态 X原子的价电子共有 6种空间运动状态
B. 在 Y 的简单氢化物分子中,Y的原子轨道杂化类型为 sp
C. Z 的简单氢化物在乙醇中的溶解性大于 Y的简单氢化物的
2
D. Y 与 Z 可形成的YZ3 的空间构型为平面三角形
12.下列物质分离提纯的方法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分离提纯实验室制取的硝基苯选择装置:④③
C.分离乙二醇(沸点为 197.3℃)和乙酸(沸点为 117.9℃)选择装置:③
D.提纯含不溶性杂质的粗苯甲酸,需经过加热溶解、冷却结晶、过滤、洗涤、
干燥等操作
13. 下图 a、b、c、d依次代表常见的 NaCl、CO2、金刚石、冰的晶胞或结构,下
列表述正确的是
A. MgO 的晶胞结构与 NaCl 类似,MgO 的晶格能小于 NaCl
B. 晶体中距离CO2分子最近且等距离的CO2分子有 8个
3 3 1
C. 若金刚石晶胞中 1的原子坐标为(0,0,0),则 2的原子坐标为( , , )
4 4 4
D. 冰晶体中存在氢键,18g 冰含有 4mol 氢键
14.某有机超强碱结构如图所示。下列说法错误的是
A.该有机物存在对映异构
B.该有机物核磁共振氢谱有 12 组峰
3 2
C.该有机物中 C和 N均有 sp 和 sp 两种杂化方式
D.该有机物中 C、N、O 三种元素形成的最简单氢化物分子
的键角依次减小
化 学 试 题 第 4 页 共 8页
15. 脯氨酸( )是构成蛋白质的氨基酸中唯一的亚氨基酸,它可催化分
子间的羟醛缩合反应,机理如图所示。下列说法正确的是
A. 有机物②和⑦中采取 sp3杂化的原子数之比为1:2
B. 脯氨酸具有两性,理论上 1mol 脯氨酸与足量NaHCO3反应生成44gCO2
C. 反应中涉及的氢离子均符合 2电子稳定结构
D. 若原料为 2-丁酮和甲醛,则产物可能为( )
三、非选择题:共 60 分
16.(13 分)W、X、Y、Z 是同一周期的四种短周期主族元素,原子序数依次增大。
Z 元素 最高正价与最低负价代数和为 6,它们能够形成一种新型化合物 M,其结
构如图。
(1)元素 W在周期表中的位置 ,
写出元素 Y基态原子核外电子排布式 。
(2)X、Y、Z 最高价含氧酸的酸性由强到弱的顺序为 (用化学式表示)。
(3)X—Z 共价键与 Y—Z 共价键的极性,前者 后者(填“大于”、“小
于”或“等于”), 原因 。
(4)元素 M 是与 Y 同主族的短周期元素,两者最简单气态氢化物的稳定性关系
为: > (填化学式),键角 H—M—H H—Y—H(填“大于”、“小
于”或“等于”), 原因 。
化 学 试 题 第 5 页 共 8页
17.(12 分)高分子化合物 M 是一种矿物油的抗冻剂。实验室合成 M 的一种路线
(1)C 的名称为 ,B 中官能团的名称为 。
(2)B→C 反应类型为 ,写出 C→D 的方程式 。
(3)写出 F→G 的第一步反应方程式 。
(4)M 是 D 和 H 的加聚反应的产物,写出 M 的结构简式 。
(5)满足下列条件的 A 的同分异构体的结构简式为 (不考虑立体异构)。
①能发生水解反应 ②能发生银镜反应 ③核磁共振氢谱图中不同位置信号峰面积
比为 1:6。
18.(13 分) 铁、钴及其化合物在生活、生产中用途广泛。请回答下列问题:
(1)基态Fe2+ 的核外电子排布式为_______;第四周期元素中,基态原子未成对电
子数与 Co 相等的有_______(填元素符号)。
(2)CoCl3在氨水中能形成多种配合物。八面体配合物CoCl3 3NH3的结构有
_______种,其中极性分子有_______种;取1molCoCl3 4NH3,加入足量硝酸银溶
液,得到 1mol 白色沉淀。该物质在溶液中形成的配合离子化学式为_______。
(3)铁和氨在 640℃时可发生置换反应,一种产物的晶胞
结构如图所示,该反应的化学方程式为___ ____。
(4)钴蓝晶体的立方晶胞由 4个Ⅰ型和 4个Ⅱ型小立方体
构成,其结构如下图,晶体中Al3+ 占据O2- 形成的_______(填
“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数
3
的值,钴蓝晶体的密度为_______g/cm (列计算式)。
化 学 试 题 第 6 页 共 8页
19.(10 分)肉桂酸乙酯常用作食品香料,因其沸点高且稳定宜用于焙烤类食品。
实验室制备肉桂酸乙酯的反应原理、装置示意图和有关信息如下:
物质 相对分子质 沸点/℃ 密度/ 溶解性
-3
量 (g /cm )
肉桂酸 148 300.0 1.2475 微溶于水,易溶于乙醇
乙醇 46 78.5 0.7893 与水任意比互溶
环己烷 84 80.7 0.7785 难溶于水,易溶于乙醇
肉桂酸乙酯 176 271.0 1.0491 难溶于水,易溶于乙醇
已知:氯化钙可与乙醇形成 CaCl2 6C2H5OH。
I.肉桂酸乙酯粗产品的制备
实验过程:向三颈烧瓶中加入肉桂酸 2.96g,无水乙醇 15.00mL,浓硫酸 1.00mL 及
碎瓷片,分水器中加入 15.00mL 环己烷,再补加水,使上层环己烷液体接近支管口。
加热回流反应 2—3h,回流过程中只允许分水器中上层液体流回反应体系。反应结
束后,将分水器旋塞打开,继续蒸出环己烷及剩余的乙醇。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填序号)。
A.25mL B.50mL C.100mL D.250mL
(2)加热后发现烧瓶中没有添加碎瓷片,处理方法是 。
II.肉桂酸乙酯的提纯需要经过以下一系列的操作:
a.减压蒸馏,收集肉桂酸乙酯
b.加入等体积 5%的 Na2CO3溶液洗涤,分液
c.加入等体积的饱和食盐水洗涤至中性,分液
d.加入无水 MgSO4固体
e.加入饱和 CaCl2溶液洗涤,分液
(1)①上述提纯步骤的正确顺序是 。②加入饱和食盐水的目的
是 。
化 学 试 题 第 7 页 共 8页
(2)恢复至室温时,分离得到纯产品质量为 2.64g,则肉桂酸乙酯的产率
为 %。
(3)加热有利于提高肉桂酸乙酯的产率,但实验发现温度过高肉桂酸乙酯的产率
反而降低,可能的原因是 、 (写出两点)。
20.(12 分)随着济南新旧动能转换的持续推进,新能源汽车正走入千家万户,如
何获得高性能的锂离子电池已成为一项重要课题。作为锂离子电池的关键组件之一,
电池隔膜在电化学表现、循环寿命和安全性等方面起着至关重要的作用。一种聚酰
亚胺隔膜 J的合成路线如图所示:
已知:
①A~H 均为芳香化合物 ②R NO F e/H2
Cl R NH2
③化合物 H中有两种不同化学环境的氢
回答下列问题:
(1)C的结构简式为 ,H的结构简式为 。
(2)F+I→J的化学方程式为 ,反应类型为 。
(3)G经酸性高锰酸钾氧化得到化合物 K,写出化合物 K同时符合下列条件的同分
异构体的结构简式 (写一种即可)。
①链状化合物,只含两种官能团
②1mol 有机物与足量 NaHCO3溶液反应放出 2mol 气体
③核磁共振氢谱有三组峰,峰面积之比为 3∶2∶1
(4)聚对苯二甲酸乙二酯(PET)也可用做锂电池隔膜,设计由乙烯和对二甲苯为
原料制备 PET 的合成路线(其他试剂任选,合成路线流程图示例见本题题干)。
化 学 试 题 第 8 页 共 8页
高二下学期第三次阶段性考试(化学答案)
一、选择题:本题共 10 小题,每小题 2 分,共 20 分,每小题只有一个选项符合题
目要求。
1--5.CDABC 6--10.ACDCB
二、选择题:本题共 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题意,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11--15. AC 、AD、C、B、BD
16.(13 分)
2 3
(1)第 3 周期第ⅠA 族(2分) [Ne]3s 3p (2 分)
(2)HClO4>H3PO4>H2SiO3(2 分)
(3)大于(1 分)硅氯的电负性差大于磷氯的电负性差(2 分)
(4)NH3>PH3(1 分)大于(1 分)P 原子半径大于 N 原子,成键电子对距离中
心原子远, 成键电子对排斥作用力减弱,所以 H-P-H 键角小。(2 分)
17.(12 分)
(1)2-甲基丙烯酸 (1 分) 羟基、羧基(2 分) (2)消去反应(1 分)
(2 分)
(3)HOOCCH(Br)CH2COOH+3NaOH NaOOCCH=CHCOONa+NaBr+3H2O (2 分)
(4) (2 分) (5) (2 分)
18.(13分)
(1) [Ar]3d
6
(2 分) V As (2 分)
(2) 2 (1 分) 、 2 (1 分)、 Co NH3
+
Cl2 4 (2 分)
640℃
(3)8Fe+2NH3 2Fe4N+3H 2 (2 分)
8 (59 2 27 4 16)
(4)八面体空隙(1 分) 、 N 2a 10 7 3 (2 分)A
1
19.(10分)
I(1)B(1分)
(2)停止加热,将烧瓶中的溶液冷却至室温,再重新加入碎瓷片(1分)
II(1)①bceda(2 分)、 ②除去肉桂酸乙酯中的碳酸钠杂质,同时增加水层
的密度,有利于分层;(2 分)
(2)75、(2 分)
(3)温度过高,反应物未经反应就脱离反应体系,使反应物利用率下降(1 分);
反应可能已达平衡状态,温度升高平衡向逆反应方向移动(1分)(或温度过高,发
生了副反应);(一种方法占一分)
24(共 12 分)
(1) (2 分) ; (2 分)
(2)
(2 分)
;缩聚反应(1分)
(3) (合理即可)(2 分)
(3 分)(每个物质合成占 1分,最后物质占 1分)
2
【选择题简要解析】
1. 豆油不是高分子化合物;直馏汽油(不含碳碳双键)不水解,与裂化汽油(含
碳碳双键)的结构区别,
3.A.空间填充模型考虑原子半径大小;
4.A.弱于
6.只有一种结构的邻、间、对 3种;一个取代基是硝基,一个是主链上有 3个碳,
支链上有 1个甲基,甲基连在离苯环最近的碳上。
7.A.质谱法 B.数目不确定 D.加聚反应
8.A.不是含有,而是分解产生的不饱和烃;
D.(物质结构课本第 2章微项目内容)
9.物质结构中左端是过氧键,不是酯基;
11.X.Y.Z 分别是 Zn.S.O
12.A.振荡时下口朝上;
13.A.大于,B,12 个,D.2mol
14.C.10 组峰
15.A.考虑氧原子的杂化,C.氢正离子没有电子
【检验:老师评讲后一定能做对】
1.2-甲基-2-氯丙烷是重要的化工原料,实验室中可由叔丁醇与浓盐酸反应制备,
路线如下:
下列说法错误的是
A.无水 CaCl2的作用是除去有机相中残存的少量水
B.可用 NaOH溶液代替 Na2CO3溶液洗涤
C.由叔丁醇制备 2-甲基-2-氯丙烷的反应类型为取代反应
3
D.蒸馏除去残余反应物叔丁醇时,产物先蒸馏出体系
2 2 .在水溶液中甲醛能与 Zn(CN)4 发生反应:
Zn(CN) 2 4H 2 4 4HCHO 4H2O 4HOCH2CN Zn H2O 。下列说法错误4
的是
A.K2[Zn(CN)4]中所含的化学键有离子键、共价键和配位键
B.HCHO 和 BF3中心原子的价层电子对数相同,H-C-H 键角大于 F-B-F
键角
C.CN 和 H2O与 Zn2+的配位能力:CN H2O
D. Zn(CN) 2 4 中,σ键和π键数目之比为 1∶1
3.乙氧酰胺苯甲酯常用作氨丙啉等抗球虫药的增效剂,其结构简式如图所示。下
列关于乙氧酰胺苯甲酯的说法错误的是
A.所含官能团为酰胺基、醚键、酯基
B.与其苯环上取代基相同的芳香族化合物有 9种
C.分子中最多有 12个碳原子共面
D.其水解产物一定条件下都能发生缩聚反应
B\B\D\
4
化学试题
本试卷满分为 100 分,考试用时 90 分钟。
说明:
1.本试卷分为选择题和非选择题两部分,考试时间 90 分钟,满分 100 分。
2.选择题答案用 2B 铅笔涂在答题卡上,非选择题用黑色中性笔作答,答案必须写
在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量: H-1 Li-7 C-12 N-14 O-16 Co-59 Fe-56
Mg-24 Al-27 Si-28 Na-23 Br-80
一、选择题:本题共 10 小题,每小题 2 分,共 20 分,每小题只有一个选项符合题
目要求。
1. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆
油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸。”下列说法正确的是
A. “乌金纸”的“乌”与“纸”,其成分都是有机物
B. “巨竹膜”和豆油的主要成分都属于天然高分子化合物
C. 可以用热的氢氧化钠溶液鉴别豆油和直馏汽油
D. 豆油的主要成分为油脂,在酸性条件下可水解生成乙醇和不饱和高级脂肪酸
2.用图示的方法能够直观形象地将化学知识传授给学生。下列图示正确的是
A B C D
3. 2021 年 9 月,我国科学家团队首次在实验室中实现了二氧化碳到淀粉的全合成,
合成路径如图。下列有关微粒的化学用语不正确的是
A. CO2的填充模型:
化 学 试 题 第 1 页 共 8页
B. 基态碳原子的轨道表示式:
C. FADH 的电子式:
D. 淀粉的分子式: C6H10O5 n
4.下列说法正确的是
A.已知甲基的推电子能力强于氢原子,则 NH3的接受质子能力强于(CH3)3N
B.碳酸钠溶液、新制氢氧化铜悬浊液都可用于鉴别甲酸、甲酸钠、甲酸乙酯
C.聚乙烯材料的老化是因为发生了加成反应
D.苯和液溴的混合液中加入铁粉,将产生的气体通入硝酸酸化的硝酸银溶液中,
产生淡黄色沉淀,证明苯与液溴发生取代反应
5.有机物分子中原子(或原子团)间的相互影响会导致其化学性质发生变化。下
列事实不能说明上述观点的是
A.苯酚能与 NaOH 溶液反应,乙醇不能与 NaOH 溶液反应
B.乙苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色
C.乙醇能发生消去反应,甲醇不能发生消去反应
D.乙醛能与氢气发生加成反应,乙酸不能与氢气发生加成反应
6.D-苯基丁氨酸( )可用作氨基酸保护单体,也可用于多肽的合
成.它有多种同分异构体,其中同时符合下列条件的共有
①苯环上有两个取代基;②有一个硝基直接连接在苯环上;③分子中存在一个手性
碳原子
A.3种 B.6种 C.9种 D.12 种
7.合成高分子材料的使用彻底改变了世界面貌,对于人类的生产生活方式产生了
重要影响。下列说法正确的是
A.通过红外光谱法测定聚乙烯的平均相对分子质量可得其链节数
B. (聚碳酸酯)水解后得到的含有苯环的物质的分子中
最多 14 个碳原子共面
C. (聚乙炔)能做导电材料,主要原因是分子中存在大π键
D.有机玻璃(聚甲基丙烯酸甲酯)可通过缩聚反应制得
化 学 试 题 第 2 页 共 8页
8. 下列实验操作和现象,对应的解释或结论正确的是
选项 实验操作 现象 解释或结论
石蜡油加强热,将产生的气体通入溴的四氯化 溶液红棕 石蜡油中含有
A
碳溶液 色变无色 不饱和烃
无白色沉 苯酚与溴水未
B 向 2mL 苯酚溶液中滴加 2滴溴水
淀 反应
加热无水乙醇和浓H2SO4的混合液至 170℃, 乙醇发生了消
C 红色褪去
将产生的气体通入酸性KMnO4溶液 去反应
向新制FeSO4溶液中滴加邻二氮菲
邻二氮菲和
溶液变橙
2+
D Fe 形成配合
( )溶液 红色
物
9.有机化合物 G 是合成抗真菌药物的重要中间体,结构简式如下图。下列说法正
确的是
A.G的分子式为 C11H11O5Cl
B.G 分子仅能发生取代、氧化、加成反应
C.G分子含有σ键、π键、大π键等化学键
D.1molG 最多可与 3molH2加成,最多与 3molNaOH 反应
10. 1-甲基-2-氯环己烷( )存在如图转化关系,下列说法不正确的是
A. 1-甲基-2-氯环己烷可能具有旋光性
B. 向 1-甲基-2-氯环己烷中加入HNO3酸化的AgNO3溶液,生成白色沉淀
C. Y 在一定条件下可以转化成 X
D. X 和 Y 均能使酸性高锰酸钾溶液褪色
二、选择题:本题共 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题意,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11. 元素 X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数
为 2,元素 Y基态原子的 3p 轨道上有 4个电子。元素 Z最外层电子数是其内层的 3
化 学 试 题 第 3 页 共 8页
倍。下列说法正确的是
A. 基态 X原子的价电子共有 6种空间运动状态
B. 在 Y 的简单氢化物分子中,Y的原子轨道杂化类型为 sp
C. Z 的简单氢化物在乙醇中的溶解性大于 Y的简单氢化物的
2
D. Y 与 Z 可形成的YZ3 的空间构型为平面三角形
12.下列物质分离提纯的方法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分离提纯实验室制取的硝基苯选择装置:④③
C.分离乙二醇(沸点为 197.3℃)和乙酸(沸点为 117.9℃)选择装置:③
D.提纯含不溶性杂质的粗苯甲酸,需经过加热溶解、冷却结晶、过滤、洗涤、
干燥等操作
13. 下图 a、b、c、d依次代表常见的 NaCl、CO2、金刚石、冰的晶胞或结构,下
列表述正确的是
A. MgO 的晶胞结构与 NaCl 类似,MgO 的晶格能小于 NaCl
B. 晶体中距离CO2分子最近且等距离的CO2分子有 8个
3 3 1
C. 若金刚石晶胞中 1的原子坐标为(0,0,0),则 2的原子坐标为( , , )
4 4 4
D. 冰晶体中存在氢键,18g 冰含有 4mol 氢键
14.某有机超强碱结构如图所示。下列说法错误的是
A.该有机物存在对映异构
B.该有机物核磁共振氢谱有 12 组峰
3 2
C.该有机物中 C和 N均有 sp 和 sp 两种杂化方式
D.该有机物中 C、N、O 三种元素形成的最简单氢化物分子
的键角依次减小
化 学 试 题 第 4 页 共 8页
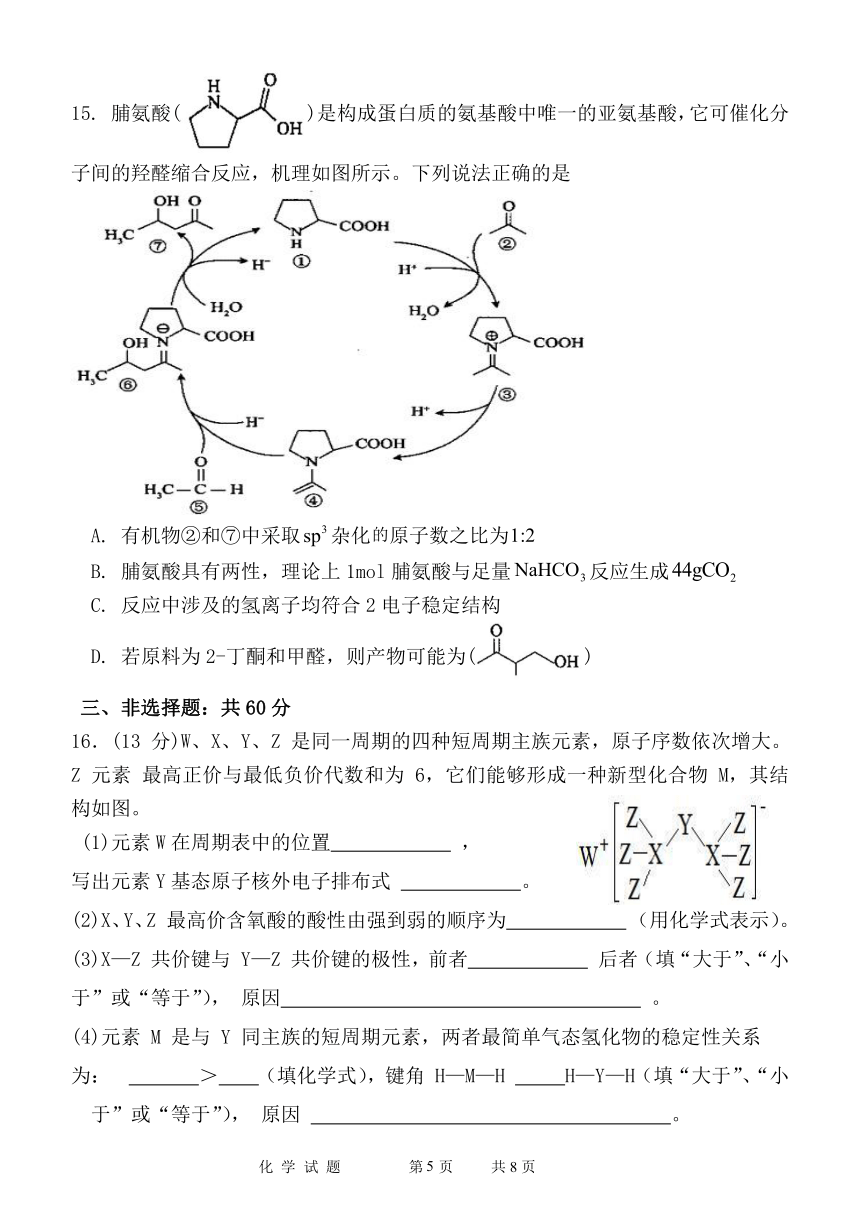
15. 脯氨酸( )是构成蛋白质的氨基酸中唯一的亚氨基酸,它可催化分
子间的羟醛缩合反应,机理如图所示。下列说法正确的是
A. 有机物②和⑦中采取 sp3杂化的原子数之比为1:2
B. 脯氨酸具有两性,理论上 1mol 脯氨酸与足量NaHCO3反应生成44gCO2
C. 反应中涉及的氢离子均符合 2电子稳定结构
D. 若原料为 2-丁酮和甲醛,则产物可能为( )
三、非选择题:共 60 分
16.(13 分)W、X、Y、Z 是同一周期的四种短周期主族元素,原子序数依次增大。
Z 元素 最高正价与最低负价代数和为 6,它们能够形成一种新型化合物 M,其结
构如图。
(1)元素 W在周期表中的位置 ,
写出元素 Y基态原子核外电子排布式 。
(2)X、Y、Z 最高价含氧酸的酸性由强到弱的顺序为 (用化学式表示)。
(3)X—Z 共价键与 Y—Z 共价键的极性,前者 后者(填“大于”、“小
于”或“等于”), 原因 。
(4)元素 M 是与 Y 同主族的短周期元素,两者最简单气态氢化物的稳定性关系
为: > (填化学式),键角 H—M—H H—Y—H(填“大于”、“小
于”或“等于”), 原因 。
化 学 试 题 第 5 页 共 8页
17.(12 分)高分子化合物 M 是一种矿物油的抗冻剂。实验室合成 M 的一种路线
(1)C 的名称为 ,B 中官能团的名称为 。
(2)B→C 反应类型为 ,写出 C→D 的方程式 。
(3)写出 F→G 的第一步反应方程式 。
(4)M 是 D 和 H 的加聚反应的产物,写出 M 的结构简式 。
(5)满足下列条件的 A 的同分异构体的结构简式为 (不考虑立体异构)。
①能发生水解反应 ②能发生银镜反应 ③核磁共振氢谱图中不同位置信号峰面积
比为 1:6。
18.(13 分) 铁、钴及其化合物在生活、生产中用途广泛。请回答下列问题:
(1)基态Fe2+ 的核外电子排布式为_______;第四周期元素中,基态原子未成对电
子数与 Co 相等的有_______(填元素符号)。
(2)CoCl3在氨水中能形成多种配合物。八面体配合物CoCl3 3NH3的结构有
_______种,其中极性分子有_______种;取1molCoCl3 4NH3,加入足量硝酸银溶
液,得到 1mol 白色沉淀。该物质在溶液中形成的配合离子化学式为_______。
(3)铁和氨在 640℃时可发生置换反应,一种产物的晶胞
结构如图所示,该反应的化学方程式为___ ____。
(4)钴蓝晶体的立方晶胞由 4个Ⅰ型和 4个Ⅱ型小立方体
构成,其结构如下图,晶体中Al3+ 占据O2- 形成的_______(填
“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数
3
的值,钴蓝晶体的密度为_______g/cm (列计算式)。
化 学 试 题 第 6 页 共 8页
19.(10 分)肉桂酸乙酯常用作食品香料,因其沸点高且稳定宜用于焙烤类食品。
实验室制备肉桂酸乙酯的反应原理、装置示意图和有关信息如下:
物质 相对分子质 沸点/℃ 密度/ 溶解性
-3
量 (g /cm )
肉桂酸 148 300.0 1.2475 微溶于水,易溶于乙醇
乙醇 46 78.5 0.7893 与水任意比互溶
环己烷 84 80.7 0.7785 难溶于水,易溶于乙醇
肉桂酸乙酯 176 271.0 1.0491 难溶于水,易溶于乙醇
已知:氯化钙可与乙醇形成 CaCl2 6C2H5OH。
I.肉桂酸乙酯粗产品的制备
实验过程:向三颈烧瓶中加入肉桂酸 2.96g,无水乙醇 15.00mL,浓硫酸 1.00mL 及
碎瓷片,分水器中加入 15.00mL 环己烷,再补加水,使上层环己烷液体接近支管口。
加热回流反应 2—3h,回流过程中只允许分水器中上层液体流回反应体系。反应结
束后,将分水器旋塞打开,继续蒸出环己烷及剩余的乙醇。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填序号)。
A.25mL B.50mL C.100mL D.250mL
(2)加热后发现烧瓶中没有添加碎瓷片,处理方法是 。
II.肉桂酸乙酯的提纯需要经过以下一系列的操作:
a.减压蒸馏,收集肉桂酸乙酯
b.加入等体积 5%的 Na2CO3溶液洗涤,分液
c.加入等体积的饱和食盐水洗涤至中性,分液
d.加入无水 MgSO4固体
e.加入饱和 CaCl2溶液洗涤,分液
(1)①上述提纯步骤的正确顺序是 。②加入饱和食盐水的目的
是 。
化 学 试 题 第 7 页 共 8页
(2)恢复至室温时,分离得到纯产品质量为 2.64g,则肉桂酸乙酯的产率
为 %。
(3)加热有利于提高肉桂酸乙酯的产率,但实验发现温度过高肉桂酸乙酯的产率
反而降低,可能的原因是 、 (写出两点)。
20.(12 分)随着济南新旧动能转换的持续推进,新能源汽车正走入千家万户,如
何获得高性能的锂离子电池已成为一项重要课题。作为锂离子电池的关键组件之一,
电池隔膜在电化学表现、循环寿命和安全性等方面起着至关重要的作用。一种聚酰
亚胺隔膜 J的合成路线如图所示:
已知:
①A~H 均为芳香化合物 ②R NO F e/H2
Cl R NH2
③化合物 H中有两种不同化学环境的氢
回答下列问题:
(1)C的结构简式为 ,H的结构简式为 。
(2)F+I→J的化学方程式为 ,反应类型为 。
(3)G经酸性高锰酸钾氧化得到化合物 K,写出化合物 K同时符合下列条件的同分
异构体的结构简式 (写一种即可)。
①链状化合物,只含两种官能团
②1mol 有机物与足量 NaHCO3溶液反应放出 2mol 气体
③核磁共振氢谱有三组峰,峰面积之比为 3∶2∶1
(4)聚对苯二甲酸乙二酯(PET)也可用做锂电池隔膜,设计由乙烯和对二甲苯为
原料制备 PET 的合成路线(其他试剂任选,合成路线流程图示例见本题题干)。
化 学 试 题 第 8 页 共 8页
高二下学期第三次阶段性考试(化学答案)
一、选择题:本题共 10 小题,每小题 2 分,共 20 分,每小题只有一个选项符合题
目要求。
1--5.CDABC 6--10.ACDCB
二、选择题:本题共 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题意,全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11--15. AC 、AD、C、B、BD
16.(13 分)
2 3
(1)第 3 周期第ⅠA 族(2分) [Ne]3s 3p (2 分)
(2)HClO4>H3PO4>H2SiO3(2 分)
(3)大于(1 分)硅氯的电负性差大于磷氯的电负性差(2 分)
(4)NH3>PH3(1 分)大于(1 分)P 原子半径大于 N 原子,成键电子对距离中
心原子远, 成键电子对排斥作用力减弱,所以 H-P-H 键角小。(2 分)
17.(12 分)
(1)2-甲基丙烯酸 (1 分) 羟基、羧基(2 分) (2)消去反应(1 分)
(2 分)
(3)HOOCCH(Br)CH2COOH+3NaOH NaOOCCH=CHCOONa+NaBr+3H2O (2 分)
(4) (2 分) (5) (2 分)
18.(13分)
(1) [Ar]3d
6
(2 分) V As (2 分)
(2) 2 (1 分) 、 2 (1 分)、 Co NH3
+
Cl2 4 (2 分)
640℃
(3)8Fe+2NH3 2Fe4N+3H 2 (2 分)
8 (59 2 27 4 16)
(4)八面体空隙(1 分) 、 N 2a 10 7 3 (2 分)A
1
19.(10分)
I(1)B(1分)
(2)停止加热,将烧瓶中的溶液冷却至室温,再重新加入碎瓷片(1分)
II(1)①bceda(2 分)、 ②除去肉桂酸乙酯中的碳酸钠杂质,同时增加水层
的密度,有利于分层;(2 分)
(2)75、(2 分)
(3)温度过高,反应物未经反应就脱离反应体系,使反应物利用率下降(1 分);
反应可能已达平衡状态,温度升高平衡向逆反应方向移动(1分)(或温度过高,发
生了副反应);(一种方法占一分)
24(共 12 分)
(1) (2 分) ; (2 分)
(2)
(2 分)
;缩聚反应(1分)
(3) (合理即可)(2 分)
(3 分)(每个物质合成占 1分,最后物质占 1分)
2
【选择题简要解析】
1. 豆油不是高分子化合物;直馏汽油(不含碳碳双键)不水解,与裂化汽油(含
碳碳双键)的结构区别,
3.A.空间填充模型考虑原子半径大小;
4.A.弱于
6.只有一种结构的邻、间、对 3种;一个取代基是硝基,一个是主链上有 3个碳,
支链上有 1个甲基,甲基连在离苯环最近的碳上。
7.A.质谱法 B.数目不确定 D.加聚反应
8.A.不是含有,而是分解产生的不饱和烃;
D.(物质结构课本第 2章微项目内容)
9.物质结构中左端是过氧键,不是酯基;
11.X.Y.Z 分别是 Zn.S.O
12.A.振荡时下口朝上;
13.A.大于,B,12 个,D.2mol
14.C.10 组峰
15.A.考虑氧原子的杂化,C.氢正离子没有电子
【检验:老师评讲后一定能做对】
1.2-甲基-2-氯丙烷是重要的化工原料,实验室中可由叔丁醇与浓盐酸反应制备,
路线如下:
下列说法错误的是
A.无水 CaCl2的作用是除去有机相中残存的少量水
B.可用 NaOH溶液代替 Na2CO3溶液洗涤
C.由叔丁醇制备 2-甲基-2-氯丙烷的反应类型为取代反应
3
D.蒸馏除去残余反应物叔丁醇时,产物先蒸馏出体系
2 2 .在水溶液中甲醛能与 Zn(CN)4 发生反应:
Zn(CN) 2 4H 2 4 4HCHO 4H2O 4HOCH2CN Zn H2O 。下列说法错误4
的是
A.K2[Zn(CN)4]中所含的化学键有离子键、共价键和配位键
B.HCHO 和 BF3中心原子的价层电子对数相同,H-C-H 键角大于 F-B-F
键角
C.CN 和 H2O与 Zn2+的配位能力:CN H2O
D. Zn(CN) 2 4 中,σ键和π键数目之比为 1∶1
3.乙氧酰胺苯甲酯常用作氨丙啉等抗球虫药的增效剂,其结构简式如图所示。下
列关于乙氧酰胺苯甲酯的说法错误的是
A.所含官能团为酰胺基、醚键、酯基
B.与其苯环上取代基相同的芳香族化合物有 9种
C.分子中最多有 12个碳原子共面
D.其水解产物一定条件下都能发生缩聚反应
B\B\D\
4
同课章节目录
