1.6 几种重要的盐(第1课时)
图片预览







文档简介
课件25张PPT。1.6 几种重要的盐
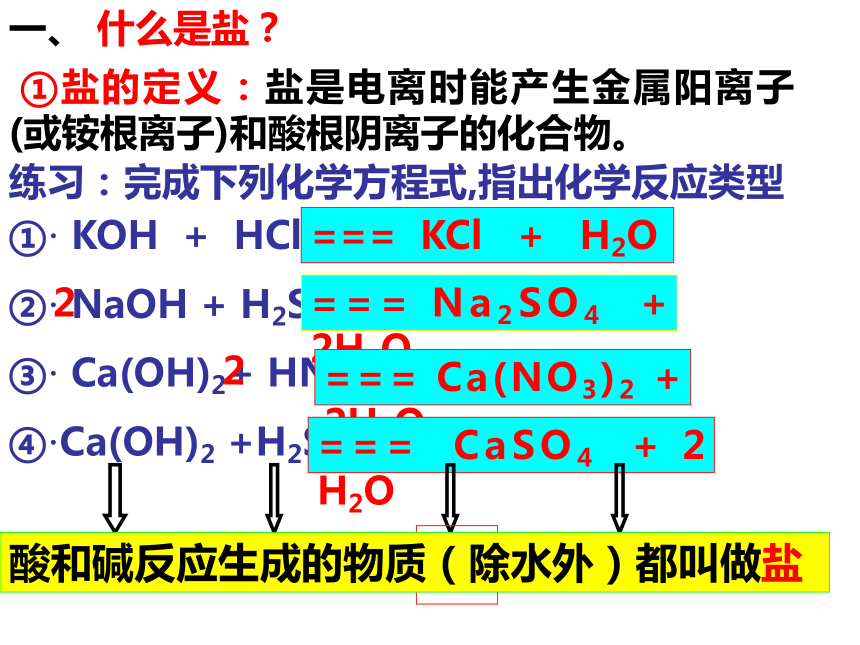
(一)盐的性质 ①盐的定义:盐是电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物。一、 什么是盐?练习:完成下列化学方程式,指出化学反应类型①· KOH + HCl
②· NaOH + H2SO4
③· Ca(OH)2+ HNO3
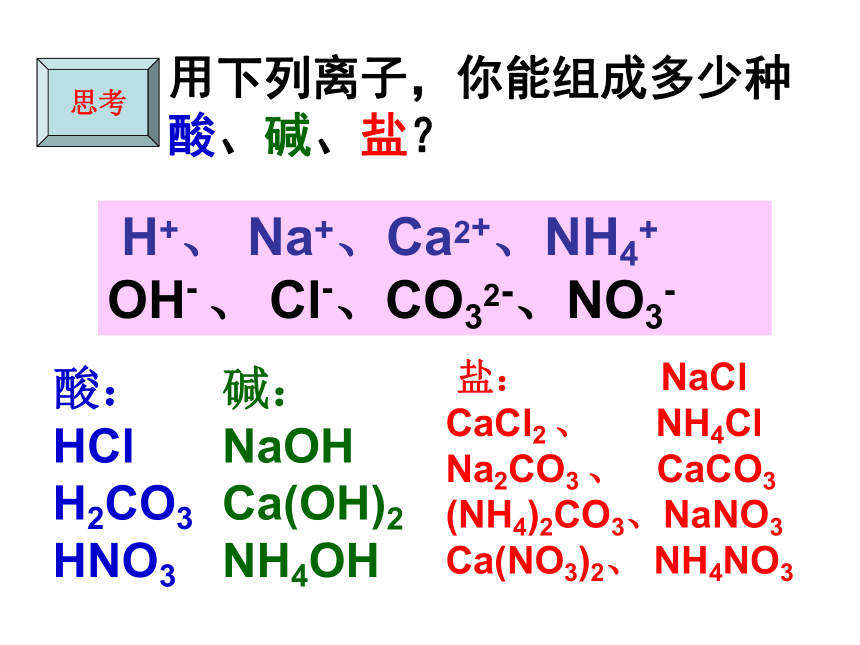
④·Ca(OH)2 +H2SO4=== KCl + H2O=== Na2SO4 + 2H2O=== Ca(NO3)2 + 2H2O=== CaSO4 + 2 H2O碱酸盐水酸和碱反应生成的物质(除水外)都叫做盐22自然界中的盐晶体非常美丽绿矾硝酸钾明矾纯碱晶体重铬酸钾氯化钠晶体硫酸铜晶体绿柱石Be3Al2Si6O18;可含有Fe等元素??橄榄石:含硅酸盐 H+、 Na+、Ca2+、NH4+
OH- 、 Cl-、CO32-、NO3-用下列离子,你能组成多少种酸、碱、盐? 盐: NaCl
CaCl2 、 NH4Cl
Na2CO3 、 CaCO3 (NH4)2CO3、NaNO3 Ca(NO3)2、 NH4NO3碱:NaOH
Ca(OH)2
NH4OH
酸:HCl
H2CO3
HNO3
思考二、几种盐的性质1、碳酸钠(Na2CO3)俗称:纯碱、苏打⑴ 碳酸钠晶体(Na2CO3?10H2O)常温下,在干燥的空气中,晶体失去部分或全部
结晶水的现象叫风化。风化属于化学变化。Na2CO3?10H2O = Na2CO3 + 10H2O纯净物实验:往碳酸钠溶液中滴入酚酞试剂,有何现象?溶液变红1.碳酸钠与酸碱指示剂反应3.与碱反应: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(一)碳酸钠的化学性质碳酸钠的水溶液呈碱性2.与酸反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl4.与盐反应:制取烧碱 酸 碱
灭火器 鉴别氢氧化钠是否变质:
甲的做法:取样品加入蒸馏水,配成溶液,滴入酚酞试液,试液变红则说明没变质,试液不变色证明已变质.
乙的做法:加入盐酸,产生气泡证明变质,不产生气泡证明没变质.
思考:你还有什么证明变质的方法吗?若有变质如何除去杂质?你来评理?×√2、碳酸钙 CaCO3石灰石大理石---花瓶A.碳酸钙是重要的建筑材料。
1)、洁白纯净的碳酸钙岩石叫汉白玉 。
2)、因含杂质而有花纹的碳酸钙叫大理石。
3)、质地致密的碳酸钙岩石叫石灰石。CaCO3+2HCl=CaCl2+H2O+CO2↑1)、碳酸钙能与酸反应2)、碳酸钙在高温下能分解B.碳酸钙的化学性质 CaCO3 CaO + CO2 ↑思考:怎样证明一块岩石是碳酸盐?岩石盐酸澄清石灰水冒气泡CaCO3+2HCl=CaCl2+CO2↑+H2O变浑浊CO2+Ca(OH)2=CaCO3↓+H2O石灰沙浆来砌砖、抹墙,就是利用熟石灰能吸收空气中的二氧化碳变成坚固的碳酸钙这一性质.1.碳酸钙是重要的建筑材料.用途3.石灰石主要用途是生产水泥.2.制生石灰和CO2珍珠石灰石和粘土按适当比例混合,再加强热,就制得水泥.坚硬难溶于水3、食盐(NaCl)⑴ 食盐主要存在于 、 、 和 。海洋盐湖盐井盐矿⑵ 用途:调味品、腌制食物、维持人的正常生
理活动、配制生理盐水(0.9%)、
重要的化工原料 日常生活中常用食盐水清洗伤口,你知道这是为什么吗? 因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,所以具有杀菌作用。日常生活中,可用食盐水清洗伤口,具有杀菌作用。NaCl+AgNO3 =AgCl↓+ NaNO3活动:收集一些汗液(或氯化钠溶液)盛放在试管中,滴入几滴硝酸银溶液,有什么现象产生?白色沉淀 氯化钠与硝酸银反应,并写出有关反应的方程式:这堂课你学了什么?一、盐的含义二、几种盐的性质1、纯碱2、碳酸钙3、食盐三、碳酸根离子的检验1、某溶液中含有Na+、H+、Cl-、SO42-,欲证明两种
阴离子确实存在,选用的最佳方案是:
先向溶液中滴加过量的 溶液至沉淀不再生成,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO32、下列各组离子能大量共存的是( )
A、H+、SO42-、OH-、Ba2+
B、 K+、Mg2+、NO3-、OH-
C、 H+、Na+、NO3-、CO32-
D、 Na+、K+、H+、SO42-D3、如何用实验方法证明溶液中同时存在Cl-、
SO42-和CO32-?(1)加入过量稀硝酸;,(2)加入过量硝酸钡溶液、
(3)加入硝酸、(4)过滤、(5)加入硝酸银溶液4、已知某无色溶液里含有硫酸,则该溶液中还
可能含有的物质是( )
A、硫酸铜 B、碳酸钠
C、硫酸锌 D、氢氧化铜C溶液为蓝色与硫酸反应与硫酸反应无色,且与硫酸不反应5、在装有下列固体的烧杯中,加入过量的稀盐酸, 能得到澄清无色的溶液的是( )
A、AgNO3 B、Cu(OH)2
C、Mg D、Fe2O3C白色沉淀蓝色溶液黄色溶液无色溶液6、一种无色溶液能与氯化钡溶液反应,生成不溶
于稀硝酸的白色沉淀,则无色溶液( )
A、一定是稀硫酸 B、一定是硝酸银溶液
C、一定含有SO42- D、无法确定D7、检验某溶液是否呈酸性时,取少量溶液进行
如下实验,其中错误的做法是( )
A、滴入Na2CO3溶液 B、滴入紫色石蕊试液
C、加入锌粒 D、滴入NaOH溶液D有气泡产生紫色石蕊变红色有气泡产生无现象8、有一包白色粉末,可能含有KCl、CaCO3、K2CO3、Na2SO4、
无水CuSO4、CaCl2中的一种或几种,取该混合物做如下实验:
⑴加蒸馏水溶解后得到无色透明溶液;
⑵在该溶液中滴加BaCl2溶液,有白色沉淀生成;
⑶过滤后,在沉淀物里加入足量的稀HNO3,沉淀全部溶解并放
出无色气体;
⑷在滤液中加入硝酸银,生成不溶于稀硝酸的白色沉淀。
根据上述现象可知原混合物中一定有(用化学式表示)
,一定没有 ,可能有 。一定没有CaCO3(不溶)和CuSO4(溶液为蓝色),
CaCl2与K2CO3和Na2SO4不能同时存在(否则生成沉淀)。可能是BaCO3(不溶)或BaSO4(不溶)或
BaCO3(不溶)和BaSO4(不溶) ,白色沉淀是BaCO3(不溶)白色沉淀是AgCl(不溶),CaCO3、CuSO4、
Na2SO4、CaCl2Na2CO3KCl9、甲、乙两个相邻的化工厂,排放的污水虽经过处理
后,仍然各溶有以下8种离子(Ag+、Ba2+、Fe3+、Na+、
Cl-、SO42-、NO3-、OH-)中的各不相同的4种离子,若各
自单独排放污水将造成环境污染。如果将甲、乙两厂的
污水按适当比例充分混合,经再沉淀后,排放出的污水
转变为无色澄清的硝酸钠稀溶液,污染程度大为降低,
又经测定甲厂污水的PH值大于7。试推断:
⑴ 甲厂污水中含有的四种离子是 ,
⑵乙厂污水中含有的四种离子是 。OH-、Ag+、Fe3+、Cl-、SO42-、Ba2+、Na+、NO3-、
10.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、
硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀
和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,
沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有?? ????????????????????;
一定没有??????????????????????? ;可能含有???????????????。(填化学式)白色沉淀可能是AgCl、Mg(OH)2、BaCO3、BaSO4白色沉淀不是AgCl、BaCO3、BaSO4 ,是Mg(OH)2白色沉淀是AgCl,滤液中一定有Cl-,BaCl2和Mg(OH)2AgCl、Na2CO3、Na2SO4KNO3原混合物中BaCl2与Na2CO3、BaCl2与Na2SO4不能同时存在则原混合物中一定有BaCl2,一定没有Na2CO3和Na2SO4
(一)盐的性质 ①盐的定义:盐是电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物。一、 什么是盐?练习:完成下列化学方程式,指出化学反应类型①· KOH + HCl
②· NaOH + H2SO4
③· Ca(OH)2+ HNO3
④·Ca(OH)2 +H2SO4=== KCl + H2O=== Na2SO4 + 2H2O=== Ca(NO3)2 + 2H2O=== CaSO4 + 2 H2O碱酸盐水酸和碱反应生成的物质(除水外)都叫做盐22自然界中的盐晶体非常美丽绿矾硝酸钾明矾纯碱晶体重铬酸钾氯化钠晶体硫酸铜晶体绿柱石Be3Al2Si6O18;可含有Fe等元素??橄榄石:含硅酸盐 H+、 Na+、Ca2+、NH4+
OH- 、 Cl-、CO32-、NO3-用下列离子,你能组成多少种酸、碱、盐? 盐: NaCl
CaCl2 、 NH4Cl
Na2CO3 、 CaCO3 (NH4)2CO3、NaNO3 Ca(NO3)2、 NH4NO3碱:NaOH
Ca(OH)2
NH4OH
酸:HCl
H2CO3
HNO3
思考二、几种盐的性质1、碳酸钠(Na2CO3)俗称:纯碱、苏打⑴ 碳酸钠晶体(Na2CO3?10H2O)常温下,在干燥的空气中,晶体失去部分或全部
结晶水的现象叫风化。风化属于化学变化。Na2CO3?10H2O = Na2CO3 + 10H2O纯净物实验:往碳酸钠溶液中滴入酚酞试剂,有何现象?溶液变红1.碳酸钠与酸碱指示剂反应3.与碱反应: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(一)碳酸钠的化学性质碳酸钠的水溶液呈碱性2.与酸反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl4.与盐反应:制取烧碱 酸 碱
灭火器 鉴别氢氧化钠是否变质:
甲的做法:取样品加入蒸馏水,配成溶液,滴入酚酞试液,试液变红则说明没变质,试液不变色证明已变质.
乙的做法:加入盐酸,产生气泡证明变质,不产生气泡证明没变质.
思考:你还有什么证明变质的方法吗?若有变质如何除去杂质?你来评理?×√2、碳酸钙 CaCO3石灰石大理石---花瓶A.碳酸钙是重要的建筑材料。
1)、洁白纯净的碳酸钙岩石叫汉白玉 。
2)、因含杂质而有花纹的碳酸钙叫大理石。
3)、质地致密的碳酸钙岩石叫石灰石。CaCO3+2HCl=CaCl2+H2O+CO2↑1)、碳酸钙能与酸反应2)、碳酸钙在高温下能分解B.碳酸钙的化学性质 CaCO3 CaO + CO2 ↑思考:怎样证明一块岩石是碳酸盐?岩石盐酸澄清石灰水冒气泡CaCO3+2HCl=CaCl2+CO2↑+H2O变浑浊CO2+Ca(OH)2=CaCO3↓+H2O石灰沙浆来砌砖、抹墙,就是利用熟石灰能吸收空气中的二氧化碳变成坚固的碳酸钙这一性质.1.碳酸钙是重要的建筑材料.用途3.石灰石主要用途是生产水泥.2.制生石灰和CO2珍珠石灰石和粘土按适当比例混合,再加强热,就制得水泥.坚硬难溶于水3、食盐(NaCl)⑴ 食盐主要存在于 、 、 和 。海洋盐湖盐井盐矿⑵ 用途:调味品、腌制食物、维持人的正常生
理活动、配制生理盐水(0.9%)、
重要的化工原料 日常生活中常用食盐水清洗伤口,你知道这是为什么吗? 因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,所以具有杀菌作用。日常生活中,可用食盐水清洗伤口,具有杀菌作用。NaCl+AgNO3 =AgCl↓+ NaNO3活动:收集一些汗液(或氯化钠溶液)盛放在试管中,滴入几滴硝酸银溶液,有什么现象产生?白色沉淀 氯化钠与硝酸银反应,并写出有关反应的方程式:这堂课你学了什么?一、盐的含义二、几种盐的性质1、纯碱2、碳酸钙3、食盐三、碳酸根离子的检验1、某溶液中含有Na+、H+、Cl-、SO42-,欲证明两种
阴离子确实存在,选用的最佳方案是:
先向溶液中滴加过量的 溶液至沉淀不再生成,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO32、下列各组离子能大量共存的是( )
A、H+、SO42-、OH-、Ba2+
B、 K+、Mg2+、NO3-、OH-
C、 H+、Na+、NO3-、CO32-
D、 Na+、K+、H+、SO42-D3、如何用实验方法证明溶液中同时存在Cl-、
SO42-和CO32-?(1)加入过量稀硝酸;,(2)加入过量硝酸钡溶液、
(3)加入硝酸、(4)过滤、(5)加入硝酸银溶液4、已知某无色溶液里含有硫酸,则该溶液中还
可能含有的物质是( )
A、硫酸铜 B、碳酸钠
C、硫酸锌 D、氢氧化铜C溶液为蓝色与硫酸反应与硫酸反应无色,且与硫酸不反应5、在装有下列固体的烧杯中,加入过量的稀盐酸, 能得到澄清无色的溶液的是( )
A、AgNO3 B、Cu(OH)2
C、Mg D、Fe2O3C白色沉淀蓝色溶液黄色溶液无色溶液6、一种无色溶液能与氯化钡溶液反应,生成不溶
于稀硝酸的白色沉淀,则无色溶液( )
A、一定是稀硫酸 B、一定是硝酸银溶液
C、一定含有SO42- D、无法确定D7、检验某溶液是否呈酸性时,取少量溶液进行
如下实验,其中错误的做法是( )
A、滴入Na2CO3溶液 B、滴入紫色石蕊试液
C、加入锌粒 D、滴入NaOH溶液D有气泡产生紫色石蕊变红色有气泡产生无现象8、有一包白色粉末,可能含有KCl、CaCO3、K2CO3、Na2SO4、
无水CuSO4、CaCl2中的一种或几种,取该混合物做如下实验:
⑴加蒸馏水溶解后得到无色透明溶液;
⑵在该溶液中滴加BaCl2溶液,有白色沉淀生成;
⑶过滤后,在沉淀物里加入足量的稀HNO3,沉淀全部溶解并放
出无色气体;
⑷在滤液中加入硝酸银,生成不溶于稀硝酸的白色沉淀。
根据上述现象可知原混合物中一定有(用化学式表示)
,一定没有 ,可能有 。一定没有CaCO3(不溶)和CuSO4(溶液为蓝色),
CaCl2与K2CO3和Na2SO4不能同时存在(否则生成沉淀)。可能是BaCO3(不溶)或BaSO4(不溶)或
BaCO3(不溶)和BaSO4(不溶) ,白色沉淀是BaCO3(不溶)白色沉淀是AgCl(不溶),CaCO3、CuSO4、
Na2SO4、CaCl2Na2CO3KCl9、甲、乙两个相邻的化工厂,排放的污水虽经过处理
后,仍然各溶有以下8种离子(Ag+、Ba2+、Fe3+、Na+、
Cl-、SO42-、NO3-、OH-)中的各不相同的4种离子,若各
自单独排放污水将造成环境污染。如果将甲、乙两厂的
污水按适当比例充分混合,经再沉淀后,排放出的污水
转变为无色澄清的硝酸钠稀溶液,污染程度大为降低,
又经测定甲厂污水的PH值大于7。试推断:
⑴ 甲厂污水中含有的四种离子是 ,
⑵乙厂污水中含有的四种离子是 。OH-、Ag+、Fe3+、Cl-、SO42-、Ba2+、Na+、NO3-、
10.有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、
硫酸钠和硝酸钾中的某几种组成。为了鉴定其成分,实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤、得白色沉淀
和无色滤液。
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生。
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,
沉淀不溶解。
试根据以上现象推断该白色粉末中一定含有?? ????????????????????;
一定没有??????????????????????? ;可能含有???????????????。(填化学式)白色沉淀可能是AgCl、Mg(OH)2、BaCO3、BaSO4白色沉淀不是AgCl、BaCO3、BaSO4 ,是Mg(OH)2白色沉淀是AgCl,滤液中一定有Cl-,BaCl2和Mg(OH)2AgCl、Na2CO3、Na2SO4KNO3原混合物中BaCl2与Na2CO3、BaCl2与Na2SO4不能同时存在则原混合物中一定有BaCl2,一定没有Na2CO3和Na2SO4
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
