专题3微粒间作用力与物质性质单元测试(含答案)高二下学期苏教版(2020)化学选择性必修2
文档属性
| 名称 | 专题3微粒间作用力与物质性质单元测试(含答案)高二下学期苏教版(2020)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 21:27:48 | ||
图片预览




文档简介
专题3《微粒间作用力与物质性质》单元检测题
一、单选题(共13题)
1.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
2.下面的排序不正确的是
A.晶体沸点由低到高:CF4<CCl4<CBr4 B.晶格能由大到小: NaF> NaCl> NaBr
C.硬度由大到小:金刚石>碳化硅>晶体硅 D.熔点由高到低:Na>Mg>Al
3.下列关于晶体的说法正确的是
A.组成金属的粒子是原子
B.晶体中分子间作用力越大,分子越稳定
C.离子晶体中一定有离子键,分子晶体中肯定没有离子键
D.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
4.在气体分析中,常用CuCl2的盐酸溶液吸收并定量测定CO的含量。某工艺通过如下流程制备氯化亚铜固体(已知CuCl容易被氧化):
下列说法正确的是
A.步骤①中可用稀硫酸代替稀盐酸
B.步骤②中SO2的作用是作为氧化剂
C.步骤③中用SO2水溶液洗涤比较有效
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
5.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
6.用NA代表阿伏伽德罗常数的值,下列说法正确的是
A.20g D216O含中子数目为9NA
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C.密闭容器中2mol NO和1mol O2充分反应后,容器中分子数为2NA
D.0.25mol Zn与一定量浓硫酸反应后完全溶解,生成气体的分子数小于0.25NA
7.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
8.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
9.H3BO3是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键);与足量的NaOH反应生成NaH2BO3。下列说法正确的是
A.根据H3BO3结构可知,H3BO3易溶于水
B.分子中B、O最外层均为8电子稳定结构
C.含1 mol H3BO3的晶体中有6 mol氢键
D.H3BO3中B为+3价,属于三元弱酸
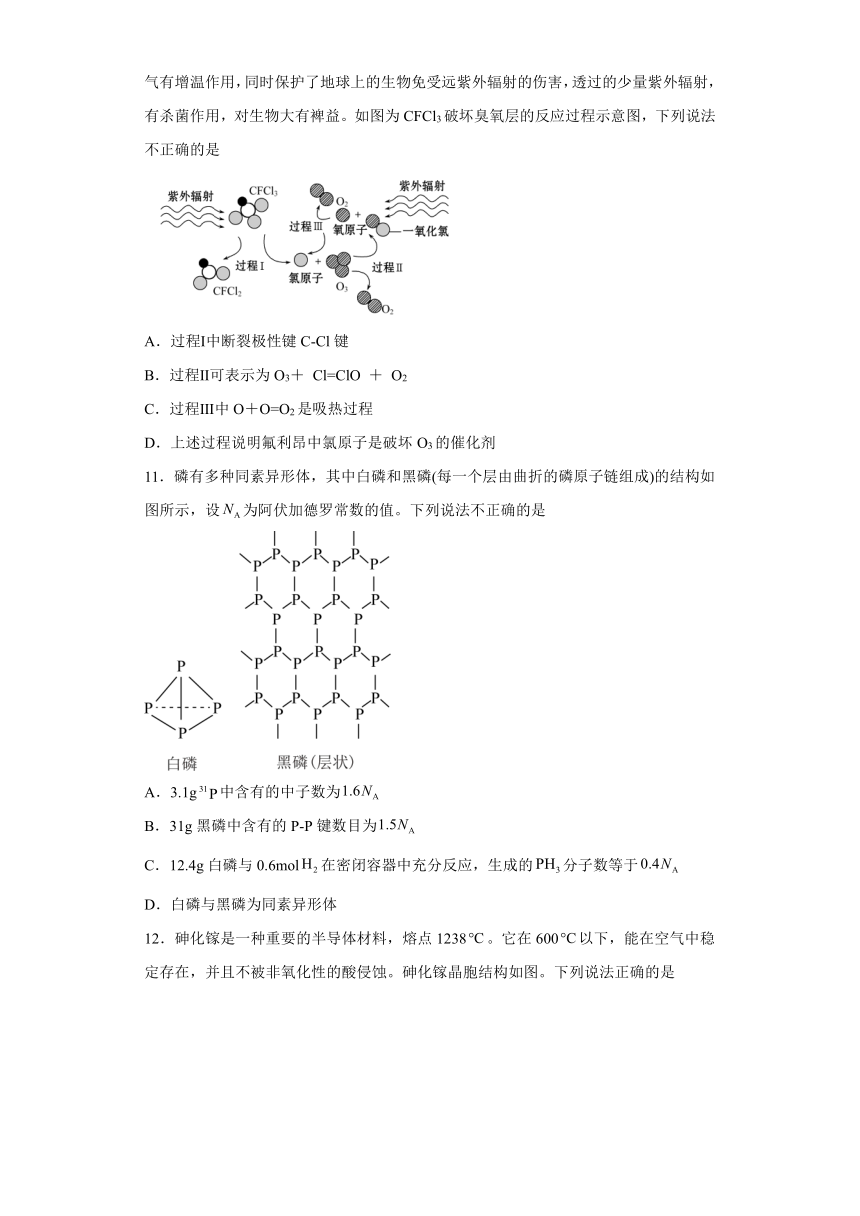
10.臭氧层是大气层的平流层中臭氧浓度高的层次。紫外辐射在高空被臭氧吸收,对大气有增温作用,同时保护了地球上的生物免受远紫外辐射的伤害,透过的少量紫外辐射,有杀菌作用,对生物大有裨益。如图为CFCl3破坏臭氧层的反应过程示意图,下列说法不正确的是
A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可表示为O3+ Cl=ClO + O2
C.过程Ⅲ中O+O=O2是吸热过程
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
11.磷有多种同素异形体,其中白磷和黑磷(每一个层由曲折的磷原子链组成)的结构如图所示,设为阿伏加德罗常数的值。下列说法不正确的是
A.3.1g中含有的中子数为
B.31g黑磷中含有的P-P键数目为
C.12.4g白磷与0.6mol在密闭容器中充分反应,生成的分子数等于
D.白磷与黑磷为同素异形体
12.砷化镓是一种重要的半导体材料,熔点1238。它在600以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.晶胞中Ga原子与As原子的数量比为4:1
D.晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
13.下列事实不能从原子结构角度解释的是
A.化合物中为价 B.沸点:
C.非金属性: D.热稳定性:
二、非选择题(共10题)
14.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
15.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
16.(1)现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。
其中既含离子键又含非极性键的是___________(填序号,下同);既含离子键又含极性键的是___________;属于电解质的是:___________。
(2)短周期的某元素的气态氢化物为H2R,则该元素的原子最外层有___________个电子。
(3)只含金属元素的主族位于第___________纵行。
(4)第四周期元素中,如第IIA族原子序数为a,则第IIIA族原子序数为___________(用含a的式子表示)。
(5)周期表中位于第8纵行的铁元素属于第___________族,已知铁的原子序数为26,最外层有2个电子,则铁的原子结构示意图为___________。
(6)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为___________;若XY2为共价化合物,则其结构式为___________。
17.如图所示是“足球稀”分子中含有12个五边形,20个六边形,30个双键。
(1)平均每个五边形所含碳原子为______个,平均每个六边形所含的碳原子为_________个。
(2)“足球烯”分子的分子式为___________。
(3)“足球烯”分子含有的化学键单键数为___________。
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为_________。
18.硫化锂Li2S(摩尔质量Mg mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
19.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
20.碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________(用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________。
②B中溶液发生反应的离子方程式是__________________________。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
21.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
22.A、B是短周期元素,原子最外层电子排布式分别为、()。A与B形成的离子化合物加水溶解后可使酚酞溶液变红,同时有气体C逸出,该气体可使湿润的红色石蕊试纸变蓝。则该离子化合物的化学式为_______,气体C的电子式为_______。
23.I.原子序数小于等于36的Q、W、X、Y、Z五种元素,它们的原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_______。
(2)与所含σ键数目之比为_______。
(3)一种由X和Z两种元素形成的化合物的晶胞如图所示,该化合物的化学式为_______。
(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为_______。
②预测该化合物熔点应_______(填“高于”或“低于”)金刚石。
II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(5)基态Fe3+的电子排布式为_______。
(6)普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为_______。又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_______。
(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为_______。
24.已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:
(1)X为____(填元素名称,下同),Y为____,Z为____。
(2)M在元素周期表的位置是____,基态N原子的价层电子排布式为____。
(3)X、Y、Z的第一电离能由大到小的顺序为____(填元素符号)。
(4)Z与N的最简单氢化物的稳定性比较:____ (写化学式),原因为____。
(5)YX2的晶体类型为____,其熔点____(填“高于”或“低于”)NX2。
参考答案:
1.D 2.D 3.C 4.C 5.D 6.B 7.A 8.C 9.A 10.C 11.C 12.D
13.B
14. 分子晶体 苯胺分子之间存在氢键
15.(1)7
(2) 2 2
(3)
16. ④ ③⑤ ③④⑤⑧ 6 2 a+11 VIII S=C=S
17. 2 C60 60 C70
18.
19. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
20. 2Na2O2+2CO2=2Na2CO3+O2 ClO-+2Br-+H2O=Cl-+Br2+2OH- 2Li+2H2O=2LiOH+H2↑ CD A中湿润的淀粉碘化钾试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘
21.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
22. Mg3N2
23.(1)N、O、Al
(2)2∶3
(3)AlN
(4) C3N4 高于
(5)
(6) 1∶1
(7)2∶3
24.(1) 氧 硅 硫
(2) 第四周期第VIB族 4s24p4
(3)O>S>Si或O、S、Si
(4) H2S>H2Se或H2Se<H2S S和Se为同主族元素,S的半径小于Se的,S-H键的键长比Se-H键的键长短,键长越短,物质越稳定
(5) 共价晶体 高于
一、单选题(共13题)
1.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
2.下面的排序不正确的是
A.晶体沸点由低到高:CF4<CCl4<CBr4 B.晶格能由大到小: NaF> NaCl> NaBr
C.硬度由大到小:金刚石>碳化硅>晶体硅 D.熔点由高到低:Na>Mg>Al
3.下列关于晶体的说法正确的是
A.组成金属的粒子是原子
B.晶体中分子间作用力越大,分子越稳定
C.离子晶体中一定有离子键,分子晶体中肯定没有离子键
D.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
4.在气体分析中,常用CuCl2的盐酸溶液吸收并定量测定CO的含量。某工艺通过如下流程制备氯化亚铜固体(已知CuCl容易被氧化):
下列说法正确的是
A.步骤①中可用稀硫酸代替稀盐酸
B.步骤②中SO2的作用是作为氧化剂
C.步骤③中用SO2水溶液洗涤比较有效
D.CuCl晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4
5.下列各组物质的变化过程中,所克服的粒子间作用力完全相同的是
A.CaO和熔化 B.Na和S受热熔化
C.NaCl和HCl溶于水 D.碘和干冰的升华
6.用NA代表阿伏伽德罗常数的值,下列说法正确的是
A.20g D216O含中子数目为9NA
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C.密闭容器中2mol NO和1mol O2充分反应后,容器中分子数为2NA
D.0.25mol Zn与一定量浓硫酸反应后完全溶解,生成气体的分子数小于0.25NA
7.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
8.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
9.H3BO3是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键);与足量的NaOH反应生成NaH2BO3。下列说法正确的是
A.根据H3BO3结构可知,H3BO3易溶于水
B.分子中B、O最外层均为8电子稳定结构
C.含1 mol H3BO3的晶体中有6 mol氢键
D.H3BO3中B为+3价,属于三元弱酸
10.臭氧层是大气层的平流层中臭氧浓度高的层次。紫外辐射在高空被臭氧吸收,对大气有增温作用,同时保护了地球上的生物免受远紫外辐射的伤害,透过的少量紫外辐射,有杀菌作用,对生物大有裨益。如图为CFCl3破坏臭氧层的反应过程示意图,下列说法不正确的是
A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可表示为O3+ Cl=ClO + O2
C.过程Ⅲ中O+O=O2是吸热过程
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
11.磷有多种同素异形体,其中白磷和黑磷(每一个层由曲折的磷原子链组成)的结构如图所示,设为阿伏加德罗常数的值。下列说法不正确的是
A.3.1g中含有的中子数为
B.31g黑磷中含有的P-P键数目为
C.12.4g白磷与0.6mol在密闭容器中充分反应,生成的分子数等于
D.白磷与黑磷为同素异形体
12.砷化镓是一种重要的半导体材料,熔点1238。它在600以下,能在空气中稳定存在,并且不被非氧化性的酸侵蚀。砷化镓晶胞结构如图。下列说法正确的是
A.砷化镓是一种分子晶体
B.砷化镓中不存在配位键
C.晶胞中Ga原子与As原子的数量比为4:1
D.晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体
13.下列事实不能从原子结构角度解释的是
A.化合物中为价 B.沸点:
C.非金属性: D.热稳定性:
二、非选择题(共10题)
14.苯胺()的晶体类型是_______。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
15.按要求填空:
(1)柠檬酸的结构简式见图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为_________mol。
(2)CO2分子中存在_________个键和_________个键。
(3)N2分子中键与键的数目比 _________。
16.(1)现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。
其中既含离子键又含非极性键的是___________(填序号,下同);既含离子键又含极性键的是___________;属于电解质的是:___________。
(2)短周期的某元素的气态氢化物为H2R,则该元素的原子最外层有___________个电子。
(3)只含金属元素的主族位于第___________纵行。
(4)第四周期元素中,如第IIA族原子序数为a,则第IIIA族原子序数为___________(用含a的式子表示)。
(5)周期表中位于第8纵行的铁元素属于第___________族,已知铁的原子序数为26,最外层有2个电子,则铁的原子结构示意图为___________。
(6)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为___________;若XY2为共价化合物,则其结构式为___________。
17.如图所示是“足球稀”分子中含有12个五边形,20个六边形,30个双键。
(1)平均每个五边形所含碳原子为______个,平均每个六边形所含的碳原子为_________个。
(2)“足球烯”分子的分子式为___________。
(3)“足球烯”分子含有的化学键单键数为___________。
(4)若某“足球烯”分子含12个正五边,25个正六边形,则其分子式为_________。
18.硫化锂Li2S(摩尔质量Mg mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
19.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
20.碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________(用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________。
②B中溶液发生反应的离子方程式是__________________________。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
21.铁黄()是重要的化工产品。某学校兴趣小组用如图所示装置,进行铁黄制备研究,具体操作如下:向三颈烧瓶中依次加入硫酸亚铁溶液、铁黄晶种和过量碎铁皮,在水浴加热条件下,持续通入空气并不断搅拌,在晶种上得到铁黄晶体。
(1)检验反应完成后上层溶液中是否存在的实验方法为_________。
(2)结合反应原理解释加入过量碎铁皮的作用是_________。
(3)测定样品中铁黄的质量分数。
①配制标准溶液。实验过程可描述为_________,继续加入蒸馏水至离刻度线处,改用胶头滴管加水至溶液凹液面最低处与刻度线相切,塞好瓶塞,颠倒摇匀,装瓶贴上标签。
②称取铁黄样品置于锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的溶液(将还原为)充分反应,再除去过量的。用上述配制的标准溶液滴定至终点(),消耗溶液。计算该样品中铁黄的质量分数_________(写出计算过程)。
(4)铁和氨在时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为_________。
②氮原子位于由铁原子构成的正八面体的中心。在答题卡的中用“-”将铁原子构成的正八面体连接起来_________。
22.A、B是短周期元素,原子最外层电子排布式分别为、()。A与B形成的离子化合物加水溶解后可使酚酞溶液变红,同时有气体C逸出,该气体可使湿润的红色石蕊试纸变蓝。则该离子化合物的化学式为_______,气体C的电子式为_______。
23.I.原子序数小于等于36的Q、W、X、Y、Z五种元素,它们的原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_______。
(2)与所含σ键数目之比为_______。
(3)一种由X和Z两种元素形成的化合物的晶胞如图所示,该化合物的化学式为_______。
(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为_______。
②预测该化合物熔点应_______(填“高于”或“低于”)金刚石。
II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(5)基态Fe3+的电子排布式为_______。
(6)普鲁士蓝俗称铁蓝,结构如图甲所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为_______。又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_______。
(7)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为_______。
24.已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:
(1)X为____(填元素名称,下同),Y为____,Z为____。
(2)M在元素周期表的位置是____,基态N原子的价层电子排布式为____。
(3)X、Y、Z的第一电离能由大到小的顺序为____(填元素符号)。
(4)Z与N的最简单氢化物的稳定性比较:____ (写化学式),原因为____。
(5)YX2的晶体类型为____,其熔点____(填“高于”或“低于”)NX2。
参考答案:
1.D 2.D 3.C 4.C 5.D 6.B 7.A 8.C 9.A 10.C 11.C 12.D
13.B
14. 分子晶体 苯胺分子之间存在氢键
15.(1)7
(2) 2 2
(3)
16. ④ ③⑤ ③④⑤⑧ 6 2 a+11 VIII S=C=S
17. 2 C60 60 C70
18.
19. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
20. 2Na2O2+2CO2=2Na2CO3+O2 ClO-+2Br-+H2O=Cl-+Br2+2OH- 2Li+2H2O=2LiOH+H2↑ CD A中湿润的淀粉碘化钾试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,C中溶液滴入试管D中,关闭活塞b,取下试管D,振荡、静置,若溶液分层,且下层溶液变为紫红色,则证明溴的氧化性强于碘
21.(1)取少量上层清液,滴加2~3滴溶液,若存在,可观察到溶液变成血红色
(2)既能消除反应产生的,同时又能额外提供,实现硫酸亚铁的循环利用
(3) 用电子天平称取固体,并置于烧杯中用适量蒸馏水溶解,冷却后用玻璃棒转移至容量瓶中(已验漏),再用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液一并转移至容量瓶中 97.9%
(4)
22. Mg3N2
23.(1)N、O、Al
(2)2∶3
(3)AlN
(4) C3N4 高于
(5)
(6) 1∶1
(7)2∶3
24.(1) 氧 硅 硫
(2) 第四周期第VIB族 4s24p4
(3)O>S>Si或O、S、Si
(4) H2S>H2Se或H2Se<H2S S和Se为同主族元素,S的半径小于Se的,S-H键的键长比Se-H键的键长短,键长越短,物质越稳定
(5) 共价晶体 高于
