专题5微观结构与物质的多样性检测题(含解析)高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题5微观结构与物质的多样性检测题(含解析)高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1021.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 21:32:48 | ||
图片预览




文档简介
专题5《微观结构与物质的多样性》检测题
一、单选题
1.已知4种离子A+、B2+、C-、D2-具有相同的电子层结构,它们分别用a、b、c、d表示。现有以下排列顺序:则4种离子的半径、原子序数大小顺序均正确的是
①b>a>c>d ②c>d>a>b ③b>a>d>c ④d>c>a>b
A.②③ B.①④ C.③② D.④①
2.乙醇俗称酒精,75%的酒精能用来杀菌消毒。下列说法中正确的是
A.乙醇的球棍模型:
B.酒精的杀菌消毒原理是让蛋白质变性,且浓度越大消毒效果越好
C.酒精可以通过大量喷洒来消毒,也可以和84消毒液混合使用消毒
D.除去乙醇中的少量水,方法是加入新制生石灰,经蒸馏后即得乙醇
3.下列物质不能通过化合反应直接转化的是
A. B. C. D.
4.属于化合物的是
A.水玻璃 B.糯米酒 C.Na2CO3 D.普通玻璃
5.下列变化属于化学变化的是
A.煤燃烧 B.水汽化 C.冰融化 D.苯挥发
6.W、X、Y、Z、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
7.下列有关说法正确的是
A.三种核素的中子数均为6 B.的物理性质相同
C.均属于氢元素 D.的化学性质相同
8.下列有关物质性质与用途具有对应关系的是
A.受热易分解,可用于制胃酸中和剂
B.能与酸反应,可用作红色油漆和涂料
C.是两性氧化物,可用作耐高温材料
D.能与水反应,可用作食品干燥剂
9.下列有关化学用语表示正确的是
A.BaSO4的电离方程式:BaSO4 Ba2++SO
B.次氯酸的电子式:
C.比例模型 可以表示CO2或SiO2
D.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-
10.下列关于卤族元素(X)及其化合物叙述错误的是
A.单质均有颜色,随原子序数递增颜色加深
B.HX随原子序数递增稳定性逐渐减弱
C.单质均能与水反应形成HX和HXO
D.HX中除HF分子间存在氢键,其余HX分子均不存在氢键
11.下列物质的名称、俗名与化学式一致的是
选项 名称 俗名 化学式
A 氢氧化钠 烧碱 NaOH
B 碳酸氢钠 苏打 NaHCO3
C 氢氧化钙 熟石灰 CaO
D 乙醇 酒精 CH3COOH
A.A B.B C.C D.D
12.A、B两元素为同一周期ⅡA族和ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为:( )
①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.②④⑥ B.①③⑥ C.①②③④ D.①③⑤
13.下列说法错误的是( )
A.离子半径:S2->O2->F->Na+ B.硬度:金刚石>SiC>晶体硅
C.熔点:Li<Na<K<Rb<Cs D.结合质子能力:C2H5O->OH->
14.下列说法错误的是
A.属于氧化物中的两性氧化物
B.中子数为148的铀原子是
C.HClO的结构式:H-O-Cl
D.金刚石和石墨均为碳元素的同素异形体
15.短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mLX2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如下图。下列说法正确的是
A.X2R溶液的浓度为0.03mol·L-1
B.工业上通常采用电解法冶炼Q的单质
C.最简单气态氢化物的稳定性:Y>Z>R
D.RZ2通入BaCl2、Ba(NO3)2溶液中,均无明显现象
二、填空题
16.将下列关于氯化钠的描述进行分类,并完成下表。
① 氯化钠是由钠元素和氯元素组成的。
② 氯化钠在维持人体内的电解质平衡中起重要作用。
③ 氯化钠是常用的调味品。
④ 氯化钠是立方体晶体。
⑤ 氯化钠晶体中钠离子和氯离子的个数相等。
分类依据 相关描述(填序号)
第一类 _______ _______
第二类 _______ _______
17.现有五种物质:
A.常见活泼金属单质,A原子有13个质子;
B.氢氧化钠;
C.氢氧化铝;
D.盐酸溶液的溶质;
E.A与D反应得到的无色澄清溶液,其分散质为E。
(1)将上述五种物质按照化学键特性分类,请填入化学式:既有离子键又有共价键的物质:_____;仅含共价键的物质:____。
(2)请写出下列物质的电子式:A:____;B:____;D:____。
(3)单质A既能和氢氧化钠反应,又能和稀盐酸反应,都能产生氢气。请计算在273K,101.3kPa情况下3mol的A能与足量稀盐酸反应产生____mol氢气。
18.下面是我们熟悉的物质:①O2②金刚石③NaBr ④H2SO4⑤Na2CO3⑥NH4Cl
⑦NaHSO4⑧Ne ⑨Na2O2⑩NaOH
(1)这些物质中,只含有共价键的是______________;只含有离子键的是______________;不存在化学键的______________;
(2)属于共价化合物的是______________;
(3)将NaHSO4溶于水,破坏了NaHSO4中的_______,写出电离方程式______________;NaHSO4熔融状态下电离,破坏了___________键,写成电离方程式
______________________。
三、实验题
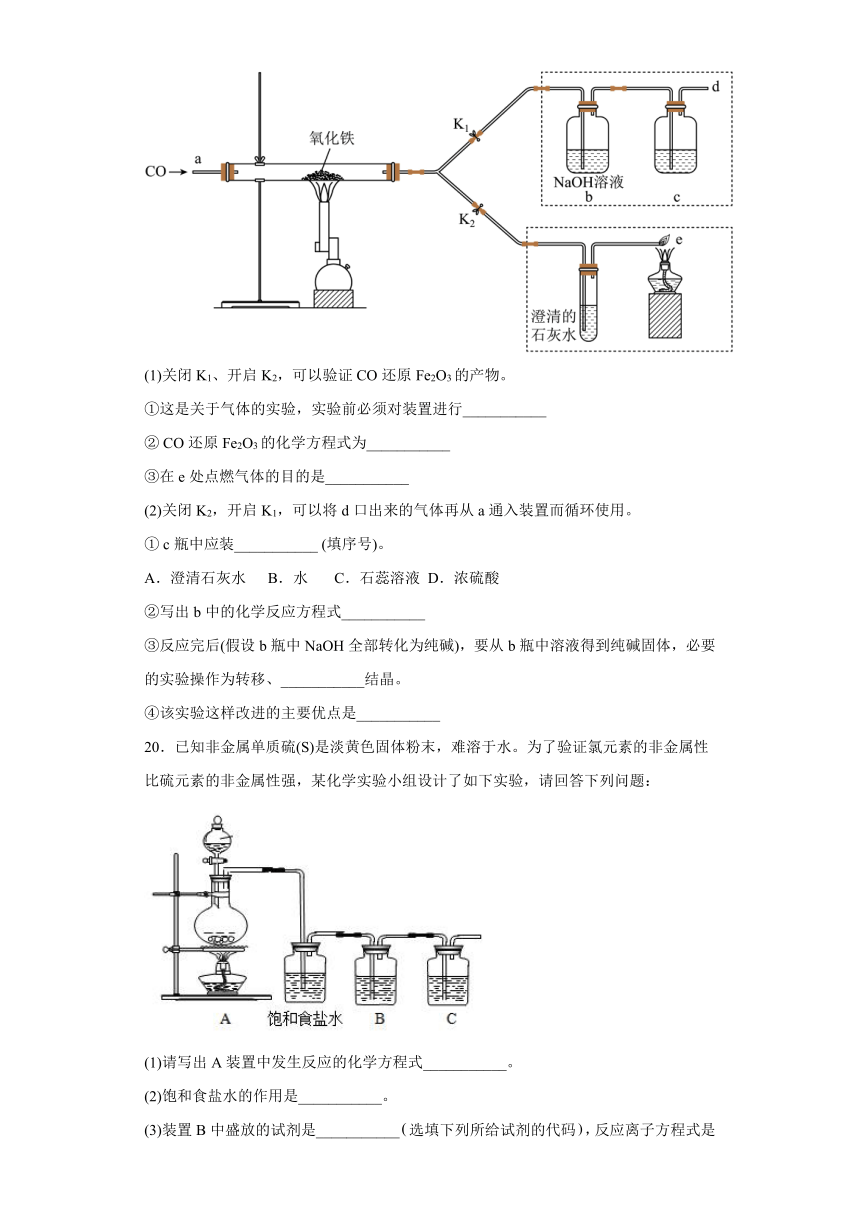
19.2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行___________
② CO还原Fe2O3的化学方程式为___________
③在e处点燃气体的目的是___________
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。
① c瓶中应装___________ (填序号)。
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②写出b中的化学反应方程式___________
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、___________结晶。
④该实验这样改进的主要优点是___________
20.已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)请写出A装置中发生反应的化学方程式___________。
(2)饱和食盐水的作用是___________。
(3)装置B中盛放的试剂是___________选填下列所给试剂的代码,反应离子方程式是___________。
A.溶液 B.溶液 C.溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强___________填编号
①比稳定
②氧化性比强
③酸性比强
④酸性比强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与反应生成,而硫与铁反应生成FeS
21.为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将C中溶液滴入试管中并振荡、静置。
(1)验证氯气的氧化性强于碘的实验现象是___________。
(2)B中溶液发生反应的离子方程式是___________。
(3)为验证溴的氧化性强于碘,过程Ⅳ中试管的现象是___________。
(4)试管B管口塞有浸有NaOH溶液的棉花的目的是___________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐___________,得电子能力逐渐___________。
四、计算题
22.平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
参考答案:
1.D
【详解】假设四种微粒的原子序数分别为z1、z2、z3、z4,根据已知4种离子A+、B2+、C-、D2-具有相同的电子层结构,则有z1-1=z2-2=z3+1=z4+2,故推知z2>z1>z3>z4,即原子序数由大到小的顺序为:b>a>c>d即①正确,又知核外电子排布相同的微粒,则核电荷数即原子序数越大,其微粒半径越小,故离子半径由大到小的顺序为:d>c>a>b即④正确;故4种离子的半径、原子序数大小顺序分别为④①,故答案为:D。
2.D
【详解】A.由于C原子半径比O原子半径大,而图中乙醇的球棍模型: 明显是O原子比C原子更大一些,故该球棍模型错误,A错误;
B.酒精的杀菌消毒原理是让蛋白质变性,但不是浓度越大消毒效果越好,通常用75%的酒精进行消毒,B错误;
C.酒精易挥发且易燃,故不可以大量喷酒来消毒,同时84消毒液又强氧化性,会与乙醇发生氧化还原反应甚至发生自燃或爆炸危险,故也不可以和84消毒液混合使用消毒,C错误;
D.CaO与水反应后,蒸馏得到乙醇,D正确;
故选D。
3.D
【详解】A.FeCl3和Fe发生化合反应生成,故A不符合题意;
B.Na2CO3 和CO2、H2O发生化合反应生成NaHCO3,故B不符合题意;
C.Fe(OH)2和O2、H2O发生化合反应得到Fe(OH)3,故C不符合题意;
D.Al(OH)3只能通过复分解反应生成,不能通过化合反应直接制得,故D符合题意;
故答案选D。
4.C
【分析】据物质成分判断其所属类别。
【详解】A. 水玻璃是硅酸钠水溶液,属于混合物,A项错误;
B. 糯米酒是酒精水溶液,属于混合物,B项错误;
C. Na2CO3是纯净物中的化合物,C项正确;
D. 普通玻璃是二氧化硅、硅酸钠、硅酸钙等构成的混合物,D项错误。
本题选C。
5.A
【详解】A.煤燃烧过程中有二氧化碳等新物质产生,属于化学变化,A符合;
B.水汽化属于状态的变化,没有产生新物质,属于物理变化,B不符合;
C.冰融化属于状态的变化,没有产生新物质,属于物理变化,C不符合;
D.苯挥发属于状态的变化,没有产生新物质,属于物理变化,D不符合;
答案选A。
6.C
【分析】由元素在周期表的位置可知,W、X、Y、Z、M、N六种主族元素分别为O、Na、Mg、S、Cl、Ge,据此分析解答。
【详解】A.同周期元素原子半径随着核电荷数增大而减小,所以原子半径Y>Z,同主族元素原子半径随着原子序数增大而增大,所以原子半径Z>W,总之,原子半径:Y>Z>W,故A正确;
B.同周期从左向右金属性减弱,还原性减弱,则单质的还原性:X>Y,故B正确;
C.非金属性:溴D.元素N为锗,位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料,故D正确。
答案选C。
7.C
【详解】A.原子符号左上角数字表示质量数,左下角数字表示质子数,中子数=质量数-质子数,所以三种核素的中子数分别为6、7、8,故A错误;
B.的质量数不同,中子数不同,则物理性质不同,故B错误;
C.H为氢元素的一种核素,H-和H+为两种氢离子,均属于氢元素,故C正确;
D.的核外电子数分别为1、2、0,所以化学性质不同,故D错误;
综上所述答案为C。
8.D
【详解】A. 能与HCl反应,可用于制胃酸中和剂,故A错误;
B. 是红色固体,难氧化,可用作红色油漆和涂料,故B错误;
C. 熔点高,可用作耐高温材料,故C错误;
D. 能与水反应,可用作食品干燥剂,防止食品因潮湿而变质,故D正确;
故选D。
9.D
【详解】A. BaSO4是强电解质,电离方程式:BaSO4=Ba2++SO,A错误;
B. 次氯酸分子内,氧原子分别与氢原子、氯原子共用一对电子对,电子式:,B错误;
C. 比例模型 可以表示CO2,因为二氧化碳是共价分子、SiO2不是共价分子、其晶体属于原子晶体,C错误;
D.35Cl-与37Cl-的质子数、原子核外电子排布均相同,故离子结构示意图 既可以表示35Cl-,也可以表示37Cl-,D正确;
答案选D。
10.C
【详解】A.卤族元素的单质的颜色从上到下为浅黄绿色、黄绿色、深红棕色、紫黑色,颜色逐渐加深,A正确;
B.非金属性越强,其氢化物越稳定,同主族从上到下非金属性减弱,即HX随着原子序数递增,稳定性逐渐减弱,B正确;
C.F2与水反应生成HF和O2,C错误;
D.F的非金属性极强,HF分子间存在氢键,其余HX不存在分子间氢键,D正确;
综上所述答案为C。
11.A
【详解】A. 氢氧化钠俗称火碱、烧碱、苛性钠,其化学为NaOH,其名称、俗名、化学式一致;
B. 碳酸氢钠俗称小苏打,其化学式为NaHCO3,其名称、俗名、化学式不一致;
C. 氢氧化钙俗称熟石灰,其化学式为Ca(OH)2,其名称、俗名、化学式不一致;
D. 乙醇俗称酒精,其化学式为C2H5OH,其名称、俗名、化学式不一致;
故选A。
12.D
【详解】在第二、三周期中第IIA族和第IIIA族元素紧相邻,所以B元素的原子序数可能为x+1,在第四、五周期中第IIA族和第IIIA族元素相差10种元素,所以则B元素的原子序数可能为x+11,第六、第七周期里应为有镧系和锕系第IIA族和第IIIA族元素相差10+14种元素,所以则B元素的原子序数可能为x+25,因此①③⑤满足题意,D选项正确;
答案选D。
【点睛】本题考查元素周期表的相关知识,学生只要熟记元素周期表的结构就能熟练解题。注意第IIA族和第IIIA族之间会随着周期的不同,原子序数的差值会发生变化。
13.C
【详解】A、S2-比O2-多一电子层,半径S2->O2-,O2-、F-、Na+电子层结构相同,核电荷大的半径小,半径O2->F->Na+,选项A正确;
B、C与Si同为IVA族元素,它们的相似性表现在金刚石是原子晶体,硅晶体,碳化硅也是原子晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱,碳化硅应在Si与C之间。三种原子晶体,空间结构相似,硬度决定于它们的键长与键能,碳与碳键长最短,金刚石硬度最大,则故硬度从高到低分别是金刚石、碳化硅、晶体硅,选项B正确;
C、金属晶体的熔点决定于金属键的强弱,同主族元素的离子半径从上到下逐渐增大,金属阳离子与自由电子间的作用力逐渐减小,熔点:Li>Na>K>Rb>Cs,选项C错误;
D、酸性:乙醇<水<苯酚,结合质子能力:C2H5O->OH->,选项D正确;
答案选C。
14.B
【详解】A.既能与酸反应生成盐和水,又能和碱反应生成盐和水,属于氧化物中的两性氧化物,A正确;
B.铀原子的质子数为92,中子数为148,根据质量数(A)=质子数(Z)+中子数(N)可知,,其正确书写应该为,B错误;
C.HClO的电子式为,故其结构式为H-O-Cl,C正确;
D.金刚石和石墨均为碳元素形成的性质不同的碳单质,是碳元素的同素异形体,D正确。
故选B。
15.B
【分析】由条件“X的简单阴离子与锂离子具有相同的结构”可知,X为H元素;由条件“Y原子的最外层电子个数是内层电子数的两倍”可知,Y为C元素;由条件“Q的单质与稀硫酸剧烈反应生成氢气”可知,Q为第三周期的金属元素(Na或Mg或Al);由X可以与R形成H2R化合物可知,R为S元素;S可以与Z形成SZ2气体,所以Z为O元素。
【详解】A.硫化氢气体与二氧化硫气体反应的方程式:;当通入336mL,即0.015molSO2时,溶液恰好为中性,即恰好反应完全,所以原硫化氢溶液中,那么浓度即为0.3mol/L,A错误;
B.Q无论是Na,Mg,Al中的哪一种元素,获得其单质都是采用电冶金的方式,B正确;
C.Y,Z,R分别为C,O,S三种元素,所以简单氢化物的稳定性为H2O>H2S>CH4,即Z>R>Y,C错误;
D.SO2通入BaCl2溶液中无现象,但是通入Ba(NO3)2溶液中会出现白色沉淀,D错误。
答案选B。
16. 组成结构 ①④⑤ 功能 ②③
【详解】氯化钠是由钠元素和氯元素组成的、立方体晶体、氯化钠晶体中钠离子和氯离子的个数相等,均是在描述的氯化钠的组成结构;氯化钠在维持人体内的电解质平衡中起重要作用、是常用的调味品,均是在描述氯化钠的功能,所以第一行依次填:组成结构、①④⑤;第二行依次填:功能、②③。
17.(1) B、C D
(2)
(3)4.5
【分析】A有13个质子,质子数决定元素种类,故A为Al;B为NaOH;C为Al(OH)3;D为HCl
【详解】(1)既有离子键又有共价键的物质:NaOH、C为Al(OH)3;仅含共价键的物质:HCl;
故答案为:B、C;D。
(2)A为Al的电子式:;B为NaOH的电子式:;D为HCl的电子:式:
故答案为:;;。
(3),铝与产生氢气的物质的量之比为2:3,3mol的Al完全反应,则生成的氢气4.5mol;
故答案为:4.5
18. ①②④ ③ ⑧ ④ 离子键和共价键 NaHSO4=Na++H++SO42- 离子 NaHSO4= Na++HSO4-
【详解】(1)非金属元素之间一般形成的是共价键,所以含有共价键的是①②④;活泼的金属和活泼的非金属之间容易形成离子键,因此只含有离子键的是③;稀有气体元素的最外层电子已经达到平衡状态,所以稀有气体分子的单质中不存在化学键。
(2)只含有共价键的化合物是共价化合物,因此答案选④。
(3)硫酸氢钠溶于水电离出的是Na+、H+、SO42- ,电离方程式是NaHSO4=Na++H++SO42-,所以破坏的是离子键和共价键;而在熔融状态下,电离出的是Na++HSO4-,电离方程式是NaHSO4= Na++HSO4-,所以破坏的是离子键。
19.(1) 气密性检查 尾气处理、除去没有反应的CO。
(2) D 蒸发浓缩、冷却 能循环利用CO、提高了原料利用率、减少了二氧化碳的排放
【分析】在高温下,一氧化碳能还原氧化铁得到铁和二氧化碳。一氧化碳有毒,因此必须进行尾气处理。反应混合气体先通过碱液吸收,再点燃处理CO,据此回答。
(1)
①为了防止漏气、关于气体的实验,实验前必须对装置进行气密性检查。
②高温下,CO还原Fe2O3得到CO2和Fe,化学方程式为。
③CO有剧毒,不能直接排放到空气中,在e处点燃气体的目的是:尾气处理、除去没有反应的CO。
(2)
关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。则:① d口出来的气体必须是纯净而干燥的CO气体,b装置能充分吸收二氧化碳、c装置用于干燥,则c瓶中应装浓硫酸,选D。
②b中氢氧化钠溶液吸收二氧化碳、化学反应方程式:。
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,从溶液中提取的碳酸钠固体是。适合用冷却结晶法。必要的实验操作为转移、蒸发浓缩、冷却、结晶。
④过量的CO从d排出进入a,故该实验这样改进的主要优点是能循环利用CO、提高了原料利用率、减少了二氧化碳的排放。
20. 浓) 除去中混有的HCl气体 A ①③⑥
【分析】本实验的实验目的为验证氯元素的非金属性比硫元素的非金属性强,其中A装置为制取氯气的装置,B装置为验证装置,C为尾气处理装置,据此结合元素及其化合物的相关性质解答问题。
【详解】(1)A装置为制取氯气的装置,实验室常用浓盐酸与二氧化锰混合加热制取氯气,反应的化学方程式为浓);
(2)浓盐酸易挥发,故制得的氯气中含有挥发的HCl气体,饱和食盐水可除去Cl2中混有的HCl气体;
(3)B装置为验证装置,可选用Na2S溶液,由于Cl2的氧化性强于S,故可以从Na2S中置换出S,发生的反应为;
(4)①非金属性越强,氢化物越稳定,比稳定,说明非金属性Cl>S,①选;
②氧化性比强不能说明非金属性Cl>S,②不选;
③非金属性越强,最高价氧化物对应水化物的酸性越强,酸性比强,说明非金属性Cl>S,③选;
④HCl和H2S均不是Cl和S的最高价含氧酸,故酸性比强不能说明非金属性Cl>S,④不选;
⑤氯原子最外层有7个电子,硫原子最外层有6个电子不能说明非金属性Cl>S,⑤不选;
⑥铁与反应生成,而硫与铁反应生成FeS,说明氧化性:Cl2>S,则非金属性Cl>S,⑥选;
综上,答案选①③⑥。
21. 湿润的淀粉-KI试纸变蓝 Cl2+2Br-=2Cl-+Br2 溶液分层,上层为无色(变浅),下层为紫红色(紫色) 吸收多余氯气,防治污染空气 增大 减弱
【分析】验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,以此解答该题。
【详解】(1)A中产生的黄绿色气体是氯气,氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以验证氯气的氧化性强于碘的实验现象是湿润的淀粉KI试纸变蓝。
(2)氯元素的非金属性强于溴元素的非金属性,所以B中氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
(3)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作为打开活塞b,将C中溶液滴入试管中并振荡、静置,故现象为:静置后溶液分层,上层为无色(变浅),下层CCl4溶液层为紫红色(紫色)。
(4)由于Cl2有毒,试管B管口塞有浸有NaOH溶液的棉花的目的为吸收多余氯气,防治污染空气。
(5)根据元素周期律可知氯、溴、碘单质的氧化性逐渐减弱的原因是:同主族元素从上到下原子半径逐渐增大,得电子能力逐渐减弱。
【点睛】本题主要考查了卤素单质氧化性的相对强弱的实验验证,明确实验原理、根据实验现象并用卤素性质进行解释是解答关键,注意要排除干扰因素的存在,注意从结构决定性质的这一角度分析元素的性质递变规律。
22. 0.005mol 0.03mol Al2Mg6(OH)16CO3·4H2O
【分析】⑴按照方程式HCO3- + H+ = H2O+ CO2↑计算生成二氧化碳消耗盐酸的物质的量,根据碳元素守恒得碳酸根的物质的量。
⑵生成氢氧化镁的沉淀质量为1.74g,计算氢氧化镁的物质的量,再根据守恒得镁离子的物质的量。
⑶先计算n(OH-),再根据n(OH-):n(CO32-):n(Mg2+)和根据电荷守恒求出n(OH-):n(CO32-):n(Mg2+):n(Al3+)的比例,根据碳酸根物质的量求摩尔质量求出n值。
【详解】⑴CO32- + 2H+ = H2O+ CO2↑生成二氧化碳消耗盐酸的物质的量为2.0mol/L × 0.0025L = 0.005mol;根据碳元素守恒得碳酸根的物质的量为0.005mol;故答案为:0.005mol。
⑵生成氢氧化镁的沉淀质量为1.74g,物质的量为,镁离子的物质的量为0.03mol;故答案为:0.03mol。
⑶n(OH-) = 2.0mol/L× 0.0425L = 0.085mol,因此n(OH-):n(CO32-):n(Mg2+)=0.085mol:0.005mol:0.03mol = 16:6:1,AlxMg6(OH)16CO3·nH2O,再根据电荷守恒(+3)x+(+2)×6+(-1)×16+(-2)×1 = 0,得到x = 2,根据碳酸根物质的量求摩尔质量,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。
一、单选题
1.已知4种离子A+、B2+、C-、D2-具有相同的电子层结构,它们分别用a、b、c、d表示。现有以下排列顺序:则4种离子的半径、原子序数大小顺序均正确的是
①b>a>c>d ②c>d>a>b ③b>a>d>c ④d>c>a>b
A.②③ B.①④ C.③② D.④①
2.乙醇俗称酒精,75%的酒精能用来杀菌消毒。下列说法中正确的是
A.乙醇的球棍模型:
B.酒精的杀菌消毒原理是让蛋白质变性,且浓度越大消毒效果越好
C.酒精可以通过大量喷洒来消毒,也可以和84消毒液混合使用消毒
D.除去乙醇中的少量水,方法是加入新制生石灰,经蒸馏后即得乙醇
3.下列物质不能通过化合反应直接转化的是
A. B. C. D.
4.属于化合物的是
A.水玻璃 B.糯米酒 C.Na2CO3 D.普通玻璃
5.下列变化属于化学变化的是
A.煤燃烧 B.水汽化 C.冰融化 D.苯挥发
6.W、X、Y、Z、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
7.下列有关说法正确的是
A.三种核素的中子数均为6 B.的物理性质相同
C.均属于氢元素 D.的化学性质相同
8.下列有关物质性质与用途具有对应关系的是
A.受热易分解,可用于制胃酸中和剂
B.能与酸反应,可用作红色油漆和涂料
C.是两性氧化物,可用作耐高温材料
D.能与水反应,可用作食品干燥剂
9.下列有关化学用语表示正确的是
A.BaSO4的电离方程式:BaSO4 Ba2++SO
B.次氯酸的电子式:
C.比例模型 可以表示CO2或SiO2
D.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-
10.下列关于卤族元素(X)及其化合物叙述错误的是
A.单质均有颜色,随原子序数递增颜色加深
B.HX随原子序数递增稳定性逐渐减弱
C.单质均能与水反应形成HX和HXO
D.HX中除HF分子间存在氢键,其余HX分子均不存在氢键
11.下列物质的名称、俗名与化学式一致的是
选项 名称 俗名 化学式
A 氢氧化钠 烧碱 NaOH
B 碳酸氢钠 苏打 NaHCO3
C 氢氧化钙 熟石灰 CaO
D 乙醇 酒精 CH3COOH
A.A B.B C.C D.D
12.A、B两元素为同一周期ⅡA族和ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为:( )
①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.②④⑥ B.①③⑥ C.①②③④ D.①③⑤
13.下列说法错误的是( )
A.离子半径:S2->O2->F->Na+ B.硬度:金刚石>SiC>晶体硅
C.熔点:Li<Na<K<Rb<Cs D.结合质子能力:C2H5O->OH->
14.下列说法错误的是
A.属于氧化物中的两性氧化物
B.中子数为148的铀原子是
C.HClO的结构式:H-O-Cl
D.金刚石和石墨均为碳元素的同素异形体
15.短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mLX2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如下图。下列说法正确的是
A.X2R溶液的浓度为0.03mol·L-1
B.工业上通常采用电解法冶炼Q的单质
C.最简单气态氢化物的稳定性:Y>Z>R
D.RZ2通入BaCl2、Ba(NO3)2溶液中,均无明显现象
二、填空题
16.将下列关于氯化钠的描述进行分类,并完成下表。
① 氯化钠是由钠元素和氯元素组成的。
② 氯化钠在维持人体内的电解质平衡中起重要作用。
③ 氯化钠是常用的调味品。
④ 氯化钠是立方体晶体。
⑤ 氯化钠晶体中钠离子和氯离子的个数相等。
分类依据 相关描述(填序号)
第一类 _______ _______
第二类 _______ _______
17.现有五种物质:
A.常见活泼金属单质,A原子有13个质子;
B.氢氧化钠;
C.氢氧化铝;
D.盐酸溶液的溶质;
E.A与D反应得到的无色澄清溶液,其分散质为E。
(1)将上述五种物质按照化学键特性分类,请填入化学式:既有离子键又有共价键的物质:_____;仅含共价键的物质:____。
(2)请写出下列物质的电子式:A:____;B:____;D:____。
(3)单质A既能和氢氧化钠反应,又能和稀盐酸反应,都能产生氢气。请计算在273K,101.3kPa情况下3mol的A能与足量稀盐酸反应产生____mol氢气。
18.下面是我们熟悉的物质:①O2②金刚石③NaBr ④H2SO4⑤Na2CO3⑥NH4Cl
⑦NaHSO4⑧Ne ⑨Na2O2⑩NaOH
(1)这些物质中,只含有共价键的是______________;只含有离子键的是______________;不存在化学键的______________;
(2)属于共价化合物的是______________;
(3)将NaHSO4溶于水,破坏了NaHSO4中的_______,写出电离方程式______________;NaHSO4熔融状态下电离,破坏了___________键,写成电离方程式
______________________。
三、实验题
19.2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”。某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物。
①这是关于气体的实验,实验前必须对装置进行___________
② CO还原Fe2O3的化学方程式为___________
③在e处点燃气体的目的是___________
(2)关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。
① c瓶中应装___________ (填序号)。
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②写出b中的化学反应方程式___________
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,必要的实验操作为转移、___________结晶。
④该实验这样改进的主要优点是___________
20.已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)请写出A装置中发生反应的化学方程式___________。
(2)饱和食盐水的作用是___________。
(3)装置B中盛放的试剂是___________选填下列所给试剂的代码,反应离子方程式是___________。
A.溶液 B.溶液 C.溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强___________填编号
①比稳定
②氧化性比强
③酸性比强
④酸性比强
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
⑥铁与反应生成,而硫与铁反应生成FeS
21.为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将C中溶液滴入试管中并振荡、静置。
(1)验证氯气的氧化性强于碘的实验现象是___________。
(2)B中溶液发生反应的离子方程式是___________。
(3)为验证溴的氧化性强于碘,过程Ⅳ中试管的现象是___________。
(4)试管B管口塞有浸有NaOH溶液的棉花的目的是___________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐___________,得电子能力逐渐___________。
四、计算题
22.平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中:
(1)碳酸根的物质的量_____________;
(2)镁离子的物质的量_____________;
(3)通过计算确定该物质的化学组成为___________。
参考答案:
1.D
【详解】假设四种微粒的原子序数分别为z1、z2、z3、z4,根据已知4种离子A+、B2+、C-、D2-具有相同的电子层结构,则有z1-1=z2-2=z3+1=z4+2,故推知z2>z1>z3>z4,即原子序数由大到小的顺序为:b>a>c>d即①正确,又知核外电子排布相同的微粒,则核电荷数即原子序数越大,其微粒半径越小,故离子半径由大到小的顺序为:d>c>a>b即④正确;故4种离子的半径、原子序数大小顺序分别为④①,故答案为:D。
2.D
【详解】A.由于C原子半径比O原子半径大,而图中乙醇的球棍模型: 明显是O原子比C原子更大一些,故该球棍模型错误,A错误;
B.酒精的杀菌消毒原理是让蛋白质变性,但不是浓度越大消毒效果越好,通常用75%的酒精进行消毒,B错误;
C.酒精易挥发且易燃,故不可以大量喷酒来消毒,同时84消毒液又强氧化性,会与乙醇发生氧化还原反应甚至发生自燃或爆炸危险,故也不可以和84消毒液混合使用消毒,C错误;
D.CaO与水反应后,蒸馏得到乙醇,D正确;
故选D。
3.D
【详解】A.FeCl3和Fe发生化合反应生成,故A不符合题意;
B.Na2CO3 和CO2、H2O发生化合反应生成NaHCO3,故B不符合题意;
C.Fe(OH)2和O2、H2O发生化合反应得到Fe(OH)3,故C不符合题意;
D.Al(OH)3只能通过复分解反应生成,不能通过化合反应直接制得,故D符合题意;
故答案选D。
4.C
【分析】据物质成分判断其所属类别。
【详解】A. 水玻璃是硅酸钠水溶液,属于混合物,A项错误;
B. 糯米酒是酒精水溶液,属于混合物,B项错误;
C. Na2CO3是纯净物中的化合物,C项正确;
D. 普通玻璃是二氧化硅、硅酸钠、硅酸钙等构成的混合物,D项错误。
本题选C。
5.A
【详解】A.煤燃烧过程中有二氧化碳等新物质产生,属于化学变化,A符合;
B.水汽化属于状态的变化,没有产生新物质,属于物理变化,B不符合;
C.冰融化属于状态的变化,没有产生新物质,属于物理变化,C不符合;
D.苯挥发属于状态的变化,没有产生新物质,属于物理变化,D不符合;
答案选A。
6.C
【分析】由元素在周期表的位置可知,W、X、Y、Z、M、N六种主族元素分别为O、Na、Mg、S、Cl、Ge,据此分析解答。
【详解】A.同周期元素原子半径随着核电荷数增大而减小,所以原子半径Y>Z,同主族元素原子半径随着原子序数增大而增大,所以原子半径Z>W,总之,原子半径:Y>Z>W,故A正确;
B.同周期从左向右金属性减弱,还原性减弱,则单质的还原性:X>Y,故B正确;
C.非金属性:溴
答案选C。
7.C
【详解】A.原子符号左上角数字表示质量数,左下角数字表示质子数,中子数=质量数-质子数,所以三种核素的中子数分别为6、7、8,故A错误;
B.的质量数不同,中子数不同,则物理性质不同,故B错误;
C.H为氢元素的一种核素,H-和H+为两种氢离子,均属于氢元素,故C正确;
D.的核外电子数分别为1、2、0,所以化学性质不同,故D错误;
综上所述答案为C。
8.D
【详解】A. 能与HCl反应,可用于制胃酸中和剂,故A错误;
B. 是红色固体,难氧化,可用作红色油漆和涂料,故B错误;
C. 熔点高,可用作耐高温材料,故C错误;
D. 能与水反应,可用作食品干燥剂,防止食品因潮湿而变质,故D正确;
故选D。
9.D
【详解】A. BaSO4是强电解质,电离方程式:BaSO4=Ba2++SO,A错误;
B. 次氯酸分子内,氧原子分别与氢原子、氯原子共用一对电子对,电子式:,B错误;
C. 比例模型 可以表示CO2,因为二氧化碳是共价分子、SiO2不是共价分子、其晶体属于原子晶体,C错误;
D.35Cl-与37Cl-的质子数、原子核外电子排布均相同,故离子结构示意图 既可以表示35Cl-,也可以表示37Cl-,D正确;
答案选D。
10.C
【详解】A.卤族元素的单质的颜色从上到下为浅黄绿色、黄绿色、深红棕色、紫黑色,颜色逐渐加深,A正确;
B.非金属性越强,其氢化物越稳定,同主族从上到下非金属性减弱,即HX随着原子序数递增,稳定性逐渐减弱,B正确;
C.F2与水反应生成HF和O2,C错误;
D.F的非金属性极强,HF分子间存在氢键,其余HX不存在分子间氢键,D正确;
综上所述答案为C。
11.A
【详解】A. 氢氧化钠俗称火碱、烧碱、苛性钠,其化学为NaOH,其名称、俗名、化学式一致;
B. 碳酸氢钠俗称小苏打,其化学式为NaHCO3,其名称、俗名、化学式不一致;
C. 氢氧化钙俗称熟石灰,其化学式为Ca(OH)2,其名称、俗名、化学式不一致;
D. 乙醇俗称酒精,其化学式为C2H5OH,其名称、俗名、化学式不一致;
故选A。
12.D
【详解】在第二、三周期中第IIA族和第IIIA族元素紧相邻,所以B元素的原子序数可能为x+1,在第四、五周期中第IIA族和第IIIA族元素相差10种元素,所以则B元素的原子序数可能为x+11,第六、第七周期里应为有镧系和锕系第IIA族和第IIIA族元素相差10+14种元素,所以则B元素的原子序数可能为x+25,因此①③⑤满足题意,D选项正确;
答案选D。
【点睛】本题考查元素周期表的相关知识,学生只要熟记元素周期表的结构就能熟练解题。注意第IIA族和第IIIA族之间会随着周期的不同,原子序数的差值会发生变化。
13.C
【详解】A、S2-比O2-多一电子层,半径S2->O2-,O2-、F-、Na+电子层结构相同,核电荷大的半径小,半径O2->F->Na+,选项A正确;
B、C与Si同为IVA族元素,它们的相似性表现在金刚石是原子晶体,硅晶体,碳化硅也是原子晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱,碳化硅应在Si与C之间。三种原子晶体,空间结构相似,硬度决定于它们的键长与键能,碳与碳键长最短,金刚石硬度最大,则故硬度从高到低分别是金刚石、碳化硅、晶体硅,选项B正确;
C、金属晶体的熔点决定于金属键的强弱,同主族元素的离子半径从上到下逐渐增大,金属阳离子与自由电子间的作用力逐渐减小,熔点:Li>Na>K>Rb>Cs,选项C错误;
D、酸性:乙醇<水<苯酚,结合质子能力:C2H5O->OH->,选项D正确;
答案选C。
14.B
【详解】A.既能与酸反应生成盐和水,又能和碱反应生成盐和水,属于氧化物中的两性氧化物,A正确;
B.铀原子的质子数为92,中子数为148,根据质量数(A)=质子数(Z)+中子数(N)可知,,其正确书写应该为,B错误;
C.HClO的电子式为,故其结构式为H-O-Cl,C正确;
D.金刚石和石墨均为碳元素形成的性质不同的碳单质,是碳元素的同素异形体,D正确。
故选B。
15.B
【分析】由条件“X的简单阴离子与锂离子具有相同的结构”可知,X为H元素;由条件“Y原子的最外层电子个数是内层电子数的两倍”可知,Y为C元素;由条件“Q的单质与稀硫酸剧烈反应生成氢气”可知,Q为第三周期的金属元素(Na或Mg或Al);由X可以与R形成H2R化合物可知,R为S元素;S可以与Z形成SZ2气体,所以Z为O元素。
【详解】A.硫化氢气体与二氧化硫气体反应的方程式:;当通入336mL,即0.015molSO2时,溶液恰好为中性,即恰好反应完全,所以原硫化氢溶液中,那么浓度即为0.3mol/L,A错误;
B.Q无论是Na,Mg,Al中的哪一种元素,获得其单质都是采用电冶金的方式,B正确;
C.Y,Z,R分别为C,O,S三种元素,所以简单氢化物的稳定性为H2O>H2S>CH4,即Z>R>Y,C错误;
D.SO2通入BaCl2溶液中无现象,但是通入Ba(NO3)2溶液中会出现白色沉淀,D错误。
答案选B。
16. 组成结构 ①④⑤ 功能 ②③
【详解】氯化钠是由钠元素和氯元素组成的、立方体晶体、氯化钠晶体中钠离子和氯离子的个数相等,均是在描述的氯化钠的组成结构;氯化钠在维持人体内的电解质平衡中起重要作用、是常用的调味品,均是在描述氯化钠的功能,所以第一行依次填:组成结构、①④⑤;第二行依次填:功能、②③。
17.(1) B、C D
(2)
(3)4.5
【分析】A有13个质子,质子数决定元素种类,故A为Al;B为NaOH;C为Al(OH)3;D为HCl
【详解】(1)既有离子键又有共价键的物质:NaOH、C为Al(OH)3;仅含共价键的物质:HCl;
故答案为:B、C;D。
(2)A为Al的电子式:;B为NaOH的电子式:;D为HCl的电子:式:
故答案为:;;。
(3),铝与产生氢气的物质的量之比为2:3,3mol的Al完全反应,则生成的氢气4.5mol;
故答案为:4.5
18. ①②④ ③ ⑧ ④ 离子键和共价键 NaHSO4=Na++H++SO42- 离子 NaHSO4= Na++HSO4-
【详解】(1)非金属元素之间一般形成的是共价键,所以含有共价键的是①②④;活泼的金属和活泼的非金属之间容易形成离子键,因此只含有离子键的是③;稀有气体元素的最外层电子已经达到平衡状态,所以稀有气体分子的单质中不存在化学键。
(2)只含有共价键的化合物是共价化合物,因此答案选④。
(3)硫酸氢钠溶于水电离出的是Na+、H+、SO42- ,电离方程式是NaHSO4=Na++H++SO42-,所以破坏的是离子键和共价键;而在熔融状态下,电离出的是Na++HSO4-,电离方程式是NaHSO4= Na++HSO4-,所以破坏的是离子键。
19.(1) 气密性检查 尾气处理、除去没有反应的CO。
(2) D 蒸发浓缩、冷却 能循环利用CO、提高了原料利用率、减少了二氧化碳的排放
【分析】在高温下,一氧化碳能还原氧化铁得到铁和二氧化碳。一氧化碳有毒,因此必须进行尾气处理。反应混合气体先通过碱液吸收,再点燃处理CO,据此回答。
(1)
①为了防止漏气、关于气体的实验,实验前必须对装置进行气密性检查。
②高温下,CO还原Fe2O3得到CO2和Fe,化学方程式为。
③CO有剧毒,不能直接排放到空气中,在e处点燃气体的目的是:尾气处理、除去没有反应的CO。
(2)
关闭K2,开启K1,可以将d口出来的气体再从a通入装置而循环使用。则:① d口出来的气体必须是纯净而干燥的CO气体,b装置能充分吸收二氧化碳、c装置用于干燥,则c瓶中应装浓硫酸,选D。
②b中氢氧化钠溶液吸收二氧化碳、化学反应方程式:。
③反应完后(假设b瓶中NaOH全部转化为纯碱),要从b瓶中溶液得到纯碱固体,从溶液中提取的碳酸钠固体是。适合用冷却结晶法。必要的实验操作为转移、蒸发浓缩、冷却、结晶。
④过量的CO从d排出进入a,故该实验这样改进的主要优点是能循环利用CO、提高了原料利用率、减少了二氧化碳的排放。
20. 浓) 除去中混有的HCl气体 A ①③⑥
【分析】本实验的实验目的为验证氯元素的非金属性比硫元素的非金属性强,其中A装置为制取氯气的装置,B装置为验证装置,C为尾气处理装置,据此结合元素及其化合物的相关性质解答问题。
【详解】(1)A装置为制取氯气的装置,实验室常用浓盐酸与二氧化锰混合加热制取氯气,反应的化学方程式为浓);
(2)浓盐酸易挥发,故制得的氯气中含有挥发的HCl气体,饱和食盐水可除去Cl2中混有的HCl气体;
(3)B装置为验证装置,可选用Na2S溶液,由于Cl2的氧化性强于S,故可以从Na2S中置换出S,发生的反应为;
(4)①非金属性越强,氢化物越稳定,比稳定,说明非金属性Cl>S,①选;
②氧化性比强不能说明非金属性Cl>S,②不选;
③非金属性越强,最高价氧化物对应水化物的酸性越强,酸性比强,说明非金属性Cl>S,③选;
④HCl和H2S均不是Cl和S的最高价含氧酸,故酸性比强不能说明非金属性Cl>S,④不选;
⑤氯原子最外层有7个电子,硫原子最外层有6个电子不能说明非金属性Cl>S,⑤不选;
⑥铁与反应生成,而硫与铁反应生成FeS,说明氧化性:Cl2>S,则非金属性Cl>S,⑥选;
综上,答案选①③⑥。
21. 湿润的淀粉-KI试纸变蓝 Cl2+2Br-=2Cl-+Br2 溶液分层,上层为无色(变浅),下层为紫红色(紫色) 吸收多余氯气,防治污染空气 增大 减弱
【分析】验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,以此解答该题。
【详解】(1)A中产生的黄绿色气体是氯气,氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,所以验证氯气的氧化性强于碘的实验现象是湿润的淀粉KI试纸变蓝。
(2)氯元素的非金属性强于溴元素的非金属性,所以B中氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
(3)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作为打开活塞b,将C中溶液滴入试管中并振荡、静置,故现象为:静置后溶液分层,上层为无色(变浅),下层CCl4溶液层为紫红色(紫色)。
(4)由于Cl2有毒,试管B管口塞有浸有NaOH溶液的棉花的目的为吸收多余氯气,防治污染空气。
(5)根据元素周期律可知氯、溴、碘单质的氧化性逐渐减弱的原因是:同主族元素从上到下原子半径逐渐增大,得电子能力逐渐减弱。
【点睛】本题主要考查了卤素单质氧化性的相对强弱的实验验证,明确实验原理、根据实验现象并用卤素性质进行解释是解答关键,注意要排除干扰因素的存在,注意从结构决定性质的这一角度分析元素的性质递变规律。
22. 0.005mol 0.03mol Al2Mg6(OH)16CO3·4H2O
【分析】⑴按照方程式HCO3- + H+ = H2O+ CO2↑计算生成二氧化碳消耗盐酸的物质的量,根据碳元素守恒得碳酸根的物质的量。
⑵生成氢氧化镁的沉淀质量为1.74g,计算氢氧化镁的物质的量,再根据守恒得镁离子的物质的量。
⑶先计算n(OH-),再根据n(OH-):n(CO32-):n(Mg2+)和根据电荷守恒求出n(OH-):n(CO32-):n(Mg2+):n(Al3+)的比例,根据碳酸根物质的量求摩尔质量求出n值。
【详解】⑴CO32- + 2H+ = H2O+ CO2↑生成二氧化碳消耗盐酸的物质的量为2.0mol/L × 0.0025L = 0.005mol;根据碳元素守恒得碳酸根的物质的量为0.005mol;故答案为:0.005mol。
⑵生成氢氧化镁的沉淀质量为1.74g,物质的量为,镁离子的物质的量为0.03mol;故答案为:0.03mol。
⑶n(OH-) = 2.0mol/L× 0.0425L = 0.085mol,因此n(OH-):n(CO32-):n(Mg2+)=0.085mol:0.005mol:0.03mol = 16:6:1,AlxMg6(OH)16CO3·nH2O,再根据电荷守恒(+3)x+(+2)×6+(-1)×16+(-2)×1 = 0,得到x = 2,根据碳酸根物质的量求摩尔质量,27×2 + 24×6 + 17×16 + 48 + 18×n=602,n = 4;因此化学式为Al2Mg6(OH)16CO3·4H2O;故答案为Al2Mg6(OH)16CO3·4H2O。
