专题6化学反应与能量变化章节练习(含答案)下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题6化学反应与能量变化章节练习(含答案)下学期高一化学苏教版(2019)必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 21:38:56 | ||
图片预览




文档简介
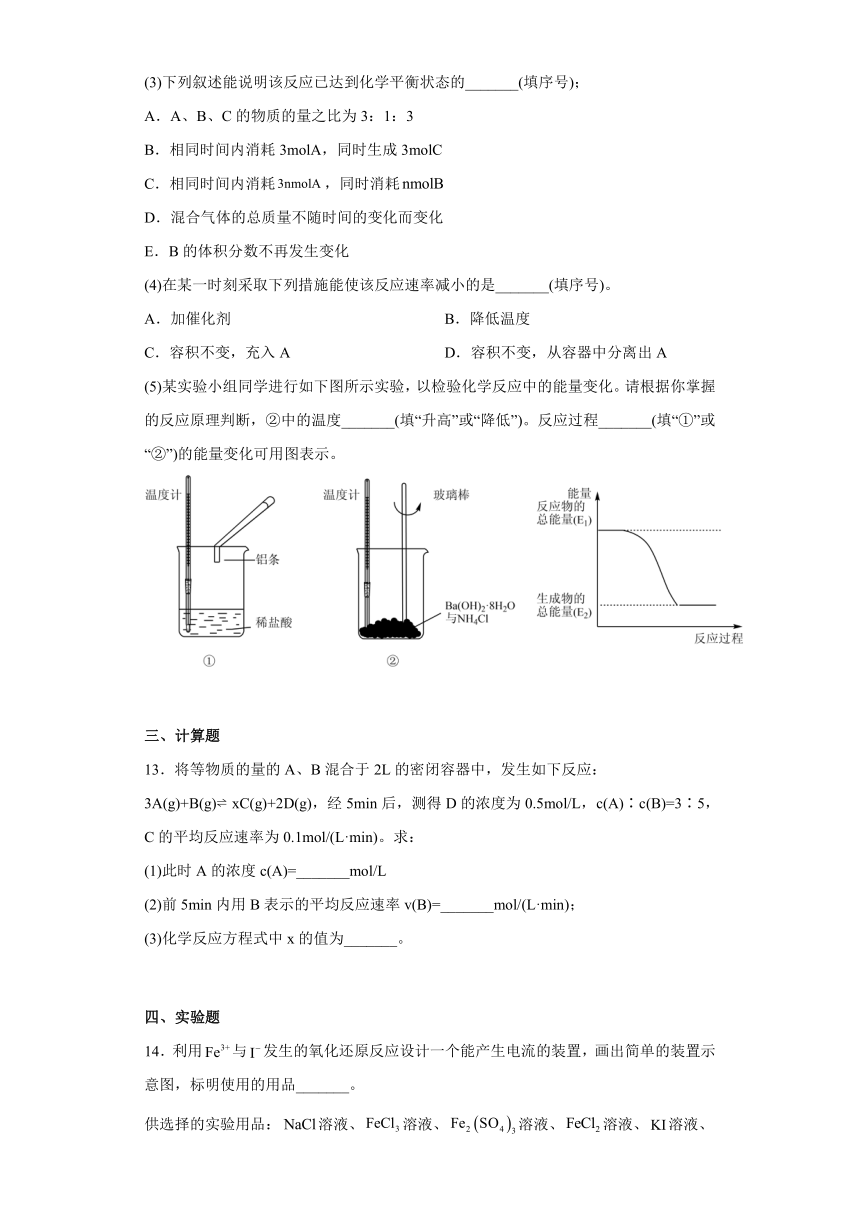
专题6 化学反应与能量变化 章节练习 高一下册化学苏教版(2020)必修第二册
一、单选题
1.下列变化过程,属于吸热反应的是
A.液态水变成水蒸气 B.酸碱中和反应
C.煅烧石灰石 D.铝热反应
2.有关如图所示四个常用电化学装置的叙述中,正确的是
A.图I所示电池中,的作用是作催化剂
B.图Ⅱ所示电池放电过程中,负极质量不断增加
C.图Ⅲ所示装置工作过程中,电解质溶液质量将增加
D.图Ⅳ所示电池中,正极的电极反应式为
3.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是
A.化学方程式:2NM
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,M的浓度是N的浓度的2倍
4.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④放热反应中反应物断键吸收的总能量小于生成物成键所释放的总能量
⑤液态水汽化和氯酸钾分解制氧气都属于吸热反应
A.③④ B.①②⑤ C.①②③④ D.③④⑤
5.下列说法中正确的是
A.物质燃烧放出的热量是燃烧热
B.1 mol C燃烧生成CO时放出的热量就是C的燃烧热
C.1 mol H2燃烧生成水时放出的热量是H2的燃烧热
D.相同条件下,1 mol H2O(l)完全分解吸收的热量与H2、O2化合生成1 mol H2O(l)放出的热量值相等
6.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1C.T2℃下,在前30分钟内用CO表示的化学反应速率为1.20 mol/(L·h)
D.该反应的△H>0
7.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
8.一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
A.反应开始到10s,用X表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.395mol/L
C.反应的化学方程式为:X(g)+Y(g)Z(g)
D.反应开始到10s时,Y的转化率为79.0%
9.在体积为的密闭容器中,充入和,一定条件下发生反应:,能说明上述反应达到平衡状态的是
A.反应中与的物质的量浓度相等时
B.V(CO2)=V(H2)
C.单位时间内每消耗,同时生成
D.的体积分数在混合气体中保持不变
10.化学与生产、生活密切相关,下列说法错误的是
A.高纯硅晶体可用于制作太阳能电池
B.稀土永磁材料是电子通讯技术中的重要材料,稀土元素都是金属元素
C.生活中制作油条的口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱
D.干电池低汞化、无汞化,有利于减少废电池造成的土壤污染
二、填空题
11.Ⅰ.回答下列问题:
(1)已知键能:H—H 436 kJ/mol,N—H 391 kJ/mol,N≡N 946 kJ/mol。则N2(g) + 3H2(g) 2NH3(g)生成1 mol NH3_______(填“吸收”或“放出”)_______kJ热量。
Ⅱ. 实验小组对可逆反应aX(g) + bY(g) pZ(g)进行探究。回答下列问题:
(2)T℃时,起始向10 L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。
①a∶b∶p=_______。
②0~4 min内的反应速率v(Z)=_______。
③2 min时的正反应速率_______(填“大于”、“小于”或“等于”)4 min时的正反应速率。
(3)若在不同条件下进行上述反应,测得反应速率分别为①v(X)=0.3 mol·L-1·min-1,②v(Y)=0.4 mol·L-1·min-1,③v(Z)=0.5 mol·L·min-1,其中反应速率最慢的是_______(填序号)。
Ⅲ. 完成下列问题
(4)下列装置中能够组成原电池的是_______(填序号)。
12.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。
根据图中数据,试填写下列空白:
(1)该反应的化学方程式为_______;
(2)从开始至2min,B的平均反应速率为_______;平衡时,C的物质的量为_______;
(3)下列叙述能说明该反应已达到化学平衡状态的_______(填序号);
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗,同时消耗
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是_______(填序号)。
A.加催化剂 B.降低温度
C.容积不变,充入A D.容积不变,从容器中分离出A
(5)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程_______(填“①”或“②”)的能量变化可用图表示。
三、计算题
13.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______mol/(L·min);
(3)化学反应方程式中x的值为_______。
四、实验题
14.利用与发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品_______。
供选择的实验用品:溶液、溶液、溶液、溶液、溶液、铜片、锌片、铁片、碳棒、滤纸、导线
五、有机推断题
15.有机物A在标准状况下的密度为1.25g L-1。以A为原料合成乙酸乙酯的路线如图所示。已知D的分子式为C2H4O2。
请回答下列问题:
(1)A的结构简式为___,D中官能团的名称是___,反应④的反应类型是___。
(2)反应②的化学方程式是__,反应⑤的化学方程式是__。
(3)某同学用如图所示的装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的,不溶于水的油状液体。
①实验开始前试管甲中的试剂为__,导管不能插入试管甲溶液中的原因是___。
②用1molB和1molD充分反应,理论上不能生成1mol乙酸乙酯,原因是__。
六、元素或物质推断题
16.X、Y、Z、W代表四种短周期主族元素,有关它们的部分结构信息及性质信息如下表所示:
元素 部分结构信息 部分性质信息
X X原子的最外层电子数等于其电子层数 由X元素形成的单质是最清洁的燃料
Y Y原子的最外层电子数是其次外层电子数的3倍 Y与X能形成两种化合物
Z Y、Z同主族 ZY2的排放易造成空气污染
W W是短周期主族元素中原子半径最大的元素 与XY剧烈反应
请按要求回答下列问题:
(1)W元素为_________(填元素符号),Z在元素周期表中的位置是_______。
(2)Y、Z的最简单氢化物中稳定性较强的是_______(填化学式)。
(3)X2Y2的电子式为__________,X2Y2可与ZY2反应,写出此反应的化学方程式:____。
(4)写出W的氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式:___。
(5)一种ZY2—Y2质子交换膜燃料电池可以利用大气所含的ZY2进行放电,其原理如图所示。
①放电时消耗ZY2和Y2的物质的量之比为_______。
②负极的电极反应式为___________。
七、工业流程题
17.某工厂采用辉铋矿(主要成分为,含有、杂质)与软锰矿(主要成分为)联合焙烧法制备和,工艺流程如下:
已知:①焙烧时过量的分解为,转变为;
②金属活动性:;
③相关金属离子开始形成氢氧化物至沉淀完全的范围:
Fe2+: 6.5~8.3 Fe3+: 1.6~2.8 Mn2+ : 8.1~10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为___________。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)在空气中单独焙烧生成,反应的化学方程式为___________。
(3)“水浸”还原剂为___________(填化学式)。
(4)滤渣的主要成分为___________。(填化学式)。
(5)生成气体A的离子方程式为___________。
(6)加入金属Bi的目的是___________。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为___________。
八、原理综合题
18.化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
A.CaO+H2O=Ca(OH)2
B.C+CO22CO
C.NaOH+HCl=NaCl+H2O
D.2FeCl3+Cu=2FeCl2+CuCl2
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。
①该同学设计这两个实验的目的是___________。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________,工作时间内装置所产生氢气的体积为 ___________L(标准状况)。
九、结构与性质
19.科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。
(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)2CO(g)+4H2(g)的△H=_________
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为______________
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按(CO2):(H2)=1:3投料,如图所示为不同温度()下,平衡时四种气态物质的物质的量()的关系。
①该反应的△H_______0(填“>”或“<”)。
②曲线表示的物质为______(填化学式)。
参考答案:
1.C
2.B
3.A
4.A
5.D
6.B
7.A
8.D
9.D
10.C
11.(1) 放出 46
(2) 1∶2∶3 0.0375 mol·L-1·min-1 大于
(3)③
(4)③⑤
12.(1)3A(g)B(g) + 3C(g)
(2) 0.2 mol L 1 min 1 2.4mol
(3)CE
(4)BD
(5) 降低 ①
13. 0.75 0.05 2
14.
15. CH2=CH2 羧基 取代反应(或酯化反应) 2CH3CH2OH+O22CH3CHO+2H2O CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH 饱和Na2CO3溶液 插入会引起倒吸 该反应为可逆反应,有一定的限度,不可能完全转化
16. Na 第三周期ⅥA族 H2O 2:1
17.(1)ab
(2)
(3)SO2
(4)SiO2
(5)
(6)将Fe3+转化为Fe2+
(7)24.02%
18.(1)D
(2) 通过对比实验探究Zn与稀硫酸在不同条件下反应的能量变化 A
(3) Zn-2e-=Zn2+ 5.6
19. -71.4 kJ·mol-1 0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 40% < C2H4
一、单选题
1.下列变化过程,属于吸热反应的是
A.液态水变成水蒸气 B.酸碱中和反应
C.煅烧石灰石 D.铝热反应
2.有关如图所示四个常用电化学装置的叙述中,正确的是
A.图I所示电池中,的作用是作催化剂
B.图Ⅱ所示电池放电过程中,负极质量不断增加
C.图Ⅲ所示装置工作过程中,电解质溶液质量将增加
D.图Ⅳ所示电池中,正极的电极反应式为
3.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是
A.化学方程式:2NM
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,M的浓度是N的浓度的2倍
4.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④放热反应中反应物断键吸收的总能量小于生成物成键所释放的总能量
⑤液态水汽化和氯酸钾分解制氧气都属于吸热反应
A.③④ B.①②⑤ C.①②③④ D.③④⑤
5.下列说法中正确的是
A.物质燃烧放出的热量是燃烧热
B.1 mol C燃烧生成CO时放出的热量就是C的燃烧热
C.1 mol H2燃烧生成水时放出的热量是H2的燃烧热
D.相同条件下,1 mol H2O(l)完全分解吸收的热量与H2、O2化合生成1 mol H2O(l)放出的热量值相等
6.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1
D.该反应的△H>0
7.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
8.一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
A.反应开始到10s,用X表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.395mol/L
C.反应的化学方程式为:X(g)+Y(g)Z(g)
D.反应开始到10s时,Y的转化率为79.0%
9.在体积为的密闭容器中,充入和,一定条件下发生反应:,能说明上述反应达到平衡状态的是
A.反应中与的物质的量浓度相等时
B.V(CO2)=V(H2)
C.单位时间内每消耗,同时生成
D.的体积分数在混合气体中保持不变
10.化学与生产、生活密切相关,下列说法错误的是
A.高纯硅晶体可用于制作太阳能电池
B.稀土永磁材料是电子通讯技术中的重要材料,稀土元素都是金属元素
C.生活中制作油条的口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱
D.干电池低汞化、无汞化,有利于减少废电池造成的土壤污染
二、填空题
11.Ⅰ.回答下列问题:
(1)已知键能:H—H 436 kJ/mol,N—H 391 kJ/mol,N≡N 946 kJ/mol。则N2(g) + 3H2(g) 2NH3(g)生成1 mol NH3_______(填“吸收”或“放出”)_______kJ热量。
Ⅱ. 实验小组对可逆反应aX(g) + bY(g) pZ(g)进行探究。回答下列问题:
(2)T℃时,起始向10 L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。
①a∶b∶p=_______。
②0~4 min内的反应速率v(Z)=_______。
③2 min时的正反应速率_______(填“大于”、“小于”或“等于”)4 min时的正反应速率。
(3)若在不同条件下进行上述反应,测得反应速率分别为①v(X)=0.3 mol·L-1·min-1,②v(Y)=0.4 mol·L-1·min-1,③v(Z)=0.5 mol·L·min-1,其中反应速率最慢的是_______(填序号)。
Ⅲ. 完成下列问题
(4)下列装置中能够组成原电池的是_______(填序号)。
12.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。
根据图中数据,试填写下列空白:
(1)该反应的化学方程式为_______;
(2)从开始至2min,B的平均反应速率为_______;平衡时,C的物质的量为_______;
(3)下列叙述能说明该反应已达到化学平衡状态的_______(填序号);
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗,同时消耗
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是_______(填序号)。
A.加催化剂 B.降低温度
C.容积不变,充入A D.容积不变,从容器中分离出A
(5)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程_______(填“①”或“②”)的能量变化可用图表示。
三、计算题
13.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______mol/(L·min);
(3)化学反应方程式中x的值为_______。
四、实验题
14.利用与发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品_______。
供选择的实验用品:溶液、溶液、溶液、溶液、溶液、铜片、锌片、铁片、碳棒、滤纸、导线
五、有机推断题
15.有机物A在标准状况下的密度为1.25g L-1。以A为原料合成乙酸乙酯的路线如图所示。已知D的分子式为C2H4O2。
请回答下列问题:
(1)A的结构简式为___,D中官能团的名称是___,反应④的反应类型是___。
(2)反应②的化学方程式是__,反应⑤的化学方程式是__。
(3)某同学用如图所示的装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的,不溶于水的油状液体。
①实验开始前试管甲中的试剂为__,导管不能插入试管甲溶液中的原因是___。
②用1molB和1molD充分反应,理论上不能生成1mol乙酸乙酯,原因是__。
六、元素或物质推断题
16.X、Y、Z、W代表四种短周期主族元素,有关它们的部分结构信息及性质信息如下表所示:
元素 部分结构信息 部分性质信息
X X原子的最外层电子数等于其电子层数 由X元素形成的单质是最清洁的燃料
Y Y原子的最外层电子数是其次外层电子数的3倍 Y与X能形成两种化合物
Z Y、Z同主族 ZY2的排放易造成空气污染
W W是短周期主族元素中原子半径最大的元素 与XY剧烈反应
请按要求回答下列问题:
(1)W元素为_________(填元素符号),Z在元素周期表中的位置是_______。
(2)Y、Z的最简单氢化物中稳定性较强的是_______(填化学式)。
(3)X2Y2的电子式为__________,X2Y2可与ZY2反应,写出此反应的化学方程式:____。
(4)写出W的氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式:___。
(5)一种ZY2—Y2质子交换膜燃料电池可以利用大气所含的ZY2进行放电,其原理如图所示。
①放电时消耗ZY2和Y2的物质的量之比为_______。
②负极的电极反应式为___________。
七、工业流程题
17.某工厂采用辉铋矿(主要成分为,含有、杂质)与软锰矿(主要成分为)联合焙烧法制备和,工艺流程如下:
已知:①焙烧时过量的分解为,转变为;
②金属活动性:;
③相关金属离子开始形成氢氧化物至沉淀完全的范围:
Fe2+: 6.5~8.3 Fe3+: 1.6~2.8 Mn2+ : 8.1~10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为___________。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)在空气中单独焙烧生成,反应的化学方程式为___________。
(3)“水浸”还原剂为___________(填化学式)。
(4)滤渣的主要成分为___________。(填化学式)。
(5)生成气体A的离子方程式为___________。
(6)加入金属Bi的目的是___________。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为___________。
八、原理综合题
18.化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
A.CaO+H2O=Ca(OH)2
B.C+CO22CO
C.NaOH+HCl=NaCl+H2O
D.2FeCl3+Cu=2FeCl2+CuCl2
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。
①该同学设计这两个实验的目的是___________。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________,工作时间内装置所产生氢气的体积为 ___________L(标准状况)。
九、结构与性质
19.科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。
(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 kJ·mol-1、283. 0 kJ·mol-1、285. 8 kJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)2CO(g)+4H2(g)的△H=_________
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为______________
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)C2H4 (g)+4H2O(g) △H。在0 .1 MPa时,按(CO2):(H2)=1:3投料,如图所示为不同温度()下,平衡时四种气态物质的物质的量()的关系。
①该反应的△H_______0(填“>”或“<”)。
②曲线表示的物质为______(填化学式)。
参考答案:
1.C
2.B
3.A
4.A
5.D
6.B
7.A
8.D
9.D
10.C
11.(1) 放出 46
(2) 1∶2∶3 0.0375 mol·L-1·min-1 大于
(3)③
(4)③⑤
12.(1)3A(g)B(g) + 3C(g)
(2) 0.2 mol L 1 min 1 2.4mol
(3)CE
(4)BD
(5) 降低 ①
13. 0.75 0.05 2
14.
15. CH2=CH2 羧基 取代反应(或酯化反应) 2CH3CH2OH+O22CH3CHO+2H2O CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH 饱和Na2CO3溶液 插入会引起倒吸 该反应为可逆反应,有一定的限度,不可能完全转化
16. Na 第三周期ⅥA族 H2O 2:1
17.(1)ab
(2)
(3)SO2
(4)SiO2
(5)
(6)将Fe3+转化为Fe2+
(7)24.02%
18.(1)D
(2) 通过对比实验探究Zn与稀硫酸在不同条件下反应的能量变化 A
(3) Zn-2e-=Zn2+ 5.6
19. -71.4 kJ·mol-1 0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 40% < C2H4
