化学人教版(2019)必修第二册8.1自然资源的开发利用 课件(共56张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1自然资源的开发利用 课件(共56张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 47.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-13 22:18:24 | ||
图片预览











文档简介
(共56张PPT)
第1课时 金属矿物的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
金属元素在自然界中有哪些存在形式?
思考交流
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
自然金
自然铂
陨铁
游离态
化合态
思考交流
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
自然金
自然铂
陨铁
在生活中使用的金属材料多是纯金属或合金,如何从矿石中得到金属单质?
金、铂首饰 铁锅 钛合金飞机外壳
铝板 锌粒 铜导线
一、金属矿物的开发利用
1. 金属元素在自然界中的存在形态
游离态:金、铂等极少数金属;
化合态:绝大多数金属元素。
2. 金属的冶炼
赤铁矿(Fe2O3)
纯铁
利用氧化还原反应
化合态 游离态
Mn++ne-→M
与金属活动性(还原性)有关
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
强
弱
电解法
热还原法
热分解法
3. 金属的冶炼方法
物理方法
一、金属矿物的开发利用
(1)物理方法
淘金原理:金的质量较沙重,在淘去粗沙后,用水银滚动吸附金。(水银是已知唯一可以粘附金的物质)
一、金属矿物的开发利用
3. 金属的冶炼方法
千淘万漉虽辛苦,吹尽狂沙始到金。
美人首饰侯王印,尽是沙中浪底来。
——刘禹锡《浪淘沙》
一、金属矿物的开发利用
3. 金属的冶炼方法
(2) 热分解法:
2HgO === 2Hg + O2↑
△
2Ag2O === 4Ag + O2↑
△
适用于一些不活泼的金属(如:Hg 、Ag )
古代炼丹术家葛洪,曾经在他的著作《抱朴子》中记载有“丹砂烧之成水银”。
HgS === Hg + S
△
一、金属矿物的开发利用
3. 金属的冶炼方法
(3) 热还原法:
Fe2O3+3CO===2Fe+3CO2
高温
高炉炼铁
适用于大多数中等活泼金属的冶炼
常用的还原剂有:CO、H2、C(焦炭)、活泼金属等
CuO+H2 Cu+H2O
现象:镁条剧烈燃烧,发出白光,导致混合物剧烈反应,发出强光,有红热的熔融物生成。
原理:2Al+Fe2O3===2Fe+Al2O3
高温
镁条的作用:引燃剂
氯酸钾的作用:助燃剂
铝热反应即铝粉与某些金属氧化物粉末的混合物在高温下进行的反应。铝粉与金属氧化物粉末的混合物称为铝热剂。
铝热反应
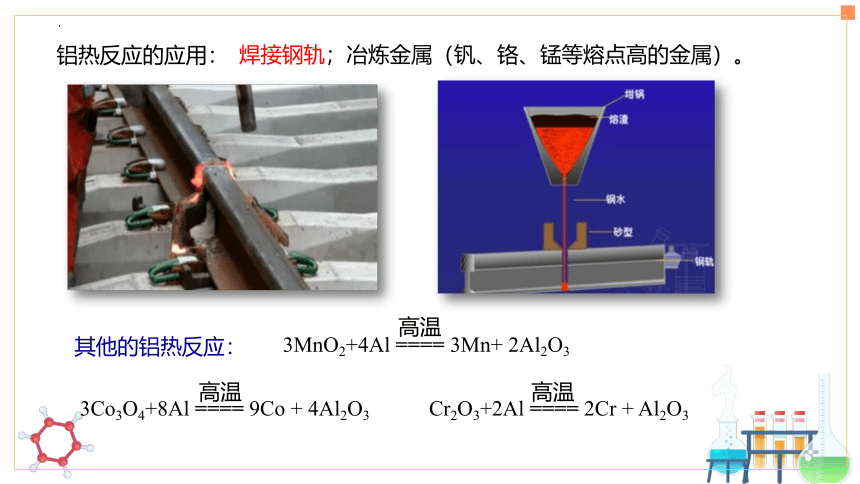
铝热反应的应用:
焊接钢轨;冶炼金属(钒、铬、锰等熔点高的金属)。
3MnO2+4Al ==== 3Mn+ 2Al2O3
高温
Cr2O3+2Al ==== 2Cr + Al2O3
高温
3Co3O4+8Al ==== 9Co + 4Al2O3
高温
其他的铝热反应:
一、金属矿物的开发利用
3. 金属的冶炼方法
(4) 电解法:
MgCl2(熔融)=== Mg + Cl2↑
电解
2Al2O3(熔融)==== 4Al + 3O2↑
电解
冰晶石
2NaCl(熔融)===2Na + Cl2↑
电解
适用于K、Ca、Na、Mg、Al等非常活泼的金属
冰晶石
(六氟合铝酸钠)
温馨提示:冰晶石(Na3AlF6)降低Al2O3熔化所需温度,降低能耗。
2Al2O3(熔融) 4Al+3O2↑
电解
冰晶石
为什么工业上炼铝不用AlCl3,而炼镁时不用MgO
MgCl2(熔融) Mg+Cl2↑
电解
工业上冶炼Al时用Al2O3,因为AlCl3为共价化合物,熔融态不能电离。
工业上冶炼Mg时用MgCl2,因为MgO的熔点很高,耗能太大。
离子化合物
交流讨论
一、金属矿物的开发利用
3. 金属的冶炼方法
(4) 其他方法:
湿法炼铜
火法炼铜
CuSO4+Fe==Cu+FeSO4
Cu2S+O2===2Cu+SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
归纳总结
金属冶炼方法与金属活泼性关系
一、金属矿物的开发利用
4.金属矿物资源的开发和利用措施
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)使用其他材料代替金属材料,减少金属的使用量。
(5)加强废旧金属的回收和再利用。
1.判断正误
(1)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(2)越活泼的金属,人类利用的越晚( )
(3)可以通过电解饱和食盐水的方法获取金属钠( )
(4)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
(5)铝热反应的本质是用铝将活泼性比铝弱的金属从其化合物中置换出来( )
√
√
×
×
√
2.如图为铝热反应的实验装置,请回答下列问题:
(1)写出该铝热反应的化学方程式:____________________________。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是
___________________________。
(3)若将所得产品置于足量的NaOH溶液中,可能看到的现象是
_________________________。
(4)假设铝足量且反应充分,设计一种实验方案,证明本实验中有单质铁生成:____________________________________________________________________________________________________________________________________________________________________________________________。
若铝过量,剩余的铝及产物氧化铝均与NaOH溶液反应
不能
镁比铝活泼,铝不能置换出镁
2Al+Fe2O3===Al2O3+2Fe
高温
部分固体溶解,有气泡产生
取适量反应后的固体混合物,先用足量NaOH溶液除去铝,再加入稀硫酸,有气泡冒出,说明有铁生成(或用磁铁靠近固体,有固体可被磁铁吸引,说明有铁生成)
两大工艺流程
流程Ⅰ
写出与Al有关的离子方程式。
①__________________________;
②__________________________;
③_________________________________________。
Al2O3+6H+==2Al3++3H2O
Al3++4OH-==Al+2H2O
Al+CO2+2H2O==Al(OH)3↓+HC
二、铝的冶炼
思考交流
铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质) 冶炼Al
二、铝的冶炼
思考交流
铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质) 冶炼Al
两大工艺流程
流程Ⅱ
Al2O3两性氧化物
写出与Al有关的离子方程式。
④___________________________;
⑤___________________________;
⑥_________________________________。
Al2O3+2OH-==2Al +H2O
Al+4H+== Al3++2H2O
Al3++3NH3·H2O==Al(OH)3↓+3
第2课时 海水资源的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
海水资源的开发利用
海洋约占地球表面积的71%。海洋中水的储量约为1.3×1018吨,约占地球上总水量的97%。
从太空观察地球,会看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中主要含有H、O元素,还含有丰富的Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等多种元素。
海水资源
化学资源
水资源
新型能源
海水资源的开发利用
思路二
分离出盐分
一、海水水资源的开发利用
1. 海水资源的特点
广阔性
多样性
分散性
电渗析法
离子交换法
反渗析法
2. 利用途径及海水淡化方法
海水淡化
思路一
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
电渗析法
离子交换法
蒸馏法
海水的蒸馏
(1)主要仪器:
A , B_________,C_______。
(2)冷却水的流向: 口进, 口出。
(3)B中加入碎瓷片的目的是
。
直行冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
(1)蒸馏烧瓶须垫石棉网加热 ; 所盛液体不能超过容量的。
(2)温度计的水银球在烧瓶支管口处;量程应高于馏分的最高沸点。
注意事项
(最先使用,技术成熟,但成本高)
二、海水中化学资源的开发利用
从海水中制得氯化钠除了食用外,还有什么用途?
制备这些化工原料的反应原理?
交流讨论
NaCl
烧碱
纯碱
钠
氯气
氯化氢
二、海水中化学资源的开发利用
1. 海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
二、海水中化学资源的开发利用
2. 海水提溴
(1) 海水提溴的方法(吹出法)
二、海水中化学资源的开发利用
2. 海水提溴
(1) 海水提溴的方法(吹出法)
工艺流程:
基本操作:浓缩、氧化、吹出、吸收、蒸馏
(2) 氧化、吸收环节主要反应的离子方程式:
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===4H++ +2Br-
①分解贝壳(主要成分是CaCO3)、制备Ca(OH)2:
______________________,____________________。
CaO+H2O===Ca(OH)2
3.海水提镁
下图为海水提镁的工艺流程,
写出下列步骤中的化学方程式。
②沉淀Mg2+:_________________________(离子方程式)。
③制备MgCl2:______________________________。
④制取Mg:___________________________。
Mg2++2OH-===Mg(OH)2↓
Mg(OH)2+2HCl===MgCl2+2H2O
CaCO3 ==== CaO+CO2↑
高温
MgCl2(熔融) ==== Mg+Cl2↑
电解
4.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
(1)实验步骤①会用到下列仪器中的____(填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤③操作的名称是_____。
(3)步骤④中反应的离子方程式为___________________________。
acd
2I-+H2O2+2H+===I2+2H2O
过滤
灼烧海带
分离得到海带灰悬浊液中的溶液
4.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
(4)请设计一种检验水溶液中是否含有碘单质的方法:
_______________________________________________________________________________________________________________。
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤____(填序号)中实现与碘分离。
取适量水溶液于试管中,加入淀粉溶液,观察溶液是否变蓝,若变蓝则说明水溶液中含有碘单质,反之则不含
由于淀粉遇碘单质变蓝,故可以用淀粉溶液来检验水溶液中是否含碘单质。
⑤
萃取、分液
第3课时 煤、石油和天然气的综合利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
迄今为止,煤、石油和天然气仍是人类使用的主要能源,同时它们也是重要的化工原料。如何实现化石燃料的综合利用,提高利用率,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战。
煤
石油
天然气
1. 煤的组成——有机物+少量无机物
主要元素 其他元素
C
H、O、N、S 等
【思考】煤直接作为燃料有什么缺点?
一、煤的综合利用
利用率低并污染环境。
COx、NOx、
SO2 、 烟尘等
煤的综合利用
煤的干馏
煤的气化
煤的液化
获得洁净的燃料和多种化工原料
——物尽其用,保护环境
一、煤的综合利用
2. 煤的综合利用
(1)煤的干馏:
将煤隔绝空气加强热使它分解的过程。
煤焦油
出炉煤气
焦炭
【思考】煤的干馏为什么要隔绝空气?
若不隔绝空气,在高温条件下,煤会在空气中燃烧。
2. 煤的综合利用
干馏产物 主要成分 主要用途
出炉 煤气 焦炉气 H2、CH4、乙烯、CO 气体燃料、化工原料
粗氨水 NH3、铵盐 化肥、炸药、染料、医药、农药、合成材料
粗苯 苯、甲苯、二甲苯
煤焦油 苯、甲苯、二甲苯
酚类、萘 染料、医药、农药、
合成材料
沥青 筑路材料、碳素电极
焦炭 碳 冶金、合成氨造气、电石、燃料
表8-1煤的干馏的重要产品和用途
2. 煤的综合利用
(2)煤的气化:
在一定条件下把煤转化为可燃性气体的过程。
主要反应是:
C(s)+H2O(g) CO(g)+H2(g)
高温
水煤气(管道煤气)
【思考】为什么一不小心将少量水洒在烧得通红的煤上时,火不但没有熄灭,反而烧得更旺?
(3) 煤的液化
在一定条件下将煤转化为液体燃料。
◆直接液化:
煤与氢气作用生成液体燃料。
◆间接液化:
先转化为CO和H2,再在催化剂作用合成甲醇等。
2. 煤的综合利用
C(s)+H2O(g) CO(g)+H2(g)
高温
CO + 2H2 CH3OH(甲醇)
催化剂
煤的综合利用
煤的综合利用
出炉煤气
煤焦油
焦炭
可燃性气体
液体燃料
水煤气
干馏
气化
+H2
直接液化
液化
苯、甲苯等
H2O(g)
水煤气
催化剂
甲醇
催化剂
+H2O
间接液化
【小结】
二、天然气的组成及其综合利用
2. 天然气的综合利用
(1) 主要成分:CH4
(2) 综合利用
清洁的化石燃料
化工原料
合成氨
生产甲醇
合成多碳有机物
CH4
CH3OH
天然气水合物(可燃冰)
可燃冰,也就是我们所说的天然气水合物(主要成分是甲烷),就是由天然气和水在高压低温的条件下形成的类冰状的结晶化合物。可燃冰主要分布在深海沉积物和陆源的永久冻土中。从外形上看上去,可燃冰就像是白色或浅灰色的冰雪晶体。这时候如果有火源,它可以像固体酒精一样被点燃,被称为“可燃冰”。
资料卡片
1.判断正误
(1)把煤加强热使之分解的过程为煤的干馏( )
(2)煤俗称煤炭,因此可看作碳元素形成的单质( )
(3)煤中含粗苯、煤焦油等物质,可通过蒸馏获取苯、甲苯等芳香烃( )
(4)在一定条件下,煤可以和氢气直接反应生成液体燃料( )
(5)煤的气化和液化都是物理变化( )
×
×
√
×
×
二、石油的综合利用、合成高分子材料
阅读教材,结合视频,归纳石油的物理性质及组成
交流讨论
黑色或深棕色粘稠状液体,有特殊气味,比水轻,不溶于水,没有固定沸点。
三、石油的综合利用
石油是由多种碳氢化合物组成的混合物。
石油的分馏
石油的催化裂化
石油裂解(深度裂化)
石油催化重整
石油的综合利用
原理:利用原油中各组分沸点的不同进行分离的过程。
分馏产物:
石油气
汽油、煤油、柴油等
蜡油、润滑油
重油(沥青等)
轻质液
体燃料
【思考】用什么方法分离重油?为什么?
减压蒸馏,减压是为了降低重油的
沸点,避免温度过高发生分解。
1.石油的分馏
干馏 蒸馏 分馏
原理
产物
反应类型
隔绝空气、加强热使物质分解
根据液态混合物中各组分沸点不同进行分离
与蒸馏原理相同
产物为混合物
产物为单一组分的纯净物
产物为沸点相近的各组分组成的混合物
化学变化
物理变化
物理变化
化学“三馏”的比较
裂化的目的:提高轻质汽油的产量。
相对分子质量大
沸点高的烃
相对分子质量小
沸点较低的烃
断裂
原料:重油、石蜡
产物:汽油、煤油、柴油、润滑油等
C16H34
十六烷
C8H18
辛烷
+
C8H16
辛烯
催化剂
加热、加压
裂化汽油(含烯烃、烷烃)
2.石油的裂化
C8H18
辛烷
C4H10
丁烷
+
C4H8
丁烯
催化剂
加热、加压
3.石油的裂解—深度的裂化
原理:采用比裂化更高的温度,使其中相对分子质量较大的长链烃断裂成乙烯、丙烯等短链烃。
主要产物:乙烯、丙烯、甲烷等重要化工基本原料。
C4H10
丁烷
CH4
甲烷
+
C3H6
丙烯
催化剂
加热、加压
C2H6
乙烷
C4H10
丁烷
+
C2H4
乙烯
催化剂
加热、加压
在加热和催化剂的作用下,可以通过结构的重新调整,使链状烃转化为环状烃,如苯、甲苯等。
目的:1. 提高汽油的辛烷值 2. 制取芳香烃。
4.催化重整
煤、天然气、石油的综合利用
高分子材料
基础化工原料
更高价值生活用品
塑料
合成橡胶
合成纤维
1.加聚反应
2.缩聚反应
纺织品
药品
日用化学品
1.判断正误
(1)石油的分馏为物理变化,获取的各种产品为混合物( )
(2)石油的裂化和裂解原理相同,目的也相同( )
(3)含4个碳原子的烷烃,经催化裂解后,只能生成2种气态烃( )
(4)许多性能优异的合成高分子材料的原始原料为煤、石油和天然气( )
×
√
×
√
2.生活中汽车的车用燃料一般为裂化汽油。这种汽油和直馏汽油在组成上的区别是___________________________________________________________。
鉴别它们的方法是:___________________________________________________
___________________________________。
直馏汽油主要是饱和烃的混合物,裂化汽油中含不饱和烃
各取少许于试管中,加入溴的四氯化碳溶液,不褪色的是
直馏汽油,褪色的是裂化汽油
3.目前,多数石油产品仍作为燃料使用,如把石油产品用来合成高分子材料,其价值将成倍提升,试写出用汽油[主要成分为辛烷(C8H18)]为原料生成聚乙烯塑料的合成原理。
C8H18 C4H10+C4H8,
辛烷 丁烷 丁烯
C4H10 C2H4+C2H6,
丁烷 乙烯 乙烷
nCH2==CH2 —CH2—CH2—。
[ ]n
4.下列有关石油加工的叙述不正确的是
A.石油分馏所得的馏分仍是混合物
B.石油裂化的原料是石油的分馏产品,包括石油气
C.石油裂化的主要目的是获得更多汽油等轻质油
D.石油裂解的主要目的是获得乙烯、丙烯、甲烷等化工原料
石油裂化和裂解都是长链烃变成短链烃的过程,裂解是深度裂化
石油裂化的原料是石油的分馏产品重油。
√
5.(2021·合肥高一期末)下列说法正确的是
A.石油的分馏、裂化、裂解均属于化学变化
B.煤的干馏、气化、液化均属于物理变化
C.汽油、煤油、柴油、聚乙烯均是纯净物
D.石油在加热和催化剂的作用下可使烃分子重整生成苯、甲苯等有机物
裂化、裂解均属于化学变化,分馏属于物理变化
三者均有新物质生成,属于化学变化
以上均为是混合物
√
第1课时 金属矿物的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
金属元素在自然界中有哪些存在形式?
思考交流
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
自然金
自然铂
陨铁
游离态
化合态
思考交流
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
黄铁矿(FeS2)
黄铜矿(CuFeS2)
铝土矿(Al2O3)
自然金
自然铂
陨铁
在生活中使用的金属材料多是纯金属或合金,如何从矿石中得到金属单质?
金、铂首饰 铁锅 钛合金飞机外壳
铝板 锌粒 铜导线
一、金属矿物的开发利用
1. 金属元素在自然界中的存在形态
游离态:金、铂等极少数金属;
化合态:绝大多数金属元素。
2. 金属的冶炼
赤铁矿(Fe2O3)
纯铁
利用氧化还原反应
化合态 游离态
Mn++ne-→M
与金属活动性(还原性)有关
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
强
弱
电解法
热还原法
热分解法
3. 金属的冶炼方法
物理方法
一、金属矿物的开发利用
(1)物理方法
淘金原理:金的质量较沙重,在淘去粗沙后,用水银滚动吸附金。(水银是已知唯一可以粘附金的物质)
一、金属矿物的开发利用
3. 金属的冶炼方法
千淘万漉虽辛苦,吹尽狂沙始到金。
美人首饰侯王印,尽是沙中浪底来。
——刘禹锡《浪淘沙》
一、金属矿物的开发利用
3. 金属的冶炼方法
(2) 热分解法:
2HgO === 2Hg + O2↑
△
2Ag2O === 4Ag + O2↑
△
适用于一些不活泼的金属(如:Hg 、Ag )
古代炼丹术家葛洪,曾经在他的著作《抱朴子》中记载有“丹砂烧之成水银”。
HgS === Hg + S
△
一、金属矿物的开发利用
3. 金属的冶炼方法
(3) 热还原法:
Fe2O3+3CO===2Fe+3CO2
高温
高炉炼铁
适用于大多数中等活泼金属的冶炼
常用的还原剂有:CO、H2、C(焦炭)、活泼金属等
CuO+H2 Cu+H2O
现象:镁条剧烈燃烧,发出白光,导致混合物剧烈反应,发出强光,有红热的熔融物生成。
原理:2Al+Fe2O3===2Fe+Al2O3
高温
镁条的作用:引燃剂
氯酸钾的作用:助燃剂
铝热反应即铝粉与某些金属氧化物粉末的混合物在高温下进行的反应。铝粉与金属氧化物粉末的混合物称为铝热剂。
铝热反应
铝热反应的应用:
焊接钢轨;冶炼金属(钒、铬、锰等熔点高的金属)。
3MnO2+4Al ==== 3Mn+ 2Al2O3
高温
Cr2O3+2Al ==== 2Cr + Al2O3
高温
3Co3O4+8Al ==== 9Co + 4Al2O3
高温
其他的铝热反应:
一、金属矿物的开发利用
3. 金属的冶炼方法
(4) 电解法:
MgCl2(熔融)=== Mg + Cl2↑
电解
2Al2O3(熔融)==== 4Al + 3O2↑
电解
冰晶石
2NaCl(熔融)===2Na + Cl2↑
电解
适用于K、Ca、Na、Mg、Al等非常活泼的金属
冰晶石
(六氟合铝酸钠)
温馨提示:冰晶石(Na3AlF6)降低Al2O3熔化所需温度,降低能耗。
2Al2O3(熔融) 4Al+3O2↑
电解
冰晶石
为什么工业上炼铝不用AlCl3,而炼镁时不用MgO
MgCl2(熔融) Mg+Cl2↑
电解
工业上冶炼Al时用Al2O3,因为AlCl3为共价化合物,熔融态不能电离。
工业上冶炼Mg时用MgCl2,因为MgO的熔点很高,耗能太大。
离子化合物
交流讨论
一、金属矿物的开发利用
3. 金属的冶炼方法
(4) 其他方法:
湿法炼铜
火法炼铜
CuSO4+Fe==Cu+FeSO4
Cu2S+O2===2Cu+SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
归纳总结
金属冶炼方法与金属活泼性关系
一、金属矿物的开发利用
4.金属矿物资源的开发和利用措施
(1)提高金属矿物的利用率。
(2)开发环保高效的金属冶炼方法。
(3)防止金属的腐蚀。
(4)使用其他材料代替金属材料,减少金属的使用量。
(5)加强废旧金属的回收和再利用。
1.判断正误
(1)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(2)越活泼的金属,人类利用的越晚( )
(3)可以通过电解饱和食盐水的方法获取金属钠( )
(4)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
(5)铝热反应的本质是用铝将活泼性比铝弱的金属从其化合物中置换出来( )
√
√
×
×
√
2.如图为铝热反应的实验装置,请回答下列问题:
(1)写出该铝热反应的化学方程式:____________________________。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是
___________________________。
(3)若将所得产品置于足量的NaOH溶液中,可能看到的现象是
_________________________。
(4)假设铝足量且反应充分,设计一种实验方案,证明本实验中有单质铁生成:____________________________________________________________________________________________________________________________________________________________________________________________。
若铝过量,剩余的铝及产物氧化铝均与NaOH溶液反应
不能
镁比铝活泼,铝不能置换出镁
2Al+Fe2O3===Al2O3+2Fe
高温
部分固体溶解,有气泡产生
取适量反应后的固体混合物,先用足量NaOH溶液除去铝,再加入稀硫酸,有气泡冒出,说明有铁生成(或用磁铁靠近固体,有固体可被磁铁吸引,说明有铁生成)
两大工艺流程
流程Ⅰ
写出与Al有关的离子方程式。
①__________________________;
②__________________________;
③_________________________________________。
Al2O3+6H+==2Al3++3H2O
Al3++4OH-==Al+2H2O
Al+CO2+2H2O==Al(OH)3↓+HC
二、铝的冶炼
思考交流
铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质) 冶炼Al
二、铝的冶炼
思考交流
铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质) 冶炼Al
两大工艺流程
流程Ⅱ
Al2O3两性氧化物
写出与Al有关的离子方程式。
④___________________________;
⑤___________________________;
⑥_________________________________。
Al2O3+2OH-==2Al +H2O
Al+4H+== Al3++2H2O
Al3++3NH3·H2O==Al(OH)3↓+3
第2课时 海水资源的开发利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
海水资源的开发利用
海洋约占地球表面积的71%。海洋中水的储量约为1.3×1018吨,约占地球上总水量的97%。
从太空观察地球,会看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中主要含有H、O元素,还含有丰富的Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等多种元素。
海水资源
化学资源
水资源
新型能源
海水资源的开发利用
思路二
分离出盐分
一、海水水资源的开发利用
1. 海水资源的特点
广阔性
多样性
分散性
电渗析法
离子交换法
反渗析法
2. 利用途径及海水淡化方法
海水淡化
思路一
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
电渗析法
离子交换法
蒸馏法
海水的蒸馏
(1)主要仪器:
A , B_________,C_______。
(2)冷却水的流向: 口进, 口出。
(3)B中加入碎瓷片的目的是
。
直行冷凝管
蒸馏烧瓶
锥形瓶
a
b
防止液体暴沸
(1)蒸馏烧瓶须垫石棉网加热 ; 所盛液体不能超过容量的。
(2)温度计的水银球在烧瓶支管口处;量程应高于馏分的最高沸点。
注意事项
(最先使用,技术成熟,但成本高)
二、海水中化学资源的开发利用
从海水中制得氯化钠除了食用外,还有什么用途?
制备这些化工原料的反应原理?
交流讨论
NaCl
烧碱
纯碱
钠
氯气
氯化氢
二、海水中化学资源的开发利用
1. 海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
二、海水中化学资源的开发利用
2. 海水提溴
(1) 海水提溴的方法(吹出法)
二、海水中化学资源的开发利用
2. 海水提溴
(1) 海水提溴的方法(吹出法)
工艺流程:
基本操作:浓缩、氧化、吹出、吸收、蒸馏
(2) 氧化、吸收环节主要反应的离子方程式:
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===4H++ +2Br-
①分解贝壳(主要成分是CaCO3)、制备Ca(OH)2:
______________________,____________________。
CaO+H2O===Ca(OH)2
3.海水提镁
下图为海水提镁的工艺流程,
写出下列步骤中的化学方程式。
②沉淀Mg2+:_________________________(离子方程式)。
③制备MgCl2:______________________________。
④制取Mg:___________________________。
Mg2++2OH-===Mg(OH)2↓
Mg(OH)2+2HCl===MgCl2+2H2O
CaCO3 ==== CaO+CO2↑
高温
MgCl2(熔融) ==== Mg+Cl2↑
电解
4.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
(1)实验步骤①会用到下列仪器中的____(填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤③操作的名称是_____。
(3)步骤④中反应的离子方程式为___________________________。
acd
2I-+H2O2+2H+===I2+2H2O
过滤
灼烧海带
分离得到海带灰悬浊液中的溶液
4.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
(4)请设计一种检验水溶液中是否含有碘单质的方法:
_______________________________________________________________________________________________________________。
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤____(填序号)中实现与碘分离。
取适量水溶液于试管中,加入淀粉溶液,观察溶液是否变蓝,若变蓝则说明水溶液中含有碘单质,反之则不含
由于淀粉遇碘单质变蓝,故可以用淀粉溶液来检验水溶液中是否含碘单质。
⑤
萃取、分液
第3课时 煤、石油和天然气的综合利用
第八章 化学与可持续发展 第一节 自然资源的开发利用
金属矿物
海水资源
化石燃料
迄今为止,煤、石油和天然气仍是人类使用的主要能源,同时它们也是重要的化工原料。如何实现化石燃料的综合利用,提高利用率,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战。
煤
石油
天然气
1. 煤的组成——有机物+少量无机物
主要元素 其他元素
C
H、O、N、S 等
【思考】煤直接作为燃料有什么缺点?
一、煤的综合利用
利用率低并污染环境。
COx、NOx、
SO2 、 烟尘等
煤的综合利用
煤的干馏
煤的气化
煤的液化
获得洁净的燃料和多种化工原料
——物尽其用,保护环境
一、煤的综合利用
2. 煤的综合利用
(1)煤的干馏:
将煤隔绝空气加强热使它分解的过程。
煤焦油
出炉煤气
焦炭
【思考】煤的干馏为什么要隔绝空气?
若不隔绝空气,在高温条件下,煤会在空气中燃烧。
2. 煤的综合利用
干馏产物 主要成分 主要用途
出炉 煤气 焦炉气 H2、CH4、乙烯、CO 气体燃料、化工原料
粗氨水 NH3、铵盐 化肥、炸药、染料、医药、农药、合成材料
粗苯 苯、甲苯、二甲苯
煤焦油 苯、甲苯、二甲苯
酚类、萘 染料、医药、农药、
合成材料
沥青 筑路材料、碳素电极
焦炭 碳 冶金、合成氨造气、电石、燃料
表8-1煤的干馏的重要产品和用途
2. 煤的综合利用
(2)煤的气化:
在一定条件下把煤转化为可燃性气体的过程。
主要反应是:
C(s)+H2O(g) CO(g)+H2(g)
高温
水煤气(管道煤气)
【思考】为什么一不小心将少量水洒在烧得通红的煤上时,火不但没有熄灭,反而烧得更旺?
(3) 煤的液化
在一定条件下将煤转化为液体燃料。
◆直接液化:
煤与氢气作用生成液体燃料。
◆间接液化:
先转化为CO和H2,再在催化剂作用合成甲醇等。
2. 煤的综合利用
C(s)+H2O(g) CO(g)+H2(g)
高温
CO + 2H2 CH3OH(甲醇)
催化剂
煤的综合利用
煤的综合利用
出炉煤气
煤焦油
焦炭
可燃性气体
液体燃料
水煤气
干馏
气化
+H2
直接液化
液化
苯、甲苯等
H2O(g)
水煤气
催化剂
甲醇
催化剂
+H2O
间接液化
【小结】
二、天然气的组成及其综合利用
2. 天然气的综合利用
(1) 主要成分:CH4
(2) 综合利用
清洁的化石燃料
化工原料
合成氨
生产甲醇
合成多碳有机物
CH4
CH3OH
天然气水合物(可燃冰)
可燃冰,也就是我们所说的天然气水合物(主要成分是甲烷),就是由天然气和水在高压低温的条件下形成的类冰状的结晶化合物。可燃冰主要分布在深海沉积物和陆源的永久冻土中。从外形上看上去,可燃冰就像是白色或浅灰色的冰雪晶体。这时候如果有火源,它可以像固体酒精一样被点燃,被称为“可燃冰”。
资料卡片
1.判断正误
(1)把煤加强热使之分解的过程为煤的干馏( )
(2)煤俗称煤炭,因此可看作碳元素形成的单质( )
(3)煤中含粗苯、煤焦油等物质,可通过蒸馏获取苯、甲苯等芳香烃( )
(4)在一定条件下,煤可以和氢气直接反应生成液体燃料( )
(5)煤的气化和液化都是物理变化( )
×
×
√
×
×
二、石油的综合利用、合成高分子材料
阅读教材,结合视频,归纳石油的物理性质及组成
交流讨论
黑色或深棕色粘稠状液体,有特殊气味,比水轻,不溶于水,没有固定沸点。
三、石油的综合利用
石油是由多种碳氢化合物组成的混合物。
石油的分馏
石油的催化裂化
石油裂解(深度裂化)
石油催化重整
石油的综合利用
原理:利用原油中各组分沸点的不同进行分离的过程。
分馏产物:
石油气
汽油、煤油、柴油等
蜡油、润滑油
重油(沥青等)
轻质液
体燃料
【思考】用什么方法分离重油?为什么?
减压蒸馏,减压是为了降低重油的
沸点,避免温度过高发生分解。
1.石油的分馏
干馏 蒸馏 分馏
原理
产物
反应类型
隔绝空气、加强热使物质分解
根据液态混合物中各组分沸点不同进行分离
与蒸馏原理相同
产物为混合物
产物为单一组分的纯净物
产物为沸点相近的各组分组成的混合物
化学变化
物理变化
物理变化
化学“三馏”的比较
裂化的目的:提高轻质汽油的产量。
相对分子质量大
沸点高的烃
相对分子质量小
沸点较低的烃
断裂
原料:重油、石蜡
产物:汽油、煤油、柴油、润滑油等
C16H34
十六烷
C8H18
辛烷
+
C8H16
辛烯
催化剂
加热、加压
裂化汽油(含烯烃、烷烃)
2.石油的裂化
C8H18
辛烷
C4H10
丁烷
+
C4H8
丁烯
催化剂
加热、加压
3.石油的裂解—深度的裂化
原理:采用比裂化更高的温度,使其中相对分子质量较大的长链烃断裂成乙烯、丙烯等短链烃。
主要产物:乙烯、丙烯、甲烷等重要化工基本原料。
C4H10
丁烷
CH4
甲烷
+
C3H6
丙烯
催化剂
加热、加压
C2H6
乙烷
C4H10
丁烷
+
C2H4
乙烯
催化剂
加热、加压
在加热和催化剂的作用下,可以通过结构的重新调整,使链状烃转化为环状烃,如苯、甲苯等。
目的:1. 提高汽油的辛烷值 2. 制取芳香烃。
4.催化重整
煤、天然气、石油的综合利用
高分子材料
基础化工原料
更高价值生活用品
塑料
合成橡胶
合成纤维
1.加聚反应
2.缩聚反应
纺织品
药品
日用化学品
1.判断正误
(1)石油的分馏为物理变化,获取的各种产品为混合物( )
(2)石油的裂化和裂解原理相同,目的也相同( )
(3)含4个碳原子的烷烃,经催化裂解后,只能生成2种气态烃( )
(4)许多性能优异的合成高分子材料的原始原料为煤、石油和天然气( )
×
√
×
√
2.生活中汽车的车用燃料一般为裂化汽油。这种汽油和直馏汽油在组成上的区别是___________________________________________________________。
鉴别它们的方法是:___________________________________________________
___________________________________。
直馏汽油主要是饱和烃的混合物,裂化汽油中含不饱和烃
各取少许于试管中,加入溴的四氯化碳溶液,不褪色的是
直馏汽油,褪色的是裂化汽油
3.目前,多数石油产品仍作为燃料使用,如把石油产品用来合成高分子材料,其价值将成倍提升,试写出用汽油[主要成分为辛烷(C8H18)]为原料生成聚乙烯塑料的合成原理。
C8H18 C4H10+C4H8,
辛烷 丁烷 丁烯
C4H10 C2H4+C2H6,
丁烷 乙烯 乙烷
nCH2==CH2 —CH2—CH2—。
[ ]n
4.下列有关石油加工的叙述不正确的是
A.石油分馏所得的馏分仍是混合物
B.石油裂化的原料是石油的分馏产品,包括石油气
C.石油裂化的主要目的是获得更多汽油等轻质油
D.石油裂解的主要目的是获得乙烯、丙烯、甲烷等化工原料
石油裂化和裂解都是长链烃变成短链烃的过程,裂解是深度裂化
石油裂化的原料是石油的分馏产品重油。
√
5.(2021·合肥高一期末)下列说法正确的是
A.石油的分馏、裂化、裂解均属于化学变化
B.煤的干馏、气化、液化均属于物理变化
C.汽油、煤油、柴油、聚乙烯均是纯净物
D.石油在加热和催化剂的作用下可使烃分子重整生成苯、甲苯等有机物
裂化、裂解均属于化学变化,分馏属于物理变化
三者均有新物质生成,属于化学变化
以上均为是混合物
√
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
