第2章元素与物质世界检测题(含解析)高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章元素与物质世界检测题(含解析)高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 703.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 09:23:44 | ||
图片预览


文档简介
第2章《元素与物质世界》检测题
一、单选题
1.下列离子方程式中,正确的是
A.稀硫酸除铁锈:Fe2O3+6H+=Fe3++3H2O
B.稀盐酸与银反应:2H++2Cl-+2Ag=2AgCl↓+H2↑
C.硫酸氢钠与氢氧化钾溶液反应:H++OH-=H2O
D.湿法炼铜原理:2Fe+3Cu2+=2Fe3++3Cu
2.某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,则下列说法错误的是
A.Cl2是该反应的氧化产物
B.氧化剂和还原剂的物质的量之比为1∶14
C.当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol
D.由该反应可知还原性:HCl>CrCl3
3.CaO常用于食品的干燥。CaO属于( )
A.碱 B.酸 C.盐 D.氧化物
4.在NaIO3的碱性溶液中通入氯气可以得到Na2H3IO6。下列有关该反应的说法错误的是
A.碱性条件下,Na2H3IO6的氧化性强于氯气
B.在该反应中NaIO3作还原剂
C.反应中生成lmolNa2H3IO6转移2mol电子
D.反应中氧化产物与还原产物的物质的量之比为1∶2
5.ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度 ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产 ClO2和NaClO2的工艺流程为∶
ClO2发生器中反应为(未配平),下列有关该反应的说法中,正确的是
A.反应中 Na2SO3是氧化剂
B.反应中 ClO2是氧化产物
C.每生成1 mol ClO2转移2 mol 电子
D.参加反应的NaClO3和Na2SO3的物质的量之比为2:1
6.下列物质中属于电解质的是( )
A.(NH4)2SO4 B.NH3 C.酒精 D.NaCl溶液
7.下列离子方程式正确的是
A.与氢碘酸反应:
B.向溶液中滴加溶液,至混合溶液恰好为中性:
C.中加稀硫酸:
D.向溶液中通入等量
8.下列离子方程式书写正确的是
A.硫化亚铁溶于稀硝酸中
B.硝酸铝溶液中加入过量氨水
C.Al粉加入足量的NaOH溶液中
D.溶液与足量HI溶液反应
9.为制取含浓度较高的溶液,下列图示装置和原理均正确,且能达到实验目的的是
A.制取氯气 B.制取氯水 C.提高浓度 D.过滤
A.A B.B C.C D.D
10.下列有关说法正确的是( )
A.每种元素在自然界都能以游离态和化合态两种形式存在
B.金属氧化物一定是碱性氧化物,非金属氧化物不一定是酸性氧化物
C.碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物
D.含氢元素的化合物不一定是酸
11.下列四种物质的溶液,其中一种与其他三种均能发生离子反应,这种物质是( )
A.KOH B.H2SO4 C.BaCl2 D.Na2CO3
12.如图是电解质导电实验装置,接通电源后,下列说法正确的是
A.CuSO4、NaCl均为电解质,灯泡亮起来
B.在NaCl粉末中加入适量水,灯泡会亮起来
C.CuSO4的电离方程式:CuSO4Cu2++SO
D.将NaCl(s)改为NaCl溶液,在CuSO4溶液中加入少量NaOH固体,灯泡明显变暗
13.化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是
A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
C.化工厂用电解法制备氯气 D.炼油厂用分馏法生产汽油
14.下列离子方程式中,正确的是( )
A.钠和水反应:Na+H2O=Na++OH+H2↑
B.FeCl3溶液中加入足量的氨水:Fe3++ 3OH- = Fe(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3++ Fe = 2 Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
15.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.28 g氮气含有的原子数为NA
B.标准状况下,44.8 L H2O中含有的水分子数为2 NA
C.1 mol 铁与足量的稀盐酸反应,失去的电子数为2 NA
D.0.5 mol/L Fe2(SO4)3 溶液中,SO的数目为1. 5 NA
二、填空题
16.(1)根据分散质粒子的直径大小对分散系进行分类,分散质粒子直径为___的分散系是胶体。
(2)制备氢氧化铁胶体:取一小烧杯加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴___,继续煮沸至___,停止加热。
(3)丁达尔效应可用来区分___和___。
17.2021年7月,第32届奥运会在东京召开,我国运动健儿在奥运会上取得了非凡的成绩。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式_______。
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是_______(填序号)。
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是_______(填序号)。
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式_______。
三、实验题
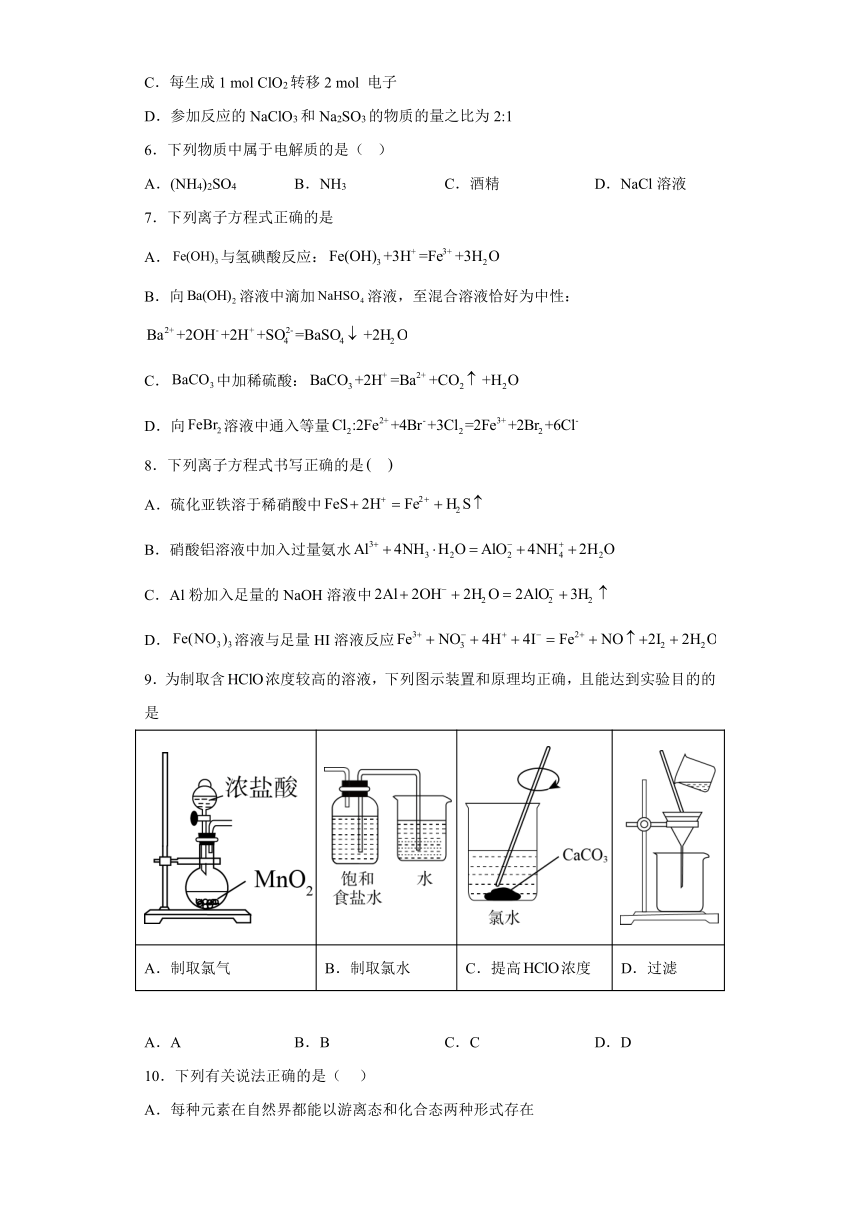
18.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示(部分夹持装置已略去)。
(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是___________(填序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________、___________。
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________(填化学式)。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当澄清石灰水过量时,反应的离子方程式为___________。此反应中1mol碳酸氢钠参加反应,生成沉淀质量为___________克。
②当碳酸氢钠与氢氧化钙的物质的量之比为2∶1时,所得溶液中溶质的化学式___________,请设计实验检验所得溶液中溶质的阴离子:___________。
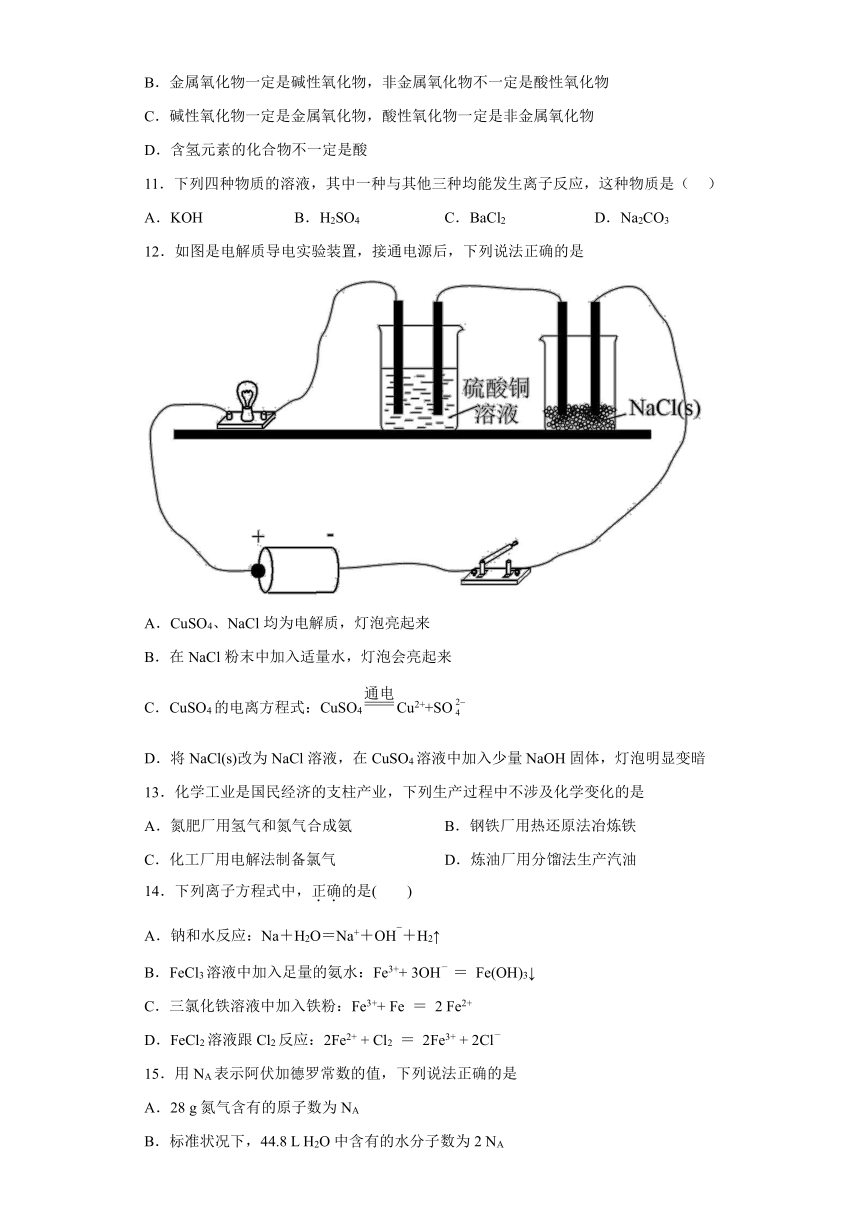
19.实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)若关闭装置中的让水夹后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,试判断装置是否漏气___________(填“漏气”、“不漏气”或“无法确定”)
(2)若装置是不漏气的,用上述装置进行实验。写出C装置中反应的化学方程式:___________。Na2O2是由___________构成的
(3)写出A中发生反应的化学方程式,并用双线桥标出化合价变化情况、电子转移的方向和数目及被氧化还原情况___________
(4)B装置中盛放的试剂是___________,其作用是___________D仪器名称是___________
四、计算题
20.氧化还原反应是一类重要的化学反应,在工农生产科学技术和日常生活中都有广泛的应用。
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:___________。
②毒性较强,常用NaHSO3处理工业废水中的,请配平该反应___________。□H++□+□=口Cr3++□+□H2O
(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为+4Cl2 +5H2O=2+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为______。
②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为_______________。
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度____,判断其 血液含钙量__________(填“正常”或“不正常”)。(已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)
21.甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
①写出铜与浓硝酸反应的化学方程式_______。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且只被还原成NO。则
①反应结束后的溶液中、的物质的量之比为_______。
②标准状况下,计算生成NO气体的体积_______。
参考答案:
1.C
【详解】
A.铁锈的主要成分为Fe2O3,可以用稀硫酸去除,但选项中的离子方程式没有配平,正确的离子方程式为Fe2O3+6H+=2Fe3++3H2O,A错误;
B.Ag的活动性较弱,与稀盐酸不发生反应,B错误;
C.硫酸氢钠在溶液中可以电离出H+,溶液中的H+可以和KOH电离出的OH-反应生成水,而其他离子互不反应,故反应的离子方程式正确,C正确;
D.湿法炼铜是用活泼金属Fe将铜盐中的铜置换出来,反应的离子方程式为Fe+Cu2+=Fe2++Cu,D错误;
故选C。
2.B
【详解】由信息可知,发生的反应为K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,反应中部分氯元素的化合价由-1价变为0价,铬元素的化合价由+6价变为+3价,
A.Cl元素的化合价升高,则Cl2是该反应的氧化产物,故A正确;
B.Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故B错误;
C.当转移0.2mol电子时,被氧化的还原剂HCl的物质的量为=0.2mol,故C正确;
D.该反应中还原剂为HCl,还原产物为CrCl3,还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故D正确;
综上所述,答案为B。
3.D
【详解】氧化物是由两种元素组成,其中一种必为氧元素;氧化钙是由钙元素和氧元素组成,所以氧化钙属于氧化物,故D正确;
故答案选D。
4.A
【详解】由向NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6可知,反应中I元素的化合价由+5价升高为+7价,Cl元素的化合价由0降低为-1价;
A.该反应中I的化合价升高,Cl的化合价降低,则碱性条件下,氯气的氧化性强于Na2H3IO6的氧化性,故A错误;
B.因I元素的化合价升高,则在该反应中NaIO3作还原剂,故B正确;
C.反应中生成1 mol Na2H3IO6转移1mol×(7-5)=2mol电子,故C正确;
D.NaIO3中I元素的化合价升高了2,Cl2中Cl的化合价降低了1,由电子守恒可知,1 Na2H3IO6~2Cl-,反应中氧化产物与还原产物的物质的量之比为1∶2,故D正确;
故选:A。
5.D
【详解】A.在NaClO3+Na2SO3+H2SO4→Na2SO4+ClO2↑+H2O中,Na2SO3中硫的化合价为+4价,反应后生成Na2SO4,硫的化合价为+6价,化合价升高,失去电子,做还原剂,故A错误;
B.氯元素的化合价从反应前NaClO3中的+5价降低到ClO2中的+4价,化合价降低,得到电子,发生还原反应,所以ClO2是还原产物,故B错误;
C.氯元素的化合价从+5价降低到+4价,生成1 mol ClO2转移1 mol电子,故C错误;
D.1 mol Na2SO3参加反应,失去2mol电子,1 mol NaClO3参加反应,得到1 mol电子,在氧化还原反应中,得失电子总数相等,所以参加反应的NaClO3和Na2SO3的物质的量之比为2:1,故D正确;
故选D。
6.A
【分析】在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,注意电解质首先必须是化合物。
【详解】A. (NH4)2SO4在水溶液里能电离出自由移动的阴阳离子而使其溶液导电,所以(NH4)2SO4是电解质,A项正确;
B. NH3在水溶液虽然导电,但不是本身导电,属于非电解质,B项错误;
C. 酒精在水溶液里以分子存在,所以其水溶液不导电,酒精是非电解质,C项错误;
D. NaCl溶液属于混合物,既不是电解质,也不是非电解质,D项错误;
答案选A。
【点睛】掌握电解质的判断方法与物质导电的原因是解此题的关键。需要注意的是,判断给出的物质是不是电解质要先判断该物质属不属于化合物,若为化合物,再进一步该物质再判断特定条件(或者熔融状态)下能否导电,进而做出最终判断,若是单质或者混合物,则一定不属于电解质。此外不能片面地认为能导电的物质就是电解质。
7.B
【详解】A.与氢碘酸反应,铁离子和碘离子发生氧化还原反应,离子方程式为:,故A错误;
B.溶液和溶液反应至混合溶液恰好为中性,离子方程式为,故B正确;
C.中加稀硫酸,生成硫酸钡和二氧化碳,离子方程式为:,故C错误;
D.向溶液中通入等量Cl2;先氧化还原性强的离子;设1mol,先有反应2Fe2+ +Cl2=2Fe3+ + 2Cl-,消耗1mol亚铁,0.5mol氯气;此式写成Fe2+ +0.5Cl2=Fe3+ + Cl-,
再有2Br- +Cl2 =Br2+2Cl-,消耗0.5mol氯气,反应掉1mol的溴离子,此式写成
Br- +0.5Cl2 =0.5Br2+Cl-,总离子方程式为,故D错误;
故答案选B。
8.C
【详解】解:硫化亚铁与稀硝酸发生氧化还原反应,正确的离子方程式为:,故A错误;
B.硝酸铝溶液中加入过量氨水,反应生成硝酸铵和氢氧化铝沉淀,正确的离子方程式为:,故B错误;
C.Al粉加入足量的NaOH溶液,反应生成偏铝酸钠和氢气,该反应的离子方程式为:,故C正确;
D.溶液中加入过量的HI溶液,二者发生氧化还原反应,正确的离子方程式为:,故D错误;
故选:C。
【点睛】注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
9.C
【详解】A.用浓盐酸与二氧化锰制取氯气时应该加热,该装置中缺少加热仪器,故A错误;
B.氯气中含有氯化氢,通入饱和食盐水的目的是除去氯气中的氯化氢,应该是长进短出,故B错误;
C.加入碳酸钙固体,HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,故C正确;
D.该装置中,漏掉下端没有紧靠烧杯内壁,操作不合理,故D错误;
故选C。
10.D
【分析】A. 活泼金属和非金属元素大多以化合态存在;
B. 金属氧化物可以是碱性氧化物、酸性氧化物或者两性氧化物,非金属氧化物可能是酸性氧化物或不成盐氧化物;
C. 碱性氧化物一定是金属氧化物,酸性氧化物可能是非金属氧化物,也可能是金属氧化物;
D. 含氢元素的化合物可能是酸,也可能是盐。
【详解】A. 活泼金属(如Na、K等)和非金属元素(如Cl、Br等)大多以化合态存在,A项错误;
B. 金属氧化物可以是碱性氧化物(如CaO)、酸性氧化物(Mn2O7)或者两性氧化物(Al2O3),非金属氧化物可能是酸性氧化物(SO2、CO2)或不成盐氧化物(NO、CO),B项错误;
C. 碱性氧化物一定是金属氧化物,酸性氧化物可能是非金属氧化物(SO2、CO2),也可能是金属氧化物(Mn2O7);
D. 含氢元素的化合物可能是酸(HCl、H2SO4),也可能是盐(NaHCO3),D项正确;
答案选D。
【点睛】解答本题时有关氧化物的性质是易错点,一般来说:
①金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
②非金属氧化物不一定是酸性氧化物,如NO、CO是不成盐氧化物。
③酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,也是酸性氧化物。
④碱性氧化物都是金属氧化物。
⑤酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱,如SiO2、Fe2O3都不溶于水,也不跟水反应。
⑥与碱反应生成盐和水的氧化物不一定是酸性氧化物,如2NO2+2NaOH===NaNO3+NaNO2+H2O,NO2不是酸性氧化物。
11.B
【详解】A.氢氧化钾与氯化钡、碳酸钠不反应,选项A错误;
B.硫酸与氢氧化钾反应生成硫酸钾和水、与氯化钡反应生成硫酸钡和盐酸、与碳酸钠反应生成硫酸钠、二氧化碳和水,故与三种物质都能发生离子反应,选项B正确;
C.氯化钡与氢氧化钾不反应,选项C错误;
D.碳酸钠与氢氧化钾不反应,选项D错误。
答案选B。
12.B
【详解】A.固体氯化钠中无自由移动离子,不导电,灯泡不亮,A项错误;
B.向中加水,氯化钠溶于水电离出,有自由移动的离子,能导电,灯泡会亮起来,B项正确;
C.电解质电离不需要通电,C项错误;
D.↓+2Na2SO4,因加入的为少量,部分转化为沉淀,同时有进入溶液,故灯泡亮度基本不变,D项错误;
答案选B。
13.D
【分析】化学变化是指在原子核不变的情况下,有新物质生成的变化。物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成。
【详解】A.氮肥厂用氢气和氮气合成氨有新物质氨生成,是化学变化,故A错误;
B.钢铁厂用热还原法冶炼铁有新物质铁生成,是化学变化,故B错误;
C.化工厂用电解法制备氯气有新物质铁生成,是化学变化,故C错误;
D.用分馏法生产汽油没有新物质生成,属于物理变化,故D正确;
故选D。
14.D
【详解】A.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.FeCl3溶液中加入足量的氨水,离子方程式:Fe3++3NH3 H2O═Fe(OH)3↓+3NH4+,故B错误;
C.三氯化铁溶液中加入铁粉,离子方程式:2Fe3++Fe═3Fe2+,故C错误;
D.FeCl2溶液跟Cl2反应,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D。
15.C
【详解】A.N2中所含原子的物质的量=,即2NA,A错误;
B.标准状况下,水为非气体,不能使用气体摩尔体积22.4 L/mol求算其物质的量,B错误;
C.Fe与盐酸反应生成FeCl2,转移电子物质的量=2n(Fe)=2 mol,即2NA,C正确;
D.由于溶液体积未知,无法求算与溶质相关的物质的量,D错误;
故答案选C。
16. 1~100nm FeCl3饱和溶液 呈红褐色 胶体 溶液
【详解】(1)分散质粒子直径为1~100nm的分散系是胶体;
(2)制备氢氧化铁胶体操作:取一小烧杯加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至呈红褐色,停止加热;
(3)丁达尔效应可用来区分胶体和溶液。
17.(1)
(2)A
(3)B
(4)(或)
【分析】(1)
氢气是可燃性气体,其燃烧产生H2O,该反应的化学方程式为:;
(2)
铅是金属单质,由Pb原子构成,故合理选项是A;
(3)
A.航空级铝合金跳板是合金,属于金属材料,A不符合题意; B.聚酯纤维泳衣属于有机合成材料,B符合题意;
C.金牌是金属材料,C不符合题意;
故合理选项是B;
(4)
①氯酸钾受撞击迅速分解产生氯化钾和氧气,反应方程式为;
红磷与O2在点燃时反应产生P2O5,反应的化学方程式为:。
18.(1)II
(2) 2NaHCO3Na2CO3+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O
(3)NaHCO3
(4) Ca2++OH-+HCO=CaCO3↓+H2O 100 Na2CO3 取少量所得溶液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根离子
【解析】(1)
图I不能达到实验目的,因为无论是碳酸钠还是碳酸氢钠均可以与盐酸反应产生二氧化碳,使澄清石灰水变浑浊;图II可以达到实验目的,因为等质量的碳酸钠和碳酸氢钠与足量的稀盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀大小鉴别;
(2)
碳酸钠受热不分解,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊,因此图III、IV所涉及反应的化学方程式为:2NaHCO3Na2CO3+H2O+CO2↑、CO2+Ca(OH)2=CaCO3↓+H2O;
(3)
试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,更能表明碳酸氢钠不稳定;
(4)
①当澄清石灰水过量时,碳酸氢钠与氢氧化钙反应的离子方程式为:Ca2++OH-+HCO=CaCO3↓+H2O;由离子方程式可知,当有1mol碳酸氢钠参加反应,生成1mol碳酸钙,因此沉淀质量为1mol100g/mol=100g;
②当碳酸氢钠与氢氧化钙的物质的量之比为2∶1时,反应的化学方程式为:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,则所得溶液中溶质是Na2CO3;所得溶液中溶质的阴离子是碳酸根离子,检验碳酸根离子的方法为:取少量所得溶液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根离子。
19.(1)漏气
(2) 2Na+O2Na2O2 离子键
(3)
(4) 浓硫酸 除去氧气中的水蒸气 干燥管
【解析】(1)
关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,说明装置漏气,因为漏斗中的液体能全部流入试管,说明试管中压强与外界相通而漏气;
(2)
若装置是不漏气的,用上述装置进行实验。在C装置中Na与O2在点燃时发生反应产生Na2O2,该反应的化学方程式为:2Na+O2Na2O2;
Na2O2是由Na+与通过离子键构成的离子化合物;
(3)
A装置中为Na2O2与H2O生成NaOH与O2,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑。在该反应中O元素化合价由反应前Na2O2中的-1价部分升高变为O2中的0价,化合价升高2×1=2价,失去电子2×e-,被氧化;O元素化合价部分由反应前Na2O2中的-1价降低变为NaOH中的-2价,化合价降低2×1=2价,得到电子2×e-,被还原,用双线桥法表示电子转移为: ;
(4)
A中用Na2O2与水反应制取O2,制得的O2中混有水蒸气,水蒸气会与Na反应,故应排除水蒸气的干扰,故B装置中盛放浓硫酸,其作用是除去氧气中的水蒸气;根据装置图可知仪器D的名称为干燥管,其中盛有碱石灰,其作用是防止空气中的二氧化碳和水蒸气进入装置C中。
20. V2O5+6H++2Cl-2VO2++Cl2↑+3H2O 5;1;3;;2;3;4 0.4NA或者2.408×1023 1:5 2.5×10-3 mol/L 正常
【详解】(1)①V2O5与沸腾的浓盐酸作用产生氯气和VO2+等,该反应的离子方程式为:V2O5+6H++2Cl-2VO2++Cl2↑+3H2O。
②配平方程式时,先利用得失电子守恒配平含变价元素的化学计量数,即得1+3=2Cr3++3,再依据电荷守恒和质量守恒配其它物质的化学计量数,从而得出配平的离子方程式为:5H++1+3=2Cr3++3+4H2O。答案为:V2O5+6H++2Cl-2VO2++Cl2↑+3H2O;5;1;3;;2;3;4;
(2)①在脱氯反应+4Cl2 +5H2O=2+ 10H++8Cl-中,可建立如下关系式:Cl2——2e-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为 =0.4NA或者2.408×1023。
②在反应KIO3+6HI=3I2+ KI +3H2O中,若有6molHI参加反应,则其中5mol表现出还原性,1mol表现出酸性,所以氧化剂和还原剂的物质的量之比为1:5。
③由反应方程式,可建立以下关系式:2KMnO4——5H2C2O4——5Ca2+,则n(Ca2+)==2.5×10-5mol,则此人血液中Ca2+的浓度为=2.5×10-3 mol/L;因为2.5×10-3 mol/L介于2.2×10-3 ~2.7×10-3 mol/L之间,所以其血液含钙量正常。答案为:0.4NA或者2.408×1023;1:5;2.5×10-3 mol/L;正常。
【点睛】分析氧化还原反应中物质表现的性质时,应从变价元素的寻找及化合价的确定切入。
21.(1) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 酸性、氧化性 9.8
(2) 1:3 1.68L
【详解】(1)①铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。该反应中2个硝酸分子得电子表现氧化性,2个硝酸分子元素化合价未变化表现酸性。
②试管b中完全反应,Cu全部转化为硝酸铜,向b液体中加入足量氢氧化钠溶液,生成氢氧化铜沉淀,6.4gCu为0.1mol,根据Cu守恒,可知生成Cu(OH)2为0.1mol即9.8g。
(2)①设反应结束后Fe3+有xmol,Fe2+有ymol,根据铁守恒,x+y=0.1mol,根据得失电子守恒,3x+2y=(0.3-3x-2y)×3,解得x=0.025,y=0.075,则n(Fe3+):n(Fe2+)=1:3。
②根据第一小问计算可知生成硝酸铁0.025mol,生成硝酸亚铁0.075mol,则根据N守恒,生成的NO为(0.3-0.025×3-0.075×2)=0.075mol,故生成NO标况下体积为0.075mol×22.4L/mol=1.68L。
一、单选题
1.下列离子方程式中,正确的是
A.稀硫酸除铁锈:Fe2O3+6H+=Fe3++3H2O
B.稀盐酸与银反应:2H++2Cl-+2Ag=2AgCl↓+H2↑
C.硫酸氢钠与氢氧化钾溶液反应:H++OH-=H2O
D.湿法炼铜原理:2Fe+3Cu2+=2Fe3++3Cu
2.某反应的反应物与生成物有K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性:K2Cr2O7>Cl2,则下列说法错误的是
A.Cl2是该反应的氧化产物
B.氧化剂和还原剂的物质的量之比为1∶14
C.当转移0.2 mol电子时,被氧化的还原剂的物质的量为0.2 mol
D.由该反应可知还原性:HCl>CrCl3
3.CaO常用于食品的干燥。CaO属于( )
A.碱 B.酸 C.盐 D.氧化物
4.在NaIO3的碱性溶液中通入氯气可以得到Na2H3IO6。下列有关该反应的说法错误的是
A.碱性条件下,Na2H3IO6的氧化性强于氯气
B.在该反应中NaIO3作还原剂
C.反应中生成lmolNa2H3IO6转移2mol电子
D.反应中氧化产物与还原产物的物质的量之比为1∶2
5.ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度 ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产 ClO2和NaClO2的工艺流程为∶
ClO2发生器中反应为(未配平),下列有关该反应的说法中,正确的是
A.反应中 Na2SO3是氧化剂
B.反应中 ClO2是氧化产物
C.每生成1 mol ClO2转移2 mol 电子
D.参加反应的NaClO3和Na2SO3的物质的量之比为2:1
6.下列物质中属于电解质的是( )
A.(NH4)2SO4 B.NH3 C.酒精 D.NaCl溶液
7.下列离子方程式正确的是
A.与氢碘酸反应:
B.向溶液中滴加溶液,至混合溶液恰好为中性:
C.中加稀硫酸:
D.向溶液中通入等量
8.下列离子方程式书写正确的是
A.硫化亚铁溶于稀硝酸中
B.硝酸铝溶液中加入过量氨水
C.Al粉加入足量的NaOH溶液中
D.溶液与足量HI溶液反应
9.为制取含浓度较高的溶液,下列图示装置和原理均正确,且能达到实验目的的是
A.制取氯气 B.制取氯水 C.提高浓度 D.过滤
A.A B.B C.C D.D
10.下列有关说法正确的是( )
A.每种元素在自然界都能以游离态和化合态两种形式存在
B.金属氧化物一定是碱性氧化物,非金属氧化物不一定是酸性氧化物
C.碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物
D.含氢元素的化合物不一定是酸
11.下列四种物质的溶液,其中一种与其他三种均能发生离子反应,这种物质是( )
A.KOH B.H2SO4 C.BaCl2 D.Na2CO3
12.如图是电解质导电实验装置,接通电源后,下列说法正确的是
A.CuSO4、NaCl均为电解质,灯泡亮起来
B.在NaCl粉末中加入适量水,灯泡会亮起来
C.CuSO4的电离方程式:CuSO4Cu2++SO
D.将NaCl(s)改为NaCl溶液,在CuSO4溶液中加入少量NaOH固体,灯泡明显变暗
13.化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是
A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
C.化工厂用电解法制备氯气 D.炼油厂用分馏法生产汽油
14.下列离子方程式中,正确的是( )
A.钠和水反应:Na+H2O=Na++OH+H2↑
B.FeCl3溶液中加入足量的氨水:Fe3++ 3OH- = Fe(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3++ Fe = 2 Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
15.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.28 g氮气含有的原子数为NA
B.标准状况下,44.8 L H2O中含有的水分子数为2 NA
C.1 mol 铁与足量的稀盐酸反应,失去的电子数为2 NA
D.0.5 mol/L Fe2(SO4)3 溶液中,SO的数目为1. 5 NA
二、填空题
16.(1)根据分散质粒子的直径大小对分散系进行分类,分散质粒子直径为___的分散系是胶体。
(2)制备氢氧化铁胶体:取一小烧杯加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴___,继续煮沸至___,停止加热。
(3)丁达尔效应可用来区分___和___。
17.2021年7月,第32届奥运会在东京召开,我国运动健儿在奥运会上取得了非凡的成绩。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式_______。
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是_______(填序号)。
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是_______(填序号)。
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式_______。
三、实验题
18.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示(部分夹持装置已略去)。
(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是___________(填序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________、___________。
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________(填化学式)。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当澄清石灰水过量时,反应的离子方程式为___________。此反应中1mol碳酸氢钠参加反应,生成沉淀质量为___________克。
②当碳酸氢钠与氢氧化钙的物质的量之比为2∶1时,所得溶液中溶质的化学式___________,请设计实验检验所得溶液中溶质的阴离子:___________。
19.实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
(1)若关闭装置中的让水夹后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,试判断装置是否漏气___________(填“漏气”、“不漏气”或“无法确定”)
(2)若装置是不漏气的,用上述装置进行实验。写出C装置中反应的化学方程式:___________。Na2O2是由___________构成的
(3)写出A中发生反应的化学方程式,并用双线桥标出化合价变化情况、电子转移的方向和数目及被氧化还原情况___________
(4)B装置中盛放的试剂是___________,其作用是___________D仪器名称是___________
四、计算题
20.氧化还原反应是一类重要的化学反应,在工农生产科学技术和日常生活中都有广泛的应用。
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:___________。
②毒性较强,常用NaHSO3处理工业废水中的,请配平该反应___________。□H++□+□=口Cr3++□+□H2O
(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为+4Cl2 +5H2O=2+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为______。
②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为_______________。
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度____,判断其 血液含钙量__________(填“正常”或“不正常”)。(已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)
21.甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
①写出铜与浓硝酸反应的化学方程式_______。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且只被还原成NO。则
①反应结束后的溶液中、的物质的量之比为_______。
②标准状况下,计算生成NO气体的体积_______。
参考答案:
1.C
【详解】
A.铁锈的主要成分为Fe2O3,可以用稀硫酸去除,但选项中的离子方程式没有配平,正确的离子方程式为Fe2O3+6H+=2Fe3++3H2O,A错误;
B.Ag的活动性较弱,与稀盐酸不发生反应,B错误;
C.硫酸氢钠在溶液中可以电离出H+,溶液中的H+可以和KOH电离出的OH-反应生成水,而其他离子互不反应,故反应的离子方程式正确,C正确;
D.湿法炼铜是用活泼金属Fe将铜盐中的铜置换出来,反应的离子方程式为Fe+Cu2+=Fe2++Cu,D错误;
故选C。
2.B
【详解】由信息可知,发生的反应为K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,反应中部分氯元素的化合价由-1价变为0价,铬元素的化合价由+6价变为+3价,
A.Cl元素的化合价升高,则Cl2是该反应的氧化产物,故A正确;
B.Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故B错误;
C.当转移0.2mol电子时,被氧化的还原剂HCl的物质的量为=0.2mol,故C正确;
D.该反应中还原剂为HCl,还原产物为CrCl3,还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故D正确;
综上所述,答案为B。
3.D
【详解】氧化物是由两种元素组成,其中一种必为氧元素;氧化钙是由钙元素和氧元素组成,所以氧化钙属于氧化物,故D正确;
故答案选D。
4.A
【详解】由向NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6可知,反应中I元素的化合价由+5价升高为+7价,Cl元素的化合价由0降低为-1价;
A.该反应中I的化合价升高,Cl的化合价降低,则碱性条件下,氯气的氧化性强于Na2H3IO6的氧化性,故A错误;
B.因I元素的化合价升高,则在该反应中NaIO3作还原剂,故B正确;
C.反应中生成1 mol Na2H3IO6转移1mol×(7-5)=2mol电子,故C正确;
D.NaIO3中I元素的化合价升高了2,Cl2中Cl的化合价降低了1,由电子守恒可知,1 Na2H3IO6~2Cl-,反应中氧化产物与还原产物的物质的量之比为1∶2,故D正确;
故选:A。
5.D
【详解】A.在NaClO3+Na2SO3+H2SO4→Na2SO4+ClO2↑+H2O中,Na2SO3中硫的化合价为+4价,反应后生成Na2SO4,硫的化合价为+6价,化合价升高,失去电子,做还原剂,故A错误;
B.氯元素的化合价从反应前NaClO3中的+5价降低到ClO2中的+4价,化合价降低,得到电子,发生还原反应,所以ClO2是还原产物,故B错误;
C.氯元素的化合价从+5价降低到+4价,生成1 mol ClO2转移1 mol电子,故C错误;
D.1 mol Na2SO3参加反应,失去2mol电子,1 mol NaClO3参加反应,得到1 mol电子,在氧化还原反应中,得失电子总数相等,所以参加反应的NaClO3和Na2SO3的物质的量之比为2:1,故D正确;
故选D。
6.A
【分析】在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,注意电解质首先必须是化合物。
【详解】A. (NH4)2SO4在水溶液里能电离出自由移动的阴阳离子而使其溶液导电,所以(NH4)2SO4是电解质,A项正确;
B. NH3在水溶液虽然导电,但不是本身导电,属于非电解质,B项错误;
C. 酒精在水溶液里以分子存在,所以其水溶液不导电,酒精是非电解质,C项错误;
D. NaCl溶液属于混合物,既不是电解质,也不是非电解质,D项错误;
答案选A。
【点睛】掌握电解质的判断方法与物质导电的原因是解此题的关键。需要注意的是,判断给出的物质是不是电解质要先判断该物质属不属于化合物,若为化合物,再进一步该物质再判断特定条件(或者熔融状态)下能否导电,进而做出最终判断,若是单质或者混合物,则一定不属于电解质。此外不能片面地认为能导电的物质就是电解质。
7.B
【详解】A.与氢碘酸反应,铁离子和碘离子发生氧化还原反应,离子方程式为:,故A错误;
B.溶液和溶液反应至混合溶液恰好为中性,离子方程式为,故B正确;
C.中加稀硫酸,生成硫酸钡和二氧化碳,离子方程式为:,故C错误;
D.向溶液中通入等量Cl2;先氧化还原性强的离子;设1mol,先有反应2Fe2+ +Cl2=2Fe3+ + 2Cl-,消耗1mol亚铁,0.5mol氯气;此式写成Fe2+ +0.5Cl2=Fe3+ + Cl-,
再有2Br- +Cl2 =Br2+2Cl-,消耗0.5mol氯气,反应掉1mol的溴离子,此式写成
Br- +0.5Cl2 =0.5Br2+Cl-,总离子方程式为,故D错误;
故答案选B。
8.C
【详解】解:硫化亚铁与稀硝酸发生氧化还原反应,正确的离子方程式为:,故A错误;
B.硝酸铝溶液中加入过量氨水,反应生成硝酸铵和氢氧化铝沉淀,正确的离子方程式为:,故B错误;
C.Al粉加入足量的NaOH溶液,反应生成偏铝酸钠和氢气,该反应的离子方程式为:,故C正确;
D.溶液中加入过量的HI溶液,二者发生氧化还原反应,正确的离子方程式为:,故D错误;
故选:C。
【点睛】注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
9.C
【详解】A.用浓盐酸与二氧化锰制取氯气时应该加热,该装置中缺少加热仪器,故A错误;
B.氯气中含有氯化氢,通入饱和食盐水的目的是除去氯气中的氯化氢,应该是长进短出,故B错误;
C.加入碳酸钙固体,HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,故C正确;
D.该装置中,漏掉下端没有紧靠烧杯内壁,操作不合理,故D错误;
故选C。
10.D
【分析】A. 活泼金属和非金属元素大多以化合态存在;
B. 金属氧化物可以是碱性氧化物、酸性氧化物或者两性氧化物,非金属氧化物可能是酸性氧化物或不成盐氧化物;
C. 碱性氧化物一定是金属氧化物,酸性氧化物可能是非金属氧化物,也可能是金属氧化物;
D. 含氢元素的化合物可能是酸,也可能是盐。
【详解】A. 活泼金属(如Na、K等)和非金属元素(如Cl、Br等)大多以化合态存在,A项错误;
B. 金属氧化物可以是碱性氧化物(如CaO)、酸性氧化物(Mn2O7)或者两性氧化物(Al2O3),非金属氧化物可能是酸性氧化物(SO2、CO2)或不成盐氧化物(NO、CO),B项错误;
C. 碱性氧化物一定是金属氧化物,酸性氧化物可能是非金属氧化物(SO2、CO2),也可能是金属氧化物(Mn2O7);
D. 含氢元素的化合物可能是酸(HCl、H2SO4),也可能是盐(NaHCO3),D项正确;
答案选D。
【点睛】解答本题时有关氧化物的性质是易错点,一般来说:
①金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
②非金属氧化物不一定是酸性氧化物,如NO、CO是不成盐氧化物。
③酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,也是酸性氧化物。
④碱性氧化物都是金属氧化物。
⑤酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱,如SiO2、Fe2O3都不溶于水,也不跟水反应。
⑥与碱反应生成盐和水的氧化物不一定是酸性氧化物,如2NO2+2NaOH===NaNO3+NaNO2+H2O,NO2不是酸性氧化物。
11.B
【详解】A.氢氧化钾与氯化钡、碳酸钠不反应,选项A错误;
B.硫酸与氢氧化钾反应生成硫酸钾和水、与氯化钡反应生成硫酸钡和盐酸、与碳酸钠反应生成硫酸钠、二氧化碳和水,故与三种物质都能发生离子反应,选项B正确;
C.氯化钡与氢氧化钾不反应,选项C错误;
D.碳酸钠与氢氧化钾不反应,选项D错误。
答案选B。
12.B
【详解】A.固体氯化钠中无自由移动离子,不导电,灯泡不亮,A项错误;
B.向中加水,氯化钠溶于水电离出,有自由移动的离子,能导电,灯泡会亮起来,B项正确;
C.电解质电离不需要通电,C项错误;
D.↓+2Na2SO4,因加入的为少量,部分转化为沉淀,同时有进入溶液,故灯泡亮度基本不变,D项错误;
答案选B。
13.D
【分析】化学变化是指在原子核不变的情况下,有新物质生成的变化。物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成。
【详解】A.氮肥厂用氢气和氮气合成氨有新物质氨生成,是化学变化,故A错误;
B.钢铁厂用热还原法冶炼铁有新物质铁生成,是化学变化,故B错误;
C.化工厂用电解法制备氯气有新物质铁生成,是化学变化,故C错误;
D.用分馏法生产汽油没有新物质生成,属于物理变化,故D正确;
故选D。
14.D
【详解】A.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.FeCl3溶液中加入足量的氨水,离子方程式:Fe3++3NH3 H2O═Fe(OH)3↓+3NH4+,故B错误;
C.三氯化铁溶液中加入铁粉,离子方程式:2Fe3++Fe═3Fe2+,故C错误;
D.FeCl2溶液跟Cl2反应,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D。
15.C
【详解】A.N2中所含原子的物质的量=,即2NA,A错误;
B.标准状况下,水为非气体,不能使用气体摩尔体积22.4 L/mol求算其物质的量,B错误;
C.Fe与盐酸反应生成FeCl2,转移电子物质的量=2n(Fe)=2 mol,即2NA,C正确;
D.由于溶液体积未知,无法求算与溶质相关的物质的量,D错误;
故答案选C。
16. 1~100nm FeCl3饱和溶液 呈红褐色 胶体 溶液
【详解】(1)分散质粒子直径为1~100nm的分散系是胶体;
(2)制备氢氧化铁胶体操作:取一小烧杯加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至呈红褐色,停止加热;
(3)丁达尔效应可用来区分胶体和溶液。
17.(1)
(2)A
(3)B
(4)(或)
【分析】(1)
氢气是可燃性气体,其燃烧产生H2O,该反应的化学方程式为:;
(2)
铅是金属单质,由Pb原子构成,故合理选项是A;
(3)
A.航空级铝合金跳板是合金,属于金属材料,A不符合题意; B.聚酯纤维泳衣属于有机合成材料,B符合题意;
C.金牌是金属材料,C不符合题意;
故合理选项是B;
(4)
①氯酸钾受撞击迅速分解产生氯化钾和氧气,反应方程式为;
红磷与O2在点燃时反应产生P2O5,反应的化学方程式为:。
18.(1)II
(2) 2NaHCO3Na2CO3+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O
(3)NaHCO3
(4) Ca2++OH-+HCO=CaCO3↓+H2O 100 Na2CO3 取少量所得溶液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根离子
【解析】(1)
图I不能达到实验目的,因为无论是碳酸钠还是碳酸氢钠均可以与盐酸反应产生二氧化碳,使澄清石灰水变浑浊;图II可以达到实验目的,因为等质量的碳酸钠和碳酸氢钠与足量的稀盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀大小鉴别;
(2)
碳酸钠受热不分解,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊,因此图III、IV所涉及反应的化学方程式为:2NaHCO3Na2CO3+H2O+CO2↑、CO2+Ca(OH)2=CaCO3↓+H2O;
(3)
试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,更能表明碳酸氢钠不稳定;
(4)
①当澄清石灰水过量时,碳酸氢钠与氢氧化钙反应的离子方程式为:Ca2++OH-+HCO=CaCO3↓+H2O;由离子方程式可知,当有1mol碳酸氢钠参加反应,生成1mol碳酸钙,因此沉淀质量为1mol100g/mol=100g;
②当碳酸氢钠与氢氧化钙的物质的量之比为2∶1时,反应的化学方程式为:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,则所得溶液中溶质是Na2CO3;所得溶液中溶质的阴离子是碳酸根离子,检验碳酸根离子的方法为:取少量所得溶液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根离子。
19.(1)漏气
(2) 2Na+O2Na2O2 离子键
(3)
(4) 浓硫酸 除去氧气中的水蒸气 干燥管
【解析】(1)
关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,说明装置漏气,因为漏斗中的液体能全部流入试管,说明试管中压强与外界相通而漏气;
(2)
若装置是不漏气的,用上述装置进行实验。在C装置中Na与O2在点燃时发生反应产生Na2O2,该反应的化学方程式为:2Na+O2Na2O2;
Na2O2是由Na+与通过离子键构成的离子化合物;
(3)
A装置中为Na2O2与H2O生成NaOH与O2,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑。在该反应中O元素化合价由反应前Na2O2中的-1价部分升高变为O2中的0价,化合价升高2×1=2价,失去电子2×e-,被氧化;O元素化合价部分由反应前Na2O2中的-1价降低变为NaOH中的-2价,化合价降低2×1=2价,得到电子2×e-,被还原,用双线桥法表示电子转移为: ;
(4)
A中用Na2O2与水反应制取O2,制得的O2中混有水蒸气,水蒸气会与Na反应,故应排除水蒸气的干扰,故B装置中盛放浓硫酸,其作用是除去氧气中的水蒸气;根据装置图可知仪器D的名称为干燥管,其中盛有碱石灰,其作用是防止空气中的二氧化碳和水蒸气进入装置C中。
20. V2O5+6H++2Cl-2VO2++Cl2↑+3H2O 5;1;3;;2;3;4 0.4NA或者2.408×1023 1:5 2.5×10-3 mol/L 正常
【详解】(1)①V2O5与沸腾的浓盐酸作用产生氯气和VO2+等,该反应的离子方程式为:V2O5+6H++2Cl-2VO2++Cl2↑+3H2O。
②配平方程式时,先利用得失电子守恒配平含变价元素的化学计量数,即得1+3=2Cr3++3,再依据电荷守恒和质量守恒配其它物质的化学计量数,从而得出配平的离子方程式为:5H++1+3=2Cr3++3+4H2O。答案为:V2O5+6H++2Cl-2VO2++Cl2↑+3H2O;5;1;3;;2;3;4;
(2)①在脱氯反应+4Cl2 +5H2O=2+ 10H++8Cl-中,可建立如下关系式:Cl2——2e-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为 =0.4NA或者2.408×1023。
②在反应KIO3+6HI=3I2+ KI +3H2O中,若有6molHI参加反应,则其中5mol表现出还原性,1mol表现出酸性,所以氧化剂和还原剂的物质的量之比为1:5。
③由反应方程式,可建立以下关系式:2KMnO4——5H2C2O4——5Ca2+,则n(Ca2+)==2.5×10-5mol,则此人血液中Ca2+的浓度为=2.5×10-3 mol/L;因为2.5×10-3 mol/L介于2.2×10-3 ~2.7×10-3 mol/L之间,所以其血液含钙量正常。答案为:0.4NA或者2.408×1023;1:5;2.5×10-3 mol/L;正常。
【点睛】分析氧化还原反应中物质表现的性质时,应从变价元素的寻找及化合价的确定切入。
21.(1) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 酸性、氧化性 9.8
(2) 1:3 1.68L
【详解】(1)①铜与浓硝酸反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。该反应中2个硝酸分子得电子表现氧化性,2个硝酸分子元素化合价未变化表现酸性。
②试管b中完全反应,Cu全部转化为硝酸铜,向b液体中加入足量氢氧化钠溶液,生成氢氧化铜沉淀,6.4gCu为0.1mol,根据Cu守恒,可知生成Cu(OH)2为0.1mol即9.8g。
(2)①设反应结束后Fe3+有xmol,Fe2+有ymol,根据铁守恒,x+y=0.1mol,根据得失电子守恒,3x+2y=(0.3-3x-2y)×3,解得x=0.025,y=0.075,则n(Fe3+):n(Fe2+)=1:3。
②根据第一小问计算可知生成硝酸铁0.025mol,生成硝酸亚铁0.075mol,则根据N守恒,生成的NO为(0.3-0.025×3-0.075×2)=0.075mol,故生成NO标况下体积为0.075mol×22.4L/mol=1.68L。
