浙江省舟山市2023年学考专题突破之元素或物质推断题(含答案)
文档属性
| 名称 | 浙江省舟山市2023年学考专题突破之元素或物质推断题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 00:00:00 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
元素或物质推断题
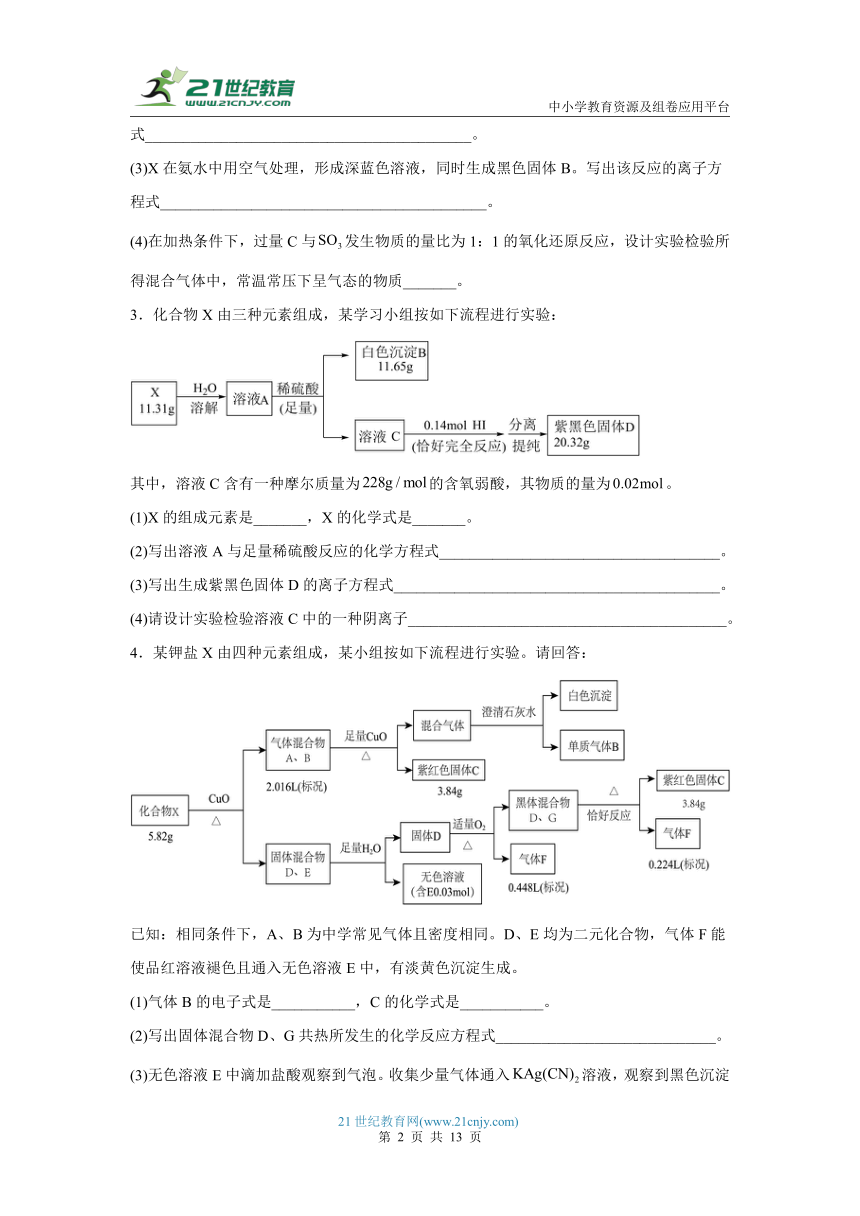
1.固体化合物由种前四周期的元素组成,某学习小组开展如下探究实验:
其中,固体煅烧时还会产生能使澄清石灰水变浑浊的气体;混合气体由两种化合物组成,均含有氧元素和另一种元素,且两种元素总质量比为:;气体是一种纯净物,可使湿润的红色石蕊试纸变蓝。
请回答:
(1)固体的化学式是 ______ 。
(2)写出反应的离子方程式 ______________________________ 。
(3)酸与气体的组成元素相同,相对分子质量为。已知:具有相同原子数和核外电子数的微粒结构相似,则酸的酸根电子式为 ______ 。
(4)将混合气体通入氨水中,恰好完全反应,得到的溶液呈酸性,原因为 ____________________________________ 。用文字说明原因
(5)煅烧固体同时生成一种无色的气体,将过量的通入溶液中,产生白色沉淀。实验验证反应后溶液中主要的阴离子 __________________________________________ 。
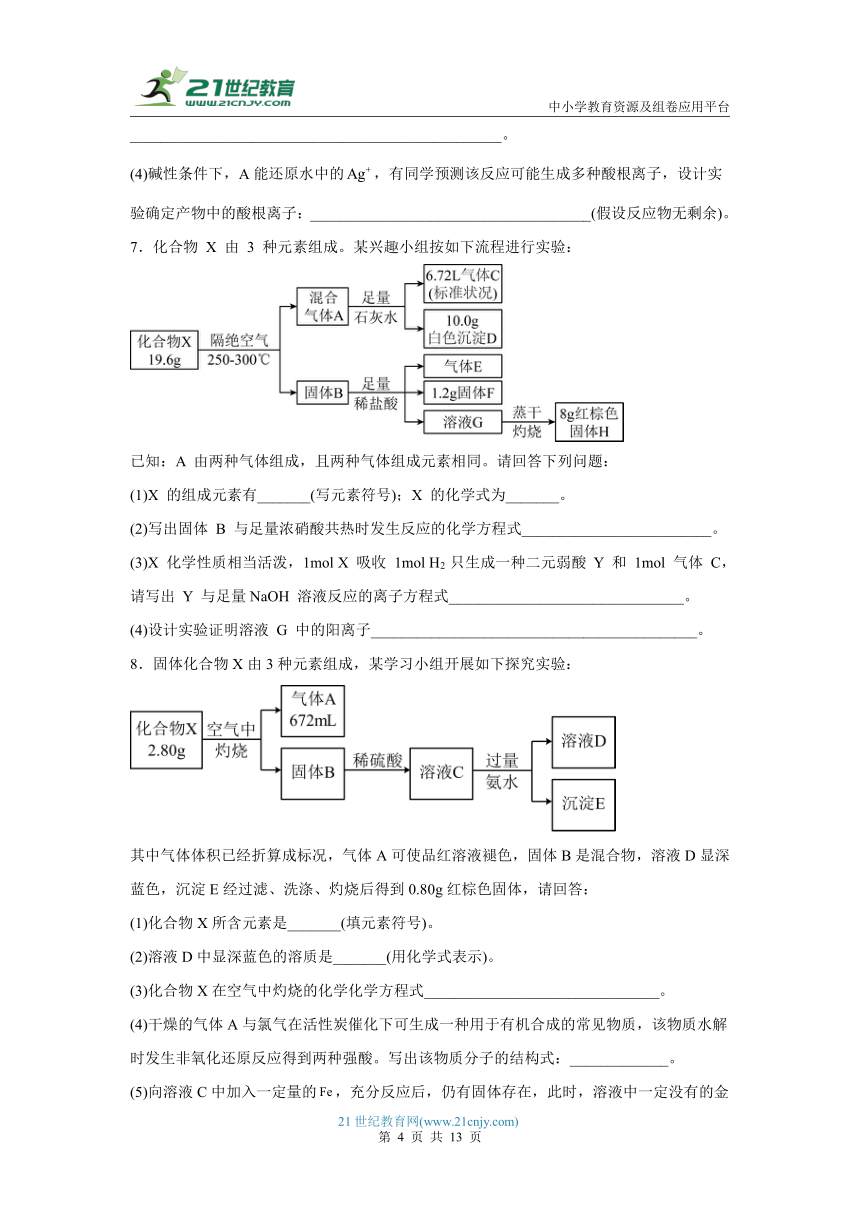
2.固体化合物X(式量介于100~160之间)由两种元素组成,某实验小组按如下流程进行相关实验:
已知:固体单质B为黑色,溶液D中除盐酸外仅有一种含氯的一元弱酸。请回答下列问题:
(1)X的化学式为_______;A、B分别为_______ (写名称)。
(2)绿色溶液E中除、外的主要离子有_______。写出单质A与浓盐酸反应的离子方程式___________________________________________。
(3)X在氨水中用空气处理,形成深蓝色溶液,同时生成黑色固体B。写出该反应的离子方程式___________________________________________。
(4)在加热条件下,过量C与发生物质的量比为1:1的氧化还原反应,设计实验检验所得混合气体中,常温常压下呈气态的物质_______。
3.化合物X由三种元素组成,某学习小组按如下流程进行实验:
其中,溶液C含有一种摩尔质量为的含氧弱酸,其物质的量为。
(1)X的组成元素是_______,X的化学式是_______。
(2)写出溶液A与足量稀硫酸反应的化学方程式_____________________________________。
(3)写出生成紫黑色固体D的离子方程式___________________________________________。
(4)请设计实验检验溶液C中的一种阴离子__________________________________________。
4.某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答:
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是___________,C的化学式是___________。
(2)写出固体混合物D、G共热所发生的化学反应方程式_____________________________。
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)_______________________。
(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子_________________。
5.固体化合物A由4种短周期元素组成,某实验小组按如下流程进行相关实验:
流程中固体、气体均为纯净物,溶液中均为单一成分溶质,其中气体A的分子空间构型为三角锥形,气体C可使带火星木条复燃,所有数据均在标准状况下测得,流程中的反应均充分进行。请回答:
(1)组成固体A的4种元素是_______(填元素符号),气体B的结构式为_______。
(2)写出反应①的离子方程式___________________________________________;
(3)写出反应②的化学方程式___________________________________________。
(4)白色沉淀A、B、C的样品标签遗失,请设计实验方案检验三种沉淀的成分_______________
______________________________________________________________________________。
6.物质A由三种常见的元素组成,某兴趣小组进行了如下实验:
已知:A的摩尔质量在之间,焰色为紫色;气体B能使品红溶液褪色;盐C和盐D的组成元素和A相同,且C、D的物质的量之比为。
请回答下列问题:
(1)组成A的元素有_______;A的化学式为_______。
(2)A在潮湿空气中转化为由两种酸式盐组成的混合物,反应的化学方程式是_____________。
(3)一种生产A的方法:在35~45℃下,气体B与锌粉—水悬浊液反应生成中间产物;然后加入相应的碱溶液,充分反应,过滤分离得到A溶液。写出该过程中总反应的化学方程式:_________________________________________________。
(4)碱性条件下,A能还原水中的,有同学预测该反应可能生成多种酸根离子,设计实验确定产物中的酸根离子:_____________________________________(假设反应物无剩余)。
7.化合物 X 由 3 种元素组成。某兴趣小组按如下流程进行实验:
已知:A 由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X 的组成元素有_______(写元素符号);X 的化学式为_______。
(2)写出固体 B 与足量浓硝酸共热时发生反应的化学方程式_________________________。
(3)X 化学性质相当活泼,1mol X 吸收 1mol H2 只生成一种二元弱酸 Y 和 1mol 气体 C,请写出 Y 与足量NaOH 溶液反应的离子方程式_______________________________。
(4)设计实验证明溶液 G 中的阳离子___________________________________________。
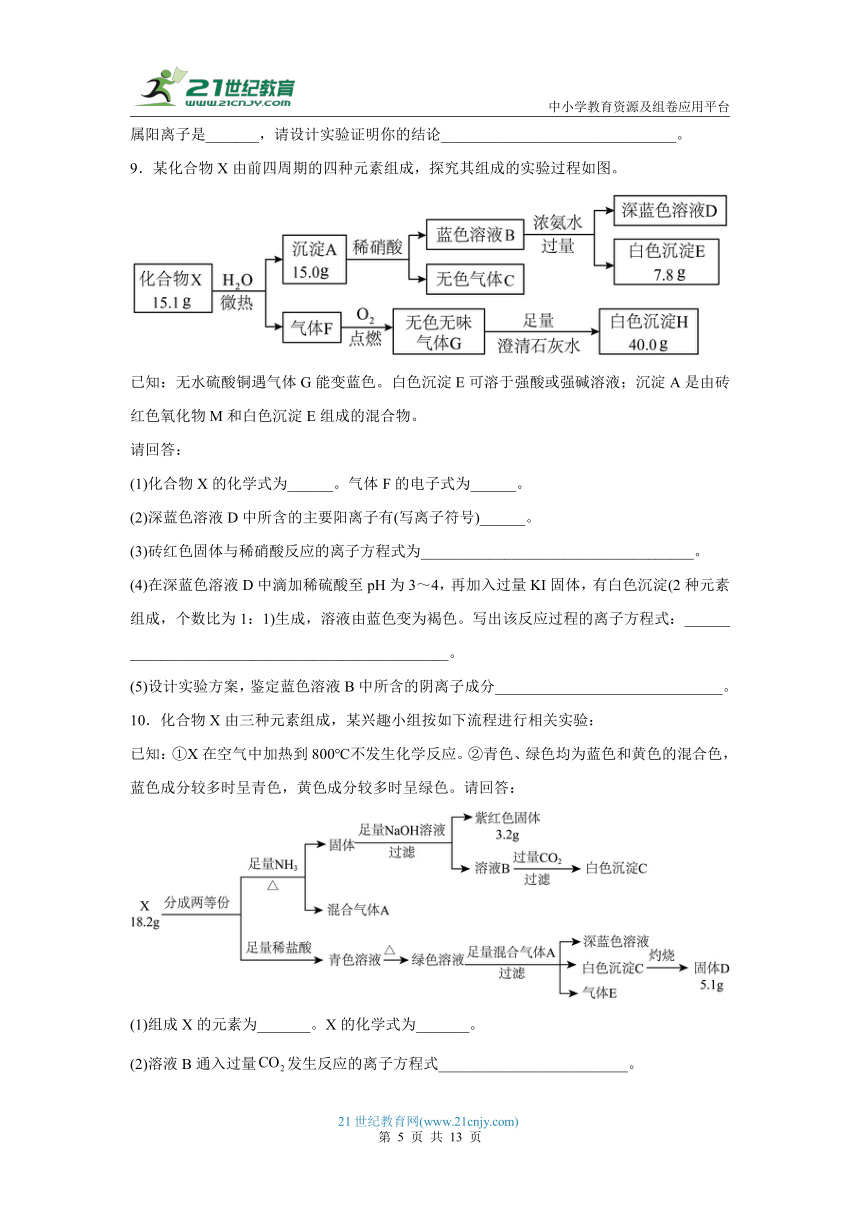
8.固体化合物X由3种元素组成,某学习小组开展如下探究实验:
其中气体体积已经折算成标况,气体A可使品红溶液褪色,固体B是混合物,溶液D显深蓝色,沉淀E经过滤、洗涤、灼烧后得到0.80g红棕色固体,请回答:
(1)化合物X所含元素是_______(填元素符号)。
(2)溶液D中显深蓝色的溶质是_______(用化学式表示)。
(3)化合物X在空气中灼烧的化学化学方程式_______________________________。
(4)干燥的气体A与氯气在活性炭催化下可生成一种用于有机合成的常见物质,该物质水解时发生非氧化还原反应得到两种强酸。写出该物质分子的结构式:_____________。
(5)向溶液C中加入一定量的,充分反应后,仍有固体存在,此时,溶液中一定没有的金属阳离子是_______,请设计实验证明你的结论_______________________________。
9.某化合物X由前四周期的四种元素组成,探究其组成的实验过程如图。
已知:无水硫酸铜遇气体G能变蓝色。白色沉淀E可溶于强酸或强碱溶液;沉淀A是由砖红色氧化物M和白色沉淀E组成的混合物。
请回答:
(1)化合物X的化学式为______。气体F的电子式为______。
(2)深蓝色溶液D中所含的主要阳离子有(写离子符号)______。
(3)砖红色固体与稀硝酸反应的离子方程式为____________________________________。
(4)在深蓝色溶液D中滴加稀硫酸至pH为3~4,再加入过量KI固体,有白色沉淀(2种元素组成,个数比为1:1)生成,溶液由蓝色变为褐色。写出该反应过程的离子方程式:______
__________________________________________。
(5)设计实验方案,鉴定蓝色溶液B中所含的阴离子成分______________________________。
10.化合物X由三种元素组成,某兴趣小组按如下流程进行相关实验:
已知:①X在空气中加热到800℃不发生化学反应。②青色、绿色均为蓝色和黄色的混合色,蓝色成分较多时呈青色,黄色成分较多时呈绿色。请回答:
(1)组成X的元素为_______。X的化学式为_______。
(2)溶液B通入过量发生反应的离子方程式_________________________。
(3)青色溶液转化为绿色溶液的原因(结合离子方程式说明)_____________________________。
(4)绿色溶液转化为深蓝色溶液发生的主要化学方程式_______________________________。
(5)气体E与镁在一定条件下可反应,将产物溶于过量盐酸,设计实验检验溶液中含有的阳离子(除外):_____________________________________________________________。
11.化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
已知:X、A、B、C、D均为单一物质,且固体B隔绝空气加热不发生反应。
请回答:
(1)组成X的三种元素为___________;X的化学式为___________。
(2)溶液2的溶质组成为___________(用化学式表示)。
(3)由X到A和B的化学方程式为___________________________________;黑色固体D可缓慢溶于浓氨水,写出该反应的离子方程式_________________________________________。
(4)设计实验,检验溶液5中的阴离子:_________________________________________。
12.固体X是四种短周期元素组成的化合物,X的性质与铵盐相似。为探究固体X的组成,取3.28g X,与含NaOH 0.04mol的溶液恰好发生复分解反应,得溶液A(溶液A中含两种溶质,其中一种溶质的相对分子质量为33),将溶液A分成和两等份,完成如下实验(与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
(1)组成X的四种元素是_________(填元素符号),X的化学式为_________。
(2)A中某种溶质与AgBr反应可生成两种单质,化学方程式为_____________________。
(3)写出X的水溶液与溶液反应生成白色沉淀的离子方程式:_______________。
(4)为探究和NaOH的反应,设计实验方案如下:向含的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则与NaOH的反应可能为_________________________________(写离子方程式);若无沉淀生成,则与NaOH的反应可能为_______________________________________(写离子方程式)。该实验方案有无不妥之处?若有,提出修正意见:___________________________。
13.某研究小组探究白色难溶盐X(含五种元素,M<200g·mol-1)的组成,进行如下实验:
已知:固体A为常见单质;气体B能使品红褪色,实验测得气体体积为3.36L(标准状况),为防止污染环境,实验过程中用NaClO溶液吸收;溶液E中含有两种溶质,且阴离子相同。
请回答下列问题:
(1)X除含有H、O元素,还含有_______元素,X的化学式为_______。
(2)混合溶液C中的溶质主要有_______(填化学式)。
(3)可用气体B通入深蓝色溶液E制备X,写出相应的离子方程式___________________。
(4)设计实验方案证明吸收气体B的NaClO溶液已过量:_________________________。
14.X通常状况下是一种红黄色气体,相对分子质量小于100,含有三种常见短周期元素。为研究X的组成,5.895g的X分三等份进行实验,过程如下(气体体积已折算至标准状况):
请回答:
(1)X的化学式为_______。溶液A的成分为_______。
(2)X与反应的化学方程式为_____________________________________。
(3)金(Au)可溶于浓B溶液生成C和金的一价配离子(与具有相同的空间结构),写出该反应的化学方程式:___________________________________________。
(4)设计一个实验方案,探究溶液F中溶质的阳离子成分:_________________________。
15.为探究矿物(含三种常见元素)的组成和性质,某兴趣小组设计了如下实验:已知实验中所用试剂均足量,固体B是一种单质和化合物的混合物,请回答如下问题:
(1)X所含元素的名称为:_______。
(2)溴水是否可以用酸化的双氧水代替,若不可行,请说明理由,若可行,请写出反应的离子方程式:_______________________________。
(3)检验溶液G中的金属阳离子的实验方案:_____________________________________。
(4)溶液G转化为沉淀H的现象_________________________________________________。
(5)X在高温下与氧气充分反应的化学方程式:_____________________________________。
参考答案:
1.(1)
(2)
(3)
(4)混合气体与氨水反应生成溶液,水解程度大于水解程度,故溶液呈酸性
(5)取反应后的混合物进行过滤,取滤液于试管中,逐滴滴加盐酸,若立即产生无色无味的气体,则主要离子为
2.(1) Cu2C2 铜、炭
(2) [CuCl4]2-、[Cu(H2O)4]2+、Cu2+ 2Cu+4H++4Cl-=2HCuCl2+H2↑
(3)Cu2C2+O2+8NH3H2O=2[Cu(NH3)]2++4OH-+2C+6H2O
(4)将反应后混合气体依次通过品红溶液和足量氢氧化钠溶液中,若品红溶液褪色,则证明有SO2,若氢氧化钠溶液中有气泡,则证明有CO
3.(1) 、I、 或
(2)
(3)
(4)取适量溶液C于试管中,滴加稀盐酸无现象,加入产生白色沉淀,则含有
4.(1)
(2)
(3)
(4)取适量该无色溶液,加入适量的酸,溶液变成蓝色,且产生难溶于水的紫红色沉淀,该溶液中含有
5.(1) N、H、O、Cl O=C=O
(2)2NH+BaCO3=Ba2++2NH3↑+CO2↑+H2O
(3)Ba(ClO3)2BaCl2+ 3O2↑
(4)分别取少量样品,加入浓盐酸有气泡产生的是CaCO3,加Na2S溶液有黑色沉淀生成的是AgCl固体,余下的为BaSO4固体
6.(1) K、S、O
(2)
(3)
(4)取反应后的上层清液,分成两份,一份滴加适量酸性高锰酸钾溶液,若溶液紫红色褪去,则含有;另一份滴加足量盐酸,再加适量溶液,若有沉淀产生,则含有;若上述现象均有,则说明含有和
7.(1) Fe、C、O Fe(CO)5
(2)FeC+10HNO3=Fe(NO3)3+CO2↑+7NO2↑+5H2O
(3)H2Fe(CO)4+2OH-= Fe(CO)+2H2O
(4)取少量 G 溶液分别置于试管 A、B 中,往 A 试管中滴加紫色石蕊,若变红,则有H+;往B试管中滴加KSCN 无明显现象,再加氯水(或双氧水),溶液变血红色,则有 Fe 2+
8.(1)、、S
(2)
(3)
(4)
(5) 取少量反应后的溶液于试管中加入溶液,溶液不显红色
9.(1) CuAl(CH3)4
(2)[Cu(NH3)4]2+、NH
(3)3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O
(4)2[Cu(NH3)4]2++8H++4I-=2CuI↓+I2+8NH
(5)取少许溶液B放入一支洁净的试管,滴加适量浓硫酸,加热浓缩,插入铜丝,若产生红棕色的气体,则证明溶液中含有NO
10.(1) 、、O
(2)
(3)为吸热反应,加热,平衡正向移动,浓度减小,浓度增大,青色转变为绿色
(4)
(5)取少量混合溶液分装在两支试管中,一份加足量氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,若试纸变蓝则含有。另一份滴加氢氧化钠溶液至过量,若一直有白色稳定的沉淀,则含有
11.(1) Na、Cu、I
(2)、、
(3)
(4)取少量溶液分为两等份,其中一份滴加足量盐酸,无明显变化,再滴加溶液,若出现白色沉淀,说明存在;向另一份溶液中滴加酚酞试液,若变为红色,说明存在
12.(1) N、S、H、O [或、、]
(2)
(3)
(4) 先煮沸,然后滴加氯化钙稀溶液
13.(1) N、S、Cu (NH4)CuSO3
(2)CuSO4、(NH4)2SO4
(3)4H2O+3SO2+2[Cu(NH3)4]2+=2(NH4)CuSO3+6 NH+SO
(4)向反应后的溶液D少量于试管中,滴加几滴酚酞溶液,溶液先变红后褪色,说明二氧化硫被完全吸收,NaClO溶液已过量
14.(1) NOCl NaCl、NaNO2、NaOH
(2)3NOCl+2H2O=HNO3+3HCl+2NO
(3)Au+HNO3+4HCl=HAuCl4+NO↑+2H2O
(4)F溶液中含有的阳离子可能为Fe3+、Fe2+。取F溶液于2支试管中,一支加入KSCN溶液,若溶液变血红色,说明存在Fe3+;另一支试管中加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,说明存在Fe2+
15.(1)铜、铁、硫
(2)
(3)取少量待测液于试管中,先加溶液,无明显现象,再滴加新制氯水,溶液变为血红色,则说明溶液中有(或者滴加几滴铁氰化钾溶液,有蓝色沉淀生成)
(4)生成白色沉淀,迅速转化为灰绿色,最后转化为红褐色沉淀
(5)
21世纪教育网(www.21cnjy.com)
元素或物质推断题
1.固体化合物由种前四周期的元素组成,某学习小组开展如下探究实验:
其中,固体煅烧时还会产生能使澄清石灰水变浑浊的气体;混合气体由两种化合物组成,均含有氧元素和另一种元素,且两种元素总质量比为:;气体是一种纯净物,可使湿润的红色石蕊试纸变蓝。
请回答:
(1)固体的化学式是 ______ 。
(2)写出反应的离子方程式 ______________________________ 。
(3)酸与气体的组成元素相同,相对分子质量为。已知:具有相同原子数和核外电子数的微粒结构相似,则酸的酸根电子式为 ______ 。
(4)将混合气体通入氨水中,恰好完全反应,得到的溶液呈酸性,原因为 ____________________________________ 。用文字说明原因
(5)煅烧固体同时生成一种无色的气体,将过量的通入溶液中,产生白色沉淀。实验验证反应后溶液中主要的阴离子 __________________________________________ 。
2.固体化合物X(式量介于100~160之间)由两种元素组成,某实验小组按如下流程进行相关实验:
已知:固体单质B为黑色,溶液D中除盐酸外仅有一种含氯的一元弱酸。请回答下列问题:
(1)X的化学式为_______;A、B分别为_______ (写名称)。
(2)绿色溶液E中除、外的主要离子有_______。写出单质A与浓盐酸反应的离子方程式___________________________________________。
(3)X在氨水中用空气处理,形成深蓝色溶液,同时生成黑色固体B。写出该反应的离子方程式___________________________________________。
(4)在加热条件下,过量C与发生物质的量比为1:1的氧化还原反应,设计实验检验所得混合气体中,常温常压下呈气态的物质_______。
3.化合物X由三种元素组成,某学习小组按如下流程进行实验:
其中,溶液C含有一种摩尔质量为的含氧弱酸,其物质的量为。
(1)X的组成元素是_______,X的化学式是_______。
(2)写出溶液A与足量稀硫酸反应的化学方程式_____________________________________。
(3)写出生成紫黑色固体D的离子方程式___________________________________________。
(4)请设计实验检验溶液C中的一种阴离子__________________________________________。
4.某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答:
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是___________,C的化学式是___________。
(2)写出固体混合物D、G共热所发生的化学反应方程式_____________________________。
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)_______________________。
(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子_________________。
5.固体化合物A由4种短周期元素组成,某实验小组按如下流程进行相关实验:
流程中固体、气体均为纯净物,溶液中均为单一成分溶质,其中气体A的分子空间构型为三角锥形,气体C可使带火星木条复燃,所有数据均在标准状况下测得,流程中的反应均充分进行。请回答:
(1)组成固体A的4种元素是_______(填元素符号),气体B的结构式为_______。
(2)写出反应①的离子方程式___________________________________________;
(3)写出反应②的化学方程式___________________________________________。
(4)白色沉淀A、B、C的样品标签遗失,请设计实验方案检验三种沉淀的成分_______________
______________________________________________________________________________。
6.物质A由三种常见的元素组成,某兴趣小组进行了如下实验:
已知:A的摩尔质量在之间,焰色为紫色;气体B能使品红溶液褪色;盐C和盐D的组成元素和A相同,且C、D的物质的量之比为。
请回答下列问题:
(1)组成A的元素有_______;A的化学式为_______。
(2)A在潮湿空气中转化为由两种酸式盐组成的混合物,反应的化学方程式是_____________。
(3)一种生产A的方法:在35~45℃下,气体B与锌粉—水悬浊液反应生成中间产物;然后加入相应的碱溶液,充分反应,过滤分离得到A溶液。写出该过程中总反应的化学方程式:_________________________________________________。
(4)碱性条件下,A能还原水中的,有同学预测该反应可能生成多种酸根离子,设计实验确定产物中的酸根离子:_____________________________________(假设反应物无剩余)。
7.化合物 X 由 3 种元素组成。某兴趣小组按如下流程进行实验:
已知:A 由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X 的组成元素有_______(写元素符号);X 的化学式为_______。
(2)写出固体 B 与足量浓硝酸共热时发生反应的化学方程式_________________________。
(3)X 化学性质相当活泼,1mol X 吸收 1mol H2 只生成一种二元弱酸 Y 和 1mol 气体 C,请写出 Y 与足量NaOH 溶液反应的离子方程式_______________________________。
(4)设计实验证明溶液 G 中的阳离子___________________________________________。
8.固体化合物X由3种元素组成,某学习小组开展如下探究实验:
其中气体体积已经折算成标况,气体A可使品红溶液褪色,固体B是混合物,溶液D显深蓝色,沉淀E经过滤、洗涤、灼烧后得到0.80g红棕色固体,请回答:
(1)化合物X所含元素是_______(填元素符号)。
(2)溶液D中显深蓝色的溶质是_______(用化学式表示)。
(3)化合物X在空气中灼烧的化学化学方程式_______________________________。
(4)干燥的气体A与氯气在活性炭催化下可生成一种用于有机合成的常见物质,该物质水解时发生非氧化还原反应得到两种强酸。写出该物质分子的结构式:_____________。
(5)向溶液C中加入一定量的,充分反应后,仍有固体存在,此时,溶液中一定没有的金属阳离子是_______,请设计实验证明你的结论_______________________________。
9.某化合物X由前四周期的四种元素组成,探究其组成的实验过程如图。
已知:无水硫酸铜遇气体G能变蓝色。白色沉淀E可溶于强酸或强碱溶液;沉淀A是由砖红色氧化物M和白色沉淀E组成的混合物。
请回答:
(1)化合物X的化学式为______。气体F的电子式为______。
(2)深蓝色溶液D中所含的主要阳离子有(写离子符号)______。
(3)砖红色固体与稀硝酸反应的离子方程式为____________________________________。
(4)在深蓝色溶液D中滴加稀硫酸至pH为3~4,再加入过量KI固体,有白色沉淀(2种元素组成,个数比为1:1)生成,溶液由蓝色变为褐色。写出该反应过程的离子方程式:______
__________________________________________。
(5)设计实验方案,鉴定蓝色溶液B中所含的阴离子成分______________________________。
10.化合物X由三种元素组成,某兴趣小组按如下流程进行相关实验:
已知:①X在空气中加热到800℃不发生化学反应。②青色、绿色均为蓝色和黄色的混合色,蓝色成分较多时呈青色,黄色成分较多时呈绿色。请回答:
(1)组成X的元素为_______。X的化学式为_______。
(2)溶液B通入过量发生反应的离子方程式_________________________。
(3)青色溶液转化为绿色溶液的原因(结合离子方程式说明)_____________________________。
(4)绿色溶液转化为深蓝色溶液发生的主要化学方程式_______________________________。
(5)气体E与镁在一定条件下可反应,将产物溶于过量盐酸,设计实验检验溶液中含有的阳离子(除外):_____________________________________________________________。
11.化合物X由三种元素组成,某实验小组按如下流程进行相关实验:
已知:X、A、B、C、D均为单一物质,且固体B隔绝空气加热不发生反应。
请回答:
(1)组成X的三种元素为___________;X的化学式为___________。
(2)溶液2的溶质组成为___________(用化学式表示)。
(3)由X到A和B的化学方程式为___________________________________;黑色固体D可缓慢溶于浓氨水,写出该反应的离子方程式_________________________________________。
(4)设计实验,检验溶液5中的阴离子:_________________________________________。
12.固体X是四种短周期元素组成的化合物,X的性质与铵盐相似。为探究固体X的组成,取3.28g X,与含NaOH 0.04mol的溶液恰好发生复分解反应,得溶液A(溶液A中含两种溶质,其中一种溶质的相对分子质量为33),将溶液A分成和两等份,完成如下实验(与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
(1)组成X的四种元素是_________(填元素符号),X的化学式为_________。
(2)A中某种溶质与AgBr反应可生成两种单质,化学方程式为_____________________。
(3)写出X的水溶液与溶液反应生成白色沉淀的离子方程式:_______________。
(4)为探究和NaOH的反应,设计实验方案如下:向含的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则与NaOH的反应可能为_________________________________(写离子方程式);若无沉淀生成,则与NaOH的反应可能为_______________________________________(写离子方程式)。该实验方案有无不妥之处?若有,提出修正意见:___________________________。
13.某研究小组探究白色难溶盐X(含五种元素,M<200g·mol-1)的组成,进行如下实验:
已知:固体A为常见单质;气体B能使品红褪色,实验测得气体体积为3.36L(标准状况),为防止污染环境,实验过程中用NaClO溶液吸收;溶液E中含有两种溶质,且阴离子相同。
请回答下列问题:
(1)X除含有H、O元素,还含有_______元素,X的化学式为_______。
(2)混合溶液C中的溶质主要有_______(填化学式)。
(3)可用气体B通入深蓝色溶液E制备X,写出相应的离子方程式___________________。
(4)设计实验方案证明吸收气体B的NaClO溶液已过量:_________________________。
14.X通常状况下是一种红黄色气体,相对分子质量小于100,含有三种常见短周期元素。为研究X的组成,5.895g的X分三等份进行实验,过程如下(气体体积已折算至标准状况):
请回答:
(1)X的化学式为_______。溶液A的成分为_______。
(2)X与反应的化学方程式为_____________________________________。
(3)金(Au)可溶于浓B溶液生成C和金的一价配离子(与具有相同的空间结构),写出该反应的化学方程式:___________________________________________。
(4)设计一个实验方案,探究溶液F中溶质的阳离子成分:_________________________。
15.为探究矿物(含三种常见元素)的组成和性质,某兴趣小组设计了如下实验:已知实验中所用试剂均足量,固体B是一种单质和化合物的混合物,请回答如下问题:
(1)X所含元素的名称为:_______。
(2)溴水是否可以用酸化的双氧水代替,若不可行,请说明理由,若可行,请写出反应的离子方程式:_______________________________。
(3)检验溶液G中的金属阳离子的实验方案:_____________________________________。
(4)溶液G转化为沉淀H的现象_________________________________________________。
(5)X在高温下与氧气充分反应的化学方程式:_____________________________________。
参考答案:
1.(1)
(2)
(3)
(4)混合气体与氨水反应生成溶液,水解程度大于水解程度,故溶液呈酸性
(5)取反应后的混合物进行过滤,取滤液于试管中,逐滴滴加盐酸,若立即产生无色无味的气体,则主要离子为
2.(1) Cu2C2 铜、炭
(2) [CuCl4]2-、[Cu(H2O)4]2+、Cu2+ 2Cu+4H++4Cl-=2HCuCl2+H2↑
(3)Cu2C2+O2+8NH3H2O=2[Cu(NH3)]2++4OH-+2C+6H2O
(4)将反应后混合气体依次通过品红溶液和足量氢氧化钠溶液中,若品红溶液褪色,则证明有SO2,若氢氧化钠溶液中有气泡,则证明有CO
3.(1) 、I、 或
(2)
(3)
(4)取适量溶液C于试管中,滴加稀盐酸无现象,加入产生白色沉淀,则含有
4.(1)
(2)
(3)
(4)取适量该无色溶液,加入适量的酸,溶液变成蓝色,且产生难溶于水的紫红色沉淀,该溶液中含有
5.(1) N、H、O、Cl O=C=O
(2)2NH+BaCO3=Ba2++2NH3↑+CO2↑+H2O
(3)Ba(ClO3)2BaCl2+ 3O2↑
(4)分别取少量样品,加入浓盐酸有气泡产生的是CaCO3,加Na2S溶液有黑色沉淀生成的是AgCl固体,余下的为BaSO4固体
6.(1) K、S、O
(2)
(3)
(4)取反应后的上层清液,分成两份,一份滴加适量酸性高锰酸钾溶液,若溶液紫红色褪去,则含有;另一份滴加足量盐酸,再加适量溶液,若有沉淀产生,则含有;若上述现象均有,则说明含有和
7.(1) Fe、C、O Fe(CO)5
(2)FeC+10HNO3=Fe(NO3)3+CO2↑+7NO2↑+5H2O
(3)H2Fe(CO)4+2OH-= Fe(CO)+2H2O
(4)取少量 G 溶液分别置于试管 A、B 中,往 A 试管中滴加紫色石蕊,若变红,则有H+;往B试管中滴加KSCN 无明显现象,再加氯水(或双氧水),溶液变血红色,则有 Fe 2+
8.(1)、、S
(2)
(3)
(4)
(5) 取少量反应后的溶液于试管中加入溶液,溶液不显红色
9.(1) CuAl(CH3)4
(2)[Cu(NH3)4]2+、NH
(3)3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O
(4)2[Cu(NH3)4]2++8H++4I-=2CuI↓+I2+8NH
(5)取少许溶液B放入一支洁净的试管,滴加适量浓硫酸,加热浓缩,插入铜丝,若产生红棕色的气体,则证明溶液中含有NO
10.(1) 、、O
(2)
(3)为吸热反应,加热,平衡正向移动,浓度减小,浓度增大,青色转变为绿色
(4)
(5)取少量混合溶液分装在两支试管中,一份加足量氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,若试纸变蓝则含有。另一份滴加氢氧化钠溶液至过量,若一直有白色稳定的沉淀,则含有
11.(1) Na、Cu、I
(2)、、
(3)
(4)取少量溶液分为两等份,其中一份滴加足量盐酸,无明显变化,再滴加溶液,若出现白色沉淀,说明存在;向另一份溶液中滴加酚酞试液,若变为红色,说明存在
12.(1) N、S、H、O [或、、]
(2)
(3)
(4) 先煮沸,然后滴加氯化钙稀溶液
13.(1) N、S、Cu (NH4)CuSO3
(2)CuSO4、(NH4)2SO4
(3)4H2O+3SO2+2[Cu(NH3)4]2+=2(NH4)CuSO3+6 NH+SO
(4)向反应后的溶液D少量于试管中,滴加几滴酚酞溶液,溶液先变红后褪色,说明二氧化硫被完全吸收,NaClO溶液已过量
14.(1) NOCl NaCl、NaNO2、NaOH
(2)3NOCl+2H2O=HNO3+3HCl+2NO
(3)Au+HNO3+4HCl=HAuCl4+NO↑+2H2O
(4)F溶液中含有的阳离子可能为Fe3+、Fe2+。取F溶液于2支试管中,一支加入KSCN溶液,若溶液变血红色,说明存在Fe3+;另一支试管中加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,说明存在Fe2+
15.(1)铜、铁、硫
(2)
(3)取少量待测液于试管中,先加溶液,无明显现象,再滴加新制氯水,溶液变为血红色,则说明溶液中有(或者滴加几滴铁氰化钾溶液,有蓝色沉淀生成)
(4)生成白色沉淀,迅速转化为灰绿色,最后转化为红褐色沉淀
(5)
21世纪教育网(www.21cnjy.com)
同课章节目录
