河南省洛阳市2022-2023学年高二下学期6月质量检测化学试卷(无答案)
文档属性
| 名称 | 河南省洛阳市2022-2023学年高二下学期6月质量检测化学试卷(无答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 08:43:42 | ||
图片预览




文档简介
洛阳市2022-2023学年高二下学期6月质量检测
化学试卷
本试卷共8页,共100分,考试时间为90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考号填写在答题卡上。
2.考试结束,将答题卡交回。
本试卷可能用到的相对原子质量:B:11 N:14 0:16 P:31 Cl:35.5
一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题2分,共20分)
1. 2022年北京冬奥会体现了绿色奥运、科技奥运的理念。下列说法错误的是
A.火炬“飞扬”使用纯氢作燃料,实现碳排放为零
B.冬奥场馆“冰丝带”使用CO 制冰,比氟利昂更环保
C.领奖礼服中的石墨烯发热材料属于有机高分子材料
D.部分场馆建筑应用了碲化镉发电玻璃,将光能转化为电能
2. 下列表示错误的是
A.乙烯的结构简式CH =CH
B.基态氧原子的轨道表示式
C. KOH 的电子式
D. Mg 基态电子排布式:1s 2s 2p
3. 劳动创造美好生活。下列劳动项目与所述化学知识正确且有关联的是
选项 劳动项目 化学知识
A 用白醋清洗水壶中的水垢 乙酸可由乙醇氧化制得
B 园丁用石灰水涂抹树干 碱使蛋白质变性
C 糕点师用小苏打发制面团 NaHCO 是离子晶体
D 舞台师用干冰制造舞台的“烟雾”缭绕 CO 的VSEPR模型是直线形
4. 在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析错误的是
A.与深海地区相比,浅海地区水温较高,有利于游离的CO 增多、石灰石沉积
B.与浅海地区相比,深海地区压强大,石灰石岩层易被CO 溶解,沉积少
C.深海地区石灰石岩层的溶解反应为:CaCO (s) +H O(l) +CO (aq) =Ca(HCO ) (aq)
D.海水呈弱酸性,大气中CO 浓度增加,会导致海水中C浓度增大
5、下列有机化合物的命名错误的是
A、CH CH(C H )CH 2-甲基丁烷
C. CH BrCH Br 二溴乙烷
6. 甲烷消除NO 的污染原理为CH ( g) +2NO ( g) ══N ( g)+CO ( g)+2H O( g)。
在一定温度下,向恒容密闭容器中充入一定量的CH 和NO 进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是
B.容器中混合气体的密度不再变化
C.容器中混合气体总压强不再发生变化
D.单位时间内,消耗l mol CH 同时生成1 mol N
7. 下列图示与对应的叙述符合的是
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO (g) +O ( g) 2SO ( g) 的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSO 溶液中的,可向溶液中加入适量CuO至pH=4
D.图丁表示常温下向20mL 0.001 mol/L 的醋酸溶液中滴加0.001 mol/L 的NaOH溶液,溶液的pH 随NaOH溶液体积的变化关系
8. 工业合成氨是人类科学技术的一项重大突破。其合成原理为:N (g) + 3H ( g) 2NH (g)△H <0 , 下列说法错误的是
A.增大压强,单位体积内活化分子增多,反应速率加快
B.该反应在低温下能自发进行
C.为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化
D.用勒夏特列原理解释通常采用500 ℃有利于氨的合成
9. 离子液体广泛应用于科研和生产中。某离子液体结构如下图.其中阳离子有类似苯环的特殊稳定性。下列说法错误的是
A.阳离子中C有两种不同的杂化方式
B.阳离子中存在大π键
C.阳离子中所有C、N原子不可能共面
D.阴离子中含有配位键
10. 冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。18-冠-6与K 作用形成超分子如下图所示。下列说法正确的是
A.利用18-冠-6将KMnO 带入有机物中,更有利于有机物的氧化
B.18-冠-6中O原子与K 间存在离子键
C.18-冠-6中C和O的杂化轨道类型不同
D.18-冠-6与K 作用,不与Li 或Na 作用,这反映了超分子的“自组装”特征
二、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共30分)
11. 如图所示为CCl F破坏臭氧层的过程,下列说法错误的是
A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可用方程式表示为(=ClO· + O
C.过程Ⅲ中O·+O·=O 是吸热过程
D.上述过程说明CCl F 中的氯原子是破坏臭氧层的催化剂
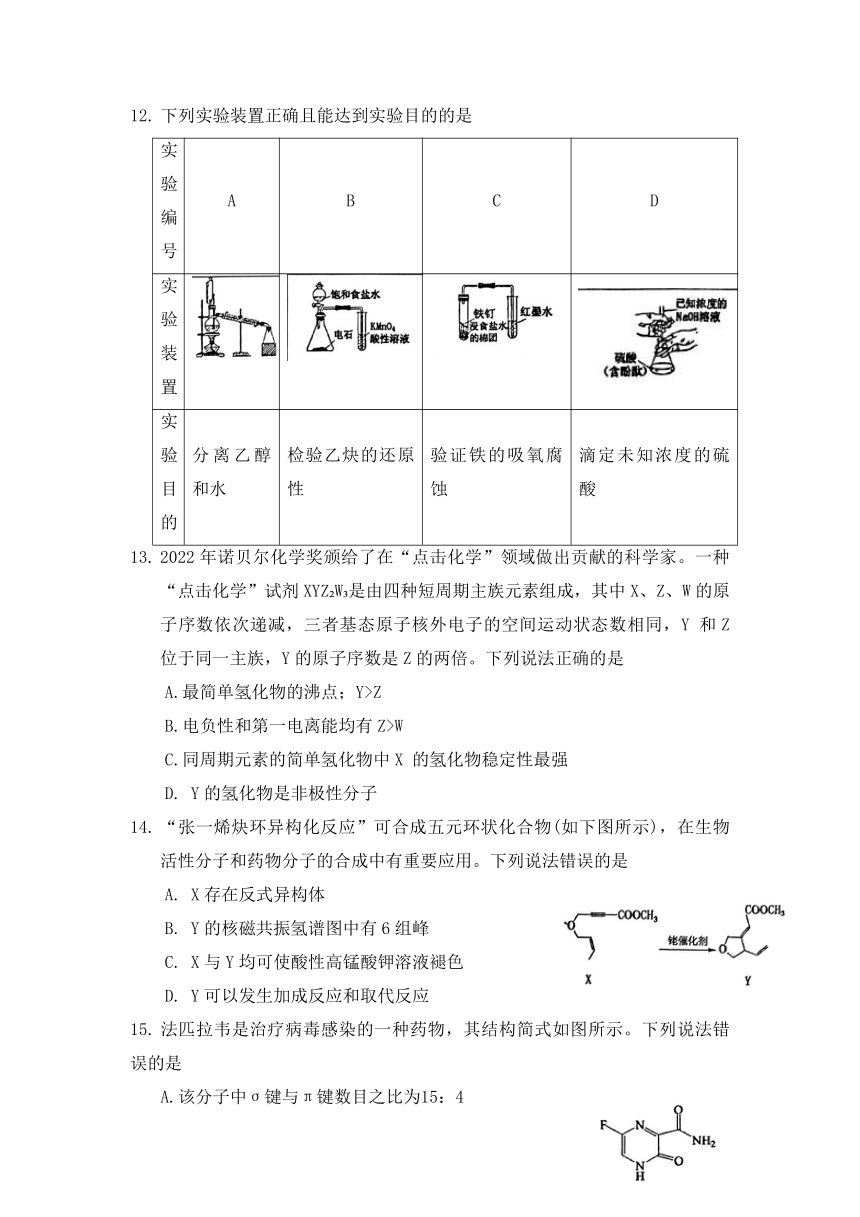
12. 下列实验装置正确且能达到实验目的的是
实验 编号 A B C D
实验 装置
实验 目的 分离乙醇和水 检验乙炔的还原性 验证铁的吸氧腐蚀 滴定未知浓度的硫酸
13. 2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。一种“点击化学”试剂XYZ W 是由四种短周期主族元素组成,其中X、Z、W的原子序数依次递减,三者基态原子核外电子的空间运动状态数相同,Y 和Z位于同一主族,Y的原子序数是Z的两倍。下列说法正确的是
A.最简单氢化物的沸点;Y>Z
B.电负性和第一电离能均有Z>W
C.同周期元素的简单氢化物中X 的氢化物稳定性最强
D. Y的氢化物是非极性分子
14. “张一烯炔环异构化反应”可合成五元环状化合物(如下图所示),在生物活性分子和药物分子的合成中有重要应用。下列说法错误的是
A. X存在反式异构体
B. Y的核磁共振氢谱图中有6组峰
C. X与Y均可使酸性高锰酸钾溶液褪色
D. Y可以发生加成反应和取代反应
15. 法匹拉韦是治疗病毒感染的一种药物,其结构简式如图所示。下列说法错误的是
A.该分子中σ键与π键数目之比为15:4
B. N、O、F与H形成的键的极性:N-HC.该分子中C-N键的键能小于C=N键的键能
D.该分子中所有N原子都为sp 杂化化
16. 将Cl 缓慢通入溶液中,反应过程中无CO 逸出,用数字传感器测得溶液中pH与c(HClO)的变化如图所示。已知下列说法错误的是
A.曲线①表示溶液中pH 的变化
B.整个过程中,水的电离程度逐渐减小
C. a 点溶液中: + c ( OH )
D. pH=10.3时:
17. 下列方案设计、现象和结论都正确的是
选项 目的 方案设计 现象和结论
A 检验淀粉是否已经发生水解 将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH) ,加热,没有砖红色沉淀产生 淀粉未发生水解
B 探究KI与FeCl 反应的限度 取5 mL 0.1 mol·L KI 溶液于试管中,加入1 mL 0.1 mol·L FeCl 溶液,充分反应后滴入5滴15%KSCN 溶液 溶液变血红色,则KI与FeCl 的反应有一定限度
C 检验溴乙烷中溴元素 溴乙烷和NaOH 溶液混合,振荡后加热,静置分层后,取少量上层清液,移入另一支试管中,加入2滴AgNO 溶液 若有淡黄色沉淀产生,则说明溴乙烷中含溴元素
D 检验气体Y 用湿润的淀粉碘化钾试纸检验气体Y 若试纸变蓝色,Y一定是Cl
18. 根据下列图示,下列说法错误的是
A.第三周期某元素的前五级的电离能如图1所示,则该元素是Al
B.图2表示石墨晶体结构,石墨晶体既存在共价键又存在范德华力,属于混合型晶体
C.图3所示是的部分结构以及其中H-N-H键的键角,键角比NH 大的原因与NH 中N原子的孤电子对转化为成键电子对有关
D.立方BN晶胞结构如图4所示,晶胞体对角线长等于晶胞中最近的B、N原子之间距离的4倍
19. 已知含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的pK 与溶液的pH 的关系如下图,该温度下向初始pH=6的含磷废水中加入CaCl 可以得到Ca (PO ) OH沉淀而实现废水除磷。下列叙述错误的是
该温度下,磷酸的
若逐渐增大该废水的pH,溶液中将随之不断增大
pH=6的该废水中离子浓度存在关系
该废水除磷的离子反应有
20. 我国提出要“打赢蓝天保卫战”,对污染防治要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下。下列说法错误的是
A.盐桥中K 向Y极移动,Cl 向X极移动
B. X极附近溶液pH减少,Y 极附近溶液pH增大
C.1 mol NO 在Y极上反应制得0.5 mol氮气时,由X极经过溶液向Y极转移5 mol 电子
D.电路中通过7.5 mol电子时,理论上共产生N 的体积为44.8 L(标准状况)
三、填空题(本题共4小题,共50分)
21. (11分)亚硝酰氯(NOCl)是有机物合成中的重要试剂,是一种红褐色液体或黄色气体。某化学小组利用NO 和Cl 在实验室中制备NOCl,装置如图。
已知:沸点Cl 为-34 ℃、NO为-152 ℃、NOCl为-6℃。NOCl易水解,能与O 反应。
回答下列问题:
(1)NOCl分子中各原子均满足8电子的稳定结构,则NOCl的结构式为 。
(2)仪器a的名称
(3)NO和氯气混合前,先关闭K ,打开K 、K ,这样操作的目的为 。
(4)装置D中的温度区间应控制在 。
(5)上述实验装置有一处不足,请指出不足之处: 。
(6)亚硝酰氯(NOCl)纯度的测定。取D中所得液体20g溶于适量的NaOH 溶液中,配制成250mL溶液;取出25.00mL样品溶液于锥形瓶中,滴加适量试剂X,用AgNO 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
①已知:
物质 AgCl AgBr AgI Ag CrO AgSCN Ag S
Ka甲 1.8×10 5.4×10 8.5×10 9.0×10 1.0×10 6.3×10
颜色 白色 淡黄色 黄色 砖红色 白色 灰黑色
试剂X为 (填标号)
A. NaBr B. NaI C. Na CrO D. Na S
②亚硝酰氯(NOCl)的质量分数为 。
22. (13分)我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应
反应II :
反应Ⅲ: CO (g) +3H ( g) =CH OH( g) +H O(g) △H
(1)原料CO 可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO 捕获剂的是 (填标号)。
A. NaOH溶液 B.浓氨水 C. CH CH OH D. NH NO 溶液
(2)根据盖斯定律,反应Ⅲ的
(3)为提高单位时间内CH OH的产量,可采取的措施有 。(任填2项)
(4)上述反应平衡常数的自然对数lnK随表示温度)的变化如图所示:
①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是 ,写出推理过程 。
②若图中A点时发生反应CH OH(g)+CO (g)2CO(g)+H (g)+H O(g),则该反应此时的lnK= (填数值)
(5)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO 和3 mol H 发生反应Ⅰ和Ⅲ,
达到平衡时,容器中CH OH(g)为a mol,CO为 bmol,此时H 的浓度为 _____(用含a、b、V的代数式表示)。
23. (13分)我国磷、铬、锂等矿产资源储量丰富。回答下列问题:
(1)基态铬原子核外共有 种不同运动状态的电子;基态铬原子的价电子轨道表示式为 。
(2)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数或边长为a pm);
①固态磷化硼属于 (填“分子”“离子”或“共价”)晶体。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0),则Q点的原子分数坐标为 。
③磷化硼晶体的密度为 (列出计算式)。
(3)物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是 _____(填标号)。
A.[Cr(OH) ] B.[Cu( CN) ] D.[Fe( CN)6]
(4) Ga、Li 和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
①该晶体的化学式为 。
②上述晶胞沿着a轴的投影图为 (填选项字母)。
24.(13分)有机玻璃树脂G和高聚物K的合成路线如图所示(A~M均为有机物):
已知:
回答下列问题:
(1)A的官能团名称为 ,F→G的反应类型为 。
(2)J的分子式为 。
(3)C的结构简式为 。
(4)M+A→B的化学方程式为 。
(5)F的同分异构体中,与F具有相同官能团且能发生水解反应和银镜反应的化合物_________
、________ (不考虑立体异构,任写2种)。
(6)如图是以环己烯和乙烯为原料制备十元环状二酯化合物R 的合成路线,请写出有机物P、Q、R的结构简式 _________ 、__________ 、 __________ 。
化学试卷
本试卷共8页,共100分,考试时间为90分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、考号填写在答题卡上。
2.考试结束,将答题卡交回。
本试卷可能用到的相对原子质量:B:11 N:14 0:16 P:31 Cl:35.5
一、选择题(本题共10小题,每小题只有一个选项符合题意,每小题2分,共20分)
1. 2022年北京冬奥会体现了绿色奥运、科技奥运的理念。下列说法错误的是
A.火炬“飞扬”使用纯氢作燃料,实现碳排放为零
B.冬奥场馆“冰丝带”使用CO 制冰,比氟利昂更环保
C.领奖礼服中的石墨烯发热材料属于有机高分子材料
D.部分场馆建筑应用了碲化镉发电玻璃,将光能转化为电能
2. 下列表示错误的是
A.乙烯的结构简式CH =CH
B.基态氧原子的轨道表示式
C. KOH 的电子式
D. Mg 基态电子排布式:1s 2s 2p
3. 劳动创造美好生活。下列劳动项目与所述化学知识正确且有关联的是
选项 劳动项目 化学知识
A 用白醋清洗水壶中的水垢 乙酸可由乙醇氧化制得
B 园丁用石灰水涂抹树干 碱使蛋白质变性
C 糕点师用小苏打发制面团 NaHCO 是离子晶体
D 舞台师用干冰制造舞台的“烟雾”缭绕 CO 的VSEPR模型是直线形
4. 在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析错误的是
A.与深海地区相比,浅海地区水温较高,有利于游离的CO 增多、石灰石沉积
B.与浅海地区相比,深海地区压强大,石灰石岩层易被CO 溶解,沉积少
C.深海地区石灰石岩层的溶解反应为:CaCO (s) +H O(l) +CO (aq) =Ca(HCO ) (aq)
D.海水呈弱酸性,大气中CO 浓度增加,会导致海水中C浓度增大
5、下列有机化合物的命名错误的是
A、CH CH(C H )CH 2-甲基丁烷
C. CH BrCH Br 二溴乙烷
6. 甲烷消除NO 的污染原理为CH ( g) +2NO ( g) ══N ( g)+CO ( g)+2H O( g)。
在一定温度下,向恒容密闭容器中充入一定量的CH 和NO 进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是
B.容器中混合气体的密度不再变化
C.容器中混合气体总压强不再发生变化
D.单位时间内,消耗l mol CH 同时生成1 mol N
7. 下列图示与对应的叙述符合的是
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO (g) +O ( g) 2SO ( g) 的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSO 溶液中的,可向溶液中加入适量CuO至pH=4
D.图丁表示常温下向20mL 0.001 mol/L 的醋酸溶液中滴加0.001 mol/L 的NaOH溶液,溶液的pH 随NaOH溶液体积的变化关系
8. 工业合成氨是人类科学技术的一项重大突破。其合成原理为:N (g) + 3H ( g) 2NH (g)△H <0 , 下列说法错误的是
A.增大压强,单位体积内活化分子增多,反应速率加快
B.该反应在低温下能自发进行
C.为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化
D.用勒夏特列原理解释通常采用500 ℃有利于氨的合成
9. 离子液体广泛应用于科研和生产中。某离子液体结构如下图.其中阳离子有类似苯环的特殊稳定性。下列说法错误的是
A.阳离子中C有两种不同的杂化方式
B.阳离子中存在大π键
C.阳离子中所有C、N原子不可能共面
D.阴离子中含有配位键
10. 冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。18-冠-6与K 作用形成超分子如下图所示。下列说法正确的是
A.利用18-冠-6将KMnO 带入有机物中,更有利于有机物的氧化
B.18-冠-6中O原子与K 间存在离子键
C.18-冠-6中C和O的杂化轨道类型不同
D.18-冠-6与K 作用,不与Li 或Na 作用,这反映了超分子的“自组装”特征
二、选择题(本题共10小题,每小题只有一个选项符合题意,每小题3分,共30分)
11. 如图所示为CCl F破坏臭氧层的过程,下列说法错误的是
A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可用方程式表示为(=ClO· + O
C.过程Ⅲ中O·+O·=O 是吸热过程
D.上述过程说明CCl F 中的氯原子是破坏臭氧层的催化剂
12. 下列实验装置正确且能达到实验目的的是
实验 编号 A B C D
实验 装置
实验 目的 分离乙醇和水 检验乙炔的还原性 验证铁的吸氧腐蚀 滴定未知浓度的硫酸
13. 2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。一种“点击化学”试剂XYZ W 是由四种短周期主族元素组成,其中X、Z、W的原子序数依次递减,三者基态原子核外电子的空间运动状态数相同,Y 和Z位于同一主族,Y的原子序数是Z的两倍。下列说法正确的是
A.最简单氢化物的沸点;Y>Z
B.电负性和第一电离能均有Z>W
C.同周期元素的简单氢化物中X 的氢化物稳定性最强
D. Y的氢化物是非极性分子
14. “张一烯炔环异构化反应”可合成五元环状化合物(如下图所示),在生物活性分子和药物分子的合成中有重要应用。下列说法错误的是
A. X存在反式异构体
B. Y的核磁共振氢谱图中有6组峰
C. X与Y均可使酸性高锰酸钾溶液褪色
D. Y可以发生加成反应和取代反应
15. 法匹拉韦是治疗病毒感染的一种药物,其结构简式如图所示。下列说法错误的是
A.该分子中σ键与π键数目之比为15:4
B. N、O、F与H形成的键的极性:N-H
D.该分子中所有N原子都为sp 杂化化
16. 将Cl 缓慢通入溶液中,反应过程中无CO 逸出,用数字传感器测得溶液中pH与c(HClO)的变化如图所示。已知下列说法错误的是
A.曲线①表示溶液中pH 的变化
B.整个过程中,水的电离程度逐渐减小
C. a 点溶液中: + c ( OH )
D. pH=10.3时:
17. 下列方案设计、现象和结论都正确的是
选项 目的 方案设计 现象和结论
A 检验淀粉是否已经发生水解 将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH) ,加热,没有砖红色沉淀产生 淀粉未发生水解
B 探究KI与FeCl 反应的限度 取5 mL 0.1 mol·L KI 溶液于试管中,加入1 mL 0.1 mol·L FeCl 溶液,充分反应后滴入5滴15%KSCN 溶液 溶液变血红色,则KI与FeCl 的反应有一定限度
C 检验溴乙烷中溴元素 溴乙烷和NaOH 溶液混合,振荡后加热,静置分层后,取少量上层清液,移入另一支试管中,加入2滴AgNO 溶液 若有淡黄色沉淀产生,则说明溴乙烷中含溴元素
D 检验气体Y 用湿润的淀粉碘化钾试纸检验气体Y 若试纸变蓝色,Y一定是Cl
18. 根据下列图示,下列说法错误的是
A.第三周期某元素的前五级的电离能如图1所示,则该元素是Al
B.图2表示石墨晶体结构,石墨晶体既存在共价键又存在范德华力,属于混合型晶体
C.图3所示是的部分结构以及其中H-N-H键的键角,键角比NH 大的原因与NH 中N原子的孤电子对转化为成键电子对有关
D.立方BN晶胞结构如图4所示,晶胞体对角线长等于晶胞中最近的B、N原子之间距离的4倍
19. 已知含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的pK 与溶液的pH 的关系如下图,该温度下向初始pH=6的含磷废水中加入CaCl 可以得到Ca (PO ) OH沉淀而实现废水除磷。下列叙述错误的是
该温度下,磷酸的
若逐渐增大该废水的pH,溶液中将随之不断增大
pH=6的该废水中离子浓度存在关系
该废水除磷的离子反应有
20. 我国提出要“打赢蓝天保卫战”,对污染防治要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下。下列说法错误的是
A.盐桥中K 向Y极移动,Cl 向X极移动
B. X极附近溶液pH减少,Y 极附近溶液pH增大
C.1 mol NO 在Y极上反应制得0.5 mol氮气时,由X极经过溶液向Y极转移5 mol 电子
D.电路中通过7.5 mol电子时,理论上共产生N 的体积为44.8 L(标准状况)
三、填空题(本题共4小题,共50分)
21. (11分)亚硝酰氯(NOCl)是有机物合成中的重要试剂,是一种红褐色液体或黄色气体。某化学小组利用NO 和Cl 在实验室中制备NOCl,装置如图。
已知:沸点Cl 为-34 ℃、NO为-152 ℃、NOCl为-6℃。NOCl易水解,能与O 反应。
回答下列问题:
(1)NOCl分子中各原子均满足8电子的稳定结构,则NOCl的结构式为 。
(2)仪器a的名称
(3)NO和氯气混合前,先关闭K ,打开K 、K ,这样操作的目的为 。
(4)装置D中的温度区间应控制在 。
(5)上述实验装置有一处不足,请指出不足之处: 。
(6)亚硝酰氯(NOCl)纯度的测定。取D中所得液体20g溶于适量的NaOH 溶液中,配制成250mL溶液;取出25.00mL样品溶液于锥形瓶中,滴加适量试剂X,用AgNO 标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。
①已知:
物质 AgCl AgBr AgI Ag CrO AgSCN Ag S
Ka甲 1.8×10 5.4×10 8.5×10 9.0×10 1.0×10 6.3×10
颜色 白色 淡黄色 黄色 砖红色 白色 灰黑色
试剂X为 (填标号)
A. NaBr B. NaI C. Na CrO D. Na S
②亚硝酰氯(NOCl)的质量分数为 。
22. (13分)我国力争于2030年前做到碳达峰,2060年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应
反应II :
反应Ⅲ: CO (g) +3H ( g) =CH OH( g) +H O(g) △H
(1)原料CO 可通过捕获技术从空气或工业尾气中获取,下列物质能作为CO 捕获剂的是 (填标号)。
A. NaOH溶液 B.浓氨水 C. CH CH OH D. NH NO 溶液
(2)根据盖斯定律,反应Ⅲ的
(3)为提高单位时间内CH OH的产量,可采取的措施有 。(任填2项)
(4)上述反应平衡常数的自然对数lnK随表示温度)的变化如图所示:
①反应Ⅰ、Ⅱ、Ⅲ中属于吸热反应的是 ,写出推理过程 。
②若图中A点时发生反应CH OH(g)+CO (g)2CO(g)+H (g)+H O(g),则该反应此时的lnK= (填数值)
(5)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO 和3 mol H 发生反应Ⅰ和Ⅲ,
达到平衡时,容器中CH OH(g)为a mol,CO为 bmol,此时H 的浓度为 _____(用含a、b、V的代数式表示)。
23. (13分)我国磷、铬、锂等矿产资源储量丰富。回答下列问题:
(1)基态铬原子核外共有 种不同运动状态的电子;基态铬原子的价电子轨道表示式为 。
(2)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示(其晶胞参数或边长为a pm);
①固态磷化硼属于 (填“分子”“离子”或“共价”)晶体。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知原子分数坐标:M点为(0,0,0),则Q点的原子分数坐标为 。
③磷化硼晶体的密度为 (列出计算式)。
(3)物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是 _____(填标号)。
A.[Cr(OH) ] B.[Cu( CN) ] D.[Fe( CN)6]
(4) Ga、Li 和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
①该晶体的化学式为 。
②上述晶胞沿着a轴的投影图为 (填选项字母)。
24.(13分)有机玻璃树脂G和高聚物K的合成路线如图所示(A~M均为有机物):
已知:
回答下列问题:
(1)A的官能团名称为 ,F→G的反应类型为 。
(2)J的分子式为 。
(3)C的结构简式为 。
(4)M+A→B的化学方程式为 。
(5)F的同分异构体中,与F具有相同官能团且能发生水解反应和银镜反应的化合物_________
、________ (不考虑立体异构,任写2种)。
(6)如图是以环己烯和乙烯为原料制备十元环状二酯化合物R 的合成路线,请写出有机物P、Q、R的结构简式 _________ 、__________ 、 __________ 。
同课章节目录
