2023年中考化学复习 主题六 题型突破第27讲 综合能力——化工流程题课件(共29张PPT)
文档属性
| 名称 | 2023年中考化学复习 主题六 题型突破第27讲 综合能力——化工流程题课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 08:55:36 | ||
图片预览






文档简介
(共29张PPT)
主题六 题型突破
第27讲 综合能力——化工流程题
化工流程题是中考必考题型。它将初中化学知识和模拟化工生产有机结合起来,具有综合性、应用性、陌生性的特点,着重考查学生基础知识应用能力、提取应用信息的能力,考查的知识点主要包括:物质的转化、除杂、分离等知识。题目一般包含:题头(以文字的形式介绍工艺生产的情景和产品等必要信息),题干(一般以流程图的形式介绍工艺生产的流程),题尾(将生产过程中涉及的初中化学知识设置成问题)三部分构成。化工流程题的一般解法:
1.阅读题头。从题头中获取相关信息,明确化工流程的目的。
2.精读题干。就是仔细分析流程图的每一环节。主要从这几个方面分析:涉及哪些物质?有没有过量的物质?发生了哪些化学反应?这些反应的结果怎样?对最后的产品有什么影响?采用什么方式提纯分离最终的产品?
3.关注箭头方向。从左向右的箭头表示流程顺序和步骤,从上往下的箭头表示添加原料,逆转的箭头表示可循环利用。
4.准确作答。根据题目设置的问题,找到题干中对应的步骤,找出关键词,仔细辨析,正确作答。特别要注意书写规范,表述准确。
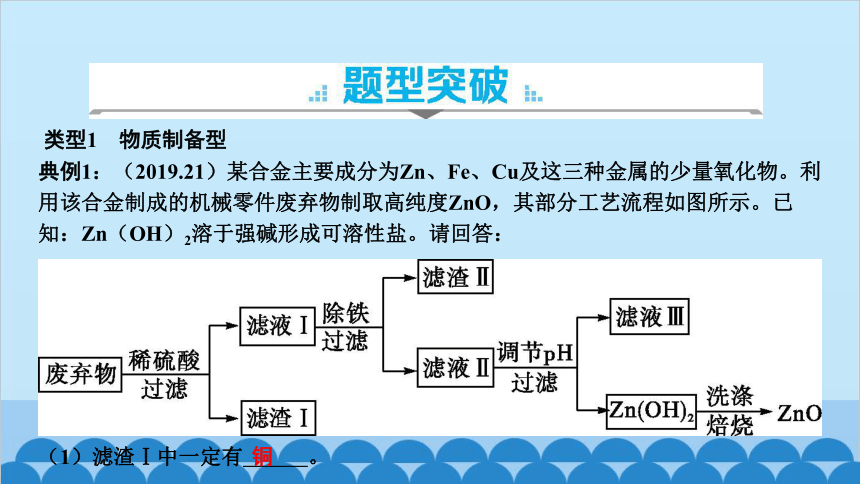
类型1 物质制备型
典例1:(2019.21)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。已知:Zn(OH)2溶于强碱形成可溶性盐。请回答:
(1)滤渣Ⅰ中一定有 铜 。
铜
(3)调节pH可用NaOH,但不能过量,其原因是 Zn(OH)2溶于强碱形成可溶性盐,导致产率下降 。
生成的氢气具有可燃
性,避免不纯的氢气遇明火发生爆炸
置换反
应
Zn(OH)2溶于强碱形成可溶
性盐,导致产率下降
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 Zn(OH)2 ZnO+H2O 。
ZnO+
H2O
解析:根据“合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物”,加入稀硫酸后,可直接判断出:滤渣Ⅰ是铜,滤液Ⅰ中含有的溶质是硫酸锌、硫酸亚铁、硫酸铜及铁元素的硫酸盐,同时生成了氢气;根据题目信息“Zn(OH)2溶于强碱形成可溶性盐”可知,调节pH时NaOH不能过量;最后根据流程图的最后一步提供的信息写出氢氧化锌分解的化学方程式,此处要注意反应条件直接写“焙烧”,不能写成高温。
变式训练
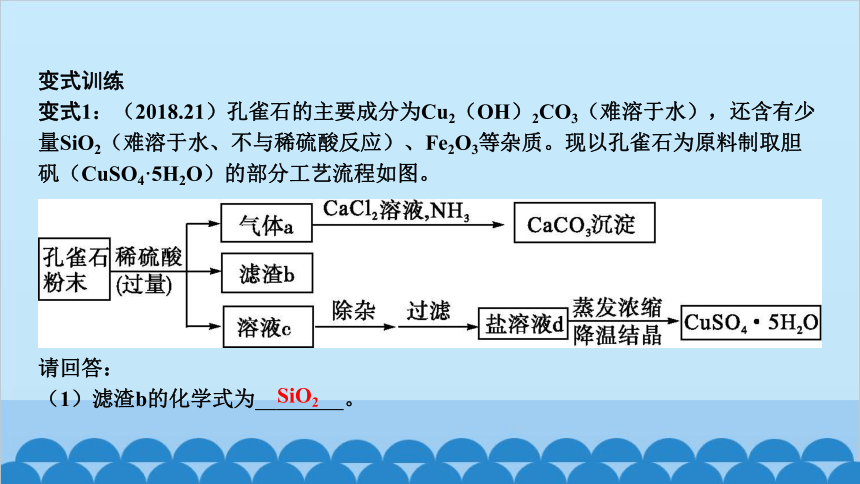
变式1:(2018.21)孔雀石的主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。
请回答:
(1)滤渣b的化学式为 SiO2 。
SiO2
(2)溶液c中的溶质有: H2SO4 、 CuSO4 、 Fe2(SO4)3 (写化学式)。
(3)盐溶液d的颜色为 蓝色 ;实验室蒸发溶液时用到的玻璃仪器有 玻璃棒 (写一种)。
H2SO4
CuSO4
Fe2(SO4)3
蓝色
玻璃棒
氯化铵
类型2 物质的利用型
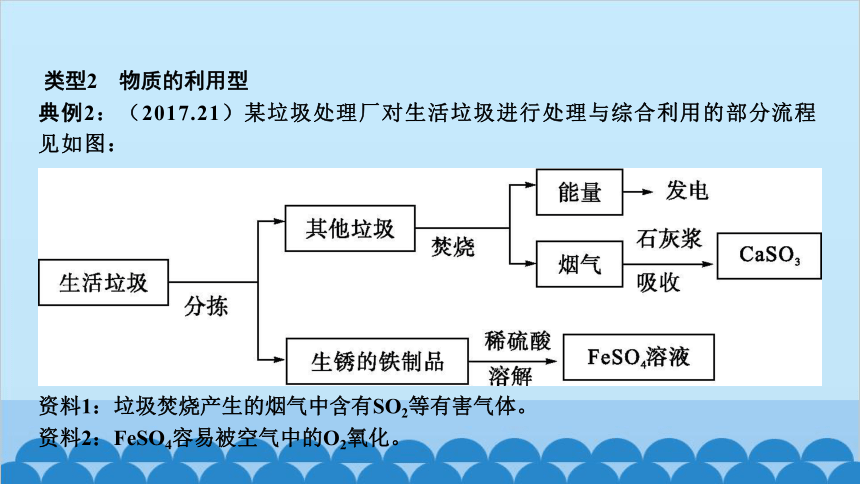
典例2:(2017.21)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、 降温结晶 、过滤,得到FeSO4晶体,其中氮气的作用是 防止硫酸亚铁被氧化 。
Ca(OH)2+
降温结晶
防止硫酸亚铁被氧化
(4)政府倡导垃圾分类,其好处是 保护环境(或“回收利用废旧资源”) (写一点)。
保护环境(或“回收利用废旧资源”)
解析:根据“资料1:垃圾焚烧产生的烟气中含有SO2等有害气体”和“石灰浆吸收SO2(性质与CO2相似)”这两条信息,写出石灰浆吸收SO2的化学方程式。根据题干中“生锈的铁制品”这一信息可知含有铁和氧化铁,分别写出它们与稀硫酸反应的化学方程式。根据“将所得FeSO4溶液在氮气环境中蒸发浓缩”这一信息可知下一步是降温结晶,再根据“资料2:FeSO4容易被空气中的O2氧化”这一信息推测氮气的作用。
变式训练
变式2:(2021·深圳)某科学兴趣小组,用废渣(主要为CaCO3,还含有C、Fe2O3、MgO等少量杂质)去制作CaCl2,反应过程如图所示。
(1)Ⅰ过程中加过量稀盐酸的目的是 使碳酸钙、氧化铁、氧化镁完全反应 。
使碳酸钙、氧化铁、氧化镁完全反应
(3)滤渣一的成分为 C (填化学式)。
(4)X溶液为 NaOH (填化学式)。
(5)NaCl在生活中的用处: 用作调味品 (写一例)。
(6)已知CaCl2与焦炭、BaSO4在高温下生成BaCl2、CO和CaS,写出该反应的化学方程式:
复分解
C
NaOH
用作调味品
1.(2021.20)牙膏中常用碳酸钙粉末作摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。
过滤
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由: 有影响,是因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,从而导致碳酸钙产率降低 。
(4)大气中CO2含量不断上升,会导致 温室效应 。我国在联合国大会上提出:努力争取2060年前实现“碳中和”。请提出一条实现“碳中和”的措施: 多植树造林(或低碳出行等) 。
复分解反应
有影响,是因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,从而导致碳酸
钙产率降低
温室效应
多
植树造林(或低碳出行等)
2.(2020.20)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图:
(1)该废酸液的pH < 7(填“>”或“<”)。操作Ⅰ的名称为 过滤 。
(2)电石渣转化为石灰乳的过程会 放出 (填“吸收”或“放出”)热量。
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是 Fe(OH)2 和 CaSO4 (填化学式)。
<
过滤
放出
Fe(OH)2
CaSO4
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 Fe3O4 。
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 7.5 ,pH较低时产率较低的主要原因是 Fe3O4能与酸发生反应 。
溶液的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰黑色
产率 43.9% 50.6% 86.2% 93.0% 92.3% 91.6%
Fe3O4
7.5
Fe3O4能与酸发
生反应
3.(2022·内江)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。提纯工业级粗氧化锌(含有FeO、MnO、NiO等杂质)的流程如图所示:
(已知:在反应①中,金属氧化物与硫酸发生复分解反应生成盐和水。)
(3)反应②中除掉的杂质离子是 Mn2+、Fe2+ ;反应④所得滤液中,溶质的主要成分是 硫酸钠 。
(4)反应⑤生成三种氧化物,反应的化学方程式为 Zn2(OH)2CO3 2ZnO+CO2↑+H2O ,若在实验室中进行此反应,Zn2(OH)2CO3固体应放在 坩埚 (填“坩埚”或“烧杯”)中高温加热。
将粗ZnO研碎
H2O
置换
Mn2+、Fe2+
硫酸钠
Zn2(OH)2CO3
2ZnO
+CO2↑+H2O
坩
埚
4.(2022·贵港)要实现“装满‘米袋子’,充实‘菜篮子’”的目标,化肥起到非常重要的作用。工业以煤、空气和水为原料生产碳酸氢铵的一种流程如图所示:
(1)NH4HCO3属于 氮 (填“氮”、“磷”、“钾”或“复合”)肥,其中碳元素的化合价为 +4 。
(2)“造气”是利用煤、空气和水在一定条件下反应获取CO2、N2和H2,加快“造气”反应速率的具体措施有 将煤粉碎(或升高温度,加入催化剂等) (写一点)。
氮
+4
将煤粉碎(或升高温度,加入催化剂等)
(4)“循环”是指 氮气、氢气 (填物质名称)的循环利用。
N2
氮气、氢气
5.(2022·梧州)二氧化氯(ClO2)是一种常用的消毒剂,工业以粗盐水(含少量CaSO4、MgSO4等杂质)为原料生产ClO2,工艺流程如图所示。
(1)除去粗盐中的难溶性杂质的步骤是溶解、 过滤 。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序: ③②①(或②③①或②①③) (填序号)。
①Na2CO3 ②BaCl2 ③NaOH
过滤
③
②①(或②③①或②①③)
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的 Na2CO3、NaOH (填化学式)。
(5)生产过程中能循环利用的物质X是 NaCl (填化学式)。
Na2CO3、NaOH
3H2↑
NaCl
6.(2022·广安)黄铜(铜锌合金)长期使用会锈蚀,铜锈主要成分为Cu2(OH)2CO3。查阅资料:铜锈可以与稀硫酸反应,杂质不与稀硫酸反应。回收废黄铜有用成分,调配锌铜比例,可以铸造新的黄铜,变废为宝。其工艺流程图如下:
Cu2(OH)2 CO3
(2)步骤一、步骤二、步骤三中均有混合物分离的操作,且方法相同,分离需要的玻璃仪器除玻璃棒、烧杯外,还需要 漏斗 (填玻璃仪器名称),其中玻璃棒的作用是 引流 。
(4)系列处理二后获得锌的质量 > (填“<”“=”或“>”)原废黄铜中锌的质量。
(5)黄铜颜色与黄金相似,人称“愚人金”,常被不法商贩冒充黄金牟取暴利。下列选项中不能区别黄铜与黄金的方法是 A 。
A.用磁铁吸引 B.浸入稀盐酸溶液,观察有无气泡
C.在空气中灼烧后观察颜色 D.测定密度大小
漏斗
引流
置
换反应
>
A
7.(2022·黄石)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某学习小组以此粉末为原料,设计以下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体[NH4Fe(SO4)2·xH2O]
已知:①CeO2不与稀酸反应,也不与NaOH溶液反应;②SiO2不与酸反应(氢氟酸除外)。
回答下列问题:
(1)若NH4Fe(SO4)2·xH2O的相对分子质量为374,则x= 6 。
(2)稀酸A是 稀硫酸 ;操作①的名称为 过滤 ;滤渣2是 SiO2 (填化学式)。
(3)滤液1中的溶质是(稀酸A不过量) FeSO4 和 Fe2(SO4)3 (写化学式)。
(5)滤液2生成Ce(OH)4的过程中,铈元素的化合价 升高 (填“升高”或“降低”)。
6
稀硫酸
过滤
SiO2
FeSO4
Fe2(SO4)3
H2O
升高
2H2O
8.(2022·哈尔滨模拟)高纯氧化铁(Fe2O3)又称“引火铁“,在现代工业上有广泛应用前景。如图是用赤铁矿(含少量SiO2等杂质,SiO2及杂质不溶于水、不与酸反应)为原料,实验室模拟制备高纯氧化铁的生产流程示意图。
已知:氨水呈碱性;(NH4)2CO3溶液呈碱性,40 ℃以上易分解;FeCO3是白色沉淀
(2)步骤①的反应现象是 有气泡生成,溶液变成浅绿色 ,步骤②要进行的操作是 过滤 。
(3)溶液I中的溶质有 FeSO4、H2SO4 (写化学式)。
3CO2
有气泡生成,溶液变成浅绿色
过滤
FeSO4、H2SO4
除去过量的硫酸
FeSO4+(NH4) 2CO3
防止(NH4)2CO3受热分解
(5)用蒸馏水洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志:取最后一次洗涤液,向其中加入适量的BaCl2溶液, 无白色沉淀产生 (填现象),即为洗涤干净。
无白色沉淀产生
主题六 题型突破
第27讲 综合能力——化工流程题
化工流程题是中考必考题型。它将初中化学知识和模拟化工生产有机结合起来,具有综合性、应用性、陌生性的特点,着重考查学生基础知识应用能力、提取应用信息的能力,考查的知识点主要包括:物质的转化、除杂、分离等知识。题目一般包含:题头(以文字的形式介绍工艺生产的情景和产品等必要信息),题干(一般以流程图的形式介绍工艺生产的流程),题尾(将生产过程中涉及的初中化学知识设置成问题)三部分构成。化工流程题的一般解法:
1.阅读题头。从题头中获取相关信息,明确化工流程的目的。
2.精读题干。就是仔细分析流程图的每一环节。主要从这几个方面分析:涉及哪些物质?有没有过量的物质?发生了哪些化学反应?这些反应的结果怎样?对最后的产品有什么影响?采用什么方式提纯分离最终的产品?
3.关注箭头方向。从左向右的箭头表示流程顺序和步骤,从上往下的箭头表示添加原料,逆转的箭头表示可循环利用。
4.准确作答。根据题目设置的问题,找到题干中对应的步骤,找出关键词,仔细辨析,正确作答。特别要注意书写规范,表述准确。
类型1 物质制备型
典例1:(2019.21)某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。已知:Zn(OH)2溶于强碱形成可溶性盐。请回答:
(1)滤渣Ⅰ中一定有 铜 。
铜
(3)调节pH可用NaOH,但不能过量,其原因是 Zn(OH)2溶于强碱形成可溶性盐,导致产率下降 。
生成的氢气具有可燃
性,避免不纯的氢气遇明火发生爆炸
置换反
应
Zn(OH)2溶于强碱形成可溶
性盐,导致产率下降
(4)焙烧Zn(OH)2发生分解反应的化学方程式为 Zn(OH)2 ZnO+H2O 。
ZnO+
H2O
解析:根据“合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物”,加入稀硫酸后,可直接判断出:滤渣Ⅰ是铜,滤液Ⅰ中含有的溶质是硫酸锌、硫酸亚铁、硫酸铜及铁元素的硫酸盐,同时生成了氢气;根据题目信息“Zn(OH)2溶于强碱形成可溶性盐”可知,调节pH时NaOH不能过量;最后根据流程图的最后一步提供的信息写出氢氧化锌分解的化学方程式,此处要注意反应条件直接写“焙烧”,不能写成高温。
变式训练
变式1:(2018.21)孔雀石的主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。
请回答:
(1)滤渣b的化学式为 SiO2 。
SiO2
(2)溶液c中的溶质有: H2SO4 、 CuSO4 、 Fe2(SO4)3 (写化学式)。
(3)盐溶液d的颜色为 蓝色 ;实验室蒸发溶液时用到的玻璃仪器有 玻璃棒 (写一种)。
H2SO4
CuSO4
Fe2(SO4)3
蓝色
玻璃棒
氯化铵
类型2 物质的利用型
典例2:(2017.21)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、 降温结晶 、过滤,得到FeSO4晶体,其中氮气的作用是 防止硫酸亚铁被氧化 。
Ca(OH)2+
降温结晶
防止硫酸亚铁被氧化
(4)政府倡导垃圾分类,其好处是 保护环境(或“回收利用废旧资源”) (写一点)。
保护环境(或“回收利用废旧资源”)
解析:根据“资料1:垃圾焚烧产生的烟气中含有SO2等有害气体”和“石灰浆吸收SO2(性质与CO2相似)”这两条信息,写出石灰浆吸收SO2的化学方程式。根据题干中“生锈的铁制品”这一信息可知含有铁和氧化铁,分别写出它们与稀硫酸反应的化学方程式。根据“将所得FeSO4溶液在氮气环境中蒸发浓缩”这一信息可知下一步是降温结晶,再根据“资料2:FeSO4容易被空气中的O2氧化”这一信息推测氮气的作用。
变式训练
变式2:(2021·深圳)某科学兴趣小组,用废渣(主要为CaCO3,还含有C、Fe2O3、MgO等少量杂质)去制作CaCl2,反应过程如图所示。
(1)Ⅰ过程中加过量稀盐酸的目的是 使碳酸钙、氧化铁、氧化镁完全反应 。
使碳酸钙、氧化铁、氧化镁完全反应
(3)滤渣一的成分为 C (填化学式)。
(4)X溶液为 NaOH (填化学式)。
(5)NaCl在生活中的用处: 用作调味品 (写一例)。
(6)已知CaCl2与焦炭、BaSO4在高温下生成BaCl2、CO和CaS,写出该反应的化学方程式:
复分解
C
NaOH
用作调味品
1.(2021.20)牙膏中常用碳酸钙粉末作摩擦剂,利用石灰石(杂质不溶于水和酸)制备纯净碳酸钙的一种方法如图。
过滤
(3)该方法中,用稀硫酸代替稀盐酸对制备碳酸钙是否有影响?判断并简述理由: 有影响,是因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,从而导致碳酸钙产率降低 。
(4)大气中CO2含量不断上升,会导致 温室效应 。我国在联合国大会上提出:努力争取2060年前实现“碳中和”。请提出一条实现“碳中和”的措施: 多植树造林(或低碳出行等) 。
复分解反应
有影响,是因为稀硫酸和氧化钙反应生成的硫酸钙微溶于水,从而导致碳酸
钙产率降低
温室效应
多
植树造林(或低碳出行等)
2.(2020.20)某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。工艺流程如图:
(1)该废酸液的pH < 7(填“>”或“<”)。操作Ⅰ的名称为 过滤 。
(2)电石渣转化为石灰乳的过程会 放出 (填“吸收”或“放出”)热量。
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是 Fe(OH)2 和 CaSO4 (填化学式)。
<
过滤
放出
Fe(OH)2
CaSO4
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为 Fe3O4 。
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为 7.5 ,pH较低时产率较低的主要原因是 Fe3O4能与酸发生反应 。
溶液的pH 6.0 6.5 7.0 7.5 8.0 9.0
产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰黑色
产率 43.9% 50.6% 86.2% 93.0% 92.3% 91.6%
Fe3O4
7.5
Fe3O4能与酸发
生反应
3.(2022·内江)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。提纯工业级粗氧化锌(含有FeO、MnO、NiO等杂质)的流程如图所示:
(已知:在反应①中,金属氧化物与硫酸发生复分解反应生成盐和水。)
(3)反应②中除掉的杂质离子是 Mn2+、Fe2+ ;反应④所得滤液中,溶质的主要成分是 硫酸钠 。
(4)反应⑤生成三种氧化物,反应的化学方程式为 Zn2(OH)2CO3 2ZnO+CO2↑+H2O ,若在实验室中进行此反应,Zn2(OH)2CO3固体应放在 坩埚 (填“坩埚”或“烧杯”)中高温加热。
将粗ZnO研碎
H2O
置换
Mn2+、Fe2+
硫酸钠
Zn2(OH)2CO3
2ZnO
+CO2↑+H2O
坩
埚
4.(2022·贵港)要实现“装满‘米袋子’,充实‘菜篮子’”的目标,化肥起到非常重要的作用。工业以煤、空气和水为原料生产碳酸氢铵的一种流程如图所示:
(1)NH4HCO3属于 氮 (填“氮”、“磷”、“钾”或“复合”)肥,其中碳元素的化合价为 +4 。
(2)“造气”是利用煤、空气和水在一定条件下反应获取CO2、N2和H2,加快“造气”反应速率的具体措施有 将煤粉碎(或升高温度,加入催化剂等) (写一点)。
氮
+4
将煤粉碎(或升高温度,加入催化剂等)
(4)“循环”是指 氮气、氢气 (填物质名称)的循环利用。
N2
氮气、氢气
5.(2022·梧州)二氧化氯(ClO2)是一种常用的消毒剂,工业以粗盐水(含少量CaSO4、MgSO4等杂质)为原料生产ClO2,工艺流程如图所示。
(1)除去粗盐中的难溶性杂质的步骤是溶解、 过滤 。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序: ③②①(或②③①或②①③) (填序号)。
①Na2CO3 ②BaCl2 ③NaOH
过滤
③
②①(或②③①或②①③)
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的 Na2CO3、NaOH (填化学式)。
(5)生产过程中能循环利用的物质X是 NaCl (填化学式)。
Na2CO3、NaOH
3H2↑
NaCl
6.(2022·广安)黄铜(铜锌合金)长期使用会锈蚀,铜锈主要成分为Cu2(OH)2CO3。查阅资料:铜锈可以与稀硫酸反应,杂质不与稀硫酸反应。回收废黄铜有用成分,调配锌铜比例,可以铸造新的黄铜,变废为宝。其工艺流程图如下:
Cu2(OH)2 CO3
(2)步骤一、步骤二、步骤三中均有混合物分离的操作,且方法相同,分离需要的玻璃仪器除玻璃棒、烧杯外,还需要 漏斗 (填玻璃仪器名称),其中玻璃棒的作用是 引流 。
(4)系列处理二后获得锌的质量 > (填“<”“=”或“>”)原废黄铜中锌的质量。
(5)黄铜颜色与黄金相似,人称“愚人金”,常被不法商贩冒充黄金牟取暴利。下列选项中不能区别黄铜与黄金的方法是 A 。
A.用磁铁吸引 B.浸入稀盐酸溶液,观察有无气泡
C.在空气中灼烧后观察颜色 D.测定密度大小
漏斗
引流
置
换反应
>
A
7.(2022·黄石)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某学习小组以此粉末为原料,设计以下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体[NH4Fe(SO4)2·xH2O]
已知:①CeO2不与稀酸反应,也不与NaOH溶液反应;②SiO2不与酸反应(氢氟酸除外)。
回答下列问题:
(1)若NH4Fe(SO4)2·xH2O的相对分子质量为374,则x= 6 。
(2)稀酸A是 稀硫酸 ;操作①的名称为 过滤 ;滤渣2是 SiO2 (填化学式)。
(3)滤液1中的溶质是(稀酸A不过量) FeSO4 和 Fe2(SO4)3 (写化学式)。
(5)滤液2生成Ce(OH)4的过程中,铈元素的化合价 升高 (填“升高”或“降低”)。
6
稀硫酸
过滤
SiO2
FeSO4
Fe2(SO4)3
H2O
升高
2H2O
8.(2022·哈尔滨模拟)高纯氧化铁(Fe2O3)又称“引火铁“,在现代工业上有广泛应用前景。如图是用赤铁矿(含少量SiO2等杂质,SiO2及杂质不溶于水、不与酸反应)为原料,实验室模拟制备高纯氧化铁的生产流程示意图。
已知:氨水呈碱性;(NH4)2CO3溶液呈碱性,40 ℃以上易分解;FeCO3是白色沉淀
(2)步骤①的反应现象是 有气泡生成,溶液变成浅绿色 ,步骤②要进行的操作是 过滤 。
(3)溶液I中的溶质有 FeSO4、H2SO4 (写化学式)。
3CO2
有气泡生成,溶液变成浅绿色
过滤
FeSO4、H2SO4
除去过量的硫酸
FeSO4+(NH4) 2CO3
防止(NH4)2CO3受热分解
(5)用蒸馏水洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志:取最后一次洗涤液,向其中加入适量的BaCl2溶液, 无白色沉淀产生 (填现象),即为洗涤干净。
无白色沉淀产生
同课章节目录
