化学人教版(2019)必修第一册2.3.1物质的量的单位——摩尔 课件(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1物质的量的单位——摩尔 课件(共21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 34.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 16:59:50 | ||
图片预览








文档简介
(共21张PPT)
第二章 海水中重要的元素
——钠和氯
第三节 物质的量
第1 课时 物质的量的单位——摩尔
1.了解物质的量的单位-摩尔、阿伏加德罗常数、摩尔质量的概念。
2. 建立物质的量与物质的粒子数、物质的质量之间的计算模型。
3.能结合实验或生产、生活中的实际数据,能运用模型进行相关计算。
4. 认识物质的量在化学定量研究中的重要作用。
教学引入:一滴水,大乾坤
水
分
子
宏观
微观
连接宏观世界与微观世界的桥梁
物质的量
01
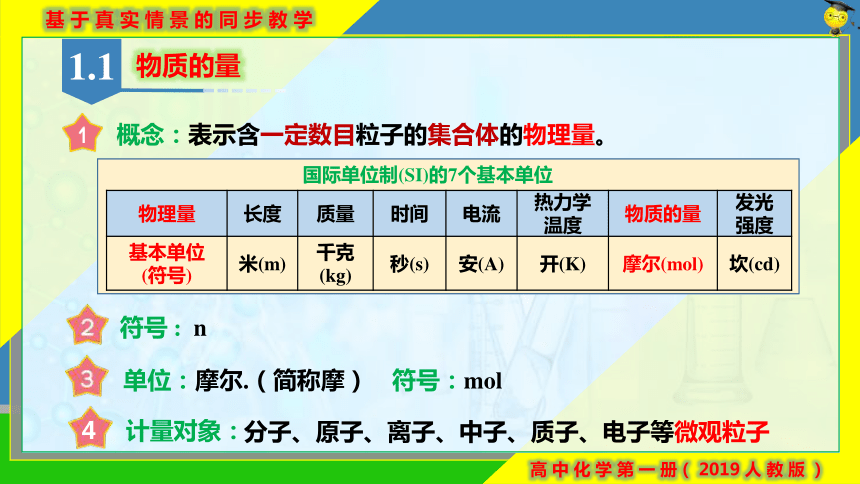
国际单位制(SI)的7个基本单位
1.1
物质的量
概念:表示含一定数目粒子的集合体的物理量。
符号 : n
单位:摩尔.(简称摩) 符号:mol
4
计量对象:
分子、原子、离子、中子、质子、电子等微观粒子
物理量 长度 质量 时间 电流 热力学 温度 物质的量 发光
强度
基本单位 (符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩尔(mol) 坎(cd)
微点拨
1.“物质的量”是一个专有名词,是个整体,不是物质的数量,也不是物质的质量。
2. 摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
3. 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。若用中文,则必须指明微粒的种类。
4. 物质的量的数值可以是整数,也可以是小数。
2. 3 mol O
3. 1 mol 氧
4. 2 mol H2O
8. 1 mol 钠元素
5. 5 mol e-
6. 1 mol 质子
7. 1.5 mol OH-
9. 1 mol 细菌
1. 1 mol 苹果
对
不对,指代不明,可指氧原子也可指氧分子
对,指氧原子
对,指水分子
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
对
不对,不能指宏观物质
对
判断下列说法是否正确,并加以说明理由
课堂检测
1.下列表示错误的是:( )
A.1molH2 B.1molFe C.1molNH4+ D.1mol小米
D
2. 0.1molCH4中有 mol H, mol 原子
3. 含有0.12mol O的SO3的物质的量为 mol
4. 0.2mol CuSO4·5H2O中含有 mol O
5. 1mol H2O中有 mol质子。
6. 2 mol O2与 mol H2SO4所含O相等。
0.4
0.5
0.04
1.8
10
1
1mol 微观粒子
?个
1打 = 12个
1箱 = 24瓶
国际上规定,1mol 粒子集合体中所含的微粒数约为6.02×1023 。
单位:mol-1
符号:NA
阿伏加德罗常数
≈ 6.02×1023
例:1mol H2O 中约含有6.02×1023个水分子
例:1mol Al 中约含有6.02×1023个铝原子
1.2
阿伏伽德罗常数
概念:1 mol 任何粒子的粒子数。
符号 : NA
单位:单位: mol-1 (每摩尔)
4
近似值:6.02×1023mol-1
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数,不能误认为NA就是6.02×1023。
(2)在计算时采用近似值6.02×1023mol-1
微点拨
完成下列表格
微粒种类 H2O H2O Al Al N2 N2
物质的量(n) 1 mol 0.5 mol 5 mol
微粒数目(N) 2NA 3NA NA
3 mol
2 mol
1 mol
NA
0.5NA
5NA
【思考】物质的量(n)、微粒数目(N)和阿伏伽德罗常数(NA)之间存在怎样的定量关系?
N = n × NA
微粒数 = 物质的量 × 阿伏伽德罗常数
n=
N
NA
物质的量与微观粒子数之间成正比:
n1/n2=N1/N2
课堂检测
7. 3.01×1024 个氯化氢分子的物质的量是多少
8. 1.5 mol H2O中含有水分子的个数___________
1molH2O含___________ 个 H, ________个 O
9. 1个 H2O含________个H, ______个 O
2molH2O含___________ mol H, _________ mol O
10.1molNa2SO4中含有 molNa+ , molSO42-,
共含有离子的个数约为 _____________个。
2
1
3×6.02×1023
2
2
4
1
2NA
NA
0.5mol
1.5NA
3NA对吗?
质量是18 g
质量是27 g
1 mol H2O
约含有6.02×1023个水分子
1 mol Al
约含有6.02×1023 个铝原子
H2O的相对分子质量为18
Al的相对原子质量为27
其数值都与该粒子的相对原了质量或相对分了质量相等
1 mol任何粒子或物质
质量以克为单位时
思考:对比1mol水和铝的质量及所含粒子数,试分析有何规律?
阿伏伽德罗常数
质量是18 g
质量是27 g
1 mol H2O
约含有6.02×1023个水分子
1 mol Al
约含有6.02×1023 个铝原子
H2O的相对分子质量为18
Al的相对原子质量为27
其数值都与该粒子的相对原了质量或相对分了质量相等
1 mol任何粒子或物质
质量以克为单位时
摩尔质量
02
1.定义:
单位物质的量(1mol)的物质所具有的质量,
符号:M,单位:g/mol、或g·mol-1
m=nM )
2.公式:
(n=
m
M
2.1
摩尔质量
微点拨
①摩尔质量以g/mol为单位时,在数值上与相对分子(或原子)质量相等。
②对于指定的物质来说,其摩尔质量是一个定值,不随物质的量的多少而改变。
③电子的质量非常微小,离子的摩尔质量以g/mol为单位时,在数值上近似等于相对分子(或原子)质量。
相对原子质量:Fe:56 O:16 H:1
①铁的摩尔质量是 ,即1mol铁的质量是 ;
28g铁中含有 mol铁原子。
② 水的相对分子质量是 ,摩尔质量是 ;
2mol的水是 克;90g水是 mol
36
56g
0.5
18g/mol
56g/mol
5
18
课堂小结
连接宏观世界与微观世界的桥梁
物质的量
质量
摩尔质量
阿伏加德罗常数
微观
宏观
=
N
NA
n
微粒个数
=
m
M
(1)H2SO4的摩尔质量是98 g。( )
(2)1 mol 水中含有2 mol 氢和1 mol 氧。( )
(3)摩尔可以把宏观物质的数量与微观粒子的数量联系起来。( )
(4)摩尔表示6.02×1023个粒子的集体。( )
(5)1 mol任何物质都含有6.02×1023个分子。( )
(6)0.012 kg 12C中含有约6.02×1023个碳原子。( )
11.判断正误(正确的打“√”,错误的打“×”)。
×
×
×
×
×
√
课堂检测
12.计算填空:
(1)2 mol CO2中含 mol碳原子, 个氧原子(用NA表示阿伏加德罗常数的值,下同), 个质子,质量是 g。
(2)40.5 g某金属氯化物RCl2含有0.6 mol氯离子,则金属R的摩尔质量为 。
(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的质量为 ;
②混合气体的平均摩尔质量为 。
2
44NA
4NA
88
64 g·mol-1
5.6 g
36 g·mol-1
课堂检测
第二章 海水中的重要元素——钠和氯
第二节 物质的量
第1课时 物质的量的单位——摩尔
第二章 海水中重要的元素
——钠和氯
第三节 物质的量
第1 课时 物质的量的单位——摩尔
1.了解物质的量的单位-摩尔、阿伏加德罗常数、摩尔质量的概念。
2. 建立物质的量与物质的粒子数、物质的质量之间的计算模型。
3.能结合实验或生产、生活中的实际数据,能运用模型进行相关计算。
4. 认识物质的量在化学定量研究中的重要作用。
教学引入:一滴水,大乾坤
水
分
子
宏观
微观
连接宏观世界与微观世界的桥梁
物质的量
01
国际单位制(SI)的7个基本单位
1.1
物质的量
概念:表示含一定数目粒子的集合体的物理量。
符号 : n
单位:摩尔.(简称摩) 符号:mol
4
计量对象:
分子、原子、离子、中子、质子、电子等微观粒子
物理量 长度 质量 时间 电流 热力学 温度 物质的量 发光
强度
基本单位 (符号) 米(m) 千克(kg) 秒(s) 安(A) 开(K) 摩尔(mol) 坎(cd)
微点拨
1.“物质的量”是一个专有名词,是个整体,不是物质的数量,也不是物质的质量。
2. 摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
3. 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。若用中文,则必须指明微粒的种类。
4. 物质的量的数值可以是整数,也可以是小数。
2. 3 mol O
3. 1 mol 氧
4. 2 mol H2O
8. 1 mol 钠元素
5. 5 mol e-
6. 1 mol 质子
7. 1.5 mol OH-
9. 1 mol 细菌
1. 1 mol 苹果
对
不对,指代不明,可指氧原子也可指氧分子
对,指氧原子
对,指水分子
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
对
不对,不能指宏观物质
对
判断下列说法是否正确,并加以说明理由
课堂检测
1.下列表示错误的是:( )
A.1molH2 B.1molFe C.1molNH4+ D.1mol小米
D
2. 0.1molCH4中有 mol H, mol 原子
3. 含有0.12mol O的SO3的物质的量为 mol
4. 0.2mol CuSO4·5H2O中含有 mol O
5. 1mol H2O中有 mol质子。
6. 2 mol O2与 mol H2SO4所含O相等。
0.4
0.5
0.04
1.8
10
1
1mol 微观粒子
?个
1打 = 12个
1箱 = 24瓶
国际上规定,1mol 粒子集合体中所含的微粒数约为6.02×1023 。
单位:mol-1
符号:NA
阿伏加德罗常数
≈ 6.02×1023
例:1mol H2O 中约含有6.02×1023个水分子
例:1mol Al 中约含有6.02×1023个铝原子
1.2
阿伏伽德罗常数
概念:1 mol 任何粒子的粒子数。
符号 : NA
单位:单位: mol-1 (每摩尔)
4
近似值:6.02×1023mol-1
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数,不能误认为NA就是6.02×1023。
(2)在计算时采用近似值6.02×1023mol-1
微点拨
完成下列表格
微粒种类 H2O H2O Al Al N2 N2
物质的量(n) 1 mol 0.5 mol 5 mol
微粒数目(N) 2NA 3NA NA
3 mol
2 mol
1 mol
NA
0.5NA
5NA
【思考】物质的量(n)、微粒数目(N)和阿伏伽德罗常数(NA)之间存在怎样的定量关系?
N = n × NA
微粒数 = 物质的量 × 阿伏伽德罗常数
n=
N
NA
物质的量与微观粒子数之间成正比:
n1/n2=N1/N2
课堂检测
7. 3.01×1024 个氯化氢分子的物质的量是多少
8. 1.5 mol H2O中含有水分子的个数___________
1molH2O含___________ 个 H, ________个 O
9. 1个 H2O含________个H, ______个 O
2molH2O含___________ mol H, _________ mol O
10.1molNa2SO4中含有 molNa+ , molSO42-,
共含有离子的个数约为 _____________个。
2
1
3×6.02×1023
2
2
4
1
2NA
NA
0.5mol
1.5NA
3NA对吗?
质量是18 g
质量是27 g
1 mol H2O
约含有6.02×1023个水分子
1 mol Al
约含有6.02×1023 个铝原子
H2O的相对分子质量为18
Al的相对原子质量为27
其数值都与该粒子的相对原了质量或相对分了质量相等
1 mol任何粒子或物质
质量以克为单位时
思考:对比1mol水和铝的质量及所含粒子数,试分析有何规律?
阿伏伽德罗常数
质量是18 g
质量是27 g
1 mol H2O
约含有6.02×1023个水分子
1 mol Al
约含有6.02×1023 个铝原子
H2O的相对分子质量为18
Al的相对原子质量为27
其数值都与该粒子的相对原了质量或相对分了质量相等
1 mol任何粒子或物质
质量以克为单位时
摩尔质量
02
1.定义:
单位物质的量(1mol)的物质所具有的质量,
符号:M,单位:g/mol、或g·mol-1
m=nM )
2.公式:
(n=
m
M
2.1
摩尔质量
微点拨
①摩尔质量以g/mol为单位时,在数值上与相对分子(或原子)质量相等。
②对于指定的物质来说,其摩尔质量是一个定值,不随物质的量的多少而改变。
③电子的质量非常微小,离子的摩尔质量以g/mol为单位时,在数值上近似等于相对分子(或原子)质量。
相对原子质量:Fe:56 O:16 H:1
①铁的摩尔质量是 ,即1mol铁的质量是 ;
28g铁中含有 mol铁原子。
② 水的相对分子质量是 ,摩尔质量是 ;
2mol的水是 克;90g水是 mol
36
56g
0.5
18g/mol
56g/mol
5
18
课堂小结
连接宏观世界与微观世界的桥梁
物质的量
质量
摩尔质量
阿伏加德罗常数
微观
宏观
=
N
NA
n
微粒个数
=
m
M
(1)H2SO4的摩尔质量是98 g。( )
(2)1 mol 水中含有2 mol 氢和1 mol 氧。( )
(3)摩尔可以把宏观物质的数量与微观粒子的数量联系起来。( )
(4)摩尔表示6.02×1023个粒子的集体。( )
(5)1 mol任何物质都含有6.02×1023个分子。( )
(6)0.012 kg 12C中含有约6.02×1023个碳原子。( )
11.判断正误(正确的打“√”,错误的打“×”)。
×
×
×
×
×
√
课堂检测
12.计算填空:
(1)2 mol CO2中含 mol碳原子, 个氧原子(用NA表示阿伏加德罗常数的值,下同), 个质子,质量是 g。
(2)40.5 g某金属氯化物RCl2含有0.6 mol氯离子,则金属R的摩尔质量为 。
(3)已知0.4 mol的CO和CO2的混合气体共14.4 g,则
①CO的质量为 ;
②混合气体的平均摩尔质量为 。
2
44NA
4NA
88
64 g·mol-1
5.6 g
36 g·mol-1
课堂检测
第二章 海水中的重要元素——钠和氯
第二节 物质的量
第1课时 物质的量的单位——摩尔
