2023年广东中考化学模拟试卷(一)(25张PPT)
文档属性
| 名称 | 2023年广东中考化学模拟试卷(一)(25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 20:48:19 | ||
图片预览








文档简介
(共25张PPT)
2023年广东省初中学业水平考试
化学模拟试卷(一)
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(地方特色)潮州被称为“中国瓷都”。下列瓷器的制作过程中,主要发生化学变化的是 ( )
A.采石制泥 B.拉坯造型 C.晒坯蘸釉 D.烧窑成瓷
2.下列位置张贴的标识错误的是 ( )
A.可回收垃圾桶 B.存放酒精的试剂瓶
C.面粉加工厂 D.学校水龙头旁边
D
B
3.下列家庭中常见的物品显碱性的是 ( )
A.食盐水 B.汽水
C.肥皂水 D.厕所清洁剂
4.对物质进行分类是研究物质的基本方法。下列属于纯净物的是( )
A.蒸馏水 B.空气 C.生铁 D.盐酸
5.下列仪器加热时需要垫陶土网的是 ( )
A. B. C. D.
C
A
D
6.加入“化学用语家族”群后必须进行自我介绍,方式如图中群公告。下列自我介绍错误的是 ( )
A.Mg:我是一个镁原子,还可以表示镁元素和镁这种金属
B.2Cu:我是两个铜原子,还可以表示两个铜元素
C.O2:我是一个氧分子,还可以表示氧气
D.Al3+:我是一个带3个单位正电荷的铝离子
B
7.※※(传统文化)鎏金铜俑(如图)是广州博物馆的重要馆藏之一。传统鎏金工艺是将金溶于汞中制成“金汞齐”,涂抹在器物表面,加热使汞挥发后,金层附着于器物表面。下列说法错误的是 ( )
A.“金汞齐”是一种化合物
B.鎏金工艺利用了汞的挥发性
C.铜器鎏金能防止器物被腐蚀
D.鎏金的原理可用于金的富集
A
【解析】A.金溶于汞各自的化学性质不发生变化,得到的“金汞齐”属于混合物,错误;B.将“金汞齐”涂抹在器物表面,加热使汞挥发后,金层附着于器物表面,利用了汞的挥发性,正确;C.金不活泼,附着于铜器表面能隔绝空气和水,防止器物被腐蚀,正确;D.利用鎏金原理可将金转化为液态的“金汞齐”,与固态杂质分离后,再加热使汞挥发,得到较纯净的金,正确。故选A。
8.(社会热点)美国俄亥俄州发生的氯乙烯泄漏事件引发广泛关注。氯乙烯(C2H3Cl)常用于生产聚氯乙烯[(C2H3Cl)n]塑料,属于一级致癌物。下列有关说法正确的是 ( )
A.氯乙烯中碳、氢元素的质量比为2∶3
B.聚氯乙烯塑料属于复合材料
C.氯乙烯与聚氯乙烯的分子构成相同
D.氯乙烯与聚氯乙烯的元素组成相同
D
9.钴不仅是制造合金钢的重要金属,还是各种高级颜料的重要原料。钴的化学性质与铁相似,其相关信息如图,下列有关说法错误的是 ( )
A.图中X=15,Y=27
B.钴原子在化学反应中易得到电子
C.钴位于元素周期表第四周期
D.金属钴可与稀硫酸反应
B
10.下列有关化学知识的应用正确的是 ( )
A.安全:进入废弃的煤矿井前,应先做灯火试验
B.工业:炼铁厂通常在高温条件下用焦炭直接还原赤铁矿炼铁
C.医疗:新冠特效药的研制说明化学可以研究和创造自然界原本
不存在的新物质
D.健康:微量元素对人体具有重要作用,补充锌元素可预防甲状腺肿大
C
11.(粮食安全)2023年中央一号文件将“抓紧抓好粮食和重要农产品稳产保供”放在首位。要实现这一目标,化肥起到非常重要的作用。下列关于化肥的说法正确的是 ( )
A.KNO3、K2SO4都属于复合肥
B.Ca(H2PO4)2能增强农作物的抗倒伏能力
C.均衡适度地施用化肥,提倡施用农家肥
D.所有氮肥都不能与碱性物质混合施用
C
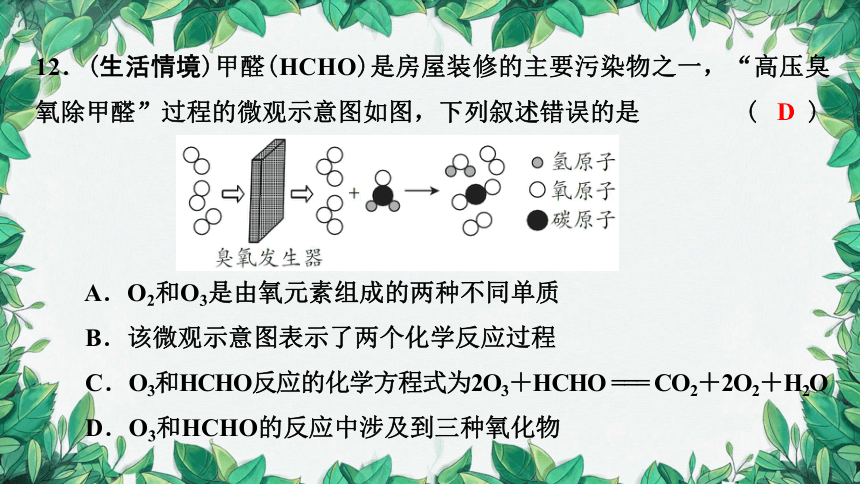
12.(生活情境)甲醛(HCHO)是房屋装修的主要污染物之一,“高压臭氧除甲醛”过程的微观示意图如图,下列叙述错误的是 ( )
A.O2和O3是由氧元素组成的两种不同单质
B.该微观示意图表示了两个化学反应过程
C.O3和HCHO反应的化学方程式为2O3+HCHO === CO2+2O2+H2O
D.O3和HCHO的反应中涉及到三种氧化物
D
13.※※如图为物质M的溶解度曲线,下列有关说法正确的是 ( )
A.t1 ℃时,M的饱和溶液的溶质质量分数为20%
B.将b点溶液降温至t1 ℃,溶液恰好饱和
C.t2 ℃时,a点溶液中溶质与溶剂的质量比为3∶7
D.将t2 ℃时M的饱和溶液降温至t1 ℃,析出10 g晶体
B
14.※※下列实验方法能达到实验目的的是 ( )
选项 实验目的 实验方法
A 鉴别CO和CO2 分别通入澄清石灰水中,观察现象
B 鉴别碳粉和MnO2 取样,分别加水搅拌,观察现象
C 除去FeSO4溶液中的少量MgSO4 加入足量镁粉,充分反应后过滤
D 除去CuCl2固体中的CuO 加水溶解后,过滤、洗涤、干燥
A
【解析】A.CO不与Ca(OH)2反应,通入澄清石灰水中无明显现象,CO2能使澄清石灰水变浑浊,正确;B.碳粉和MnO2均为不溶于水的黑色粉末,加水搅拌不能鉴别,错误;C.向含有少量MgSO4的FeSO4溶液中加入镁粉,Mg与FeSO4反应生成MgSO4和Fe,除去了要提纯的物质,错误;D.CuCl2可溶于水,CuO不溶于水,加水溶解后,过滤、洗涤、干燥后得到的是CuO固体,而不是CuCl2,错误。故选A。
15.※※(数字化实验)用不同物质测定空气里氧气的含量,分别在图甲装置的燃烧匙内放置足量铁粉、白磷,用电热丝引燃(铁粉能在空气中燃烧)。氧气含量随时间的变化情况如图乙,下列说法错误的是 ( )
A.温度传感器显示,燃烧过程中
瓶内温度均升高
B.待铁粉或白磷熄灭后,应立即
打开弹簧夹
C.分析图乙可知,用铁粉测定空
气里氧气含量的结果更准确
D.利用电热丝引燃,无需打开瓶塞,实验测定结果更准确
B
【解析】A.铁粉和白磷燃烧都放热,因此温度传感器显示,燃烧过程中瓶内温度均升高,正确;B.待铁粉或白磷熄灭后,应等装置冷却后,再打开弹簧夹,错误;C.分析图乙可知,实验中消耗氧气更彻底的是铁粉,因此用铁粉测定空气里氧气含量的结果更准确,正确;D.利用电热丝引燃,无需打开瓶塞,瓶中气体始终处于封闭状态,因此实验测定结果更准确,正确。故选B。
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.(社会热点)2023年1月1日起,全国全面供应国六B标准车用汽油。与国六A标准车用汽油相比,一氧化碳、氮氧化物及细颗粒物的排放均大幅度下降。
(1)化石能源是目前使用最广泛的能源,包括煤、石油和__________。利用石油中各成分的________不同,将其分离可得到汽油。
(2)国六B标准车用汽油大面积广泛使用后,可以缓解的环境问题有________(填序号)。
A.酸雨 B.雾霾 C.温室效应
天然气
沸点
AB
(3)汽油的标号(如92号、95号)和辛烷(C8H18)的含量有关,写出辛烷在空气中充分燃烧的化学方程式:_________________________________。
(4)汽车发动后,化油器将汽油喷成雾状进入内燃机气缸,其目的是__________________________________________。
(5)寒冷的冬天,以汽油为燃料的汽车排气管口会出现大量白雾,用分子的观点解释产生白雾的原因:_____________________________________
_________________________。
2C8H18+25O2 16CO2+18H2O
===
点燃
增大汽油与氧气的接触面积,使其充分燃烧
汽车尾气中含有的大量水蒸气喷出后在
空气中遇冷液化成小水珠
17.(传统文化)春节、清明节、端午节和中秋节为我国四大传统节日,古诗中有许多关于传统节日习俗的描述。
(1)春节——听烧爆竹童心在,看换桃符老兴偏。
①传统爆竹生产过程中常添加高氯酸钾(KClO4)来增强安全性,其中氯元素显________价。
②写春联用的毛笔常用羊毛、兔毛等制作,检验毛笔是用动物毛发制作的操作和现象是______________________________。
(2)清明节——南北山头多墓田,清明祭扫各纷然。酿酒祭祀祖先,酒的主要成分的化学式为____________。祭祖先烧纸钱时,如不小心将墓前枯草点燃,应立即用土盖灭,这种灭火方法利用的原理是__________。
+7
灼烧,能闻到烧焦羽毛的气味
C2H5OH
隔绝氧气
(3)端午节——彩缕碧筠粽,香粳白玉团。
①鲜肉粽子用料讲究,除了糯米,还有猪肉、蛋黄、食用盐、植物油等。小欣的午餐是鲜肉粽子,从营养均衡的角度来看,还需增加的食物是________(填序号)。
A.馒头 B.卤鸡腿 C.炒青菜
②粽子虽然好吃,但不宜过量食用。小欣吃过粽子后,感觉有些胃酸过多,于是服用了一片胃药[主要成分为Mg(OH)2],发生反应的化学方程式为_____________________________________。
(4)中秋节——桂子月中落,天香云外飘。桂花香气的成分有多种,其中一种是芳樟醇(化学式为C10H18O),芳樟醇中________元素的质量分数最小。
C
Mg(OH)2+2HCl === MgCl2+2H2O
氧
18.化学是一门以实验为基础的科学。兴趣小组利用下列装置进行实验探究:
Ⅰ.常见气体的制取(如图1)
(1)标号仪器a的名称是________。
(2)用装置A制取氧气的化学反应方程式是_______________________________。
(3)在实验室制取二氧化碳应选用的药品是_________________________,装置B、C均可用于制取二氧化碳,与装置B相比,装置C的优点是______
__________________________________。收集CO2应选用装置_______(填序号),不选用另一个收集装置的原因是________________。
水槽
2KMnO4 K2MnO4+MnO2+O2↑
==
△
稀盐酸和大理石(或石灰石)
可以
随时添加药品(或可以持续产生气体)
E
CO2能溶于水
Ⅱ.(创新实验)探究分子的运动(如图2)
分别取6只装满氢气和空气的集气瓶,完成实验并记录现象如下表:
序号 集气瓶① 集气瓶② 抽取玻璃片后时间/s 火柴引燃的集气瓶 实验现象
实验1 H2 空气 10 ② 无爆鸣声
实验2 H2 空气 20 ② 微弱爆鸣声
实验3 H2 空气 30 ② 尖锐爆鸣声
实验4 空气 H2 5 ① 尖锐爆鸣声
实验5 空气 H2 10 ① 尖锐爆鸣声
实验6 空气 H2 15 ① 非常尖锐爆鸣声
(4)收集该实验所用的氢气最好选用图1中的装置________(填序号)。
(5)对比实验1和5,能说明氢气具有的物理性质是__________________。
(6)通过实验1~3的现象分析,可得出的结论是__________________。
D
密度比空气小
分子在不断运动
19.某化学小组进行综合实践活动时,对某工厂所排放污水的成分产生了兴趣,他们设计实验展开如下探究(不考虑其他成分对实验的影响)。
【查阅资料】①该工厂使用的原材料有硫酸钠、碳酸钠、氢氧化钠、氯化钠;②硫酸钠溶液显中性。
【提出问题】该工厂所排放污水的成分有哪些?
【作出猜想】排放的污水中含有硫酸钠、碳酸钠、氢氧化钠、氯化钠中的一种或几种。
【实验探究】(1)小明设计以下实验探究污水的成分:
实验步骤 实验现象 实验结论
①取少量污水,向其中滴入足量稀硝酸 有气泡产生 污水中含__________
_____________
②向①反应后的溶液中滴入少量BaCl2溶液 产生白色沉淀 污水中含__________
____________
Na2CO3
(或碳酸钠)
Na2SO4
(或硫酸钠)
实验步骤 实验现象 实验结论
①取少量污水,向其中滴入足量稀硝酸 有气泡产生 污水中含__________
_____________
②向①反应后的溶液中滴入少量BaCl2溶液 产生白色沉淀 污水中含__________
____________
③向②反应后的溶液中滴入少量AgNO3溶液 _________________ 污水中含有NaCl
④另取少量污水,向其中滴入过量CaCl2溶液,振荡,静置后再滴入无色酚酞溶液 _________________ _______________ 污水中不含NaOH
Na2CO3
(或碳酸钠)
Na2SO4
(或硫酸钠)
产生白色沉淀
先产生白色沉淀,
后溶液不变色
(2)写出步骤②中发生反应的化学方程式:______________________________。
【反思交流】(3)小红认为步骤③的结论不严谨,理由是_________________
_____________________________________________________。
(4)步骤④中加入过量CaCl2溶液的目的是______________________________
______________。
BaCl2+Na2SO4 === BaSO4↓+2NaCl
步骤②中滴加的
BaCl2溶液引入了Cl-,无法确定Cl-是否来源于NaCl
除尽Na2CO3,以免干扰NaOH
的检验
【拓展应用】处理污水通常采用的方法是“物化+生化”,主要操作设备包括:
a.格栅:除去污水中较大的悬浮物和漂浮物。
b.吸附池:吸附除去污水中的有机物。
c.沉淀池:加絮凝剂除去污水中较小的悬浮物。
d.接触池:“氯化法”对污水进行消毒。
(5)吸附池中,常加入____________除去污水中的色素和异味。
(6)结合日常所学,你认为上述污水处理流程的正确排序是_________(填序号)。
活性炭
acbd
20.天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶的各种化合物的主要原料。以天青石为原料生产Sr(OH)2·8H2O的工艺流程如下,请回答下列问题:
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
(1)“反应A”的化学方程式为SrSO4+2NH4HCO3 ==== SrCO3↓+(NH4)2SO4+CO2↑+X,则X的化学式为____________,反应温度要控制在30 ℃以下,其原因是_________________________。
H2O
NH4HCO3受热易分解
(2)操作Ⅰ中玻璃棒的作用是________,所得滤液2的溶质为(NH4)2SO4和_____________。
(3)“煅烧”过程中发生反应的化学方程式为______________________
________________________________ (写一个)。
引流
NH4HCO3
CaCO3 CaO+
CO2↑(或SrCO3 SrO+CO2↑)
===
高温
===
高温
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
(4)固体3“水浸”过程中________(填“吸收”或“放出”)热量,滤渣4的主要成分为____________。“趁热过滤”的目的是________________
____________________________。
(5)操作Ⅱ的步骤主要是蒸发浓缩、___________、过滤、洗涤、干燥。
放出
Ca(OH)2
防止温度降低时
Sr(OH)2因溶解度减小而析出
降温结晶
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
21.为测定某品牌小苏打(含NaCl杂质)中碳酸氢钠的含量,老师引导学生设计了如图实验装置(固定装置略,碱石灰可吸收CO2和水蒸气)。取20.0 g小苏打样品进行实验,充分反应后通入一段时间空气,最终称得干燥管a增重8.8 g。
(1)该实验中充分反应后通入空气的目的是__________________________
______________________。
(2)装置中干燥管b的作用是_______________________________________。
使反应产生的CO2完全被干
燥管a中的碱石灰吸收
防止空气中的CO2和水蒸气对结果产生干扰
(3)根据实验数据,计算该小苏打中碳酸氢钠的质量分数。(写出计算过程)
偏大
(4)若撤去装置中盛有浓硫酸的洗气瓶,则测定结果________(填“偏大”
“偏小”或“无影响”)。
2023年广东省初中学业水平考试
化学模拟试卷(一)
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(地方特色)潮州被称为“中国瓷都”。下列瓷器的制作过程中,主要发生化学变化的是 ( )
A.采石制泥 B.拉坯造型 C.晒坯蘸釉 D.烧窑成瓷
2.下列位置张贴的标识错误的是 ( )
A.可回收垃圾桶 B.存放酒精的试剂瓶
C.面粉加工厂 D.学校水龙头旁边
D
B
3.下列家庭中常见的物品显碱性的是 ( )
A.食盐水 B.汽水
C.肥皂水 D.厕所清洁剂
4.对物质进行分类是研究物质的基本方法。下列属于纯净物的是( )
A.蒸馏水 B.空气 C.生铁 D.盐酸
5.下列仪器加热时需要垫陶土网的是 ( )
A. B. C. D.
C
A
D
6.加入“化学用语家族”群后必须进行自我介绍,方式如图中群公告。下列自我介绍错误的是 ( )
A.Mg:我是一个镁原子,还可以表示镁元素和镁这种金属
B.2Cu:我是两个铜原子,还可以表示两个铜元素
C.O2:我是一个氧分子,还可以表示氧气
D.Al3+:我是一个带3个单位正电荷的铝离子
B
7.※※(传统文化)鎏金铜俑(如图)是广州博物馆的重要馆藏之一。传统鎏金工艺是将金溶于汞中制成“金汞齐”,涂抹在器物表面,加热使汞挥发后,金层附着于器物表面。下列说法错误的是 ( )
A.“金汞齐”是一种化合物
B.鎏金工艺利用了汞的挥发性
C.铜器鎏金能防止器物被腐蚀
D.鎏金的原理可用于金的富集
A
【解析】A.金溶于汞各自的化学性质不发生变化,得到的“金汞齐”属于混合物,错误;B.将“金汞齐”涂抹在器物表面,加热使汞挥发后,金层附着于器物表面,利用了汞的挥发性,正确;C.金不活泼,附着于铜器表面能隔绝空气和水,防止器物被腐蚀,正确;D.利用鎏金原理可将金转化为液态的“金汞齐”,与固态杂质分离后,再加热使汞挥发,得到较纯净的金,正确。故选A。
8.(社会热点)美国俄亥俄州发生的氯乙烯泄漏事件引发广泛关注。氯乙烯(C2H3Cl)常用于生产聚氯乙烯[(C2H3Cl)n]塑料,属于一级致癌物。下列有关说法正确的是 ( )
A.氯乙烯中碳、氢元素的质量比为2∶3
B.聚氯乙烯塑料属于复合材料
C.氯乙烯与聚氯乙烯的分子构成相同
D.氯乙烯与聚氯乙烯的元素组成相同
D
9.钴不仅是制造合金钢的重要金属,还是各种高级颜料的重要原料。钴的化学性质与铁相似,其相关信息如图,下列有关说法错误的是 ( )
A.图中X=15,Y=27
B.钴原子在化学反应中易得到电子
C.钴位于元素周期表第四周期
D.金属钴可与稀硫酸反应
B
10.下列有关化学知识的应用正确的是 ( )
A.安全:进入废弃的煤矿井前,应先做灯火试验
B.工业:炼铁厂通常在高温条件下用焦炭直接还原赤铁矿炼铁
C.医疗:新冠特效药的研制说明化学可以研究和创造自然界原本
不存在的新物质
D.健康:微量元素对人体具有重要作用,补充锌元素可预防甲状腺肿大
C
11.(粮食安全)2023年中央一号文件将“抓紧抓好粮食和重要农产品稳产保供”放在首位。要实现这一目标,化肥起到非常重要的作用。下列关于化肥的说法正确的是 ( )
A.KNO3、K2SO4都属于复合肥
B.Ca(H2PO4)2能增强农作物的抗倒伏能力
C.均衡适度地施用化肥,提倡施用农家肥
D.所有氮肥都不能与碱性物质混合施用
C
12.(生活情境)甲醛(HCHO)是房屋装修的主要污染物之一,“高压臭氧除甲醛”过程的微观示意图如图,下列叙述错误的是 ( )
A.O2和O3是由氧元素组成的两种不同单质
B.该微观示意图表示了两个化学反应过程
C.O3和HCHO反应的化学方程式为2O3+HCHO === CO2+2O2+H2O
D.O3和HCHO的反应中涉及到三种氧化物
D
13.※※如图为物质M的溶解度曲线,下列有关说法正确的是 ( )
A.t1 ℃时,M的饱和溶液的溶质质量分数为20%
B.将b点溶液降温至t1 ℃,溶液恰好饱和
C.t2 ℃时,a点溶液中溶质与溶剂的质量比为3∶7
D.将t2 ℃时M的饱和溶液降温至t1 ℃,析出10 g晶体
B
14.※※下列实验方法能达到实验目的的是 ( )
选项 实验目的 实验方法
A 鉴别CO和CO2 分别通入澄清石灰水中,观察现象
B 鉴别碳粉和MnO2 取样,分别加水搅拌,观察现象
C 除去FeSO4溶液中的少量MgSO4 加入足量镁粉,充分反应后过滤
D 除去CuCl2固体中的CuO 加水溶解后,过滤、洗涤、干燥
A
【解析】A.CO不与Ca(OH)2反应,通入澄清石灰水中无明显现象,CO2能使澄清石灰水变浑浊,正确;B.碳粉和MnO2均为不溶于水的黑色粉末,加水搅拌不能鉴别,错误;C.向含有少量MgSO4的FeSO4溶液中加入镁粉,Mg与FeSO4反应生成MgSO4和Fe,除去了要提纯的物质,错误;D.CuCl2可溶于水,CuO不溶于水,加水溶解后,过滤、洗涤、干燥后得到的是CuO固体,而不是CuCl2,错误。故选A。
15.※※(数字化实验)用不同物质测定空气里氧气的含量,分别在图甲装置的燃烧匙内放置足量铁粉、白磷,用电热丝引燃(铁粉能在空气中燃烧)。氧气含量随时间的变化情况如图乙,下列说法错误的是 ( )
A.温度传感器显示,燃烧过程中
瓶内温度均升高
B.待铁粉或白磷熄灭后,应立即
打开弹簧夹
C.分析图乙可知,用铁粉测定空
气里氧气含量的结果更准确
D.利用电热丝引燃,无需打开瓶塞,实验测定结果更准确
B
【解析】A.铁粉和白磷燃烧都放热,因此温度传感器显示,燃烧过程中瓶内温度均升高,正确;B.待铁粉或白磷熄灭后,应等装置冷却后,再打开弹簧夹,错误;C.分析图乙可知,实验中消耗氧气更彻底的是铁粉,因此用铁粉测定空气里氧气含量的结果更准确,正确;D.利用电热丝引燃,无需打开瓶塞,瓶中气体始终处于封闭状态,因此实验测定结果更准确,正确。故选B。
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.(社会热点)2023年1月1日起,全国全面供应国六B标准车用汽油。与国六A标准车用汽油相比,一氧化碳、氮氧化物及细颗粒物的排放均大幅度下降。
(1)化石能源是目前使用最广泛的能源,包括煤、石油和__________。利用石油中各成分的________不同,将其分离可得到汽油。
(2)国六B标准车用汽油大面积广泛使用后,可以缓解的环境问题有________(填序号)。
A.酸雨 B.雾霾 C.温室效应
天然气
沸点
AB
(3)汽油的标号(如92号、95号)和辛烷(C8H18)的含量有关,写出辛烷在空气中充分燃烧的化学方程式:_________________________________。
(4)汽车发动后,化油器将汽油喷成雾状进入内燃机气缸,其目的是__________________________________________。
(5)寒冷的冬天,以汽油为燃料的汽车排气管口会出现大量白雾,用分子的观点解释产生白雾的原因:_____________________________________
_________________________。
2C8H18+25O2 16CO2+18H2O
===
点燃
增大汽油与氧气的接触面积,使其充分燃烧
汽车尾气中含有的大量水蒸气喷出后在
空气中遇冷液化成小水珠
17.(传统文化)春节、清明节、端午节和中秋节为我国四大传统节日,古诗中有许多关于传统节日习俗的描述。
(1)春节——听烧爆竹童心在,看换桃符老兴偏。
①传统爆竹生产过程中常添加高氯酸钾(KClO4)来增强安全性,其中氯元素显________价。
②写春联用的毛笔常用羊毛、兔毛等制作,检验毛笔是用动物毛发制作的操作和现象是______________________________。
(2)清明节——南北山头多墓田,清明祭扫各纷然。酿酒祭祀祖先,酒的主要成分的化学式为____________。祭祖先烧纸钱时,如不小心将墓前枯草点燃,应立即用土盖灭,这种灭火方法利用的原理是__________。
+7
灼烧,能闻到烧焦羽毛的气味
C2H5OH
隔绝氧气
(3)端午节——彩缕碧筠粽,香粳白玉团。
①鲜肉粽子用料讲究,除了糯米,还有猪肉、蛋黄、食用盐、植物油等。小欣的午餐是鲜肉粽子,从营养均衡的角度来看,还需增加的食物是________(填序号)。
A.馒头 B.卤鸡腿 C.炒青菜
②粽子虽然好吃,但不宜过量食用。小欣吃过粽子后,感觉有些胃酸过多,于是服用了一片胃药[主要成分为Mg(OH)2],发生反应的化学方程式为_____________________________________。
(4)中秋节——桂子月中落,天香云外飘。桂花香气的成分有多种,其中一种是芳樟醇(化学式为C10H18O),芳樟醇中________元素的质量分数最小。
C
Mg(OH)2+2HCl === MgCl2+2H2O
氧
18.化学是一门以实验为基础的科学。兴趣小组利用下列装置进行实验探究:
Ⅰ.常见气体的制取(如图1)
(1)标号仪器a的名称是________。
(2)用装置A制取氧气的化学反应方程式是_______________________________。
(3)在实验室制取二氧化碳应选用的药品是_________________________,装置B、C均可用于制取二氧化碳,与装置B相比,装置C的优点是______
__________________________________。收集CO2应选用装置_______(填序号),不选用另一个收集装置的原因是________________。
水槽
2KMnO4 K2MnO4+MnO2+O2↑
==
△
稀盐酸和大理石(或石灰石)
可以
随时添加药品(或可以持续产生气体)
E
CO2能溶于水
Ⅱ.(创新实验)探究分子的运动(如图2)
分别取6只装满氢气和空气的集气瓶,完成实验并记录现象如下表:
序号 集气瓶① 集气瓶② 抽取玻璃片后时间/s 火柴引燃的集气瓶 实验现象
实验1 H2 空气 10 ② 无爆鸣声
实验2 H2 空气 20 ② 微弱爆鸣声
实验3 H2 空气 30 ② 尖锐爆鸣声
实验4 空气 H2 5 ① 尖锐爆鸣声
实验5 空气 H2 10 ① 尖锐爆鸣声
实验6 空气 H2 15 ① 非常尖锐爆鸣声
(4)收集该实验所用的氢气最好选用图1中的装置________(填序号)。
(5)对比实验1和5,能说明氢气具有的物理性质是__________________。
(6)通过实验1~3的现象分析,可得出的结论是__________________。
D
密度比空气小
分子在不断运动
19.某化学小组进行综合实践活动时,对某工厂所排放污水的成分产生了兴趣,他们设计实验展开如下探究(不考虑其他成分对实验的影响)。
【查阅资料】①该工厂使用的原材料有硫酸钠、碳酸钠、氢氧化钠、氯化钠;②硫酸钠溶液显中性。
【提出问题】该工厂所排放污水的成分有哪些?
【作出猜想】排放的污水中含有硫酸钠、碳酸钠、氢氧化钠、氯化钠中的一种或几种。
【实验探究】(1)小明设计以下实验探究污水的成分:
实验步骤 实验现象 实验结论
①取少量污水,向其中滴入足量稀硝酸 有气泡产生 污水中含__________
_____________
②向①反应后的溶液中滴入少量BaCl2溶液 产生白色沉淀 污水中含__________
____________
Na2CO3
(或碳酸钠)
Na2SO4
(或硫酸钠)
实验步骤 实验现象 实验结论
①取少量污水,向其中滴入足量稀硝酸 有气泡产生 污水中含__________
_____________
②向①反应后的溶液中滴入少量BaCl2溶液 产生白色沉淀 污水中含__________
____________
③向②反应后的溶液中滴入少量AgNO3溶液 _________________ 污水中含有NaCl
④另取少量污水,向其中滴入过量CaCl2溶液,振荡,静置后再滴入无色酚酞溶液 _________________ _______________ 污水中不含NaOH
Na2CO3
(或碳酸钠)
Na2SO4
(或硫酸钠)
产生白色沉淀
先产生白色沉淀,
后溶液不变色
(2)写出步骤②中发生反应的化学方程式:______________________________。
【反思交流】(3)小红认为步骤③的结论不严谨,理由是_________________
_____________________________________________________。
(4)步骤④中加入过量CaCl2溶液的目的是______________________________
______________。
BaCl2+Na2SO4 === BaSO4↓+2NaCl
步骤②中滴加的
BaCl2溶液引入了Cl-,无法确定Cl-是否来源于NaCl
除尽Na2CO3,以免干扰NaOH
的检验
【拓展应用】处理污水通常采用的方法是“物化+生化”,主要操作设备包括:
a.格栅:除去污水中较大的悬浮物和漂浮物。
b.吸附池:吸附除去污水中的有机物。
c.沉淀池:加絮凝剂除去污水中较小的悬浮物。
d.接触池:“氯化法”对污水进行消毒。
(5)吸附池中,常加入____________除去污水中的色素和异味。
(6)结合日常所学,你认为上述污水处理流程的正确排序是_________(填序号)。
活性炭
acbd
20.天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶的各种化合物的主要原料。以天青石为原料生产Sr(OH)2·8H2O的工艺流程如下,请回答下列问题:
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
(1)“反应A”的化学方程式为SrSO4+2NH4HCO3 ==== SrCO3↓+(NH4)2SO4+CO2↑+X,则X的化学式为____________,反应温度要控制在30 ℃以下,其原因是_________________________。
H2O
NH4HCO3受热易分解
(2)操作Ⅰ中玻璃棒的作用是________,所得滤液2的溶质为(NH4)2SO4和_____________。
(3)“煅烧”过程中发生反应的化学方程式为______________________
________________________________ (写一个)。
引流
NH4HCO3
CaCO3 CaO+
CO2↑(或SrCO3 SrO+CO2↑)
===
高温
===
高温
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
(4)固体3“水浸”过程中________(填“吸收”或“放出”)热量,滤渣4的主要成分为____________。“趁热过滤”的目的是________________
____________________________。
(5)操作Ⅱ的步骤主要是蒸发浓缩、___________、过滤、洗涤、干燥。
放出
Ca(OH)2
防止温度降低时
Sr(OH)2因溶解度减小而析出
降温结晶
已知:①NH4HCO3不稳定,受热易分解;②锶及其化合物的化学性质与钙及其化合物相似;③Sr(OH)2、Ca(OH)2在水中的溶解度如表:
温度/℃ 0 20 40 60 80 100
溶解度/g Sr(OH)2 0.91 1.77 3.95 8.42 20.2 91.2
Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
21.为测定某品牌小苏打(含NaCl杂质)中碳酸氢钠的含量,老师引导学生设计了如图实验装置(固定装置略,碱石灰可吸收CO2和水蒸气)。取20.0 g小苏打样品进行实验,充分反应后通入一段时间空气,最终称得干燥管a增重8.8 g。
(1)该实验中充分反应后通入空气的目的是__________________________
______________________。
(2)装置中干燥管b的作用是_______________________________________。
使反应产生的CO2完全被干
燥管a中的碱石灰吸收
防止空气中的CO2和水蒸气对结果产生干扰
(3)根据实验数据,计算该小苏打中碳酸氢钠的质量分数。(写出计算过程)
偏大
(4)若撤去装置中盛有浓硫酸的洗气瓶,则测定结果________(填“偏大”
“偏小”或“无影响”)。
同课章节目录
