1.3氧化还原反应同步练习题(含解析)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应同步练习题(含解析)高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-14 21:30:45 | ||
图片预览



文档简介
1.3 氧化还原反应 同步练习题
一、选择题
1.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料[主要成分为],青色来自蓝铜矿颜料[主要成分为]。下列说法错误的是
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.中铜的质量分数高于
2.常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明溶液中:、、、 B.氯化铵溶液中:、、、
C.强酸性溶液中:、、、 D.次氯酸钠溶液中:、、、
3.天然气因含有少量 H2S 等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
A.亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
B.脱硫过程的总反应为2H2S+O2 =2S+2H2O(反应条件省略)
C.该脱硫过程需要不断添加 Fe2(SO4)3溶液
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
4.高铜酸钾 (KCuO2)是黑色固体,可通过如下反应制取:,下列说法错误的是
A.CuO中氧元素化合价不变
B.可能具有强氧化性
C.该反应中每消耗0.2mol CuO,转移0.2mol电子
D.该反应中既发生氧化反应又发生还原反应
5.反应SiCl4 +2H2Si+4HCl中,作氧化剂的是
A.SiCl4 B.H2 C.Si D.HCl
6.下列反应中属于氧化还原反应的是
A.NH3+HCl=NH4Cl B.2Fe(OH)3Fe2O3+3H2O
C.3Fe+4H2O(g)Fe3O4+4H2 D.CaCO3+2HCl=CaCl2+H2O+CO2↑
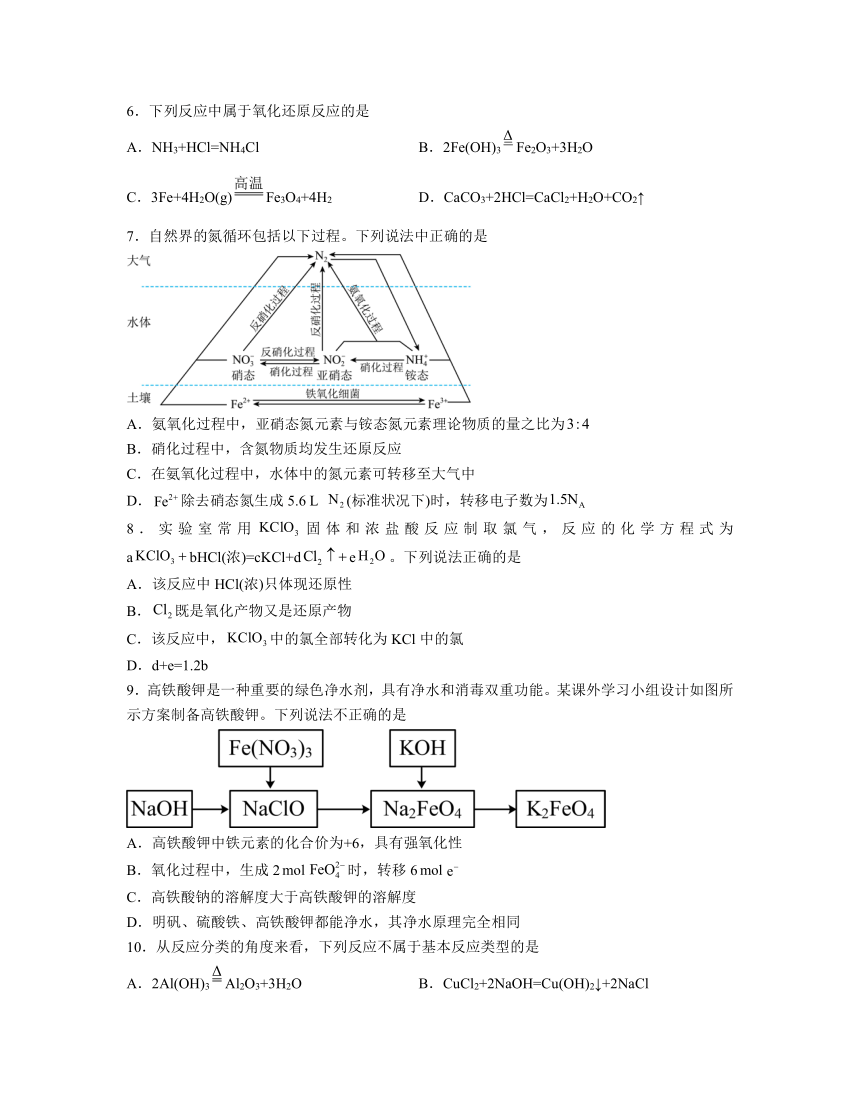
7.自然界的氮循环包括以下过程。下列说法中正确的是
A.氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为
B.硝化过程中,含氮物质均发生还原反应
C.在氨氧化过程中,水体中的氮元素可转移至大气中
D.除去硝态氮生成5.6 L (标准状况下)时,转移电子数为
8.实验室常用固体和浓盐酸反应制取氯气,反应的化学方程式为abHCl(浓)=cKCl+de。下列说法正确的是
A.该反应中HCl(浓)只体现还原性
B.既是氧化产物又是还原产物
C.该反应中,中的氯全部转化为KCl中的氯
D.d+e=1.2b
9.高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如图所示方案制备高铁酸钾。下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6,具有强氧化性
B.氧化过程中,生成2时,转移6
C.高铁酸钠的溶解度大于高铁酸钾的溶解度
D.明矾、硫酸铁、高铁酸钾都能净水,其净水原理完全相同
10.从反应分类的角度来看,下列反应不属于基本反应类型的是
A.2Al(OH)3Al2O3+3H2O B.CuCl2+2NaOH=Cu(OH)2↓+2NaCl
C.Fe(OH)3+3HCl=FeCl3+3H2O D.Fe2O3+3CO2Fe+3CO2
11.氨广泛应用于化工、化肥、制药等领域,一种新型合成方法如图所示。下列说法正确的是
A.反应①属于自然固氮
B.反应③可利用电解溶液的方法实现
C.该转化过程的总反应为
D.反应①、②、③、④均属于氧化还原反应
12.下列反应中氯元素全被还原的是
A.
B.
C.
D.
13.便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2),一种制备亚氯酸钠粗产品的工艺流程如下。已知,纯ClO2易分解爆炸,固态的亚氯酸钠加热或撞击会迅速分解生成氯化物。下列说法不正确的是
A.溶解过程中可以用盐酸代替稀硫酸
B.发生器中鼓入空气的主要目的是将ClO2稀释,避免发生爆炸
C.NaClO2加热时可以发生的反应3NaClO2 2NaClO3 + NaCl
D.ClO2与Na2O2反应也可生成亚氯酸钠
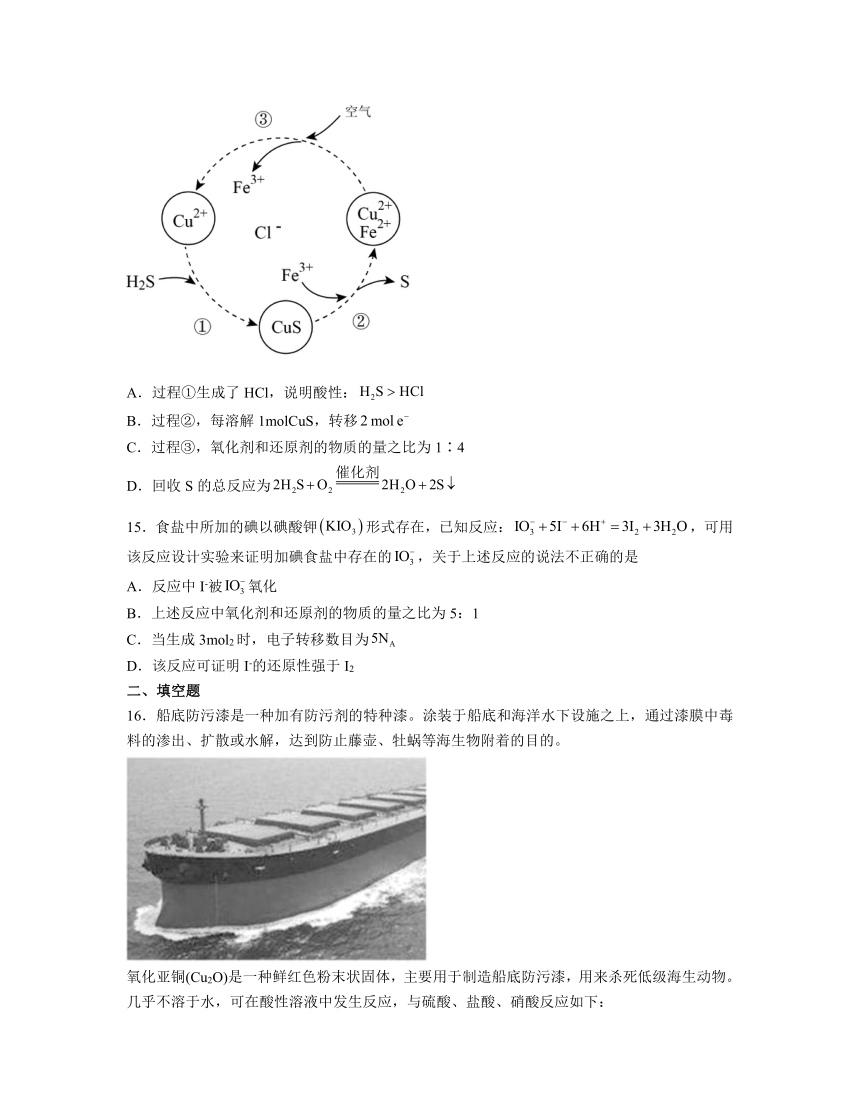
14.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如图所示。下列说法不正确的是
A.过程①生成了HCl,说明酸性:
B.过程②,每溶解1molCuS,转移
C.过程③,氧化剂和还原剂的物质的量之比为1∶4
D.回收S的总反应为
15.食盐中所加的碘以碘酸钾形式存在,已知反应:,可用该反应设计实验来证明加碘食盐中存在的,关于上述反应的说法不正确的是
A.反应中I-被氧化
B.上述反应中氧化剂和还原剂的物质的量之比为5:1
C.当生成3mol2时,电子转移数目为
D.该反应可证明I-的还原性强于I2
二、填空题
16.船底防污漆是一种加有防污剂的特种漆。涂装于船底和海洋水下设施之上,通过漆膜中毒料的渗出、扩散或水解,达到防止藤壶、牡蜗等海生物附着的目的。
氧化亚铜(Cu2O)是一种鲜红色粉末状固体,主要用于制造船底防污漆,用来杀死低级海生动物。几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4=CuSO4+Cu+H2O
②Cu2O+4HCl=2HCuCl2+H2O
③3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O
(1)Cu2O中Cu的化合价为_______。
(2)反应①中氧化剂为_______,还原剂为_______。
(3)请写出反应③的离子方程式:_______。
17.黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______。
三、计算题
18.现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示,请回答下列问题:
(1)在a→b的反应过程中,其中的氧化剂为_______,被氧化的元素为_______。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应离子方程式_______;
(3)已知c→d发生反应:2BrO+I2=2IO+Br2;当加入KBrO3量n(KBrO3)=4.2时,则此时余下单质碘的量n(I2)=_______mol;依题综合分析可推出含6 mol KI的硫酸溶液充分反应最终所能消耗n(KBrO3)的最大值为_______mol。
四、元素或物质推断题
19.固体化合物X是一种白色粉末,由四种常见元素组成。为探究X的组成,进行如下实验:
其中,流程中的各步反应均完全,气体产物完全逸出,某些生成物已略去。请回答:
(1)组成X的短周期元素的符号___________,C分子的空间构型___________。
(2)加入固体后分离得到的溶液中所含溶质的化学式___________。
(3)生成F的离子方程式___________。
(4)X加入足量氢氧化钠溶液后,在空气中蒸干灼烧,所得的固体中也含有E。写出上述过程中总的化学方程式___________。
(5)沉淀D是一种混合物,试设计实验加以证明:___________。
五、实验题
20.二氧化氯()是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1)的制备:制备的常用方法有两种,分别为Kestiog法、与反应法。
①Kestiog法制备的原理为,X的化学式为_______,将通入溶液中,有红褐色沉淀生成,溶液中的主要阴离子为、,若消耗,则被氧化的为_______mol。
②与反应法制备,生成物只有两种,参加反应的与物质的量之比为_______,与Kestiog法相比,与反应法的优点是_______(填一条)。
(2)的用途:除毒、除异味。
①可以将剧毒的氰化物氧化成和,离子方程式为,属于_______(填“酸”“碱”或“两”)性氧化物,每转移,生成_______L(标准状况下)。
②能把水溶液中有异味的氧化成四价锰,使之形成不溶于水的,该反应的离子方程式为_______。
(3)溶液浓度的测定:
步骤1:取待测溶液20.00mL于锥形瓶中;
步骤2:用稀调节该溶液的pH,加入足量的KI,使充分转化为;;
步骤3:滴入几滴指示剂,逐滴加入0.1000mol/L的溶液(),达到滴定终点时,消耗溶液的体积为29.50mL。
溶液物质的量浓度为_______mol/L。
【参考答案】
一、选择题
1.C
解析:A.和在高温时均易分解,且纸张保存需要保持一定的温度和湿度,因此保存《千里江山图》需控制温度和湿度,选项A正确;
B.孔雀石和蓝铜矿颜料中的元素均为价,处于元素的最高价态,因此孔雀石、蓝铜矿颜料不易被空气氧化,选项B正确;
C.和均能与强酸发生反应,选项C错误;
D.中的质量分数为,中的质量分数为,因此中铜的质量分数高于中铜的质量分数,选项D正确;
答案选C。
2.A
解析:A.澄清透明溶液中,、、、相互之间不反应,能大量共存,故选A;
B.NH与反应放出氨气,氯化铵溶液中不能大量含有,故不选B;
C.强酸性溶液中、反应生成S沉淀,、不能大量共存,故不选C;
D.次氯酸钠具有强氧化性,易被氧化为,次氯酸钠溶液中不含,故不选D;
选A。
3.C
解析:A.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,FeSO4可用于治疗缺铁性贫血,A正确;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S生成S单质和H2O,总反应为2H2S+O2 =2S+2H2O,B正确;
C.由图可知,Fe2(SO4)3先被消耗后又生成,该脱硫过程不需要添加 Fe2(SO4)3溶液,C错误;
D.天然气主要成分为甲烷,甲烷燃烧放出热量,“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐,D正确;
故选C。
4.C
解析:A.CuO中氧化合价为 2价,KCuO2中氧化合价为 2价,根据反应方程式分析氧化铜中氧全部转变到KCuO2中,因此CuO中氧元素化合价不变,故A正确;
B.中Cu化合价为+3价,则可能具有强氧化性,故B正确;
C.根据方程式Cu由+2价变为+3价,2molCuO失去2mol电子,2mol中失去1mol电子,得到3mol电子,转移3mol电子,因此该反应中每消耗0.2mol CuO,转移0.3mol电子,故C错误;
D.该反应中中氧化合价既升高又降低,说明既发生氧化反应又发生还原反应,故D正确。
综上所述,答案为C。
5.A
解析:反应SiCl4 +2H2Si+4HCl中Si的化合价由SiCl4中的+4价转化为Si中的0价,化合价降低,被还原,则SiCl4是氧化剂,故答案为:A。
6.C
解析:A.NH3+HCl=NH4Cl反应前后各种元素化合价不变,因此反应不属于氧化还原反应,A不符合题意;
B.2Fe(OH)3Fe2O3+3H2O反应前后各种元素化合价不变,因此反应不属于氧化还原反应,B不符合题意;
C.3Fe+4H2O(g)Fe3O4+4H2反应前后Fe、H元素化合价发生了变化,因此该反应属于氧化还原反应,C符合题意;
D.CaCO3+2HCl=CaCl2+H2O+CO2↑的反应前后各种元素化合价不变,因此反应不属于氧化还原反应,D不符合题意;
故合理选项是C。
7.C
解析:A.由图示可知,氨氧化过程中的反应为:+=N2+2H2O,故亚硝态氮元素与铵态氮元素理论物质的量之比为1:1,故A错误;
B.由图可知,硝化过程为:转化为,再进一步转化为,该过程中N元素化合价均在升高,含氮物质被氧化,均发生氧化反应,故B错误;
C.在氨氧化过程中,与反应生成N2,根据化合价变化规律知,此反应为N元素的归中反应,即+=N2+2H2O,水体中的氮元素转化为氮气,可转移至大气中,故C正确;
D.硝态氮转化为N2,反应为:+=N2+2H2O,生成1molN2转移3mol电子,标准状况下5.6 LN2的物质的量为,转移电子数为3×0.25mol×NAmol-1=0.75NA,故D错误;
故选:C。
8.B
解析:A.根据方程式分析盐酸中Cl一部分化合价升高变为氯气,一部分化合价未变,变为KCl,因此该反应中HCl(浓)体现还原性和酸性,故A错误;
B.氯酸钾中Cl化合价降低,盐酸中部分Cl化合价升高,都为变为氯气,因此既是氧化产物又是还原产物,故B正确;
C.该反应中,中的氯全部转化为氯气中的氯,故C错误;
D.氯酸钾中+5价氯化合价降低变为0价,盐酸中部分 1价氯化合价升高变为0价,根据得失电子守恒得到氯酸钾配系数为1,盐酸中升高的部分配系数为5,再根据化合价升高降低的氯元素守恒得到氯气系数为3,再根据钾守恒得到氯化钾系数为1,再根据氯元素守恒得到盐酸系数为1+5=6,再根据氢元素守恒得到水系数为3,再根据氧元素守恒检验,最终得到方程式6HCl(浓)= KCl+33,因此3+3=6即d+e=b,故D错误。
综上所述,答案为B。
9.D
【分析】氢氧化钠生成次氯酸钠,次氯酸钠和硝酸铁生成高铁酸钠加入氢氧化钾得到高铁酸钾;
解析:A.K2FeO4中K为+1价、O为-2价,由化合价代数和为0可知Fe元素化合价为+6价,Fe元素为+6价,为最高价,具有强氧化性,A正确;
B.Fe元素的化合价从+3价升高到+6价,生成2 mol FeO42-时,转移6 mol 电子,B正确;
C.加入KOH,反应向溶解度小的方向进行,生成K2FeO4,说明K2FeO4溶解度更小,即高铁酸钠的溶解度大于高铁酸钾的溶解度,C正确;
D.K2FeO4具有强氧化性,可用于消毒杀菌;明矾、硫酸铁能形成胶体吸附净水,净水原理不相同,D错误;
故选D。
10.D
解析:A.2Al(OH)3Al2O3+3H2O为分解反应,属于基本反应类型,A不符合;
B. CuCl2+2NaOH=Cu(OH)2↓+2NaCl为复分解反应,属于基本反应类型,B不符合;
C. Fe(OH)3+3HCl=FeCl3+3H2O为复分解反应,属于基本反应类型,C不符合;
D. Fe2O3+3CO2Fe+3CO2不属于分解反应、不属于复分解反应、不属于置换反应、不属于化合反应,故不属于基本反应类型,D符合;
答案选D。
11.C
解析:A.反应①属于人工固氮,A错误;
B.反应③可利用电解熔融的方法实现,B错误;
C.该转化过程的总反应为,C正确;
D.反应②属于非氧化还原反应,D错误;
故选C。
12.A
解析:A. 中,氯元素从0价降低到-1价,氯元素全被还原,A符合;
B. 中部分氯元素从0价降低到-1价,部分氯元素化合价升高到+1价,氯元素部分被还原, B不符合;
C. 中,氯气中氯元素从0价降低到-1价,氯化亚铁中氯元素化合价不变,氯元素部分被还原, C不符合;
D. 中,部分氯元素从-1价升高到0价、部分氯元素化合价不变,氯元素部分被氧化,D不符合;
答案选A。
13.A
【分析】NaClO3固体在稀硫酸中溶解,NaClO2与二氧化硫反应生成ClO2,充入的空气混合气主要避免ClO2过纯,降低浓度避免发生爆炸,ClO2通到氢氧化钠和过氧化氢的混合溶液中反应生成亚氯酸钠(NaClO2)和氧气,经过一系列操作得到亚氯酸钠(NaClO2)粗产品。
解析:A.溶解过程中可以用盐酸代替,则两者会发生氧化还原反应生成氯气,因此不能用盐酸代替稀硫酸,故A错误;
B.由于纯ClO2易分解爆炸,因此发生器中鼓入空气的主要目的是将ClO2稀释,避免发生爆炸,故B正确;
C.固态的亚氯酸钠加热或撞击会迅速分解生成氯化物即NaCl,再根据氧化还原反应原理和质量守恒得到还生成NaClO3,因此NaClO2加热时可以发生的反应3NaClO2 2NaClO3 + NaCl,故C正确;
D.ClO2具有氧化性,Na2O2具有还原性,根据氧化还原反应原理得到ClO2与Na2O2反应也可生成亚氯酸钠,故D正确。
综上所述,答案为A。
14.A
【分析】由图可知,①中发生H2S+Cu2+=CuS↓+2H+,②中发生CuS+2Fe3+=S+2Fe2++Cu2+,③中发生4Fe2++O2+4H+=4Fe3++2H2O。
解析:A. 过程①生成了HCl,H2S+Cu2+=CuS↓+2H+反应能进行是因为生成了更难电离的CuS,不能说明酸性:,故A错误;
B. 过程②,每溶解1molCuS,生成1molS,转移,故B正确;
C. 过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氧化剂O2和还原剂Fe2+的物质的量之比为1∶4,故C正确;
D. 由分析①×2+②×2+③得:回收S的总反应为,故D正确;
故选A。
15.B
解析:A.由题干离子方程式可知,反应中中碘的化合价升高到0价,而中碘的化合价由+5价降低到0价,即I—被氧化,A正确;
B.由题干离子方程式可知,上述反应中氧化剂为和还原剂为I-,二者的物质的量之比为1:5,B错误;
C.由题干离子方程式可知,当生成3molI2时,电子转移数目为,C正确;
D.由题干离子方程式可知,I-为还原剂,I2为还原产物,故该反应可证明的还原性强于I2,D正确;
故答案为:B。
二、填空题
16.(1)+1
(2) Cu2O Cu2O
(3)3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O
解析:(1)O为-2价,根据化合物中各元素化合价的代数和为零可知,Cu2O中Cu的化合价为+1;
(2)(2)反应①中只有铜元素的化合价发生了改变,+1价的Cu变为+2价和0价的Cu,化合价既有升高又有降低,故Cu2O既是氧化剂又是还原剂;
(3)反应③中的HNO3和Cu(NO3)2可拆写成离子形式,并删去12个,得到离子方程式3Cu2O+14H++2=6Cu2++2NO↑+7H2O。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
17.(1)
(2)1:3
解析:(1)反应中磷元素部分化合价由0变为-3、部分由0变为+1,根据质量守恒可知,还会有水参与反应,结合电子守恒,反应为 ;单线桥表示电子的转移情况,故表示为 ;
(2)反应中磷元素部分化合价由0变为-3发生还原反应为氧化剂、部分由0变为+1发生氧化反应为还原剂,根据电子守恒可知,氧化剂和还原剂质量比为1:3。
三、计算题
18. KBrO3 I 1.5 mol 7.2
解析:(1)a→b的反应过程中含碘物质由6 mol KI转变成3mol,根据元素守恒可知1mol产物中含有2molI,应为碘单质,KBrO3作氧化剂,将KI氧化成碘单质,被氧化的元素为I,故答案为:KBrO3;I;
(2)b→c过程中,仅有溴元素发生化合价变化,可知是KBrO3氧化a→b过程中生成的溴离子的反应,反应产物为溴单质,反应的离子方程式为:,故答案为:;
(3)由以上分析可知a→b的反应为:,该过程中6molKI完全反应时消耗1molKBrO3,同时生成1mol溴离子和3mol碘单质;b→c过程中发生的反应为:,该过程中1mol的溴离子消耗0.2molKBrO3,c→d发生反应:2BrO+I2=2IO+Br2,加入KBrO3量n(KBrO3)=4.2时前两个阶段消耗1.2mol,该过程中消耗3mol,则反应的碘单质为1.5mol,剩余的碘单质为3mol-1.5mol=1.5mol,若3mol碘单质完全被消耗时c→d过程中消耗的KBrO3为6mol,则整个过程中消耗的KBrO3物质的量为:7.2mol,故答案为:1.5mol;7.2;
四、元素或物质推断题
19.(1) H、N、Cl 三角锥
(2)NaOH、NaCl
(3)或
(4)
(5)取沉淀D少量,加入足量的盐酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加铁氰化钾溶液生成蓝色沉淀(或:取沉淀D少量,加入足量的稀硫酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加酸性高锰酸钾溶液,高锰酸钾的红色褪去)
解析:溶液A分为两等分,一分加入硝酸和硝酸银,生成11.48g白色沉淀B是AgCl,则化合物X中含有Cl的物质的量是;NaNH2和水反应生成氢氧化钠和氨气,气体C是氨气,3.9g NaNH2放出氨气的物质的量是,氨气能完全溶解11.48g AgCl生成,需要氨气的物质的量为0.16mol,说明溶液A中含有的物质的量是,则X中含有N元素0.12mol;沉淀D灼烧得0. 8g红棕色固体E,E是Fe2O3,说明溶液A中含有铁元素;所以A中含有铁元素0.02mol、N元素0.12mol、Cl元素0.04mol;根据质量守恒,A中含有H元素的物质的量是,则X的化学式是。
(1)组成X的元素有Fe、N、H、Cl,短周期元素的符号N、H、Cl;C是氨气,氨分子的空间构型三角锥;
(2)溶液A是氯化亚铁和氯化铵,加入固体后生成氢氧化亚铁、氨气、氯化钠,氢氧化钠有剩余,分离得到的溶液中所含溶质的化学式NaOH、NaCl;
(3)氯化银和氨水反应生成生成,反应的离子方程式是;
(4)加入足量氢氧化钠溶液后,在空气中蒸干灼烧,反应的化学方程式;
(5)取沉淀D少量,加入足量的盐酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加铁氰化钾溶液生成蓝色沉淀,说明D是氢氧化亚铁和氢氧化铁的混合物(或:取沉淀D少量,加入足量的稀硫酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加酸性高锰酸钾溶液,高锰酸钾的红色褪去)
五、实验题
20.(1) Cl2 5 2:1 无污染性气体生成
(2) 酸 2.24 6H2O+2ClO2+5Mn2+=5MnO2+2Cl-+10H+
(3)0.0295
解析:(1)由原子守恒知,生成物少了2个氯原子,结合方程式可得出X化学式为Cl2;ClO2中Cl元素化合价为+4价,由题意知得电子降到-1价氯离子,则1mol ClO2得5mole-,又Fe2+被氧化为Fe(OH)3,则1mol Fe2+失1mole-,得失电子守恒故消耗1mol ClO2时被氧化的FeSO4物质的量为5mol。KClO3制备ClO2,Cl元素化合价由+5降到+4得1e-,另SO2中S元素化合价由+4升高到+6失2e-,由得失电子守恒知KClO3和SO2物质的量之比为2:1;Kestiog法有Cl2生成,所以KClO3与SO2反应法的优点是无污染性气体生成。
(2)CO2能和碱反应生成盐和水,故属于酸性氧化物;由反应方程式知转移10mole-生成1molN2,所以每转移1mole-生成0.1mol N2,即标况下22.4L/mol 0.1mol=2.24L;ClO2将Mn2+氧化为MnO2,自身得电子到Cl-,由得失电子守恒、电荷守恒和原子守恒可得出该反应离子方程式为:6H2O+2ClO2+5Mn2+=5MnO2+2 Cl-+10H+。
(3)由步骤2可得出ClO2和I2对应关系为2ClO2~5I2,由步骤3可得出I2和关系为I2~,综上ClO2和关系为ClO2~,又消耗的的物质的量为0.00295mol,所以ClO2的物质的量为0.20.00295mol=0.00059mol,即物质的量浓度为。
一、选择题
1.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料[主要成分为],青色来自蓝铜矿颜料[主要成分为]。下列说法错误的是
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.中铜的质量分数高于
2.常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明溶液中:、、、 B.氯化铵溶液中:、、、
C.强酸性溶液中:、、、 D.次氯酸钠溶液中:、、、
3.天然气因含有少量 H2S 等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是
A.亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
B.脱硫过程的总反应为2H2S+O2 =2S+2H2O(反应条件省略)
C.该脱硫过程需要不断添加 Fe2(SO4)3溶液
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
4.高铜酸钾 (KCuO2)是黑色固体,可通过如下反应制取:,下列说法错误的是
A.CuO中氧元素化合价不变
B.可能具有强氧化性
C.该反应中每消耗0.2mol CuO,转移0.2mol电子
D.该反应中既发生氧化反应又发生还原反应
5.反应SiCl4 +2H2Si+4HCl中,作氧化剂的是
A.SiCl4 B.H2 C.Si D.HCl
6.下列反应中属于氧化还原反应的是
A.NH3+HCl=NH4Cl B.2Fe(OH)3Fe2O3+3H2O
C.3Fe+4H2O(g)Fe3O4+4H2 D.CaCO3+2HCl=CaCl2+H2O+CO2↑
7.自然界的氮循环包括以下过程。下列说法中正确的是
A.氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为
B.硝化过程中,含氮物质均发生还原反应
C.在氨氧化过程中,水体中的氮元素可转移至大气中
D.除去硝态氮生成5.6 L (标准状况下)时,转移电子数为
8.实验室常用固体和浓盐酸反应制取氯气,反应的化学方程式为abHCl(浓)=cKCl+de。下列说法正确的是
A.该反应中HCl(浓)只体现还原性
B.既是氧化产物又是还原产物
C.该反应中,中的氯全部转化为KCl中的氯
D.d+e=1.2b
9.高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如图所示方案制备高铁酸钾。下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6,具有强氧化性
B.氧化过程中,生成2时,转移6
C.高铁酸钠的溶解度大于高铁酸钾的溶解度
D.明矾、硫酸铁、高铁酸钾都能净水,其净水原理完全相同
10.从反应分类的角度来看,下列反应不属于基本反应类型的是
A.2Al(OH)3Al2O3+3H2O B.CuCl2+2NaOH=Cu(OH)2↓+2NaCl
C.Fe(OH)3+3HCl=FeCl3+3H2O D.Fe2O3+3CO2Fe+3CO2
11.氨广泛应用于化工、化肥、制药等领域,一种新型合成方法如图所示。下列说法正确的是
A.反应①属于自然固氮
B.反应③可利用电解溶液的方法实现
C.该转化过程的总反应为
D.反应①、②、③、④均属于氧化还原反应
12.下列反应中氯元素全被还原的是
A.
B.
C.
D.
13.便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2),一种制备亚氯酸钠粗产品的工艺流程如下。已知,纯ClO2易分解爆炸,固态的亚氯酸钠加热或撞击会迅速分解生成氯化物。下列说法不正确的是
A.溶解过程中可以用盐酸代替稀硫酸
B.发生器中鼓入空气的主要目的是将ClO2稀释,避免发生爆炸
C.NaClO2加热时可以发生的反应3NaClO2 2NaClO3 + NaCl
D.ClO2与Na2O2反应也可生成亚氯酸钠
14.硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收S,其转化如图所示。下列说法不正确的是
A.过程①生成了HCl,说明酸性:
B.过程②,每溶解1molCuS,转移
C.过程③,氧化剂和还原剂的物质的量之比为1∶4
D.回收S的总反应为
15.食盐中所加的碘以碘酸钾形式存在,已知反应:,可用该反应设计实验来证明加碘食盐中存在的,关于上述反应的说法不正确的是
A.反应中I-被氧化
B.上述反应中氧化剂和还原剂的物质的量之比为5:1
C.当生成3mol2时,电子转移数目为
D.该反应可证明I-的还原性强于I2
二、填空题
16.船底防污漆是一种加有防污剂的特种漆。涂装于船底和海洋水下设施之上,通过漆膜中毒料的渗出、扩散或水解,达到防止藤壶、牡蜗等海生物附着的目的。
氧化亚铜(Cu2O)是一种鲜红色粉末状固体,主要用于制造船底防污漆,用来杀死低级海生动物。几乎不溶于水,可在酸性溶液中发生反应,与硫酸、盐酸、硝酸反应如下:
①Cu2O+H2SO4=CuSO4+Cu+H2O
②Cu2O+4HCl=2HCuCl2+H2O
③3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O
(1)Cu2O中Cu的化合价为_______。
(2)反应①中氧化剂为_______,还原剂为_______。
(3)请写出反应③的离子方程式:_______。
17.黄磷(P4)与过量浓NaOH溶液反应,产生PH3和次磷酸钠(NaH2PO2),
(1)补全并配平该反应的化学方程式,标出电子转移的数目和方向:_______
□P4+□NaOH+□_______= □PH3↑+□NaH2PO2
标出电子转移的数目和方向:_________
方程式配平_______
(2)其中氧化剂和还原剂质量比为_______。
三、计算题
18.现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示,请回答下列问题:
(1)在a→b的反应过程中,其中的氧化剂为_______,被氧化的元素为_______。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应离子方程式_______;
(3)已知c→d发生反应:2BrO+I2=2IO+Br2;当加入KBrO3量n(KBrO3)=4.2时,则此时余下单质碘的量n(I2)=_______mol;依题综合分析可推出含6 mol KI的硫酸溶液充分反应最终所能消耗n(KBrO3)的最大值为_______mol。
四、元素或物质推断题
19.固体化合物X是一种白色粉末,由四种常见元素组成。为探究X的组成,进行如下实验:
其中,流程中的各步反应均完全,气体产物完全逸出,某些生成物已略去。请回答:
(1)组成X的短周期元素的符号___________,C分子的空间构型___________。
(2)加入固体后分离得到的溶液中所含溶质的化学式___________。
(3)生成F的离子方程式___________。
(4)X加入足量氢氧化钠溶液后,在空气中蒸干灼烧,所得的固体中也含有E。写出上述过程中总的化学方程式___________。
(5)沉淀D是一种混合物,试设计实验加以证明:___________。
五、实验题
20.二氧化氯()是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1)的制备:制备的常用方法有两种,分别为Kestiog法、与反应法。
①Kestiog法制备的原理为,X的化学式为_______,将通入溶液中,有红褐色沉淀生成,溶液中的主要阴离子为、,若消耗,则被氧化的为_______mol。
②与反应法制备,生成物只有两种,参加反应的与物质的量之比为_______,与Kestiog法相比,与反应法的优点是_______(填一条)。
(2)的用途:除毒、除异味。
①可以将剧毒的氰化物氧化成和,离子方程式为,属于_______(填“酸”“碱”或“两”)性氧化物,每转移,生成_______L(标准状况下)。
②能把水溶液中有异味的氧化成四价锰,使之形成不溶于水的,该反应的离子方程式为_______。
(3)溶液浓度的测定:
步骤1:取待测溶液20.00mL于锥形瓶中;
步骤2:用稀调节该溶液的pH,加入足量的KI,使充分转化为;;
步骤3:滴入几滴指示剂,逐滴加入0.1000mol/L的溶液(),达到滴定终点时,消耗溶液的体积为29.50mL。
溶液物质的量浓度为_______mol/L。
【参考答案】
一、选择题
1.C
解析:A.和在高温时均易分解,且纸张保存需要保持一定的温度和湿度,因此保存《千里江山图》需控制温度和湿度,选项A正确;
B.孔雀石和蓝铜矿颜料中的元素均为价,处于元素的最高价态,因此孔雀石、蓝铜矿颜料不易被空气氧化,选项B正确;
C.和均能与强酸发生反应,选项C错误;
D.中的质量分数为,中的质量分数为,因此中铜的质量分数高于中铜的质量分数,选项D正确;
答案选C。
2.A
解析:A.澄清透明溶液中,、、、相互之间不反应,能大量共存,故选A;
B.NH与反应放出氨气,氯化铵溶液中不能大量含有,故不选B;
C.强酸性溶液中、反应生成S沉淀,、不能大量共存,故不选C;
D.次氯酸钠具有强氧化性,易被氧化为,次氯酸钠溶液中不含,故不选D;
选A。
3.C
解析:A.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,FeSO4可用于治疗缺铁性贫血,A正确;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S生成S单质和H2O,总反应为2H2S+O2 =2S+2H2O,B正确;
C.由图可知,Fe2(SO4)3先被消耗后又生成,该脱硫过程不需要添加 Fe2(SO4)3溶液,C错误;
D.天然气主要成分为甲烷,甲烷燃烧放出热量,“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐,D正确;
故选C。
4.C
解析:A.CuO中氧化合价为 2价,KCuO2中氧化合价为 2价,根据反应方程式分析氧化铜中氧全部转变到KCuO2中,因此CuO中氧元素化合价不变,故A正确;
B.中Cu化合价为+3价,则可能具有强氧化性,故B正确;
C.根据方程式Cu由+2价变为+3价,2molCuO失去2mol电子,2mol中失去1mol电子,得到3mol电子,转移3mol电子,因此该反应中每消耗0.2mol CuO,转移0.3mol电子,故C错误;
D.该反应中中氧化合价既升高又降低,说明既发生氧化反应又发生还原反应,故D正确。
综上所述,答案为C。
5.A
解析:反应SiCl4 +2H2Si+4HCl中Si的化合价由SiCl4中的+4价转化为Si中的0价,化合价降低,被还原,则SiCl4是氧化剂,故答案为:A。
6.C
解析:A.NH3+HCl=NH4Cl反应前后各种元素化合价不变,因此反应不属于氧化还原反应,A不符合题意;
B.2Fe(OH)3Fe2O3+3H2O反应前后各种元素化合价不变,因此反应不属于氧化还原反应,B不符合题意;
C.3Fe+4H2O(g)Fe3O4+4H2反应前后Fe、H元素化合价发生了变化,因此该反应属于氧化还原反应,C符合题意;
D.CaCO3+2HCl=CaCl2+H2O+CO2↑的反应前后各种元素化合价不变,因此反应不属于氧化还原反应,D不符合题意;
故合理选项是C。
7.C
解析:A.由图示可知,氨氧化过程中的反应为:+=N2+2H2O,故亚硝态氮元素与铵态氮元素理论物质的量之比为1:1,故A错误;
B.由图可知,硝化过程为:转化为,再进一步转化为,该过程中N元素化合价均在升高,含氮物质被氧化,均发生氧化反应,故B错误;
C.在氨氧化过程中,与反应生成N2,根据化合价变化规律知,此反应为N元素的归中反应,即+=N2+2H2O,水体中的氮元素转化为氮气,可转移至大气中,故C正确;
D.硝态氮转化为N2,反应为:+=N2+2H2O,生成1molN2转移3mol电子,标准状况下5.6 LN2的物质的量为,转移电子数为3×0.25mol×NAmol-1=0.75NA,故D错误;
故选:C。
8.B
解析:A.根据方程式分析盐酸中Cl一部分化合价升高变为氯气,一部分化合价未变,变为KCl,因此该反应中HCl(浓)体现还原性和酸性,故A错误;
B.氯酸钾中Cl化合价降低,盐酸中部分Cl化合价升高,都为变为氯气,因此既是氧化产物又是还原产物,故B正确;
C.该反应中,中的氯全部转化为氯气中的氯,故C错误;
D.氯酸钾中+5价氯化合价降低变为0价,盐酸中部分 1价氯化合价升高变为0价,根据得失电子守恒得到氯酸钾配系数为1,盐酸中升高的部分配系数为5,再根据化合价升高降低的氯元素守恒得到氯气系数为3,再根据钾守恒得到氯化钾系数为1,再根据氯元素守恒得到盐酸系数为1+5=6,再根据氢元素守恒得到水系数为3,再根据氧元素守恒检验,最终得到方程式6HCl(浓)= KCl+33,因此3+3=6即d+e=b,故D错误。
综上所述,答案为B。
9.D
【分析】氢氧化钠生成次氯酸钠,次氯酸钠和硝酸铁生成高铁酸钠加入氢氧化钾得到高铁酸钾;
解析:A.K2FeO4中K为+1价、O为-2价,由化合价代数和为0可知Fe元素化合价为+6价,Fe元素为+6价,为最高价,具有强氧化性,A正确;
B.Fe元素的化合价从+3价升高到+6价,生成2 mol FeO42-时,转移6 mol 电子,B正确;
C.加入KOH,反应向溶解度小的方向进行,生成K2FeO4,说明K2FeO4溶解度更小,即高铁酸钠的溶解度大于高铁酸钾的溶解度,C正确;
D.K2FeO4具有强氧化性,可用于消毒杀菌;明矾、硫酸铁能形成胶体吸附净水,净水原理不相同,D错误;
故选D。
10.D
解析:A.2Al(OH)3Al2O3+3H2O为分解反应,属于基本反应类型,A不符合;
B. CuCl2+2NaOH=Cu(OH)2↓+2NaCl为复分解反应,属于基本反应类型,B不符合;
C. Fe(OH)3+3HCl=FeCl3+3H2O为复分解反应,属于基本反应类型,C不符合;
D. Fe2O3+3CO2Fe+3CO2不属于分解反应、不属于复分解反应、不属于置换反应、不属于化合反应,故不属于基本反应类型,D符合;
答案选D。
11.C
解析:A.反应①属于人工固氮,A错误;
B.反应③可利用电解熔融的方法实现,B错误;
C.该转化过程的总反应为,C正确;
D.反应②属于非氧化还原反应,D错误;
故选C。
12.A
解析:A. 中,氯元素从0价降低到-1价,氯元素全被还原,A符合;
B. 中部分氯元素从0价降低到-1价,部分氯元素化合价升高到+1价,氯元素部分被还原, B不符合;
C. 中,氯气中氯元素从0价降低到-1价,氯化亚铁中氯元素化合价不变,氯元素部分被还原, C不符合;
D. 中,部分氯元素从-1价升高到0价、部分氯元素化合价不变,氯元素部分被氧化,D不符合;
答案选A。
13.A
【分析】NaClO3固体在稀硫酸中溶解,NaClO2与二氧化硫反应生成ClO2,充入的空气混合气主要避免ClO2过纯,降低浓度避免发生爆炸,ClO2通到氢氧化钠和过氧化氢的混合溶液中反应生成亚氯酸钠(NaClO2)和氧气,经过一系列操作得到亚氯酸钠(NaClO2)粗产品。
解析:A.溶解过程中可以用盐酸代替,则两者会发生氧化还原反应生成氯气,因此不能用盐酸代替稀硫酸,故A错误;
B.由于纯ClO2易分解爆炸,因此发生器中鼓入空气的主要目的是将ClO2稀释,避免发生爆炸,故B正确;
C.固态的亚氯酸钠加热或撞击会迅速分解生成氯化物即NaCl,再根据氧化还原反应原理和质量守恒得到还生成NaClO3,因此NaClO2加热时可以发生的反应3NaClO2 2NaClO3 + NaCl,故C正确;
D.ClO2具有氧化性,Na2O2具有还原性,根据氧化还原反应原理得到ClO2与Na2O2反应也可生成亚氯酸钠,故D正确。
综上所述,答案为A。
14.A
【分析】由图可知,①中发生H2S+Cu2+=CuS↓+2H+,②中发生CuS+2Fe3+=S+2Fe2++Cu2+,③中发生4Fe2++O2+4H+=4Fe3++2H2O。
解析:A. 过程①生成了HCl,H2S+Cu2+=CuS↓+2H+反应能进行是因为生成了更难电离的CuS,不能说明酸性:,故A错误;
B. 过程②,每溶解1molCuS,生成1molS,转移,故B正确;
C. 过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,氧化剂O2和还原剂Fe2+的物质的量之比为1∶4,故C正确;
D. 由分析①×2+②×2+③得:回收S的总反应为,故D正确;
故选A。
15.B
解析:A.由题干离子方程式可知,反应中中碘的化合价升高到0价,而中碘的化合价由+5价降低到0价,即I—被氧化,A正确;
B.由题干离子方程式可知,上述反应中氧化剂为和还原剂为I-,二者的物质的量之比为1:5,B错误;
C.由题干离子方程式可知,当生成3molI2时,电子转移数目为,C正确;
D.由题干离子方程式可知,I-为还原剂,I2为还原产物,故该反应可证明的还原性强于I2,D正确;
故答案为:B。
二、填空题
16.(1)+1
(2) Cu2O Cu2O
(3)3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O
解析:(1)O为-2价,根据化合物中各元素化合价的代数和为零可知,Cu2O中Cu的化合价为+1;
(2)(2)反应①中只有铜元素的化合价发生了改变,+1价的Cu变为+2价和0价的Cu,化合价既有升高又有降低,故Cu2O既是氧化剂又是还原剂;
(3)反应③中的HNO3和Cu(NO3)2可拆写成离子形式,并删去12个,得到离子方程式3Cu2O+14H++2=6Cu2++2NO↑+7H2O。
【点睛】离子方程式书写的分为四步,第一步:正确写出反应的化学方程式,第二步:把易溶于水、易电离的物质拆写成离子形式,第三步:删去方程式两边不参加反应的离子,第四步:检查方程式两边的元素和电荷是否守恒。
17.(1)
(2)1:3
解析:(1)反应中磷元素部分化合价由0变为-3、部分由0变为+1,根据质量守恒可知,还会有水参与反应,结合电子守恒,反应为 ;单线桥表示电子的转移情况,故表示为 ;
(2)反应中磷元素部分化合价由0变为-3发生还原反应为氧化剂、部分由0变为+1发生氧化反应为还原剂,根据电子守恒可知,氧化剂和还原剂质量比为1:3。
三、计算题
18. KBrO3 I 1.5 mol 7.2
解析:(1)a→b的反应过程中含碘物质由6 mol KI转变成3mol,根据元素守恒可知1mol产物中含有2molI,应为碘单质,KBrO3作氧化剂,将KI氧化成碘单质,被氧化的元素为I,故答案为:KBrO3;I;
(2)b→c过程中,仅有溴元素发生化合价变化,可知是KBrO3氧化a→b过程中生成的溴离子的反应,反应产物为溴单质,反应的离子方程式为:,故答案为:;
(3)由以上分析可知a→b的反应为:,该过程中6molKI完全反应时消耗1molKBrO3,同时生成1mol溴离子和3mol碘单质;b→c过程中发生的反应为:,该过程中1mol的溴离子消耗0.2molKBrO3,c→d发生反应:2BrO+I2=2IO+Br2,加入KBrO3量n(KBrO3)=4.2时前两个阶段消耗1.2mol,该过程中消耗3mol,则反应的碘单质为1.5mol,剩余的碘单质为3mol-1.5mol=1.5mol,若3mol碘单质完全被消耗时c→d过程中消耗的KBrO3为6mol,则整个过程中消耗的KBrO3物质的量为:7.2mol,故答案为:1.5mol;7.2;
四、元素或物质推断题
19.(1) H、N、Cl 三角锥
(2)NaOH、NaCl
(3)或
(4)
(5)取沉淀D少量,加入足量的盐酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加铁氰化钾溶液生成蓝色沉淀(或:取沉淀D少量,加入足量的稀硫酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加酸性高锰酸钾溶液,高锰酸钾的红色褪去)
解析:溶液A分为两等分,一分加入硝酸和硝酸银,生成11.48g白色沉淀B是AgCl,则化合物X中含有Cl的物质的量是;NaNH2和水反应生成氢氧化钠和氨气,气体C是氨气,3.9g NaNH2放出氨气的物质的量是,氨气能完全溶解11.48g AgCl生成,需要氨气的物质的量为0.16mol,说明溶液A中含有的物质的量是,则X中含有N元素0.12mol;沉淀D灼烧得0. 8g红棕色固体E,E是Fe2O3,说明溶液A中含有铁元素;所以A中含有铁元素0.02mol、N元素0.12mol、Cl元素0.04mol;根据质量守恒,A中含有H元素的物质的量是,则X的化学式是。
(1)组成X的元素有Fe、N、H、Cl,短周期元素的符号N、H、Cl;C是氨气,氨分子的空间构型三角锥;
(2)溶液A是氯化亚铁和氯化铵,加入固体后生成氢氧化亚铁、氨气、氯化钠,氢氧化钠有剩余,分离得到的溶液中所含溶质的化学式NaOH、NaCl;
(3)氯化银和氨水反应生成生成,反应的离子方程式是;
(4)加入足量氢氧化钠溶液后,在空气中蒸干灼烧,反应的化学方程式;
(5)取沉淀D少量,加入足量的盐酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加铁氰化钾溶液生成蓝色沉淀,说明D是氢氧化亚铁和氢氧化铁的混合物(或:取沉淀D少量,加入足量的稀硫酸,把溶液分成两份,其中一份滴入KSCN溶液,溶液显明显的血红色,另一份滴加酸性高锰酸钾溶液,高锰酸钾的红色褪去)
五、实验题
20.(1) Cl2 5 2:1 无污染性气体生成
(2) 酸 2.24 6H2O+2ClO2+5Mn2+=5MnO2+2Cl-+10H+
(3)0.0295
解析:(1)由原子守恒知,生成物少了2个氯原子,结合方程式可得出X化学式为Cl2;ClO2中Cl元素化合价为+4价,由题意知得电子降到-1价氯离子,则1mol ClO2得5mole-,又Fe2+被氧化为Fe(OH)3,则1mol Fe2+失1mole-,得失电子守恒故消耗1mol ClO2时被氧化的FeSO4物质的量为5mol。KClO3制备ClO2,Cl元素化合价由+5降到+4得1e-,另SO2中S元素化合价由+4升高到+6失2e-,由得失电子守恒知KClO3和SO2物质的量之比为2:1;Kestiog法有Cl2生成,所以KClO3与SO2反应法的优点是无污染性气体生成。
(2)CO2能和碱反应生成盐和水,故属于酸性氧化物;由反应方程式知转移10mole-生成1molN2,所以每转移1mole-生成0.1mol N2,即标况下22.4L/mol 0.1mol=2.24L;ClO2将Mn2+氧化为MnO2,自身得电子到Cl-,由得失电子守恒、电荷守恒和原子守恒可得出该反应离子方程式为:6H2O+2ClO2+5Mn2+=5MnO2+2 Cl-+10H+。
(3)由步骤2可得出ClO2和I2对应关系为2ClO2~5I2,由步骤3可得出I2和关系为I2~,综上ClO2和关系为ClO2~,又消耗的的物质的量为0.00295mol,所以ClO2的物质的量为0.20.00295mol=0.00059mol,即物质的量浓度为。
