专题4生活中常用的有机物--烃的含氧衍生物单元检测题(含解析)高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题4生活中常用的有机物--烃的含氧衍生物单元检测题(含解析)高二下学期化学苏教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 762.2KB | ||
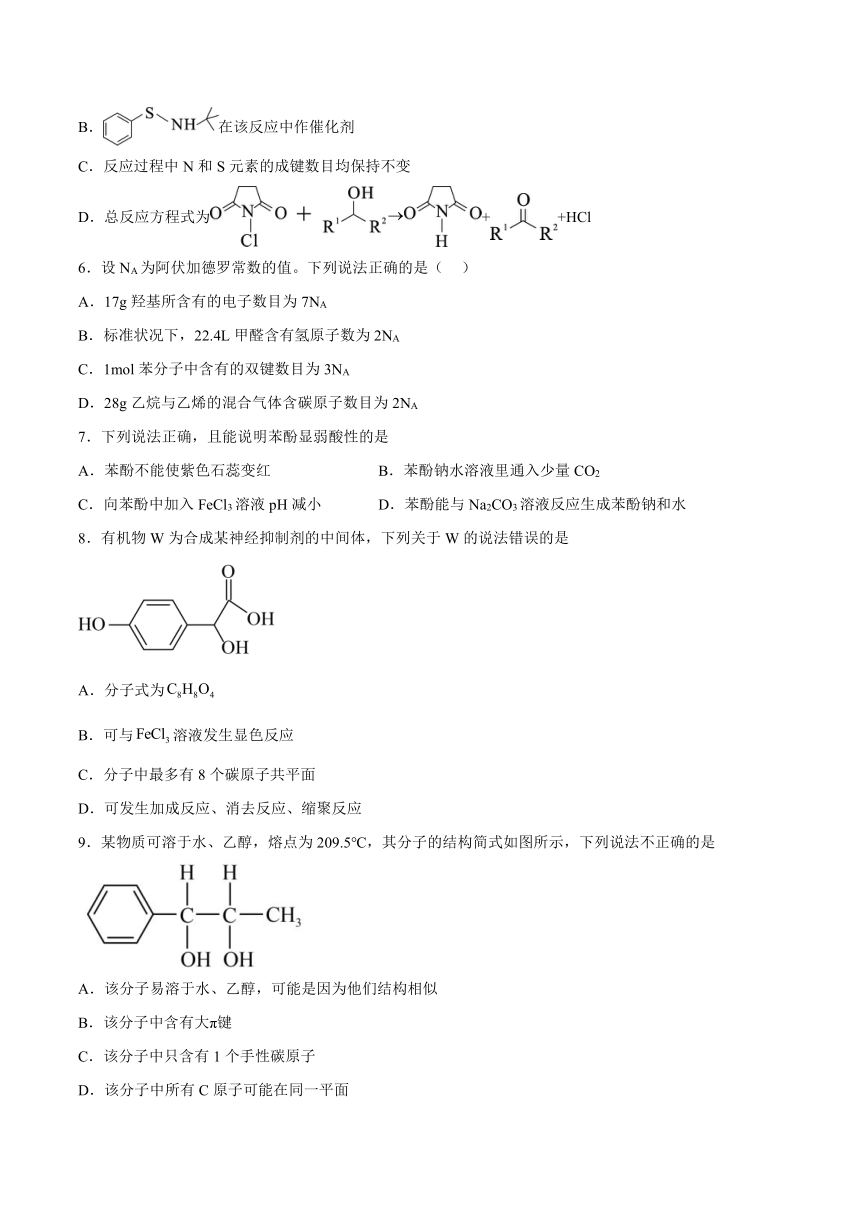
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 08:31:44 | ||
图片预览

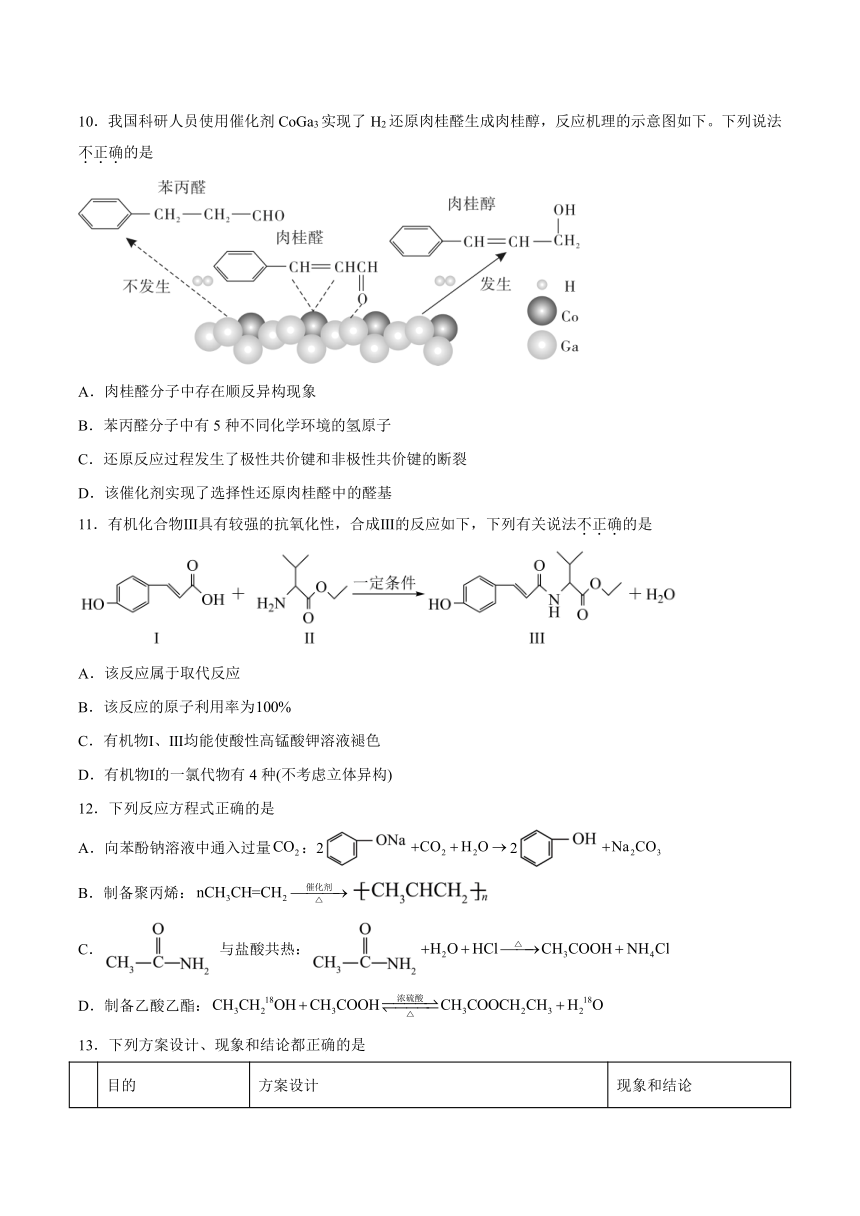

文档简介
专题4《生活中常用的有机物—烃的含氧衍生物》单元检测题
一、单选题(共13题)
1.下列关于苯酚的叙述中,正确的是
A.纯净的苯酚是粉红色晶体
B.苯酚有毒,因此不能用来制洗涤剂和软膏
C.苯比苯酚容易发生苯环上的取代反应
D.苯酚分子里羟基上的氢原子比乙醇分子里羟基上的氢原子活泼
2.下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.苯(苯酚):加溴水,振荡,过滤除去沉淀
C.乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤,蒸馏,收集馏出物
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
3.下列物质中,属于饱和一元脂肪酸的是
A.草酸 B.安息香酸 C.硬脂酸 D.石炭酸
4.某有机物一个分子中含有一个-CH3、一个-C6H4-(苯环结构)、两个-CH2-、一个-OH原子团。符合条件的结构有多种,其中能与NaOH溶液反应的物质共有
A.3种 B.6种 C.9种 D.12种
5.科研工作者研究出一种新型的醇催化氧化途径,可以避免生成有毒物质,其部分反应机理如图所示.下列说法错误的是
A.避免生成有毒物质符合绿色化学的理念
B.在该反应中作催化剂
C.反应过程中N和S元素的成键数目均保持不变
D.总反应方程式为++HCl
6.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.17g羟基所含有的电子数目为7NA
B.标准状况下,22.4L甲醛含有氢原子数为2NA
C.1mol苯分子中含有的双键数目为3NA
D.28g乙烷与乙烯的混合气体含碳原子数目为2NA
7.下列说法正确,且能说明苯酚显弱酸性的是
A.苯酚不能使紫色石蕊变红 B.苯酚钠水溶液里通入少量CO2
C.向苯酚中加入FeCl3溶液pH减小 D.苯酚能与Na2CO3溶液反应生成苯酚钠和水
8.有机物W为合成某神经抑制剂的中间体,下列关于W的说法错误的是
A.分子式为
B.可与溶液发生显色反应
C.分子中最多有8个碳原子共平面
D.可发生加成反应、消去反应、缩聚反应
9.某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图所示,下列说法不正确的是
A.该分子易溶于水、乙醇,可能是因为他们结构相似
B.该分子中含有大π键
C.该分子中只含有1个手性碳原子
D.该分子中所有C原子可能在同一平面
10.我国科研人员使用催化剂CoGa3实现了H2还原肉桂醛生成肉桂醇,反应机理的示意图如下。下列说法不正确的是
A.肉桂醛分子中存在顺反异构现象
B.苯丙醛分子中有5种不同化学环境的氢原子
C.还原反应过程发生了极性共价键和非极性共价键的断裂
D.该催化剂实现了选择性还原肉桂醛中的醛基
11.有机化合物Ⅲ具有较强的抗氧化性,合成Ⅲ的反应如下,下列有关说法不正确的是
A.该反应属于取代反应
B.该反应的原子利用率为
C.有机物Ⅰ、Ⅲ均能使酸性高锰酸钾溶液褪色
D.有机物Ⅰ的一氯代物有4种(不考虑立体异构)
12.下列反应方程式正确的是
A.向苯酚钠溶液中通入过量:22
B.制备聚丙烯:
C. 与盐酸共热:
D.制备乙酸乙酯:
13.下列方案设计、现象和结论都正确的是
目的 方案设计 现象和结论
A 探究乙醇消去反应的产物 取4mL乙醇,加入12mL浓硫酸、少量沸石,加热,将产生的气体直接通入2mL酸性KMnO4溶液中 酸性KMnO4溶液褪色,证明消去反应的产物为乙烯
B 探究Na2SO3溶液是否变质 取少量溶液置于试管中,加入足量稀盐酸,再加入BaCl2溶液 有白色沉淀产生,证明Na2SO3溶液已经变质
C 探究金属钠在氧气中燃烧所得固体的成分 取少量固体置于试管中,加入2~3mL蒸馏水 有气体生成,证明所得固体为Na2O2
D 探究Al和Mg的金属活动性 取20mL0.5mol/LNaOH溶液放入小烧杯中,将打磨光亮的铝片和镁片用导线连接后浸入溶液中 铝片表面有大量气泡冒出,证明Mg的金属性强于Al
A.A B.B C.C D.D
二、非选择题(共10题)
14.按要求填空。
(1)在3种有机物①、②CH2=CH2、③CH3CH2OH中,可用作医用消毒剂的是______(填序号,下同),从煤干馏产物中可获得的液态化工原料是______可作为水果催熟剂的是______。
(2)在3种无机物①SiO2、②Na2CO3、③NH3中,可用作食用碱的是______(填序号,下同),可用于制光导纤维的是______,可用作制冷剂的是______。
15.(1)做乙醛被新制氢氧化铜悬浊液氧化的实验时,下列各步操作中:①加入0.5mL乙醛溶液;②加入10%的氢氧化钠溶液2mL;③加入2%的CuSO4溶液4~5滴;④加热试管。正确的顺序是___。
(2)实验室配制少量银氨溶液的方法:先向试管中加入___,然后___。向制得的银氨溶液中滴加少量的乙醛,___,片刻即可在试管内壁形成银镜,化学方程式为___。
三、实验题
16.实验室制取乙酸乙酯的装置如图所示。请回答:
(1)试管a中放入了碎瓷片,作用是_______。
(2)浓硫酸的作用是_______、_______。
(3)球形干燥管的作用是导气、冷凝和_______。
(4)下列有关该实验的说法中,正确的是_______。
A.试管a中试剂加入顺序为:浓硫酸、乙醇、乙酸
B.加热反应混合液,不断蒸出产物,有利于提高产率
C.若原料为和,则乙酸乙酯中不含
D.试管b中应放入饱和碳酸钠溶液,可除去产物中混有的乙酸,并溶解部分乙醇
17.溴乙烷是一种重要的有机化工原料,其沸点为38.4℃,制备溴乙烧的一种方法是乙醇与氢溴酸反应。
实际通常是用溴化钠固体与一定浓度的硫酸以及乙醇起反应。某课外化学兴趣小组欲在实验室制备溴乙烷(装置如图),实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几小块碎瓷片;
③小心加热,使其充分反应。
回答下列问题:
(1)装置A的作用是_______,加入碎瓷片的作用是_______。
(2)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______(填标号)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水进行洗涤、分液,然后再加入无水,进行_______(填标号)实验操作。
a.分液 b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,_______(填“能”或“不能”)直接向溴乙烷中滴加硝酸银溶液来检验,其原因是_______。通常采用的方法是取少量溴乙烷,然后_______(按实验的操作顺序选填下列序号)。
①加热 ②加入溶液 ③加入稀酸化 ④加入溶液
18.用乙醇与浓硫酸的混合液在加热的条件下可以发生消去反应,某实验小组的同学在实验室用如下图所示装置验证消去反应的产物。(气密性已检验,部分夹持装置略)。
实验操作和选项:
操作 现象
点燃酒精灯加热至℃ Ⅰ:中烧瓶内液体渐渐变黑Ⅱ:内气泡连续冒出,溶液逐渐褪色
……
实验完毕,清洗烧瓶 Ⅲ:中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出
(1)烧瓶内发生的有机反应化学方程式是____________________________________,烧瓶内产生刺激性气味的气体的无机反应化学方程式是____________________________________。
(2)溶液“渐渐变黑”说明浓硫酸具有_________性。
(3)甲同学认为若中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使中溶液褪色反应的化学方程式是____________________________________。
(4)乙同学却认为即使中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在、间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
②在、间增加一个盛有浓硫酸的洗气瓶,并将中的的水溶液改为的溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
则乙同学认为中使的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使的四氯化碳溶液褪色。
四、计算题
19.在定温、定压下,如果一种物质溶解在两个同时存在的互不相溶的液体中,达到平衡后,该物质在两种溶液中的浓度之比为定值。在293 K时,在水和乙醚中的浓度之比为0.4,现有5克溶于100 mL水中,现用乙醚作为萃取剂进行萃取分液。(乙醚预先已被水所饱和,萃取时乙醚不会再溶于水),若每次只加20 mL乙醚进行萃取分液,经过多次萃取分液后水层中的质量为克,则需要操作的萃取次数为___________次(写出计算过程)?
20.酒精溶液在抗击COVID-19中发挥了极为重要的作用,现有xg乙醇(C2H5OH)在一定量氧气中燃烧生成13.2gCO2、10.8gH2O及ygCO。回答下列问题:
(1)医用消毒酒精溶液的常用浓度(体积分数)是___________。
(2)生成物中CO2、H2O的分子个数比为___________,y=___________,写出该燃烧反应的化学方程式:___________。
(3)若使该乙醇完全燃烧,至少还需要___________LO2(标准状况)。
21.链状有机物X由C、H、O三种元素组成,0.1molX在氧气中完全燃烧后,生成CO2的体积为6.72L(标准状况),生成H2O的质量为3.6g。0.1molX与足量钠反应,产生气体的体积为3.36L(标准状况)。请确定摩尔质量最小的X的分子式和结构简式____(要求写出简要推理过程。已知: 和 结构不稳定)。
22.短周期元素A、B、C、D、E ,A为原子半径最小的元素,A、D同主族,D、E同周期,C、E同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图_______。
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式_______。
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应。写出X与C单质在红热的铜丝存在时反应的化学方程式_______。
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显_______(“酸”“碱”或“中”)性,原因是:_______。
23.各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。
请回答下列问题:
(1)G元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________(填写元素符号)。
(3)写出E和乙醛反应的化学反应方程式(有机物用结构简式表示):___________________________;
反应类型:_____。
(4)写出实验室制备G的离子反应方程式:_______________________。
(5)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为____________。
(6)实验室中检验L溶液中的阳离子常选用__________(填化学式)溶液,现象是______________。
(7)A中包含X、Y、Z元素,A的化学式为_____________。
(8)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称_______________________________________、__________________。
参考答案:
1.D 2.B 3.C 4.A 5.C 6.B 7.B 8.D 9.C 10.B 11.B 12.C 13.B
14. ③ ① ② ② ① ③
15. ②③①④ 少量硝酸银溶液1~2mL 边振荡边逐滴加入稀氨水,至生成的沉淀恰好溶解为止 水浴加热 CH3CHO+2[Ag(NH3)2]OHCH3COONH4+2Ag↓+3NH3+H2O
16. 防止暴沸 催化剂 吸水剂 防止倒吸 BD
17.(1) 冷凝回流 防止暴沸
(2)a
(3)b
(4) 不能 溴乙烷不能与硝酸银溶液反应生成溴化银沉淀 ④①③②
18. 脱水性 溶液 干燥的
19.2次
20. 75% 1:2 2.8 1.12
21.C3H4O5、
22. H++HSO=H2O+SO2↑ 2C2H5OH+O22CH3CHO+2H2O 共价键和离子键 碱 反应后所得溶液为NaHCO3,HCO发生水解和电离:HCO+H2O H2CO3+OH- ,HCO CO+H+,水解大于电离,所以溶液显碱性
23. 第3周期ⅦA族 C O CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O 氧化反应 MnO2 + 4H+ + 2Cl-Mn2+ + Cl2↑+ 2H2O 纯碱(或苏打) KSCN 溶液变血红色 Cu2(OH)2CO3 金刚石 石墨(足球烯)
一、单选题(共13题)
1.下列关于苯酚的叙述中,正确的是
A.纯净的苯酚是粉红色晶体
B.苯酚有毒,因此不能用来制洗涤剂和软膏
C.苯比苯酚容易发生苯环上的取代反应
D.苯酚分子里羟基上的氢原子比乙醇分子里羟基上的氢原子活泼
2.下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.苯(苯酚):加溴水,振荡,过滤除去沉淀
C.乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤,蒸馏,收集馏出物
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
3.下列物质中,属于饱和一元脂肪酸的是
A.草酸 B.安息香酸 C.硬脂酸 D.石炭酸
4.某有机物一个分子中含有一个-CH3、一个-C6H4-(苯环结构)、两个-CH2-、一个-OH原子团。符合条件的结构有多种,其中能与NaOH溶液反应的物质共有
A.3种 B.6种 C.9种 D.12种
5.科研工作者研究出一种新型的醇催化氧化途径,可以避免生成有毒物质,其部分反应机理如图所示.下列说法错误的是
A.避免生成有毒物质符合绿色化学的理念
B.在该反应中作催化剂
C.反应过程中N和S元素的成键数目均保持不变
D.总反应方程式为++HCl
6.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.17g羟基所含有的电子数目为7NA
B.标准状况下,22.4L甲醛含有氢原子数为2NA
C.1mol苯分子中含有的双键数目为3NA
D.28g乙烷与乙烯的混合气体含碳原子数目为2NA
7.下列说法正确,且能说明苯酚显弱酸性的是
A.苯酚不能使紫色石蕊变红 B.苯酚钠水溶液里通入少量CO2
C.向苯酚中加入FeCl3溶液pH减小 D.苯酚能与Na2CO3溶液反应生成苯酚钠和水
8.有机物W为合成某神经抑制剂的中间体,下列关于W的说法错误的是
A.分子式为
B.可与溶液发生显色反应
C.分子中最多有8个碳原子共平面
D.可发生加成反应、消去反应、缩聚反应
9.某物质可溶于水、乙醇,熔点为209.5℃,其分子的结构简式如图所示,下列说法不正确的是
A.该分子易溶于水、乙醇,可能是因为他们结构相似
B.该分子中含有大π键
C.该分子中只含有1个手性碳原子
D.该分子中所有C原子可能在同一平面
10.我国科研人员使用催化剂CoGa3实现了H2还原肉桂醛生成肉桂醇,反应机理的示意图如下。下列说法不正确的是
A.肉桂醛分子中存在顺反异构现象
B.苯丙醛分子中有5种不同化学环境的氢原子
C.还原反应过程发生了极性共价键和非极性共价键的断裂
D.该催化剂实现了选择性还原肉桂醛中的醛基
11.有机化合物Ⅲ具有较强的抗氧化性,合成Ⅲ的反应如下,下列有关说法不正确的是
A.该反应属于取代反应
B.该反应的原子利用率为
C.有机物Ⅰ、Ⅲ均能使酸性高锰酸钾溶液褪色
D.有机物Ⅰ的一氯代物有4种(不考虑立体异构)
12.下列反应方程式正确的是
A.向苯酚钠溶液中通入过量:22
B.制备聚丙烯:
C. 与盐酸共热:
D.制备乙酸乙酯:
13.下列方案设计、现象和结论都正确的是
目的 方案设计 现象和结论
A 探究乙醇消去反应的产物 取4mL乙醇,加入12mL浓硫酸、少量沸石,加热,将产生的气体直接通入2mL酸性KMnO4溶液中 酸性KMnO4溶液褪色,证明消去反应的产物为乙烯
B 探究Na2SO3溶液是否变质 取少量溶液置于试管中,加入足量稀盐酸,再加入BaCl2溶液 有白色沉淀产生,证明Na2SO3溶液已经变质
C 探究金属钠在氧气中燃烧所得固体的成分 取少量固体置于试管中,加入2~3mL蒸馏水 有气体生成,证明所得固体为Na2O2
D 探究Al和Mg的金属活动性 取20mL0.5mol/LNaOH溶液放入小烧杯中,将打磨光亮的铝片和镁片用导线连接后浸入溶液中 铝片表面有大量气泡冒出,证明Mg的金属性强于Al
A.A B.B C.C D.D
二、非选择题(共10题)
14.按要求填空。
(1)在3种有机物①、②CH2=CH2、③CH3CH2OH中,可用作医用消毒剂的是______(填序号,下同),从煤干馏产物中可获得的液态化工原料是______可作为水果催熟剂的是______。
(2)在3种无机物①SiO2、②Na2CO3、③NH3中,可用作食用碱的是______(填序号,下同),可用于制光导纤维的是______,可用作制冷剂的是______。
15.(1)做乙醛被新制氢氧化铜悬浊液氧化的实验时,下列各步操作中:①加入0.5mL乙醛溶液;②加入10%的氢氧化钠溶液2mL;③加入2%的CuSO4溶液4~5滴;④加热试管。正确的顺序是___。
(2)实验室配制少量银氨溶液的方法:先向试管中加入___,然后___。向制得的银氨溶液中滴加少量的乙醛,___,片刻即可在试管内壁形成银镜,化学方程式为___。
三、实验题
16.实验室制取乙酸乙酯的装置如图所示。请回答:
(1)试管a中放入了碎瓷片,作用是_______。
(2)浓硫酸的作用是_______、_______。
(3)球形干燥管的作用是导气、冷凝和_______。
(4)下列有关该实验的说法中,正确的是_______。
A.试管a中试剂加入顺序为:浓硫酸、乙醇、乙酸
B.加热反应混合液,不断蒸出产物,有利于提高产率
C.若原料为和,则乙酸乙酯中不含
D.试管b中应放入饱和碳酸钠溶液,可除去产物中混有的乙酸,并溶解部分乙醇
17.溴乙烷是一种重要的有机化工原料,其沸点为38.4℃,制备溴乙烧的一种方法是乙醇与氢溴酸反应。
实际通常是用溴化钠固体与一定浓度的硫酸以及乙醇起反应。某课外化学兴趣小组欲在实验室制备溴乙烷(装置如图),实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几小块碎瓷片;
③小心加热,使其充分反应。
回答下列问题:
(1)装置A的作用是_______,加入碎瓷片的作用是_______。
(2)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_______(填标号)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
(3)要进一步制得纯净的溴乙烷,可继续用蒸馏水进行洗涤、分液,然后再加入无水,进行_______(填标号)实验操作。
a.分液 b.蒸馏 c.萃取
(4)为了检验溴乙烷中含有溴元素,_______(填“能”或“不能”)直接向溴乙烷中滴加硝酸银溶液来检验,其原因是_______。通常采用的方法是取少量溴乙烷,然后_______(按实验的操作顺序选填下列序号)。
①加热 ②加入溶液 ③加入稀酸化 ④加入溶液
18.用乙醇与浓硫酸的混合液在加热的条件下可以发生消去反应,某实验小组的同学在实验室用如下图所示装置验证消去反应的产物。(气密性已检验,部分夹持装置略)。
实验操作和选项:
操作 现象
点燃酒精灯加热至℃ Ⅰ:中烧瓶内液体渐渐变黑Ⅱ:内气泡连续冒出,溶液逐渐褪色
……
实验完毕,清洗烧瓶 Ⅲ:中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出
(1)烧瓶内发生的有机反应化学方程式是____________________________________,烧瓶内产生刺激性气味的气体的无机反应化学方程式是____________________________________。
(2)溶液“渐渐变黑”说明浓硫酸具有_________性。
(3)甲同学认为若中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使中溶液褪色反应的化学方程式是____________________________________。
(4)乙同学却认为即使中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在、间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
②在、间增加一个盛有浓硫酸的洗气瓶,并将中的的水溶液改为的溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
则乙同学认为中使的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使的四氯化碳溶液褪色。
四、计算题
19.在定温、定压下,如果一种物质溶解在两个同时存在的互不相溶的液体中,达到平衡后,该物质在两种溶液中的浓度之比为定值。在293 K时,在水和乙醚中的浓度之比为0.4,现有5克溶于100 mL水中,现用乙醚作为萃取剂进行萃取分液。(乙醚预先已被水所饱和,萃取时乙醚不会再溶于水),若每次只加20 mL乙醚进行萃取分液,经过多次萃取分液后水层中的质量为克,则需要操作的萃取次数为___________次(写出计算过程)?
20.酒精溶液在抗击COVID-19中发挥了极为重要的作用,现有xg乙醇(C2H5OH)在一定量氧气中燃烧生成13.2gCO2、10.8gH2O及ygCO。回答下列问题:
(1)医用消毒酒精溶液的常用浓度(体积分数)是___________。
(2)生成物中CO2、H2O的分子个数比为___________,y=___________,写出该燃烧反应的化学方程式:___________。
(3)若使该乙醇完全燃烧,至少还需要___________LO2(标准状况)。
21.链状有机物X由C、H、O三种元素组成,0.1molX在氧气中完全燃烧后,生成CO2的体积为6.72L(标准状况),生成H2O的质量为3.6g。0.1molX与足量钠反应,产生气体的体积为3.36L(标准状况)。请确定摩尔质量最小的X的分子式和结构简式____(要求写出简要推理过程。已知: 和 结构不稳定)。
22.短周期元素A、B、C、D、E ,A为原子半径最小的元素,A、D同主族,D、E同周期,C、E同主族且E的原子序数为C的原子序数的2倍,B为组成物质种类最多的元素。
(1)E离子的原子结构示意图_______。
(2)分别由A、C、D、E四种元素组成的两种盐可相互反应得到气体,写出这个反应的离子方程式_______。
(3)由A、B、C三种元素组成的物质X,式量为46,在一定条件下与C、D两种元素的单质均可反应。写出X与C单质在红热的铜丝存在时反应的化学方程式_______。
(4)A、C、D三种元素组成的化合物Y中含有的化学键为_______,B的最高价氧化物与等物质的量的Y溶液反应后,溶液显_______(“酸”“碱”或“中”)性,原因是:_______。
23.各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。
请回答下列问题:
(1)G元素在周期表中的位置______________________,C的电子式______________。
(2)比较Y与Z的原子半径大小:___________________(填写元素符号)。
(3)写出E和乙醛反应的化学反应方程式(有机物用结构简式表示):___________________________;
反应类型:_____。
(4)写出实验室制备G的离子反应方程式:_______________________。
(5)气体D与NaOH溶液反应可生成两种盐P和Q,在P中Na的质量分数为43%,其俗名为____________。
(6)实验室中检验L溶液中的阳离子常选用__________(填化学式)溶液,现象是______________。
(7)A中包含X、Y、Z元素,A的化学式为_____________。
(8)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其一种同素异形体的名称_______________________________________、__________________。
参考答案:
1.D 2.B 3.C 4.A 5.C 6.B 7.B 8.D 9.C 10.B 11.B 12.C 13.B
14. ③ ① ② ② ① ③
15. ②③①④ 少量硝酸银溶液1~2mL 边振荡边逐滴加入稀氨水,至生成的沉淀恰好溶解为止 水浴加热 CH3CHO+2[Ag(NH3)2]OHCH3COONH4+2Ag↓+3NH3+H2O
16. 防止暴沸 催化剂 吸水剂 防止倒吸 BD
17.(1) 冷凝回流 防止暴沸
(2)a
(3)b
(4) 不能 溴乙烷不能与硝酸银溶液反应生成溴化银沉淀 ④①③②
18. 脱水性 溶液 干燥的
19.2次
20. 75% 1:2 2.8 1.12
21.C3H4O5、
22. H++HSO=H2O+SO2↑ 2C2H5OH+O22CH3CHO+2H2O 共价键和离子键 碱 反应后所得溶液为NaHCO3,HCO发生水解和电离:HCO+H2O H2CO3+OH- ,HCO CO+H+,水解大于电离,所以溶液显碱性
23. 第3周期ⅦA族 C O CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O 氧化反应 MnO2 + 4H+ + 2Cl-Mn2+ + Cl2↑+ 2H2O 纯碱(或苏打) KSCN 溶液变血红色 Cu2(OH)2CO3 金刚石 石墨(足球烯)
