专题4 分子空间结构与物质性质 单元测试 高二下学期化学苏教版(2019)选择性必修2(含解析)
文档属性
| 名称 | 专题4 分子空间结构与物质性质 单元测试 高二下学期化学苏教版(2019)选择性必修2(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 548.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 11:21:06 | ||
图片预览




文档简介
专题4《分子空间结构与物质性质》单元测试卷
一、单选题
1.2016年国际纯粹与应用化学联合会命名第117号元素为Ts。关于Ts的叙述不正确的是
A.中子数177 B.质量数294
C.核外电子数117 D.相对原子质量117
2.环己基氨基酸钙约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。下列溶剂中不能溶解该化合物是
A.H2O B.CH3OH C.NH3(液) D.CCl4
3.关于CO2和SO2的说法中,正确的是
A.C和S上都没有孤电子对
B.C和S都是sp3杂化
C.都是AB2型,所以空间结构都是直线型
D.CO2的空间结构是直线型,SO2的空间结构是V型
4.下列说法正确的是
A.并不是所有原子都由质子、中子和核外电子构成
B.只要知道粒子的质子数,就一定能确定它是什么元素
C.由于质量数=质子数+中子数,所以,电子是没有质量的
D.分子的质子数等于该分子中各原子质子数与中子数之和
5.下列物质中,由极性键形成的非极性分子的是
A. B. C. D.
6.“玉兔”号月球巡视器白天用三结砷化镓太阳能电池板收集能量,夜晚用放射性同位素元素钚() “核电池”释放能量。有关说法正确的是
A.的质量数为144 B.砷化镓属于金属材料
C.“玉兔”号白天用太阳能转化为电能 D.“核电池”是通过化学反应提供电能
7.下列说法正确的是( )
A.Na2O2和 NaOH 所含化学键类型完全相同
B.NH3比 PH3稳定是因为 NH3分子间存在氢键
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.H2O2 是含非极性键的极性分子
8.下列说法正确的是
A.“中国天眼”的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
C.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
D.我国自主研发的东方超环(人造太阳)使用的氕、氘、氚互为同素异形体
9.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示。下列有关说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性,也是键的一种
D.冰变成水,氢键部分被破坏
10.如图所示的布洛芬中含有几个手性碳原子
A.0 B.1 C.2 D.3
11.光气(COCl2)是一种重要的有机中间体。反应CHCl3(l)+H2O2(l)=COCl2(g)+HCl(g)+H2O(l) ΔH<0可用于制备光气。下列有关叙述正确的是。
A.CHCl3为非极性分子 B.氯原子的结构示意图为
C.H2O2的电子式为 D.该反应低温才能自发进行反应
12.下列说法中不正确的是
A.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
B.三氟乙酸的酸性大于三氯乙酸是由于键的极性不同导致电离出氢离子能力不同
C.对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
D.氯气易溶于氢氧化钠溶液是因为“相似相溶”规律导致的
13.NA为阿伏加德罗常数的值。下列说法错误的是
A.23 g CH3-CH2-OH中sp3杂化的原子数为NA
B.0.5 mol PCl3中磷的价层电子对数为2NA
C.1 mol [Cu(H2O)4]2+中配位键的个数为4NA
D.标准状况下,11.2 L CO和H2的混合气体中分子数为0.5NA
14.利用反应CCl4+ 4NaC(金刚石) + 4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是
A.反应的四种物质分别可形成不同类型的晶体
B.CCl4与金刚石中的C原子杂化轨道类型不同
C.反应中四种物质的熔点: C(金刚石)>NaCl>Na>CCl4
D.通过X-射线衍射可鉴定合成的产品是金刚石还是石墨
15.下列物质在变化过程中,只需克服分子间作用力的是
A.HCl溶于水 B.NaCl溶于水 C.碘升华 D.加热HI使其分解
二、填空题
16.【实验】制取[Cu(NH3)4](OH)2
实验操作 实验现象 实验结论
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水 _______ _______
继续添加氨水并振荡试管 _______ ________
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁 _______ _______
[实验结论]无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在_______,它是Cu2+的另一种常见配离子,中心离子仍然是_______,而配体是_______,配位数为_______。
17.回答下列问题:
(1)氨气通入盐酸中发生反应:。
①NH3分子的VSEPR模型名称为_______,略去N原子上的_______个孤电子对,使得NH3分子的空间结构名称为_______。转化中,氮原子的杂化类型是否改变?_______(填“改变”或“未变”)。
②转化H3O+→H2O涉及的两种微粒中,H2O、H3O+的空间结构名称分别为_______、_______,中心原子的杂化类型分别为_______、_______。
(2)分子的结构往往决定了物质的有关性质,特别是物质的溶解性、熔沸点等物理性质。
①基团间的相互影响可决定物质的结构与性质,如乙烷为_______分子(填“极性”或“非极性”,下同),而乙烷中一个氢原子被羟基(—OH)取代后所得的乙醇分子为_______分子,这决定了乙烷_______溶于水,而乙醇_______溶于水。
②氧、硫、硒(Se)元素同为第VIA族元素,三者的简单氢化物结构相似,但H2S的沸点低于H2O,原因是_______,H2S的沸点低于H2Se的原因是_______。
18.现有下列9种微粒:H、H、C、C、N、Fe2+、Fe3+、O2、O3。按要求完成以下各题:
(1)互为同素异形体的微粒是__。
(2)Fe2+的中子数为___,核外电子数为__。
(3)形成上述9种微粒的核素有__种、元素有___种。
(4)常温下,16gO2、O3的混合气体中原子的物质的量为__。
(5)由1H、2H和16O、18O构成的水分子有__种。
三、实验题
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
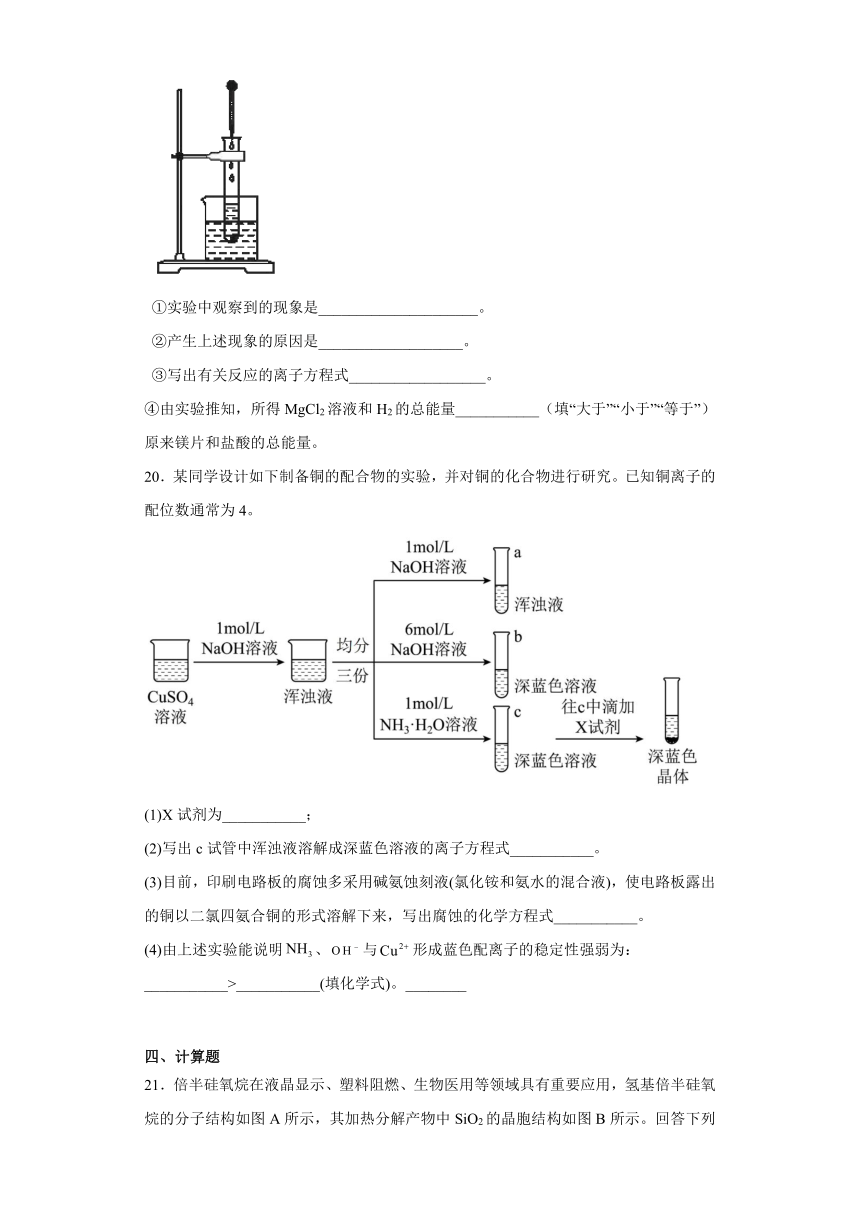
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
20.某同学设计如下制备铜的配合物的实验,并对铜的化合物进行研究。已知铜离子的配位数通常为4。
(1)X试剂为___________;
(2)写出c试管中浑浊液溶解成深蓝色溶液的离子方程式___________。
(3)目前,印刷电路板的腐蚀多采用碱氨蚀刻液(氯化铵和氨水的混合液),使电路板露出的铜以二氯四氨合铜的形式溶解下来,写出腐蚀的化学方程式___________。
(4)由上述实验能说明、与形成蓝色配离子的稳定性强弱为:___________>___________(填化学式)。________
四、计算题
21.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
参考答案:
1.D
【分析】核素中,A代表元素的质量数,Z为质子数、核电荷数、原子序数、原子核外电子数,中子数=A-Z。
【详解】A.核素的中子数为294-117=177,故A正确;
B.核素的质量数为294,故B正确;
C.核素的核外电子数为117,故C正确;
D.相对原子质量为中子数与质子数之和取整数值,核素的相对原子质量为294,故D错误;
故选D。
2.D
【解析】略
3.D
【详解】A.C的孤电子对数为,S的孤电子对数为,故A错误;
B.C的价层电子对数为,S的价层电子对数为,则C和S分别是sp杂化,sp2杂化,故B错误;
C.C的价层电子对数为2,孤电子对数为0,S的价层电子对数为3,S的孤电子对数为1,则CO2的空间结构是直线型,SO2的空间结构是V型,故C错误;
D.由C分析可知,CO2的空间结构是直线型,SO2的空间结构是V型,故D正确;
故选D。
4.A
【详解】A.一般来说,原子是由质子、中子和核外电子构成的,但是,质量数为1的氢原子,即中,中子数为0,也就是说,质量数为1的氢原子中没有中子,故A正确;
B.粒子包括原子、分子(单原子分子或多原子分子)、离子(单核或多核离子)等,只知道粒子的质子数,不一定能确定元素,如Ne原子和H2O分子的质子数都为10,故B错误;
C.在计算质量数时,由于电子的质量比质子、中子的质量小得多而被忽略,并不是电子没有质量,故C错误;
D.分子的质子数等于该分子中各原子质子数与之和,故D错误;
答案选A。
5.B
【详解】A.为非极性键形成的非极性分子,A不符合;
B.为极性键形成的非极性分子,B符合;
C.为极性键形成的极性分子,C不符合;
D.为极性键形成的极性分子,D不符合;
答案选B。
6.C
【详解】A.的质量数为238,A错误;
B.砷化镓属于半导体材料,B错误;
C.“玉兔”号月球巡视器白天用三结砷化镓太阳能电池板收集能量即太阳能转化为电能,C正确;
D.核电池又叫“放射性同位素电池”,它是通过半导体换能器将同位素在衰变过程中不断地放出具有热能的射线的热能转变为电能而制造而成,D错误;
答案选C。
7.D
【详解】A.NaOH中含有离子键和极性共价键,Na2O2含有离子键和非极性共价键,所以两者化学键类型不同,A错误;
B. 氢键影响物理性质,不影响氢化物稳定性,NH3比PH3稳定是因为N元素非金属强于P,B错误;
C. 化学反应的实质是旧键断裂生成新键,CO2溶于水与水反应生成碳酸,则CO2溶于水存在共价键和分子间作用力的改变,干冰升华只是CO2从固态变为气态,只有分子间作用力改变,因此二者作用力的改变不相同,C错误;
D. H2O2即含极性共价键又含非极性键的极性分子,D正确;
故答案为:D。
【点睛】氢键不是化学键,是一种分子间作用力,主要影响物理性质,比如熔沸点、溶解性等,不影响其化学性质。
8.B
【详解】A.钢铁结成的圈梁,属于金属材料,A错误;
B.高温结构陶瓷一般用碳化硅、氮化硅或某些金属氧化物等在高温下烧结而成,属于新型无机非金属材料,B正确;
C.太阳能电池板的主要材料是硅,C错误;
D.氕、氘、氚为H元素的不同种核素,互为同位素,D错误;
答案选B。
9.D
【详解】A.冰晶胞内水分子间以氢键结合,氢键不是化学键,故A错误;
B.由冰晶胞的结构可知,根据均摊法计算,每个冰晶胞平均含有4+8×+6×=8个水分子,故B错误;
C.水分子间的氢键具有方向性和饱和性,但氢键不是化学键,故C错误;
D.冰熔化为液态水时只是破坏了一部分氢键,液态水中仍在氢键,故D正确。
故答案为D。
10.B
【详解】同一碳原子连接四个不同的原子或原子团,则该碳原子为手性碳原子,布洛芬所含的手性碳原子如图星号所示: ,
故选B。
11.B
【详解】A.CHCl3空间构型为四面体,正负电荷中心不重合,CHCl3为极性分子,故A错误;
B.氯元素原子序数为17,其结构示意图为,故B正确;
C.过氧化氢为共价化合物,其电子式为,故C错误;
D.根据反应方程式,该反应是熵增,即ΔS>0,根据ΔG=ΔH-TΔS,该反应自发进行,ΔG<0,任何温度下均能自发进行,故D错误;
答案为B。
12.D
【详解】A.价层电子对互斥模型中,价层电子对数等于分子的中心原子与结合原子间的键和中心原子上的孤电子对,不计π键电子对数,A正确;
B.三氟乙酸的酸性大于三氯乙酸的,因为氟的电负性大于氯的,F-C的极性大于Cl-C的,使F3C-的极性变大,导致三氟乙酸的羧基中羟基的极性更大,更易电离出氢离子,B正确;
C.邻羟基苯甲醛会形成分子内氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,C正确;
D.氯气为非极性分子,水为极性溶剂,氯气易溶于氢氧化钠溶液是因为氯气与氢氧化钠发生化学反应,不是因为“相似相溶”规律,D错误;
故选D。
13.A
【详解】A.23 g CH3-CH2-OH的物质的量是0.5 mol,乙醇分子中C原子都是采用sp3杂化,O也是采用sp3杂化,在一个CH3-CH2-OH中含有3个sp3杂化的原子,则在0.5 mol乙醇中含有的sp3杂化的原子物质的量是1.5 mol,含有的这种原子数目是1.5NA,A错误;
B.PCl3中P原子价电子对数是3+=4,0.5 mol PCl3中磷的价层电子对数为0.5 mol×4×NA/mol=2NA,B正确;
C.1个[Cu(H2O)4]2+中配位键数目是4个,则1 mol [Cu(H2O)4]2+中配位键的数目为4NA,C正确;
D.标准状况下,11.2 L CO和H2的混合气体的物质的量是0.5 mol,其中含有的气体分子数为0.5NA,D正确;
故合理选项是A。
14.B
【详解】A.固体CCl4为分子晶体,Na为金属晶体,C(金刚石) 为原子晶体,NaCl为离子晶体,可形成不同类型的晶体,故A正确;
B. CCl4中C原子的价层电子对数为4,金刚石中C原子的价层电子对数也为 4,则杂化轨道类型相同,均为sp3,故B错误;
C.固体CCl4为分子晶体,常温下为液体,Na为金属晶体,熔点较低,C(金刚石) 为原子晶体,NaCl为离子晶体,原子晶体的熔点最高,其次是离子晶体,则反应中四种物质的熔点:C(金刚石)> NaCl> Na> CCl4,故C正确;
D. 金刚石和石墨的原子排列方式不同,故X-射线衍射可鉴定合成的产品是金刚石还是石墨,故D正确;
故选B。
15.C
【详解】A.HCl溶于水电离出氢离子和氯离子,需克服共价键,故不选A;
B.NaCl溶于水电离出钠离子和氯离子,需克服离子键,故不选B;
C.碘是分子晶体,碘升华,碘分子没变,碘分子间距离改变,只需克服分子间作用力,故选C;
D.加热HI使其分解为氢气和碘单质,需克服H-I键,故不选D;
选C。
16. 形成难溶物 Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH 难溶物溶解,得到深蓝色的透明溶液 Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 析出深蓝色晶体 深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度 [Cu(NH3)4]2+ Cu2+ NH3 4
【解析】略
17.(1) 正四面体形 1 三角锥形 未变 V形(或角形) 三角锥形 sp3 sp3
(2) 非极性 极性 难 极易(或易) 水分子间存在氢键,而硫化氢分子间只有范德华力 硫化氢分子间的范德华力弱于硒化氢分子间的范德华力
【解析】(1)
①NH3分子的中心原子价层电子对数为3+=4,采取sp3杂化,有1对孤对电子,VSEPR模型为正四面体形,空间结构为三角锥形。的中心原子价层电子对数为4+=4,采取sp3杂化。
②H2O的中心原子价层电子对数为2+=4,采取sp3杂化,有2对孤对电子,VSEPR模型为正四面体形,空间结构为V形,H3O+的中心原子价层电子对数为3+=4,采取sp3杂化,有1对孤对电子,VSEPR模型为正四面体形,空间结构为三角锥形。
(2)
①乙烷分子为对称性分子,决定了乙烷为非极性分子,而乙醇分子为不对称性分子,这决定了乙醇为极性分子,且乙醇能与水分子形成分子间氢键,而水是极性分子,再依据“相似相溶”规律可知:乙烷难溶于水,而乙醇极易溶于水。
②H2S分子间只有范德华力,而H2O分子间存在氢键,氢键强度大于范德华力,导致水的沸点高于硫化氢的沸点;H2S和H2Se的分子结构相似,分子间都只存在范德华力,而H2S的相对分子质量小于H2Se,决定了H2S的沸点低于H2Se的沸点。
18. O2和O3 30 24 7 5 1mol 6
【详解】(1)由同一种元素形成的不同单质互为同素异形体,因此互为同素异形体的微粒是O2和O3。
(2)质子数+中子数=质量数,所以Fe2+的中子数为56-26=30,核外电子数为26―2=24。
(3)具有一定数目质子和一定数目中子的原子是核素,因此形成上述9种微粒的核素有7种,即H、H、C、C、N、Fe2+、Fe3+,具有相同核电荷数即质子数相同的同一类原子互为同位素,因此元素有H、C、N、Fe、O,共计是五种元素。
(4)O2、O3均是由同一种氧原子形成的单质,则常温下,16gO2、O3的混合气体中原子的物质的量为16g÷16g/mol=1mol。
(5)由1H、2H和16O、18O构成的水分子有2H216O、1H218O、1H216O、2H218O、1H2H16O、2H1H18O,共计是6种。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1)无水乙醇
(2)
(3)
(4)
【分析】向CuSO4溶液中加入NaOH溶液得到Cu(OH)2悬浊液,将悬浊液分成三份后分别加入1 mol/L NaOH溶液得到Cu(OH)2浑浊液,加入6mol/L NaOH溶液得到深蓝色的溶液,加入1mol/LNH3·H2O溶液,得到深蓝色的溶液,在乙醇中溶解度较小,向溶液中加入无水乙醇,可以得到深蓝色晶体,以此解答。
【详解】(1)由分析可知,X试剂为无水乙醇。
(2)由分析可知,向Cu(OH)2悬浊液中加入1mol/LNH3·H2O溶液,得到深蓝色的溶液,离子方程式为:。
(3)印刷电路板的腐蚀多采用碱氨蚀刻液(氯化铵和氨水的混合液),使电路板露出的铜以二氯四氨合铜的形式溶解下来,该过程中Cu和氯化铵、氨水、氧气反应生成二氯四氨合铜和水,方程式为:。
(4)向生成蓝色配离子的溶液中加入氨水的溶液碱性增强,说明生成蓝色配离子为,所以试管b、c中深蓝色配离子的稳定性强弱顺序为>。
21.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的核外电子排布式为1s22s22p63s23p2或者[Ne] 3s23p2;根据泡利原理成对电子自旋方向相反;
故答案为1s22s22p63s23p2或者[Ne] 3s23p2,自旋方向相反;
(2)A分子结构中Si原子位于顶点,被3个面所共有,每个面含有4个O原子和4个Si原子,共8个原子,硅的配位数为4;A为分子结构式,所有原子均为一个分子共有,分子中含有8个Si原子,8个H原子和12个O原子,故分子式为Si8H8O12;
故答案为八,Si8H8O12;
(3)A分子中O原子显 2价,则Si显+4价,H显 1价;O原子与Si原子形成2个σ共价键,且O原子还有2对孤对电子,即含有4个σ电子对,所以O原子采用的杂化类型为sp3杂化;两种元素非金属性差距越大极性越大,Si O之间的非金属性之差大于Si H之间的非金属性之差,所以Si O键的极性强于Si H键的极性;
故答案为 1,sp3,σ键,>;
(4)图A所示为氢基倍半硅氧烷的分子结构,所以则氢基倍半硅氧烷形成的晶体类型为分子晶体,而SiO2为原子晶体;
故答案为分子,原子;
(5)SiO2晶体为面心立方结构,每个SiO2晶胞含有Si原子的个数为,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为,晶胞边长为anm,故SiO2晶体的密度=;
故答案为8,。
一、单选题
1.2016年国际纯粹与应用化学联合会命名第117号元素为Ts。关于Ts的叙述不正确的是
A.中子数177 B.质量数294
C.核外电子数117 D.相对原子质量117
2.环己基氨基酸钙约比蔗糖甜30倍,曾广泛用于食品中,但近年来发现它能致癌而禁止使用。下列溶剂中不能溶解该化合物是
A.H2O B.CH3OH C.NH3(液) D.CCl4
3.关于CO2和SO2的说法中,正确的是
A.C和S上都没有孤电子对
B.C和S都是sp3杂化
C.都是AB2型,所以空间结构都是直线型
D.CO2的空间结构是直线型,SO2的空间结构是V型
4.下列说法正确的是
A.并不是所有原子都由质子、中子和核外电子构成
B.只要知道粒子的质子数,就一定能确定它是什么元素
C.由于质量数=质子数+中子数,所以,电子是没有质量的
D.分子的质子数等于该分子中各原子质子数与中子数之和
5.下列物质中,由极性键形成的非极性分子的是
A. B. C. D.
6.“玉兔”号月球巡视器白天用三结砷化镓太阳能电池板收集能量,夜晚用放射性同位素元素钚() “核电池”释放能量。有关说法正确的是
A.的质量数为144 B.砷化镓属于金属材料
C.“玉兔”号白天用太阳能转化为电能 D.“核电池”是通过化学反应提供电能
7.下列说法正确的是( )
A.Na2O2和 NaOH 所含化学键类型完全相同
B.NH3比 PH3稳定是因为 NH3分子间存在氢键
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.H2O2 是含非极性键的极性分子
8.下列说法正确的是
A.“中国天眼”的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
C.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
D.我国自主研发的东方超环(人造太阳)使用的氕、氘、氚互为同素异形体
9.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示。下列有关说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性,也是键的一种
D.冰变成水,氢键部分被破坏
10.如图所示的布洛芬中含有几个手性碳原子
A.0 B.1 C.2 D.3
11.光气(COCl2)是一种重要的有机中间体。反应CHCl3(l)+H2O2(l)=COCl2(g)+HCl(g)+H2O(l) ΔH<0可用于制备光气。下列有关叙述正确的是。
A.CHCl3为非极性分子 B.氯原子的结构示意图为
C.H2O2的电子式为 D.该反应低温才能自发进行反应
12.下列说法中不正确的是
A.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
B.三氟乙酸的酸性大于三氯乙酸是由于键的极性不同导致电离出氢离子能力不同
C.对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
D.氯气易溶于氢氧化钠溶液是因为“相似相溶”规律导致的
13.NA为阿伏加德罗常数的值。下列说法错误的是
A.23 g CH3-CH2-OH中sp3杂化的原子数为NA
B.0.5 mol PCl3中磷的价层电子对数为2NA
C.1 mol [Cu(H2O)4]2+中配位键的个数为4NA
D.标准状况下,11.2 L CO和H2的混合气体中分子数为0.5NA
14.利用反应CCl4+ 4NaC(金刚石) + 4NaCl可实现人工合成金刚石。下列关于该反应的说法错误的是
A.反应的四种物质分别可形成不同类型的晶体
B.CCl4与金刚石中的C原子杂化轨道类型不同
C.反应中四种物质的熔点: C(金刚石)>NaCl>Na>CCl4
D.通过X-射线衍射可鉴定合成的产品是金刚石还是石墨
15.下列物质在变化过程中,只需克服分子间作用力的是
A.HCl溶于水 B.NaCl溶于水 C.碘升华 D.加热HI使其分解
二、填空题
16.【实验】制取[Cu(NH3)4](OH)2
实验操作 实验现象 实验结论
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水 _______ _______
继续添加氨水并振荡试管 _______ ________
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁 _______ _______
[实验结论]无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在_______,它是Cu2+的另一种常见配离子,中心离子仍然是_______,而配体是_______,配位数为_______。
17.回答下列问题:
(1)氨气通入盐酸中发生反应:。
①NH3分子的VSEPR模型名称为_______,略去N原子上的_______个孤电子对,使得NH3分子的空间结构名称为_______。转化中,氮原子的杂化类型是否改变?_______(填“改变”或“未变”)。
②转化H3O+→H2O涉及的两种微粒中,H2O、H3O+的空间结构名称分别为_______、_______,中心原子的杂化类型分别为_______、_______。
(2)分子的结构往往决定了物质的有关性质,特别是物质的溶解性、熔沸点等物理性质。
①基团间的相互影响可决定物质的结构与性质,如乙烷为_______分子(填“极性”或“非极性”,下同),而乙烷中一个氢原子被羟基(—OH)取代后所得的乙醇分子为_______分子,这决定了乙烷_______溶于水,而乙醇_______溶于水。
②氧、硫、硒(Se)元素同为第VIA族元素,三者的简单氢化物结构相似,但H2S的沸点低于H2O,原因是_______,H2S的沸点低于H2Se的原因是_______。
18.现有下列9种微粒:H、H、C、C、N、Fe2+、Fe3+、O2、O3。按要求完成以下各题:
(1)互为同素异形体的微粒是__。
(2)Fe2+的中子数为___,核外电子数为__。
(3)形成上述9种微粒的核素有__种、元素有___种。
(4)常温下,16gO2、O3的混合气体中原子的物质的量为__。
(5)由1H、2H和16O、18O构成的水分子有__种。
三、实验题
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
20.某同学设计如下制备铜的配合物的实验,并对铜的化合物进行研究。已知铜离子的配位数通常为4。
(1)X试剂为___________;
(2)写出c试管中浑浊液溶解成深蓝色溶液的离子方程式___________。
(3)目前,印刷电路板的腐蚀多采用碱氨蚀刻液(氯化铵和氨水的混合液),使电路板露出的铜以二氯四氨合铜的形式溶解下来,写出腐蚀的化学方程式___________。
(4)由上述实验能说明、与形成蓝色配离子的稳定性强弱为:___________>___________(填化学式)。________
四、计算题
21.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
参考答案:
1.D
【分析】核素中,A代表元素的质量数,Z为质子数、核电荷数、原子序数、原子核外电子数,中子数=A-Z。
【详解】A.核素的中子数为294-117=177,故A正确;
B.核素的质量数为294,故B正确;
C.核素的核外电子数为117,故C正确;
D.相对原子质量为中子数与质子数之和取整数值,核素的相对原子质量为294,故D错误;
故选D。
2.D
【解析】略
3.D
【详解】A.C的孤电子对数为,S的孤电子对数为,故A错误;
B.C的价层电子对数为,S的价层电子对数为,则C和S分别是sp杂化,sp2杂化,故B错误;
C.C的价层电子对数为2,孤电子对数为0,S的价层电子对数为3,S的孤电子对数为1,则CO2的空间结构是直线型,SO2的空间结构是V型,故C错误;
D.由C分析可知,CO2的空间结构是直线型,SO2的空间结构是V型,故D正确;
故选D。
4.A
【详解】A.一般来说,原子是由质子、中子和核外电子构成的,但是,质量数为1的氢原子,即中,中子数为0,也就是说,质量数为1的氢原子中没有中子,故A正确;
B.粒子包括原子、分子(单原子分子或多原子分子)、离子(单核或多核离子)等,只知道粒子的质子数,不一定能确定元素,如Ne原子和H2O分子的质子数都为10,故B错误;
C.在计算质量数时,由于电子的质量比质子、中子的质量小得多而被忽略,并不是电子没有质量,故C错误;
D.分子的质子数等于该分子中各原子质子数与之和,故D错误;
答案选A。
5.B
【详解】A.为非极性键形成的非极性分子,A不符合;
B.为极性键形成的非极性分子,B符合;
C.为极性键形成的极性分子,C不符合;
D.为极性键形成的极性分子,D不符合;
答案选B。
6.C
【详解】A.的质量数为238,A错误;
B.砷化镓属于半导体材料,B错误;
C.“玉兔”号月球巡视器白天用三结砷化镓太阳能电池板收集能量即太阳能转化为电能,C正确;
D.核电池又叫“放射性同位素电池”,它是通过半导体换能器将同位素在衰变过程中不断地放出具有热能的射线的热能转变为电能而制造而成,D错误;
答案选C。
7.D
【详解】A.NaOH中含有离子键和极性共价键,Na2O2含有离子键和非极性共价键,所以两者化学键类型不同,A错误;
B. 氢键影响物理性质,不影响氢化物稳定性,NH3比PH3稳定是因为N元素非金属强于P,B错误;
C. 化学反应的实质是旧键断裂生成新键,CO2溶于水与水反应生成碳酸,则CO2溶于水存在共价键和分子间作用力的改变,干冰升华只是CO2从固态变为气态,只有分子间作用力改变,因此二者作用力的改变不相同,C错误;
D. H2O2即含极性共价键又含非极性键的极性分子,D正确;
故答案为:D。
【点睛】氢键不是化学键,是一种分子间作用力,主要影响物理性质,比如熔沸点、溶解性等,不影响其化学性质。
8.B
【详解】A.钢铁结成的圈梁,属于金属材料,A错误;
B.高温结构陶瓷一般用碳化硅、氮化硅或某些金属氧化物等在高温下烧结而成,属于新型无机非金属材料,B正确;
C.太阳能电池板的主要材料是硅,C错误;
D.氕、氘、氚为H元素的不同种核素,互为同位素,D错误;
答案选B。
9.D
【详解】A.冰晶胞内水分子间以氢键结合,氢键不是化学键,故A错误;
B.由冰晶胞的结构可知,根据均摊法计算,每个冰晶胞平均含有4+8×+6×=8个水分子,故B错误;
C.水分子间的氢键具有方向性和饱和性,但氢键不是化学键,故C错误;
D.冰熔化为液态水时只是破坏了一部分氢键,液态水中仍在氢键,故D正确。
故答案为D。
10.B
【详解】同一碳原子连接四个不同的原子或原子团,则该碳原子为手性碳原子,布洛芬所含的手性碳原子如图星号所示: ,
故选B。
11.B
【详解】A.CHCl3空间构型为四面体,正负电荷中心不重合,CHCl3为极性分子,故A错误;
B.氯元素原子序数为17,其结构示意图为,故B正确;
C.过氧化氢为共价化合物,其电子式为,故C错误;
D.根据反应方程式,该反应是熵增,即ΔS>0,根据ΔG=ΔH-TΔS,该反应自发进行,ΔG<0,任何温度下均能自发进行,故D错误;
答案为B。
12.D
【详解】A.价层电子对互斥模型中,价层电子对数等于分子的中心原子与结合原子间的键和中心原子上的孤电子对,不计π键电子对数,A正确;
B.三氟乙酸的酸性大于三氯乙酸的,因为氟的电负性大于氯的,F-C的极性大于Cl-C的,使F3C-的极性变大,导致三氟乙酸的羧基中羟基的极性更大,更易电离出氢离子,B正确;
C.邻羟基苯甲醛会形成分子内氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,C正确;
D.氯气为非极性分子,水为极性溶剂,氯气易溶于氢氧化钠溶液是因为氯气与氢氧化钠发生化学反应,不是因为“相似相溶”规律,D错误;
故选D。
13.A
【详解】A.23 g CH3-CH2-OH的物质的量是0.5 mol,乙醇分子中C原子都是采用sp3杂化,O也是采用sp3杂化,在一个CH3-CH2-OH中含有3个sp3杂化的原子,则在0.5 mol乙醇中含有的sp3杂化的原子物质的量是1.5 mol,含有的这种原子数目是1.5NA,A错误;
B.PCl3中P原子价电子对数是3+=4,0.5 mol PCl3中磷的价层电子对数为0.5 mol×4×NA/mol=2NA,B正确;
C.1个[Cu(H2O)4]2+中配位键数目是4个,则1 mol [Cu(H2O)4]2+中配位键的数目为4NA,C正确;
D.标准状况下,11.2 L CO和H2的混合气体的物质的量是0.5 mol,其中含有的气体分子数为0.5NA,D正确;
故合理选项是A。
14.B
【详解】A.固体CCl4为分子晶体,Na为金属晶体,C(金刚石) 为原子晶体,NaCl为离子晶体,可形成不同类型的晶体,故A正确;
B. CCl4中C原子的价层电子对数为4,金刚石中C原子的价层电子对数也为 4,则杂化轨道类型相同,均为sp3,故B错误;
C.固体CCl4为分子晶体,常温下为液体,Na为金属晶体,熔点较低,C(金刚石) 为原子晶体,NaCl为离子晶体,原子晶体的熔点最高,其次是离子晶体,则反应中四种物质的熔点:C(金刚石)> NaCl> Na> CCl4,故C正确;
D. 金刚石和石墨的原子排列方式不同,故X-射线衍射可鉴定合成的产品是金刚石还是石墨,故D正确;
故选B。
15.C
【详解】A.HCl溶于水电离出氢离子和氯离子,需克服共价键,故不选A;
B.NaCl溶于水电离出钠离子和氯离子,需克服离子键,故不选B;
C.碘是分子晶体,碘升华,碘分子没变,碘分子间距离改变,只需克服分子间作用力,故选C;
D.加热HI使其分解为氢气和碘单质,需克服H-I键,故不选D;
选C。
16. 形成难溶物 Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH 难溶物溶解,得到深蓝色的透明溶液 Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 析出深蓝色晶体 深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度 [Cu(NH3)4]2+ Cu2+ NH3 4
【解析】略
17.(1) 正四面体形 1 三角锥形 未变 V形(或角形) 三角锥形 sp3 sp3
(2) 非极性 极性 难 极易(或易) 水分子间存在氢键,而硫化氢分子间只有范德华力 硫化氢分子间的范德华力弱于硒化氢分子间的范德华力
【解析】(1)
①NH3分子的中心原子价层电子对数为3+=4,采取sp3杂化,有1对孤对电子,VSEPR模型为正四面体形,空间结构为三角锥形。的中心原子价层电子对数为4+=4,采取sp3杂化。
②H2O的中心原子价层电子对数为2+=4,采取sp3杂化,有2对孤对电子,VSEPR模型为正四面体形,空间结构为V形,H3O+的中心原子价层电子对数为3+=4,采取sp3杂化,有1对孤对电子,VSEPR模型为正四面体形,空间结构为三角锥形。
(2)
①乙烷分子为对称性分子,决定了乙烷为非极性分子,而乙醇分子为不对称性分子,这决定了乙醇为极性分子,且乙醇能与水分子形成分子间氢键,而水是极性分子,再依据“相似相溶”规律可知:乙烷难溶于水,而乙醇极易溶于水。
②H2S分子间只有范德华力,而H2O分子间存在氢键,氢键强度大于范德华力,导致水的沸点高于硫化氢的沸点;H2S和H2Se的分子结构相似,分子间都只存在范德华力,而H2S的相对分子质量小于H2Se,决定了H2S的沸点低于H2Se的沸点。
18. O2和O3 30 24 7 5 1mol 6
【详解】(1)由同一种元素形成的不同单质互为同素异形体,因此互为同素异形体的微粒是O2和O3。
(2)质子数+中子数=质量数,所以Fe2+的中子数为56-26=30,核外电子数为26―2=24。
(3)具有一定数目质子和一定数目中子的原子是核素,因此形成上述9种微粒的核素有7种,即H、H、C、C、N、Fe2+、Fe3+,具有相同核电荷数即质子数相同的同一类原子互为同位素,因此元素有H、C、N、Fe、O,共计是五种元素。
(4)O2、O3均是由同一种氧原子形成的单质,则常温下,16gO2、O3的混合气体中原子的物质的量为16g÷16g/mol=1mol。
(5)由1H、2H和16O、18O构成的水分子有2H216O、1H218O、1H216O、2H218O、1H2H16O、2H1H18O,共计是6种。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1)无水乙醇
(2)
(3)
(4)
【分析】向CuSO4溶液中加入NaOH溶液得到Cu(OH)2悬浊液,将悬浊液分成三份后分别加入1 mol/L NaOH溶液得到Cu(OH)2浑浊液,加入6mol/L NaOH溶液得到深蓝色的溶液,加入1mol/LNH3·H2O溶液,得到深蓝色的溶液,在乙醇中溶解度较小,向溶液中加入无水乙醇,可以得到深蓝色晶体,以此解答。
【详解】(1)由分析可知,X试剂为无水乙醇。
(2)由分析可知,向Cu(OH)2悬浊液中加入1mol/LNH3·H2O溶液,得到深蓝色的溶液,离子方程式为:。
(3)印刷电路板的腐蚀多采用碱氨蚀刻液(氯化铵和氨水的混合液),使电路板露出的铜以二氯四氨合铜的形式溶解下来,该过程中Cu和氯化铵、氨水、氧气反应生成二氯四氨合铜和水,方程式为:。
(4)向生成蓝色配离子的溶液中加入氨水的溶液碱性增强,说明生成蓝色配离子为,所以试管b、c中深蓝色配离子的稳定性强弱顺序为>。
21.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的核外电子排布式为1s22s22p63s23p2或者[Ne] 3s23p2;根据泡利原理成对电子自旋方向相反;
故答案为1s22s22p63s23p2或者[Ne] 3s23p2,自旋方向相反;
(2)A分子结构中Si原子位于顶点,被3个面所共有,每个面含有4个O原子和4个Si原子,共8个原子,硅的配位数为4;A为分子结构式,所有原子均为一个分子共有,分子中含有8个Si原子,8个H原子和12个O原子,故分子式为Si8H8O12;
故答案为八,Si8H8O12;
(3)A分子中O原子显 2价,则Si显+4价,H显 1价;O原子与Si原子形成2个σ共价键,且O原子还有2对孤对电子,即含有4个σ电子对,所以O原子采用的杂化类型为sp3杂化;两种元素非金属性差距越大极性越大,Si O之间的非金属性之差大于Si H之间的非金属性之差,所以Si O键的极性强于Si H键的极性;
故答案为 1,sp3,σ键,>;
(4)图A所示为氢基倍半硅氧烷的分子结构,所以则氢基倍半硅氧烷形成的晶体类型为分子晶体,而SiO2为原子晶体;
故答案为分子,原子;
(5)SiO2晶体为面心立方结构,每个SiO2晶胞含有Si原子的个数为,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为,晶胞边长为anm,故SiO2晶体的密度=;
故答案为8,。
