鲁科版(2019)必修第二册 第2章化学键化学反应规律章末课件(共31张PPT)
文档属性
| 名称 | 鲁科版(2019)必修第二册 第2章化学键化学反应规律章末课件(共31张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 11:25:11 | ||
图片预览










文档简介
(共31张PPT)
第2章 化学键 化学反应规律
章末复习课
知
识
构
建
网
络
专
题
对
练
总
结
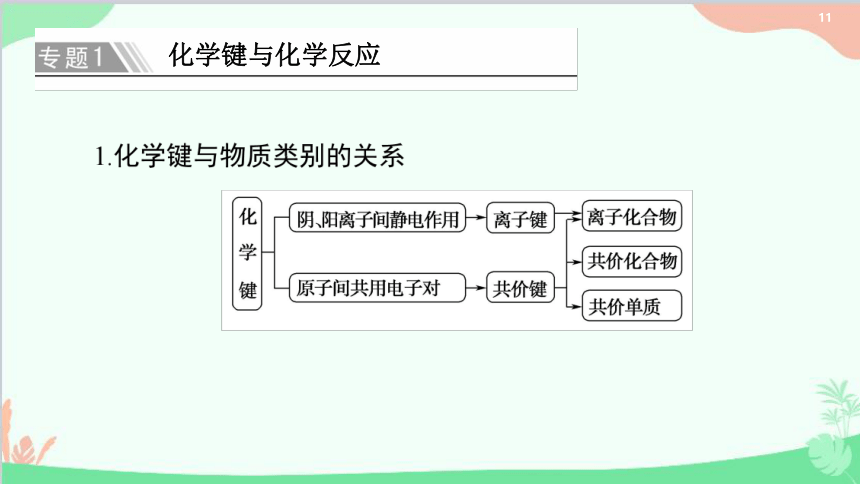
化学键与化学反应
化学反应的快慢与限度
原电池的工作原理(以铜、锌原电池为例)
Thank you for watching !
/
本质:将化学能转化为⑦
的装置
电极:相对活泼性不同的两种金属
形成条件
或金属与导电的非金属
电解质溶液:在两极发生电极反应
有导线连接两极、形成闭合回路
由两极的电极材料判断
正
根据电子移动(或电流)的方向
负极的判断
判断
根据溶液中的离子移动的方向判
断
根据两极发生的不同现象判断
是
(原电池
电极反
负极(Zn):⑧
应(铜锌
原电池)
正极(Cu):2H*+2e=H,1
总反应
离子方程式:⑨
式(铜锌
化学方程式:Zn+H2S0,
原电池)
=ZnS04+H2↑
用作电源
应用
判断金属的活动性强弱
加快某些反应的速率等
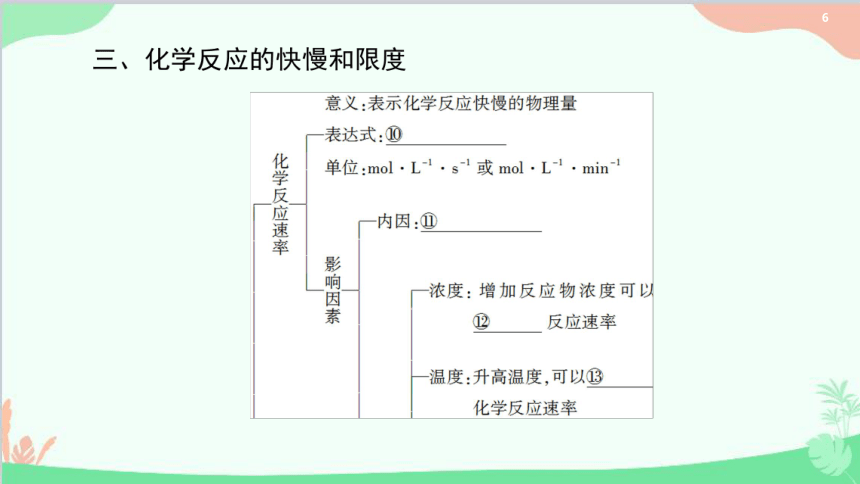
化学反应的快慢和限度
催化剂:使用催化剂能够
④
化学反应速率
压强:有气体参加的反应,增
大压强,化学反应速率
其他因素:固体表面积、光、紫
外线、超声波或溶剂等
概念:一定条件下,可逆反应的正、逆反应速
率6
反应混合物的含
化学平衡
量保持不变的状态
逆:可逆反应
等:正、逆反应速率相等
慧
动:动态平衡
定:条件一定,各组成成分的含量保
持一定
变:条件改变,化学平衡改变
氧化反应
还原反应
负极
铜锌原电池
正极
Za-2e -Zn
2H++2e=H2t
电解质溶液
谢谢水赏
第2章 化学键 化学反应规律
章末复习课
知
识
构
建
网
络
专
题
对
练
总
结
化学键与化学反应
化学反应的快慢与限度
原电池的工作原理(以铜、锌原电池为例)
Thank you for watching !
/
本质:将化学能转化为⑦
的装置
电极:相对活泼性不同的两种金属
形成条件
或金属与导电的非金属
电解质溶液:在两极发生电极反应
有导线连接两极、形成闭合回路
由两极的电极材料判断
正
根据电子移动(或电流)的方向
负极的判断
判断
根据溶液中的离子移动的方向判
断
根据两极发生的不同现象判断
是
(原电池
电极反
负极(Zn):⑧
应(铜锌
原电池)
正极(Cu):2H*+2e=H,1
总反应
离子方程式:⑨
式(铜锌
化学方程式:Zn+H2S0,
原电池)
=ZnS04+H2↑
用作电源
应用
判断金属的活动性强弱
加快某些反应的速率等
化学反应的快慢和限度
催化剂:使用催化剂能够
④
化学反应速率
压强:有气体参加的反应,增
大压强,化学反应速率
其他因素:固体表面积、光、紫
外线、超声波或溶剂等
概念:一定条件下,可逆反应的正、逆反应速
率6
反应混合物的含
化学平衡
量保持不变的状态
逆:可逆反应
等:正、逆反应速率相等
慧
动:动态平衡
定:条件一定,各组成成分的含量保
持一定
变:条件改变,化学平衡改变
氧化反应
还原反应
负极
铜锌原电池
正极
Za-2e -Zn
2H++2e=H2t
电解质溶液
谢谢水赏
