第3章物质的性质与转化单元测试卷高一上学期化学鲁科版(2019)必修第一册(含解析)
文档属性
| 名称 | 第3章物质的性质与转化单元测试卷高一上学期化学鲁科版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 15:56:14 | ||
图片预览



文档简介
第3章《物质的性质与转化》单元测试卷
一、单选题
1.下列物质不具有漂白性的是
A.O3 B.SO2 C.HClO D.NaOH
2.红珊瑚栖息于200~2000 m的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥的象征,一直用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Si D.Cu
3.下列反应属于人工固氮的是
A.N2 和 H2 在一定条件下反应生成 NH3
B.雷雨闪电时空气中的 N2 和 O2 化合生成 NO
C.用 NH3 和 CO2 合成尿素
D.用硫酸吸收氨气得到硫酸铵
4.下列有关物质的性质与用途具有对应关系的是
A.Al2O3熔点高,可用作耐高温材料 B.H2O2是无色液体,可用作消毒剂
C.Fe2(SO4)3易溶于水,可用作净水剂 D.液氨具有碱性,可用作制冷剂
5.设为阿伏加德罗常数的值,下列说法正确的是
A.100mL溶液中氮原子总数为0.2
B.常温下,2.7g铝片与足量浓硫酸反应转移的电子数为0.3
C.一定条件下,64g与足量氧气充分反应生成的分子数为
D.标准状况下,2.24L被NaOH溶液充分吸收过程中转移的电子数为0.2
6.二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将( )
A.和氯气单独通过时相同 B.和二氧化硫单独通过时相同
C.是二者作用效果之和 D.可能失去漂白性
7.下列气体的制备和性质实验,在常温下能进行,且能由现象得出相关的结论。其中错误的是
选项 试剂 试纸或试液 现象 结论
A 亚硫酸钠、浓硫酸 酸性KMnO4试液 褪色 SO2具有还原性
B 浓盐酸、浓硫酸 湿润蓝色石蕊试纸 变红色 HCl为酸性气体
C 浓盐酸、二氧化锰 湿润淀粉碘化钾试纸 变蓝色 Cl2具有氧化性
D 浓氨水、生石灰 湿润红色石蕊试纸 变蓝色 NH3为碱性气体
A.A B.B C.C D.D
8.下列有关物质性质与用途具有对应关系的是( )
A.硅酸钠溶液呈碱性,可用作木材防火剂
B.硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.铅具有还原性和导电性,可用作铅蓄电池的负极材料
9.下列实验过程能达到实验目的的是
编号 实验目的 实验过程
A 配制0.4000mol·L 1的NaOH溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容
B 鉴别NaHCO3溶液与Na2CO3溶液 用小试管分别取少量待测溶液,然后滴加澄清石灰水
C 检验Na2SO3样品未变质 用取样于试管加入水溶解,滴加几滴硝酸,再加少量BaCl2溶液,观察现象
D 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
A.A B.B C.C D.D
10.下列有关物质的性质与用途具有对应关系的是
A.Al2O3能与碱反应,可用于电解冶炼铝 B.NH3易溶于水,可用作制冷剂
C.MgCl2溶液呈酸性,可用于制取镁 D.浓硫酸具有吸水性,可用于干燥Cl2
11.下列各组产物中加入KSCN溶液,变红色的是
A.铁和过量盐酸 B.铁和过量的稀硝酸
C.过量的铁和浓硝酸 D.FeO和稀硫酸
12.下列各组离子能大量共存的是
A.K+ 、Cl- 、HCO、SO
B.Mg2+、Cl-、Ag+ 、SO
C.Ca2+、H+、Na+、CO
D.Fe2+、Cr2O、H+ 、NO
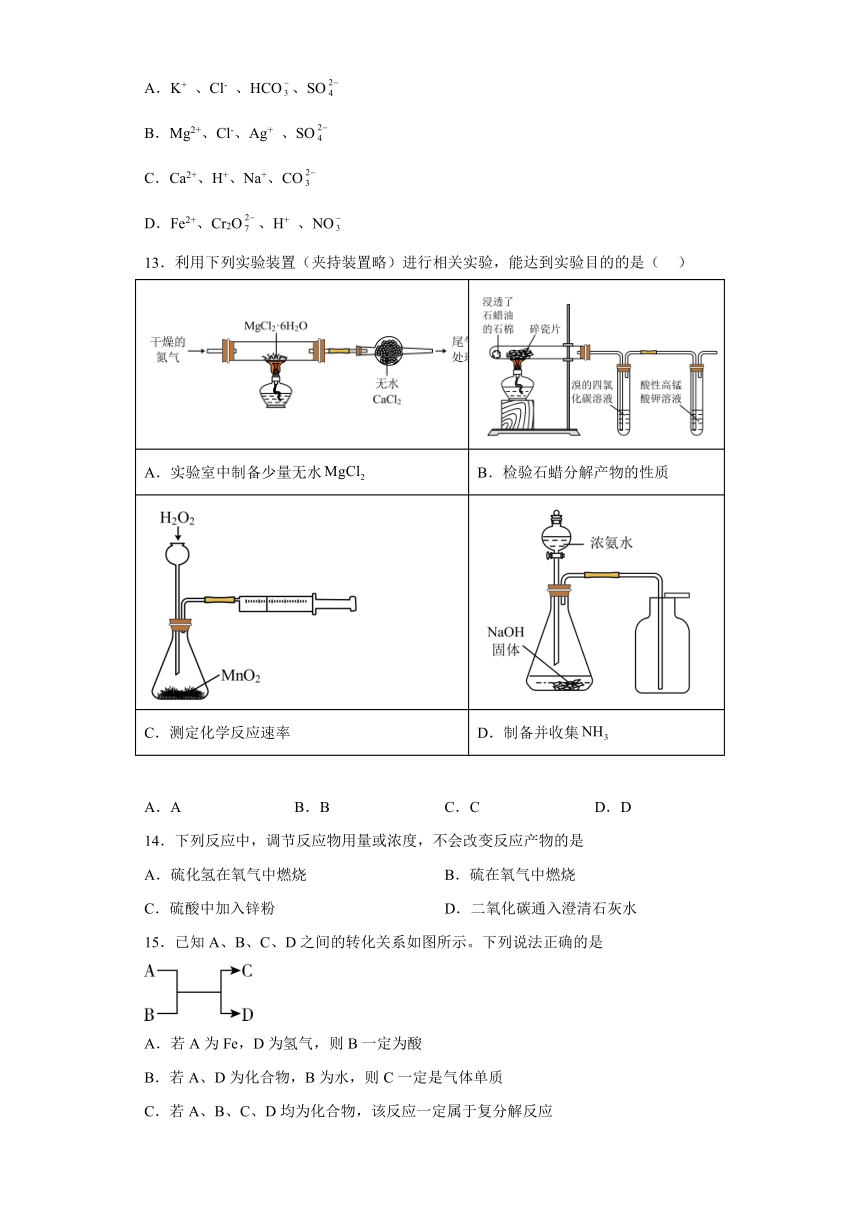
13.利用下列实验装置(夹持装置略)进行相关实验,能达到实验目的的是( )
A.实验室中制备少量无水 B.检验石蜡分解产物的性质
C.测定化学反应速率 D.制备并收集
A.A B.B C.C D.D
14.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.硫化氢在氧气中燃烧 B.硫在氧气中燃烧
C.硫酸中加入锌粉 D.二氧化碳通入澄清石灰水
15.已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D在常温下一定呈液态
二、填空题
16.工业上将NH3转化为其他铵态化肥属于人工固氮。(__)
17.人类生活离不开化学,如:①硫酸亚铁片用于治疗贫血(如图是其说明书),②复方氢氧化铝用于治疗胃酸过多,③明矾用作净水剂,等等。
阅读上方“硫酸亚铁片”的标签说明,回答:
(1)“鉴别”中,“加稀盐酸1滴”的作用是___;不是加稀硫酸的原因是_____。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝作为___(填“酸”或“碱”)中和过多胃酸;氢氧化铝也能跟烧碱溶液反应,反应的离子方程式为_____。
(3)明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____能力。
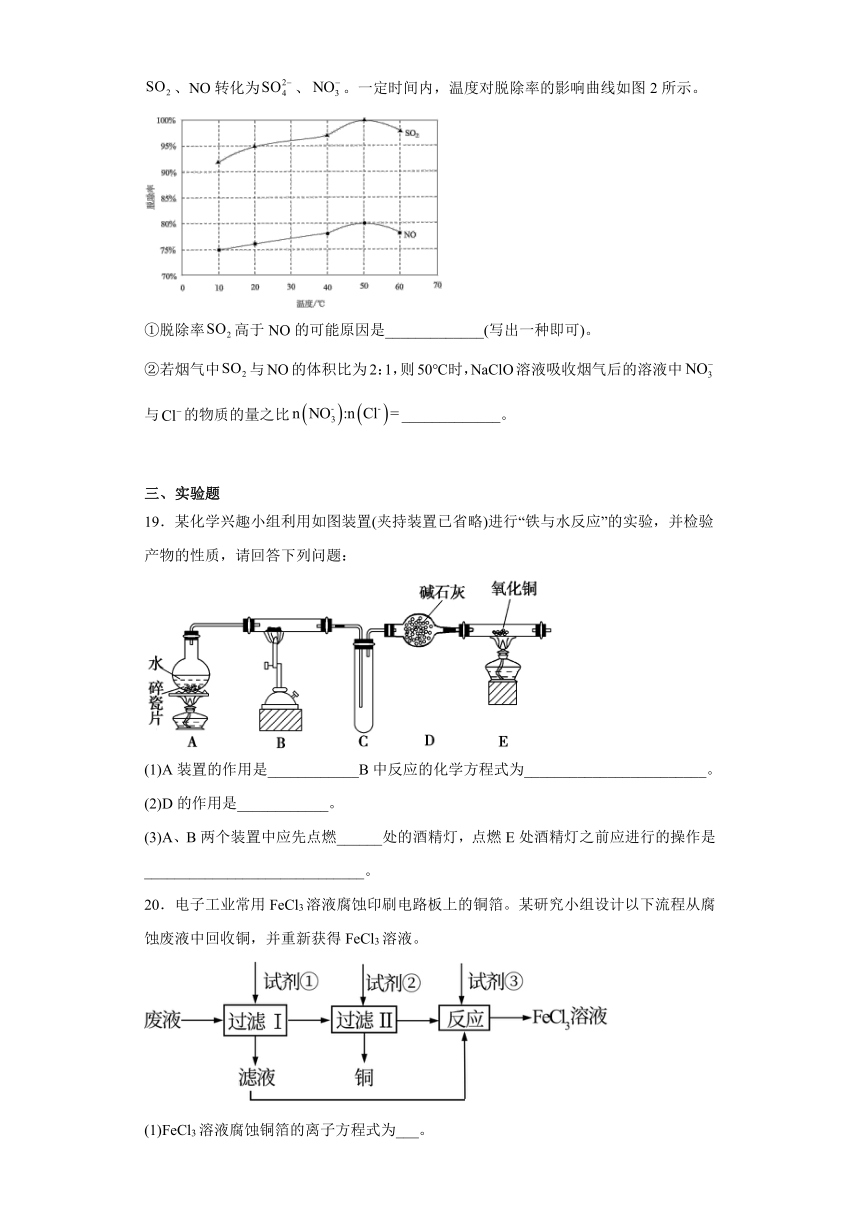
18.烟气的“脱硫”“脱硝”是环境治理的热点问题,为消除燃煤烟气中的及,研究专家提出了若干“脱硫”“脱硝”的方法。回答下列问题:
(1)催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,将烟气中转化为无污染气体。当与NO的物质的量之比为1:1时,每转化1mol该氮氧化物混合气体,需要消耗的体积(STP)为_____________L。
(2)利用氨水可以吸收、,原理如图1所示:
①I中发生反应的化学方程式为____________________________________________________。
②减压蒸发是通过减小压强,使溶液沸点降低而进行蒸发的方法。该流程中采用减压蒸发的原因是____________。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”,控制溶液,将烟气中的、NO转化为、。一定时间内,温度对脱除率的影响曲线如图2所示。
①脱除率高于NO的可能原因是_____________(写出一种即可)。
②若烟气中与NO的体积比为2:1,则50℃时,NaClO溶液吸收烟气后的溶液中与的物质的量之比_____________。
三、实验题
19.某化学兴趣小组利用如图装置(夹持装置已省略)进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是____________B中反应的化学方程式为________________________。
(2)D的作用是____________。
(3)A、B两个装置中应先点燃______处的酒精灯,点燃E处酒精灯之前应进行的操作是_____________________________。
20.电子工业常用FeCl3溶液腐蚀印刷电路板上的铜箔。某研究小组设计以下流程从腐蚀废液中回收铜,并重新获得FeCl3溶液。
(1)FeCl3溶液腐蚀铜箔的离子方程式为___。
(2)试剂①为___(写化学式),试剂②需过量的原因是___。
(3)证明“滤液”中不含Fe3+的方法为___。
(4)“反应”步骤中的离子方程式为___。
(5)向沸水中加入1mol L-1FeCl3溶液至液体呈透明的红褐色,该分散系具有的独特性质是___(写出一条)。
21.为了确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体为b L(标况)。反应的离子方程式为_______________,样品中铝的物质的量为_____________(用含b的代数式表示)。
(2)若取a g样品,在高温下能恰好完全反应,该反应的化学方程式为________________,样品中氧化铁与铝的质量比为_________________(用含a 、b的代数式表示)。
(3)待(2)中反应产物冷却后,往其中加入足量的盐酸,测得生成的气体体积为c L(标况),则该气体与(1)中所得的气体的体积比c∶b=______________。
四、计算题
22.某硫酸厂使用含杂质25%的黄铁矿制取硫酸,在反应过程中有3%的硫元素损失。1 t黄铁矿可制取98%的硫酸___________吨?
参考答案:
1.D
【详解】A.O3有强氧化性,具有漂白性,A错误;
B.SO2与水反应生成亚硫酸,可与色素结合,具有漂白性,B错误;
C.HClO有强氧化性,具有漂白性,C错误;
D.NaOH为强碱,不具备漂白性,D正确;
故选D。
2.B
【分析】红珊瑚的化学成分主要是CaCO3,矿物成分以徽晶方解石集合体形式存在.成分中还有一定数量的有机质,红珊瑚整体形态多呈树枝状,上面有纵条纹.每个单体珊瑚是红色、粉红色、橙红色最为珍贵,是我们通常所说的宝石级和收藏级的珊瑚.红色是珊瑚在生长过程中吸收海水中1%左右的氧化铁而形成的,所以红色是铁元素形成的氧化铁呈现的,依据海水中的铁元素被氧化为红色的三氧化二铁,被珊瑚吸收形成的分析判断;每升海水超过100毫克的元素.称为常量元素.最主要的常量元素有氧、钠、镁、硫、钙、钾、溴、碳、鳃、硼、氟11种,约占化学元素总含量的99.8~99.9.其他化学元素含量极少,其中,每升海水含有l~100毫克的元素.称为微量元素.如铁、钼、钾、铀、碘等.每升海水含有1毫克以下的元素称为痕量元素.如金、银、镉等.溶解于海水中的化学元素绝大多数是以盐类离子的形式存在的,其中氯化钠最多。
【详解】A、钠形成的化合物无红色物质形成,故A不符合;
B、铁元素形成氧化铁呈红色,珊瑚在生长过程中吸收氧化铁形成红色,故B符合;
C、海水中硅元素含量很低,硅元素形成的物质中无红色物质生成,故C不符合;
D、溶解于海水中的化学元素绝大多数是以盐类离子的形式存在的,海水中铜的含量低到仪器检测不到,铜离子在溶液中呈蓝色,故D不符合;
故选B。
3.A
【分析】游离态的氮转化为化合态氮的过程是氮的固定,据此解答。
【详解】A. N2和H2在一定条件下反应生成NH3属于人工固氮,A正确;
B. 雷雨闪电时空气中的N2和O2化合生成NO属于自然固氮,B错误;
C. 用NH3和CO2合成尿素不属于固氮,C错误;
D. 用硫酸吸收氨气得到硫酸铵不属于固氮,D错误;
答案选A。
4.A
【详解】A.因Al2O3熔点高,故可用作耐高温材料,如坩埚等,A正确;
B.H2O2可用作消毒剂,是因为具有氧化性,B错误;
C.Fe2(SO4)3可作净水剂,是因为Fe3+水解可以生成Fe(OH)3胶体,能吸附水中悬浮物,C错误;
D.液氨能作制冷剂是因其沸点低,D错误;
综上所述答案为A。
5.A
【详解】A.含有氮原子,所以100mL溶液中氮原子总数为0.2;故A正确;
B.常温下,铝在浓硫酸中将发生钝化,不发生生成氢气的反应,故B错误;
C.与氧气生成为可逆反应,不能完全反应;所以生成的分子数小于;故C错误;
D.与NaOH反应为;为的歧化反应;2.24L被NaOH溶液充分吸收过程中转移的电子数为0.1,故D错误;
故答案选A。
6.D
【详解】二氧化硫与氯气在水溶液中发生反应,现把二者以等物质的量混合恰好完全反应,方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,盐酸、硫酸虽为强酸,但无漂白性,所以反应后的溶液将失去漂白性,答案选D。
【点睛】二氧化硫具有漂白作用,氯气(其实质是次氯酸)也有漂白作用,二者相遇后,通入水中,发生氧化还原反应,生成强酸,不再具有漂白作用。
7.C
【详解】A.浓硫酸和亚硫酸钠反应生成二氧化硫,SO2使酸性高锰酸钾溶液褪色,体现的是SO2的还原性,A正确。
B.利用浓硫酸的高沸点性以及吸水放热的性质,可以制取HCl气体,pH试纸变红,则说明气体为酸性气体,B正确;
C.浓盐酸和二氧化锰加热可以制取Cl2,常温下不反应,Cl2可以用湿润的淀粉碘化钾试纸检验,试液变蓝,说明KI转化为I2,则说明Cl2有强氧化性,题干气体的制备方法无加热,C错误;
D.NH3制备可以采取浓氨水和生石灰制取,可用红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,D正确;
故答案选C。
8.D
【详解】A.硅酸钠耐高温,不易燃烧,可用作木材防火剂,与硅酸钠溶液呈碱性无关,故A错误;
B.硫酸铜是重金属盐,能使蛋白质变性,可用作游泳池中水的消毒剂,与硫酸铜溶液的颜色无关,故B错误;
C.酯化反应是可逆反应,常用浓硫酸作催化剂,以加快反应速率,同时浓硫酸有吸水性,可使反应正向进行,提高生成物产率,与浓硫酸具有强氧化性无关,故C错误;
D.原电池中,负极失电子发生还原,同时需要电极材料能够导电,而铅是金属,能导电,反应中易失去电子,具有还原性,故D正确;
故答案为D。
9.D
【详解】A.NaOH溶解过程放热,应冷却后再转移至容量瓶,A错误;
B.碳酸钠和碳酸氢钠均可以和澄清石灰水反应生成沉淀,B错误;
C.即便Na2SO3样品未变质,由于添加了硝酸,亚硫酸根也会被氧化为硫酸根,C错误;
D.维生素C可还原氯化铁,溶液由黄色变为浅绿色,D正确;
综上所述答案为D。
10.D
【详解】A.氧化铝是离子化合物,熔融状态下可电解得到铝单质,故A错误;
B.氨气沸点较高易被液化,液氨在气化过程中吸收大量的热,常用作制冷剂,故B错误;
C.MgCl2为离子化合物,熔融状态下可电解得到镁,与其水溶液酸性无关,故C错误;
D.浓硫酸具有吸水性,常用作干燥剂,故D正确;
故选:D。
11.B
【分析】铁离子和KSCN溶液反应,使得溶液变为红色;
【详解】A.铁和过量盐酸反应生成氯化亚铁,A错误;
B.铁和过量的稀硝酸反应生成硝酸铁和一氧化氮,B正确;
C.铁会和铁离子生成亚铁离子;过量的铁和浓硝酸生成硝酸亚铁和一氧化氮,C错误;
D.FeO和稀硫酸反应生成硫酸亚铁和水,D错误;
故选B。
12.A
【详解】A.K+ 、Cl- 、HCO、SO之间不反应,能大量共存;
B.Cl-和Ag+ 、SO产生AgCl、Ag2SO4沉淀,不能大量共存;
C.Ca2+、H+分别和CO反应生成CaCO3沉淀、水和二氧化碳,不能大量共存;
D.Fe2+、H+ 、NO之间,Fe2+、Cr2O、H+之间发生氧化还原反应,不能大量共存。
答案选A。
13.B
【详解】A.受热后结晶水脱离,则热的玻璃管内含水蒸气,易水解,致使制备的中混有MgO,A错误;
B.石蜡分解产生烯烃,烯烃能发生加成反应,能使酸性高锰酸钾溶液褪色,B正确;
C.制备的氧气从长颈漏斗中逸出,导致实验失败,应该选用分液漏斗,C错误;
D.密度比空气小,用向下排空气法收集,D错误;
故选B。
14.B
【详解】A.硫化氢在氧气中燃烧,当氧气量少时生成硫单质,氧气量多时生成二氧化硫,A错误;
B.硫在氧气中燃烧产物为二氧化硫,跟氧气的量和浓度无关,B正确;
C.稀硫酸与锌反应生成氢气,浓硫酸与锌反应生成二氧化硫,C错误;
D.二氧化碳通入澄清石灰水,二氧化碳量少时生成碳酸钙,过量时生成碳酸氢钙,D错误;
故选B。
15.D
【详解】A.若A为Fe,D为氢气,铁与水蒸气高温条件下能生成氢气,B为水,A错误;
B.若A、D为化合物,B为水,可以发生下述反应:3NO2+H2O=2HNO3+NO,C不一定是气体单质,B错误;
C.若A、B、C、D均为化合物,可以发生下述反应:3NO2+H2O=2HNO3+NO,不是复分解反应,C错误;
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,C是NH3,则A、B分别是、OH-中任意一种,D是H2O,在常温下一定呈液态,D正确;
答案选D。
16.错误
【解析】略
17. 抑制FeSO4水解 加稀硫酸会干扰硫酸根离子的检验 碱 Al(OH)3+OH-→AlO2-+2H2O 吸附
【详解】(1)硫酸亚铁为弱碱盐,溶于水时易发生水解,从而使溶液变浑浊。所以,在硫酸亚铁片溶解过程中,常加酸抑制水解。答案为:抑制FeSO4水解。
在后续检验中,还需要检验硫酸根离子,若加硫酸酸化,将会引入硫酸根离子,干扰原药片中硫酸根离子的检验。答案为:加稀硫酸会干扰硫酸根离子的检验。
(2)胃酸为盐酸,加氢氧化铝中和酸,从而表现出碱性。答案为:碱。
氢氧化铝与烧碱溶液反应的离子方程式为Al(OH)3+OH-→AlO2-+2H2O。
答案为:Al(OH)3+OH-→AlO2-+2H2O。
(3)氢氧化铝是一种胶体,具有吸附能力,能吸附水中的悬浮物。答案为:吸附。
18.(1)22.4
(2) 防止分解
(3) SO2易溶于水、NO难溶于水 1:4
【分析】氨水吸收二氧化硫生成亚硫酸氢铵,亚硫酸氢铵和NO2反应生成硫酸氢铵和氮气,硫酸氢铵溶液减压蒸发,经一系列操作得铵盐晶体。
【详解】(1)将烟气中转化为无污染的氮气,当与NO的物质的量之比为1:1时,每转化1mol该氮氧化物混合气体,得电子的物质的量为0.5mol×4+0.5mol×2=3mol,氨气转化为氮气,N元素化合价由-3升高为0,根据得失电子守恒,消耗氨气的物质的量为1mol,需要消耗的体积(STP)为22.4L。
(2)①I中氨水和二氧化硫反应生成亚硫酸氢铵,发生反应的化学方程式为 。
②铵盐受热易分解,该流程中采用减压蒸发的原因是防止分解。
(3)①SO2易溶于水、NO难溶于水,所以脱除率高于NO。
②被氧化,S元素化合价升高2价,NO被氧化为,N元素升高3价,设吸收与NO的物质的量分别为2mol、1mol,则转移电子的物质的量为2mol×100%×2+1mol×80%×3=6.4mol,NaClO被还原为,Cl元素化合价降低2价,根据得失电子守恒,生成的物质的量为3.2mol,所以NaClO溶液吸收烟气后的溶液中与的物质的量之比0.8:3.2=1:4。
19. 产生水蒸气 3Fe+4H2O(g)Fe3O4+4H2 吸收未反应的水蒸气 A 收集H2,并检验其纯度
【分析】A中用酒精灯加热产生水蒸气,水蒸气在B的玻璃管中和Fe反应生成四氧化三铁和氢气,通过D后水蒸气被吸收,氢气和E中氧化铜反应生成铜和水,据此解答。
【详解】(1)A装置的作用是产生水蒸气;水蒸气和铁在B装置的玻璃管中反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2;
(2)由分析可知D的作用是吸收未反应的水蒸气;
(3)A、B两个装置中应先点燃A处的酒精灯,通入一段时间的水蒸气后点燃B处酒精灯,以防B装置玻璃管中铁和氧气反应;氢气易燃易爆,点燃E处酒精灯之前应进行的操作是收集H2,并检验其纯度。
20. Cu+2Fe3+=2Fe2++Cu2+ Fe 确保Fe粉充分反应 取少许滤液,滴加2~3滴KSCN溶液,若溶液不变红,则说明不含Fe3+ Cl2+2Fe2+=2Fe3++2Cl- 丁达尔效应
【分析】印刷电路板的反应为:Cu+2FeCl3=2FeCl2+CuCl2,由此知废液中含有FeCl2、CuCl2、FeCl3(过量)成分,加入Fe粉(试剂①)可置换出Cu从而回收,发生反应:Fe+2FeCl3=3FeCl2、Fe+ CuCl2=Cu+FeCl2,同时溶液中Fe元素均转化为FeCl2,为了确保反应完全,所加铁粉需过量,经过过滤I,所得滤液成分为FeCl2,滤渣为Cu、Fe(过量),为了回收Cu,需除去Fe,故试剂②为盐酸,Fe与HCl反应生成FeCl2,Cu不反应被分离,两次过滤所得滤液中主要含FeCl2,通入Cl2或加新制氯水(试剂③),可将FeCl2氧化为FeCl3,从而重新获得FeCl3溶液。
【详解】(1)由分析知反应为:Cu+2FeCl3=2FeCl2+CuCl2,FeCl3、FeCl2、CuCl2可拆写成离子形式,改写后离子方程式为:Cu+2Fe3+=2Fe2++Cu2+;
(2)由分析知,试剂①为Fe粉;试剂②为盐酸,过量的目的是确保Fe粉充分反应;
(3)检验Fe3+,可使用KSCN溶液,具体操作为:取少许滤液,滴加2~3滴KSCN溶液,若溶液不变红,则说明不含Fe3+;
(4) 试剂③为Cl2或新制氯水,目的是氧化Fe2+生成Fe3+,使腐蚀液再生,离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
(5)沸水中滴加FeCl3溶液至溶液显红褐色,此时得到的是Fe(OH)3胶体,胶体特有的性质为丁达尔效应,故此处填丁达尔效应。
21. 2Al+2OH-+2H2O=2AlO2-+3H2↑ mol Fe2O3 +2Al2Fe+Al2O3 (a-)︰ 2∶3
【详解】(1)铝热剂中的氧化铁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,由方程式可知3n(Al)=2n(H2),n(Al)=×= mol;(2)铝热反应为置换反应,方程式为Fe2O3 +2Al2Fe+Al2O3,在铝热剂中铝的质量为×27g,则氧化铁的质量为(a-×27)g,故样品中氧化铁与铝的质量比为(a-):;(3)由于样品在高温下恰发完全反应,所以n(Al)=2n(Fe2O3),因此可得ag样品中铝的物质的量与反应后生成铁单质的物质的量,它们在反应中与氢气的关系式分别为2Al~3H2、2Fe~2H2,通过计算可知产生的氢气的物质的量之比为2:3,故c∶b=2:3。
【点睛】本题主要考查物质的量的计算在方程式中的应用,当涉及多个反应时,可根据关系式来进行计算过程的简化,优化计算思维。
22.1.21
【分析】根据化学方程式,找出FeS2和H2SO4量上的关系,进行相关计算。
【详解】4FeS2+11O22Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O=H2SO4;根据硫元素质量守恒可知FeS2~2H2SO4;根据关系式,设可制取98%的硫酸x吨,
列方程,求出x≈1.21t;
答案:1 t黄铁矿可制取98%的硫酸1.21t。
【点睛】在本题中,还可以通过硫元素守恒直接得到FeS2~2H2SO4的关系式,但是该方法并不适合所有的转化流程,该方法要求在转化中,某一元素理论上可以全部转化到某一物质中才行,比如1mol CaCO3高温分解一段时间之后,向所得固体加入过量稀盐酸,无论高温分解多长时间,最终所得CaCl2、CO2都是1mol,因为Ca元素最终都变为CaCl2,C元素最终都变为CO2。
一、单选题
1.下列物质不具有漂白性的是
A.O3 B.SO2 C.HClO D.NaOH
2.红珊瑚栖息于200~2000 m的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥的象征,一直用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Si D.Cu
3.下列反应属于人工固氮的是
A.N2 和 H2 在一定条件下反应生成 NH3
B.雷雨闪电时空气中的 N2 和 O2 化合生成 NO
C.用 NH3 和 CO2 合成尿素
D.用硫酸吸收氨气得到硫酸铵
4.下列有关物质的性质与用途具有对应关系的是
A.Al2O3熔点高,可用作耐高温材料 B.H2O2是无色液体,可用作消毒剂
C.Fe2(SO4)3易溶于水,可用作净水剂 D.液氨具有碱性,可用作制冷剂
5.设为阿伏加德罗常数的值,下列说法正确的是
A.100mL溶液中氮原子总数为0.2
B.常温下,2.7g铝片与足量浓硫酸反应转移的电子数为0.3
C.一定条件下,64g与足量氧气充分反应生成的分子数为
D.标准状况下,2.24L被NaOH溶液充分吸收过程中转移的电子数为0.2
6.二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将( )
A.和氯气单独通过时相同 B.和二氧化硫单独通过时相同
C.是二者作用效果之和 D.可能失去漂白性
7.下列气体的制备和性质实验,在常温下能进行,且能由现象得出相关的结论。其中错误的是
选项 试剂 试纸或试液 现象 结论
A 亚硫酸钠、浓硫酸 酸性KMnO4试液 褪色 SO2具有还原性
B 浓盐酸、浓硫酸 湿润蓝色石蕊试纸 变红色 HCl为酸性气体
C 浓盐酸、二氧化锰 湿润淀粉碘化钾试纸 变蓝色 Cl2具有氧化性
D 浓氨水、生石灰 湿润红色石蕊试纸 变蓝色 NH3为碱性气体
A.A B.B C.C D.D
8.下列有关物质性质与用途具有对应关系的是( )
A.硅酸钠溶液呈碱性,可用作木材防火剂
B.硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.铅具有还原性和导电性,可用作铅蓄电池的负极材料
9.下列实验过程能达到实验目的的是
编号 实验目的 实验过程
A 配制0.4000mol·L 1的NaOH溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容
B 鉴别NaHCO3溶液与Na2CO3溶液 用小试管分别取少量待测溶液,然后滴加澄清石灰水
C 检验Na2SO3样品未变质 用取样于试管加入水溶解,滴加几滴硝酸,再加少量BaCl2溶液,观察现象
D 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
A.A B.B C.C D.D
10.下列有关物质的性质与用途具有对应关系的是
A.Al2O3能与碱反应,可用于电解冶炼铝 B.NH3易溶于水,可用作制冷剂
C.MgCl2溶液呈酸性,可用于制取镁 D.浓硫酸具有吸水性,可用于干燥Cl2
11.下列各组产物中加入KSCN溶液,变红色的是
A.铁和过量盐酸 B.铁和过量的稀硝酸
C.过量的铁和浓硝酸 D.FeO和稀硫酸
12.下列各组离子能大量共存的是
A.K+ 、Cl- 、HCO、SO
B.Mg2+、Cl-、Ag+ 、SO
C.Ca2+、H+、Na+、CO
D.Fe2+、Cr2O、H+ 、NO
13.利用下列实验装置(夹持装置略)进行相关实验,能达到实验目的的是( )
A.实验室中制备少量无水 B.检验石蜡分解产物的性质
C.测定化学反应速率 D.制备并收集
A.A B.B C.C D.D
14.下列反应中,调节反应物用量或浓度,不会改变反应产物的是
A.硫化氢在氧气中燃烧 B.硫在氧气中燃烧
C.硫酸中加入锌粉 D.二氧化碳通入澄清石灰水
15.已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D在常温下一定呈液态
二、填空题
16.工业上将NH3转化为其他铵态化肥属于人工固氮。(__)
17.人类生活离不开化学,如:①硫酸亚铁片用于治疗贫血(如图是其说明书),②复方氢氧化铝用于治疗胃酸过多,③明矾用作净水剂,等等。
阅读上方“硫酸亚铁片”的标签说明,回答:
(1)“鉴别”中,“加稀盐酸1滴”的作用是___;不是加稀硫酸的原因是_____。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝作为___(填“酸”或“碱”)中和过多胃酸;氢氧化铝也能跟烧碱溶液反应,反应的离子方程式为_____。
(3)明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____能力。
18.烟气的“脱硫”“脱硝”是环境治理的热点问题,为消除燃煤烟气中的及,研究专家提出了若干“脱硫”“脱硝”的方法。回答下列问题:
(1)催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,将烟气中转化为无污染气体。当与NO的物质的量之比为1:1时,每转化1mol该氮氧化物混合气体,需要消耗的体积(STP)为_____________L。
(2)利用氨水可以吸收、,原理如图1所示:
①I中发生反应的化学方程式为____________________________________________________。
②减压蒸发是通过减小压强,使溶液沸点降低而进行蒸发的方法。该流程中采用减压蒸发的原因是____________。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”,控制溶液,将烟气中的、NO转化为、。一定时间内,温度对脱除率的影响曲线如图2所示。
①脱除率高于NO的可能原因是_____________(写出一种即可)。
②若烟气中与NO的体积比为2:1,则50℃时,NaClO溶液吸收烟气后的溶液中与的物质的量之比_____________。
三、实验题
19.某化学兴趣小组利用如图装置(夹持装置已省略)进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是____________B中反应的化学方程式为________________________。
(2)D的作用是____________。
(3)A、B两个装置中应先点燃______处的酒精灯,点燃E处酒精灯之前应进行的操作是_____________________________。
20.电子工业常用FeCl3溶液腐蚀印刷电路板上的铜箔。某研究小组设计以下流程从腐蚀废液中回收铜,并重新获得FeCl3溶液。
(1)FeCl3溶液腐蚀铜箔的离子方程式为___。
(2)试剂①为___(写化学式),试剂②需过量的原因是___。
(3)证明“滤液”中不含Fe3+的方法为___。
(4)“反应”步骤中的离子方程式为___。
(5)向沸水中加入1mol L-1FeCl3溶液至液体呈透明的红褐色,该分散系具有的独特性质是___(写出一条)。
21.为了确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体为b L(标况)。反应的离子方程式为_______________,样品中铝的物质的量为_____________(用含b的代数式表示)。
(2)若取a g样品,在高温下能恰好完全反应,该反应的化学方程式为________________,样品中氧化铁与铝的质量比为_________________(用含a 、b的代数式表示)。
(3)待(2)中反应产物冷却后,往其中加入足量的盐酸,测得生成的气体体积为c L(标况),则该气体与(1)中所得的气体的体积比c∶b=______________。
四、计算题
22.某硫酸厂使用含杂质25%的黄铁矿制取硫酸,在反应过程中有3%的硫元素损失。1 t黄铁矿可制取98%的硫酸___________吨?
参考答案:
1.D
【详解】A.O3有强氧化性,具有漂白性,A错误;
B.SO2与水反应生成亚硫酸,可与色素结合,具有漂白性,B错误;
C.HClO有强氧化性,具有漂白性,C错误;
D.NaOH为强碱,不具备漂白性,D正确;
故选D。
2.B
【分析】红珊瑚的化学成分主要是CaCO3,矿物成分以徽晶方解石集合体形式存在.成分中还有一定数量的有机质,红珊瑚整体形态多呈树枝状,上面有纵条纹.每个单体珊瑚是红色、粉红色、橙红色最为珍贵,是我们通常所说的宝石级和收藏级的珊瑚.红色是珊瑚在生长过程中吸收海水中1%左右的氧化铁而形成的,所以红色是铁元素形成的氧化铁呈现的,依据海水中的铁元素被氧化为红色的三氧化二铁,被珊瑚吸收形成的分析判断;每升海水超过100毫克的元素.称为常量元素.最主要的常量元素有氧、钠、镁、硫、钙、钾、溴、碳、鳃、硼、氟11种,约占化学元素总含量的99.8~99.9.其他化学元素含量极少,其中,每升海水含有l~100毫克的元素.称为微量元素.如铁、钼、钾、铀、碘等.每升海水含有1毫克以下的元素称为痕量元素.如金、银、镉等.溶解于海水中的化学元素绝大多数是以盐类离子的形式存在的,其中氯化钠最多。
【详解】A、钠形成的化合物无红色物质形成,故A不符合;
B、铁元素形成氧化铁呈红色,珊瑚在生长过程中吸收氧化铁形成红色,故B符合;
C、海水中硅元素含量很低,硅元素形成的物质中无红色物质生成,故C不符合;
D、溶解于海水中的化学元素绝大多数是以盐类离子的形式存在的,海水中铜的含量低到仪器检测不到,铜离子在溶液中呈蓝色,故D不符合;
故选B。
3.A
【分析】游离态的氮转化为化合态氮的过程是氮的固定,据此解答。
【详解】A. N2和H2在一定条件下反应生成NH3属于人工固氮,A正确;
B. 雷雨闪电时空气中的N2和O2化合生成NO属于自然固氮,B错误;
C. 用NH3和CO2合成尿素不属于固氮,C错误;
D. 用硫酸吸收氨气得到硫酸铵不属于固氮,D错误;
答案选A。
4.A
【详解】A.因Al2O3熔点高,故可用作耐高温材料,如坩埚等,A正确;
B.H2O2可用作消毒剂,是因为具有氧化性,B错误;
C.Fe2(SO4)3可作净水剂,是因为Fe3+水解可以生成Fe(OH)3胶体,能吸附水中悬浮物,C错误;
D.液氨能作制冷剂是因其沸点低,D错误;
综上所述答案为A。
5.A
【详解】A.含有氮原子,所以100mL溶液中氮原子总数为0.2;故A正确;
B.常温下,铝在浓硫酸中将发生钝化,不发生生成氢气的反应,故B错误;
C.与氧气生成为可逆反应,不能完全反应;所以生成的分子数小于;故C错误;
D.与NaOH反应为;为的歧化反应;2.24L被NaOH溶液充分吸收过程中转移的电子数为0.1,故D错误;
故答案选A。
6.D
【详解】二氧化硫与氯气在水溶液中发生反应,现把二者以等物质的量混合恰好完全反应,方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,盐酸、硫酸虽为强酸,但无漂白性,所以反应后的溶液将失去漂白性,答案选D。
【点睛】二氧化硫具有漂白作用,氯气(其实质是次氯酸)也有漂白作用,二者相遇后,通入水中,发生氧化还原反应,生成强酸,不再具有漂白作用。
7.C
【详解】A.浓硫酸和亚硫酸钠反应生成二氧化硫,SO2使酸性高锰酸钾溶液褪色,体现的是SO2的还原性,A正确。
B.利用浓硫酸的高沸点性以及吸水放热的性质,可以制取HCl气体,pH试纸变红,则说明气体为酸性气体,B正确;
C.浓盐酸和二氧化锰加热可以制取Cl2,常温下不反应,Cl2可以用湿润的淀粉碘化钾试纸检验,试液变蓝,说明KI转化为I2,则说明Cl2有强氧化性,题干气体的制备方法无加热,C错误;
D.NH3制备可以采取浓氨水和生石灰制取,可用红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,D正确;
故答案选C。
8.D
【详解】A.硅酸钠耐高温,不易燃烧,可用作木材防火剂,与硅酸钠溶液呈碱性无关,故A错误;
B.硫酸铜是重金属盐,能使蛋白质变性,可用作游泳池中水的消毒剂,与硫酸铜溶液的颜色无关,故B错误;
C.酯化反应是可逆反应,常用浓硫酸作催化剂,以加快反应速率,同时浓硫酸有吸水性,可使反应正向进行,提高生成物产率,与浓硫酸具有强氧化性无关,故C错误;
D.原电池中,负极失电子发生还原,同时需要电极材料能够导电,而铅是金属,能导电,反应中易失去电子,具有还原性,故D正确;
故答案为D。
9.D
【详解】A.NaOH溶解过程放热,应冷却后再转移至容量瓶,A错误;
B.碳酸钠和碳酸氢钠均可以和澄清石灰水反应生成沉淀,B错误;
C.即便Na2SO3样品未变质,由于添加了硝酸,亚硫酸根也会被氧化为硫酸根,C错误;
D.维生素C可还原氯化铁,溶液由黄色变为浅绿色,D正确;
综上所述答案为D。
10.D
【详解】A.氧化铝是离子化合物,熔融状态下可电解得到铝单质,故A错误;
B.氨气沸点较高易被液化,液氨在气化过程中吸收大量的热,常用作制冷剂,故B错误;
C.MgCl2为离子化合物,熔融状态下可电解得到镁,与其水溶液酸性无关,故C错误;
D.浓硫酸具有吸水性,常用作干燥剂,故D正确;
故选:D。
11.B
【分析】铁离子和KSCN溶液反应,使得溶液变为红色;
【详解】A.铁和过量盐酸反应生成氯化亚铁,A错误;
B.铁和过量的稀硝酸反应生成硝酸铁和一氧化氮,B正确;
C.铁会和铁离子生成亚铁离子;过量的铁和浓硝酸生成硝酸亚铁和一氧化氮,C错误;
D.FeO和稀硫酸反应生成硫酸亚铁和水,D错误;
故选B。
12.A
【详解】A.K+ 、Cl- 、HCO、SO之间不反应,能大量共存;
B.Cl-和Ag+ 、SO产生AgCl、Ag2SO4沉淀,不能大量共存;
C.Ca2+、H+分别和CO反应生成CaCO3沉淀、水和二氧化碳,不能大量共存;
D.Fe2+、H+ 、NO之间,Fe2+、Cr2O、H+之间发生氧化还原反应,不能大量共存。
答案选A。
13.B
【详解】A.受热后结晶水脱离,则热的玻璃管内含水蒸气,易水解,致使制备的中混有MgO,A错误;
B.石蜡分解产生烯烃,烯烃能发生加成反应,能使酸性高锰酸钾溶液褪色,B正确;
C.制备的氧气从长颈漏斗中逸出,导致实验失败,应该选用分液漏斗,C错误;
D.密度比空气小,用向下排空气法收集,D错误;
故选B。
14.B
【详解】A.硫化氢在氧气中燃烧,当氧气量少时生成硫单质,氧气量多时生成二氧化硫,A错误;
B.硫在氧气中燃烧产物为二氧化硫,跟氧气的量和浓度无关,B正确;
C.稀硫酸与锌反应生成氢气,浓硫酸与锌反应生成二氧化硫,C错误;
D.二氧化碳通入澄清石灰水,二氧化碳量少时生成碳酸钙,过量时生成碳酸氢钙,D错误;
故选B。
15.D
【详解】A.若A为Fe,D为氢气,铁与水蒸气高温条件下能生成氢气,B为水,A错误;
B.若A、D为化合物,B为水,可以发生下述反应:3NO2+H2O=2HNO3+NO,C不一定是气体单质,B错误;
C.若A、B、C、D均为化合物,可以发生下述反应:3NO2+H2O=2HNO3+NO,不是复分解反应,C错误;
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,C是NH3,则A、B分别是、OH-中任意一种,D是H2O,在常温下一定呈液态,D正确;
答案选D。
16.错误
【解析】略
17. 抑制FeSO4水解 加稀硫酸会干扰硫酸根离子的检验 碱 Al(OH)3+OH-→AlO2-+2H2O 吸附
【详解】(1)硫酸亚铁为弱碱盐,溶于水时易发生水解,从而使溶液变浑浊。所以,在硫酸亚铁片溶解过程中,常加酸抑制水解。答案为:抑制FeSO4水解。
在后续检验中,还需要检验硫酸根离子,若加硫酸酸化,将会引入硫酸根离子,干扰原药片中硫酸根离子的检验。答案为:加稀硫酸会干扰硫酸根离子的检验。
(2)胃酸为盐酸,加氢氧化铝中和酸,从而表现出碱性。答案为:碱。
氢氧化铝与烧碱溶液反应的离子方程式为Al(OH)3+OH-→AlO2-+2H2O。
答案为:Al(OH)3+OH-→AlO2-+2H2O。
(3)氢氧化铝是一种胶体,具有吸附能力,能吸附水中的悬浮物。答案为:吸附。
18.(1)22.4
(2) 防止分解
(3) SO2易溶于水、NO难溶于水 1:4
【分析】氨水吸收二氧化硫生成亚硫酸氢铵,亚硫酸氢铵和NO2反应生成硫酸氢铵和氮气,硫酸氢铵溶液减压蒸发,经一系列操作得铵盐晶体。
【详解】(1)将烟气中转化为无污染的氮气,当与NO的物质的量之比为1:1时,每转化1mol该氮氧化物混合气体,得电子的物质的量为0.5mol×4+0.5mol×2=3mol,氨气转化为氮气,N元素化合价由-3升高为0,根据得失电子守恒,消耗氨气的物质的量为1mol,需要消耗的体积(STP)为22.4L。
(2)①I中氨水和二氧化硫反应生成亚硫酸氢铵,发生反应的化学方程式为 。
②铵盐受热易分解,该流程中采用减压蒸发的原因是防止分解。
(3)①SO2易溶于水、NO难溶于水,所以脱除率高于NO。
②被氧化,S元素化合价升高2价,NO被氧化为,N元素升高3价,设吸收与NO的物质的量分别为2mol、1mol,则转移电子的物质的量为2mol×100%×2+1mol×80%×3=6.4mol,NaClO被还原为,Cl元素化合价降低2价,根据得失电子守恒,生成的物质的量为3.2mol,所以NaClO溶液吸收烟气后的溶液中与的物质的量之比0.8:3.2=1:4。
19. 产生水蒸气 3Fe+4H2O(g)Fe3O4+4H2 吸收未反应的水蒸气 A 收集H2,并检验其纯度
【分析】A中用酒精灯加热产生水蒸气,水蒸气在B的玻璃管中和Fe反应生成四氧化三铁和氢气,通过D后水蒸气被吸收,氢气和E中氧化铜反应生成铜和水,据此解答。
【详解】(1)A装置的作用是产生水蒸气;水蒸气和铁在B装置的玻璃管中反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2;
(2)由分析可知D的作用是吸收未反应的水蒸气;
(3)A、B两个装置中应先点燃A处的酒精灯,通入一段时间的水蒸气后点燃B处酒精灯,以防B装置玻璃管中铁和氧气反应;氢气易燃易爆,点燃E处酒精灯之前应进行的操作是收集H2,并检验其纯度。
20. Cu+2Fe3+=2Fe2++Cu2+ Fe 确保Fe粉充分反应 取少许滤液,滴加2~3滴KSCN溶液,若溶液不变红,则说明不含Fe3+ Cl2+2Fe2+=2Fe3++2Cl- 丁达尔效应
【分析】印刷电路板的反应为:Cu+2FeCl3=2FeCl2+CuCl2,由此知废液中含有FeCl2、CuCl2、FeCl3(过量)成分,加入Fe粉(试剂①)可置换出Cu从而回收,发生反应:Fe+2FeCl3=3FeCl2、Fe+ CuCl2=Cu+FeCl2,同时溶液中Fe元素均转化为FeCl2,为了确保反应完全,所加铁粉需过量,经过过滤I,所得滤液成分为FeCl2,滤渣为Cu、Fe(过量),为了回收Cu,需除去Fe,故试剂②为盐酸,Fe与HCl反应生成FeCl2,Cu不反应被分离,两次过滤所得滤液中主要含FeCl2,通入Cl2或加新制氯水(试剂③),可将FeCl2氧化为FeCl3,从而重新获得FeCl3溶液。
【详解】(1)由分析知反应为:Cu+2FeCl3=2FeCl2+CuCl2,FeCl3、FeCl2、CuCl2可拆写成离子形式,改写后离子方程式为:Cu+2Fe3+=2Fe2++Cu2+;
(2)由分析知,试剂①为Fe粉;试剂②为盐酸,过量的目的是确保Fe粉充分反应;
(3)检验Fe3+,可使用KSCN溶液,具体操作为:取少许滤液,滴加2~3滴KSCN溶液,若溶液不变红,则说明不含Fe3+;
(4) 试剂③为Cl2或新制氯水,目的是氧化Fe2+生成Fe3+,使腐蚀液再生,离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
(5)沸水中滴加FeCl3溶液至溶液显红褐色,此时得到的是Fe(OH)3胶体,胶体特有的性质为丁达尔效应,故此处填丁达尔效应。
21. 2Al+2OH-+2H2O=2AlO2-+3H2↑ mol Fe2O3 +2Al2Fe+Al2O3 (a-)︰ 2∶3
【详解】(1)铝热剂中的氧化铁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,由方程式可知3n(Al)=2n(H2),n(Al)=×= mol;(2)铝热反应为置换反应,方程式为Fe2O3 +2Al2Fe+Al2O3,在铝热剂中铝的质量为×27g,则氧化铁的质量为(a-×27)g,故样品中氧化铁与铝的质量比为(a-):;(3)由于样品在高温下恰发完全反应,所以n(Al)=2n(Fe2O3),因此可得ag样品中铝的物质的量与反应后生成铁单质的物质的量,它们在反应中与氢气的关系式分别为2Al~3H2、2Fe~2H2,通过计算可知产生的氢气的物质的量之比为2:3,故c∶b=2:3。
【点睛】本题主要考查物质的量的计算在方程式中的应用,当涉及多个反应时,可根据关系式来进行计算过程的简化,优化计算思维。
22.1.21
【分析】根据化学方程式,找出FeS2和H2SO4量上的关系,进行相关计算。
【详解】4FeS2+11O22Fe2O3+8SO2、2SO2+O22SO3、SO3+H2O=H2SO4;根据硫元素质量守恒可知FeS2~2H2SO4;根据关系式,设可制取98%的硫酸x吨,
列方程,求出x≈1.21t;
答案:1 t黄铁矿可制取98%的硫酸1.21t。
【点睛】在本题中,还可以通过硫元素守恒直接得到FeS2~2H2SO4的关系式,但是该方法并不适合所有的转化流程,该方法要求在转化中,某一元素理论上可以全部转化到某一物质中才行,比如1mol CaCO3高温分解一段时间之后,向所得固体加入过量稀盐酸,无论高温分解多长时间,最终所得CaCl2、CO2都是1mol,因为Ca元素最终都变为CaCl2,C元素最终都变为CO2。
