化学人教版(2019)必修第一册2.1钠及其化合物课件(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1钠及其化合物课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 22:59:20 | ||
图片预览











文档简介
(共30张PPT)
钠及其化合物
任务一 列举含Na的物质,并对其分类
Na2O
Na2O2
NaHCO3
Na2CO3
二维图
【实验】钠和氧气的反应
提示:
1.用镊子取金属钠一块,绿豆大小
用滤纸吸干钠表面的煤油
2.加热前将不用的钠块放回原试剂瓶中。
3. 点燃酒精灯后,与石棉网保持一定距离。
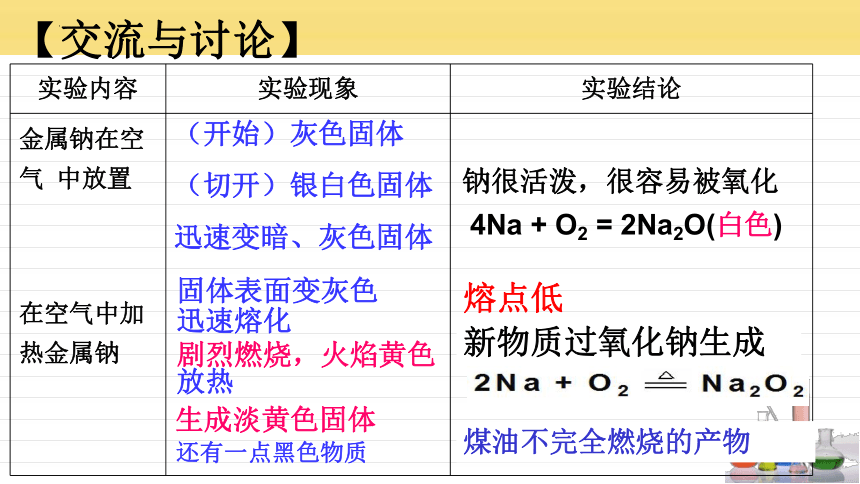
【交流与讨论】
实验内容 实验现象 实验结论
金属钠在空气 中放置 在空气中加热金属钠
(开始)灰色固体
(切开)银白色固体
迅速变暗、灰色固体
固体表面变灰色
迅速熔化
剧烈燃烧,火焰黄色
放热
生成淡黄色固体
还有一点黑色物质
钠很活泼,很容易被氧化
4Na + O2 = 2Na2O(白色)
熔点低
新物质过氧化钠生成
煤油不完全燃烧的产物
【分析】钠与氧气的反应
4Na + O2 = 2Na2O(白色)
还原剂
氧化剂
2Na + O2 = Na2O2(淡黄色)
-1
△
【实验】钠和水反应
提示:
1、用镊子取金属钠一块,绿豆大小
2、用滤纸吸干钠表面的煤油
3、取半烧杯蒸馏水
4、把钠投入水中后,烧杯口用玻璃片防护
5、仔细观察实验现象并记录
请你通过实验来验证你的预测
【交流与讨论】
浮
熔
游
响
红
实验操作 实验现象 实验结论
ρ(Na)<ρ(H2O)
钠的熔点低,反应放热
生成气体使Na受力不均衡
反应剧烈
反应生成了碱
【分析】钠与水反应的本质
2Na + 2H2O = 2NaOH + H2↑
化合价升高,失 2×e-,被氧化
化合价降低,得 2×e-,被
还原剂
氧化剂
【思考】
钠能与酸反应吗?你能预测反应的情况吗?
钠与酸和水反应的实质都是金属与H之间的氧化还原反应,都体现金属钠的还原性
+1
【实验】钠和硫酸铜溶液反应
提示:
1、用镊子取金属钠一块,绿豆大小
2、用滤纸吸干钠表面的煤油
3、取半烧杯硫酸铜溶液
4、把钠投入硫酸铜溶液中后,烧杯口用玻璃片防护
实验操作 实验现象 实验结论
【交流与讨论】
浮
熔
游
响
蓝
ρ(Na)<ρ(H2O)
钠的熔点低,反应放热
生成气体使Na受力不均衡
反应激烈
反应生成了氢氧化铜
【分析】钠与硫酸铜溶液反应的本质
2Na + 2H2O = 2NaOH + H2↑
CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4
2Na + 2H2O + CuSO4 =
Cu(OH)2↓+ Na2SO4 + H2↑
【小结】
方法提升
观察物质外观性质
预测物质的性质
实验和观察
解释和结论
运用分类的方法,根据物质类别或有关反应规律预测
运用比较的方法,归纳出物质的通性和特性
研究物质性质的基本程序
任务三 梳理含Na的典型物质的性质
16
18:00
一、碳酸钠与碳酸氢钠的用途
玻璃纤维
玻璃制品
制皂
碳酸钠的用途
造纸
17
18:00
一、碳酸钠与碳酸氢钠的用途
碳酸氢钠的用途
发酵粉的主要成分
食用治疗胃酸过多
制作泡沫灭火器
18
18:00
颜色、状态
俗名
碳酸氢钠
碳酸钠
物质
细小白色晶体
白色粉末
84
106
摩尔质量g/mol
小苏打
纯碱、苏打
二、碳酸钠和碳酸氢钠的物理比较
科学探究1
Na2CO3 和 NaHCO3 的水溶性
根据实验,我们得出什么样的结论呢?
步骤
①(分别取一小勺药品,加3滴水振荡,用手摸试管底部)
② (加6mL水 )
③ (加1~2滴酚酞)
初步结论
Na2CO3 和 NaHCO3 的水溶性
Na2CO3
NaHCO3
加水部分溶解,无明显温度变化
振荡时间长时可溶解
溶液变红(较深)
溶液变微红色
1:水溶性: Na2CO3﹥ NaHCO3,
Na2CO3溶于水放热。
2: Na2CO3 和 NaHCO3 的水溶液均为碱性,
且碱性: Na2CO3 ﹥ NaHCO3
加水结块变为晶体,放热
固体量减小,但不能全部溶解
科学探究2
Na2CO3 和 NaHCO3 的热稳定性
你们能想出什么方法来探究它们的稳定性呢?
现象 发生反应的化学方程式 结论
实验结果
Na2CO3
NaHCO3
澄清的石灰水不浑浊
澄清的石灰水变浑浊
2NaHCO3 = Na2CO3 +H2O +CO2↑
受热不易分解
受热
易分解
科学探究3
把Na2CO3和NaHCO3分别与稀盐酸中,会有什么现象?为什么?
步骤:在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的Na2CO3和NaHCO3加入试管中,注意:比较反应的剧烈程度。
Na2CO3与NaHCO3和盐酸的反应
实验:
现象:
分析:
(2) Na2CO3 和 NaHCO3 与酸的反应
Na2CO3+2HCl =
CO2↑+H2O+2NaCl
NaHCO3+HCl =
CO2↑+H2O+NaCl
(3) Na2CO3 和 NaHCO3 与碱的反应
讨论:区别Na2CO3和NaHCO3的方法:
① 加热
加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀盐酸
首先产生气体且反应较剧烈的是NaHCO3
思考:
1、在Na2CO3饱和溶液中通入CO2后会有什么现象呢,原因是什么?
[解析] 有沉淀析出
1、将CO2通入Na2CO3溶液中,发生如下反应: Na2CO3+H2O+CO2=2NaHCO3
2、生成的NaHCO3的溶解度比Na2CO3的溶解度小。
本节知识回顾
名 称 碳酸钠 碳酸氢钠
化学式
俗 名
色、态
溶解性
热稳定性
与酸反应的快慢、离子方程式
与碱反应
用途
Na2CO3
NaHCO3
苏打、纯碱
小苏打
白色粉末
白色细小晶体
易溶(溶液呈碱性)
较易溶(溶液呈碱性)
热稳定性:Na2CO3 > NaHCO3
2NaHCO3==Na2CO3+
CO2 ↑+H2O
——
NaHCO3 比Na2CO3快
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
NaHCO3+HCl=
NaCl+H2O+CO2↑
不反应
NaHCO3+ NaOH==
Na2CO3+H2O
制玻璃、肥皂、造纸、纺织等
发酵粉、灭火剂、制药等
钠及其化合物
任务一 列举含Na的物质,并对其分类
Na2O
Na2O2
NaHCO3
Na2CO3
二维图
【实验】钠和氧气的反应
提示:
1.用镊子取金属钠一块,绿豆大小
用滤纸吸干钠表面的煤油
2.加热前将不用的钠块放回原试剂瓶中。
3. 点燃酒精灯后,与石棉网保持一定距离。
【交流与讨论】
实验内容 实验现象 实验结论
金属钠在空气 中放置 在空气中加热金属钠
(开始)灰色固体
(切开)银白色固体
迅速变暗、灰色固体
固体表面变灰色
迅速熔化
剧烈燃烧,火焰黄色
放热
生成淡黄色固体
还有一点黑色物质
钠很活泼,很容易被氧化
4Na + O2 = 2Na2O(白色)
熔点低
新物质过氧化钠生成
煤油不完全燃烧的产物
【分析】钠与氧气的反应
4Na + O2 = 2Na2O(白色)
还原剂
氧化剂
2Na + O2 = Na2O2(淡黄色)
-1
△
【实验】钠和水反应
提示:
1、用镊子取金属钠一块,绿豆大小
2、用滤纸吸干钠表面的煤油
3、取半烧杯蒸馏水
4、把钠投入水中后,烧杯口用玻璃片防护
5、仔细观察实验现象并记录
请你通过实验来验证你的预测
【交流与讨论】
浮
熔
游
响
红
实验操作 实验现象 实验结论
ρ(Na)<ρ(H2O)
钠的熔点低,反应放热
生成气体使Na受力不均衡
反应剧烈
反应生成了碱
【分析】钠与水反应的本质
2Na + 2H2O = 2NaOH + H2↑
化合价升高,失 2×e-,被氧化
化合价降低,得 2×e-,被
还原剂
氧化剂
【思考】
钠能与酸反应吗?你能预测反应的情况吗?
钠与酸和水反应的实质都是金属与H之间的氧化还原反应,都体现金属钠的还原性
+1
【实验】钠和硫酸铜溶液反应
提示:
1、用镊子取金属钠一块,绿豆大小
2、用滤纸吸干钠表面的煤油
3、取半烧杯硫酸铜溶液
4、把钠投入硫酸铜溶液中后,烧杯口用玻璃片防护
实验操作 实验现象 实验结论
【交流与讨论】
浮
熔
游
响
蓝
ρ(Na)<ρ(H2O)
钠的熔点低,反应放热
生成气体使Na受力不均衡
反应激烈
反应生成了氢氧化铜
【分析】钠与硫酸铜溶液反应的本质
2Na + 2H2O = 2NaOH + H2↑
CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4
2Na + 2H2O + CuSO4 =
Cu(OH)2↓+ Na2SO4 + H2↑
【小结】
方法提升
观察物质外观性质
预测物质的性质
实验和观察
解释和结论
运用分类的方法,根据物质类别或有关反应规律预测
运用比较的方法,归纳出物质的通性和特性
研究物质性质的基本程序
任务三 梳理含Na的典型物质的性质
16
18:00
一、碳酸钠与碳酸氢钠的用途
玻璃纤维
玻璃制品
制皂
碳酸钠的用途
造纸
17
18:00
一、碳酸钠与碳酸氢钠的用途
碳酸氢钠的用途
发酵粉的主要成分
食用治疗胃酸过多
制作泡沫灭火器
18
18:00
颜色、状态
俗名
碳酸氢钠
碳酸钠
物质
细小白色晶体
白色粉末
84
106
摩尔质量g/mol
小苏打
纯碱、苏打
二、碳酸钠和碳酸氢钠的物理比较
科学探究1
Na2CO3 和 NaHCO3 的水溶性
根据实验,我们得出什么样的结论呢?
步骤
①(分别取一小勺药品,加3滴水振荡,用手摸试管底部)
② (加6mL水 )
③ (加1~2滴酚酞)
初步结论
Na2CO3 和 NaHCO3 的水溶性
Na2CO3
NaHCO3
加水部分溶解,无明显温度变化
振荡时间长时可溶解
溶液变红(较深)
溶液变微红色
1:水溶性: Na2CO3﹥ NaHCO3,
Na2CO3溶于水放热。
2: Na2CO3 和 NaHCO3 的水溶液均为碱性,
且碱性: Na2CO3 ﹥ NaHCO3
加水结块变为晶体,放热
固体量减小,但不能全部溶解
科学探究2
Na2CO3 和 NaHCO3 的热稳定性
你们能想出什么方法来探究它们的稳定性呢?
现象 发生反应的化学方程式 结论
实验结果
Na2CO3
NaHCO3
澄清的石灰水不浑浊
澄清的石灰水变浑浊
2NaHCO3 = Na2CO3 +H2O +CO2↑
受热不易分解
受热
易分解
科学探究3
把Na2CO3和NaHCO3分别与稀盐酸中,会有什么现象?为什么?
步骤:在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的Na2CO3和NaHCO3加入试管中,注意:比较反应的剧烈程度。
Na2CO3与NaHCO3和盐酸的反应
实验:
现象:
分析:
(2) Na2CO3 和 NaHCO3 与酸的反应
Na2CO3+2HCl =
CO2↑+H2O+2NaCl
NaHCO3+HCl =
CO2↑+H2O+NaCl
(3) Na2CO3 和 NaHCO3 与碱的反应
讨论:区别Na2CO3和NaHCO3的方法:
① 加热
加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀盐酸
首先产生气体且反应较剧烈的是NaHCO3
思考:
1、在Na2CO3饱和溶液中通入CO2后会有什么现象呢,原因是什么?
[解析] 有沉淀析出
1、将CO2通入Na2CO3溶液中,发生如下反应: Na2CO3+H2O+CO2=2NaHCO3
2、生成的NaHCO3的溶解度比Na2CO3的溶解度小。
本节知识回顾
名 称 碳酸钠 碳酸氢钠
化学式
俗 名
色、态
溶解性
热稳定性
与酸反应的快慢、离子方程式
与碱反应
用途
Na2CO3
NaHCO3
苏打、纯碱
小苏打
白色粉末
白色细小晶体
易溶(溶液呈碱性)
较易溶(溶液呈碱性)
热稳定性:Na2CO3 > NaHCO3
2NaHCO3==Na2CO3+
CO2 ↑+H2O
——
NaHCO3 比Na2CO3快
Na2CO3+2HCl=
2NaCl+H2O+CO2↑
NaHCO3+HCl=
NaCl+H2O+CO2↑
不反应
NaHCO3+ NaOH==
Na2CO3+H2O
制玻璃、肥皂、造纸、纺织等
发酵粉、灭火剂、制药等
