人教版(2019)必修第二册 5.1 硫和二氧化硫 课件(共23张PPT)
文档属性
| 名称 | 人教版(2019)必修第二册 5.1 硫和二氧化硫 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 23:00:41 | ||
图片预览







文档简介
(共23张PPT)
硫及其化合物
北海道阿寒国立公园里有一座千年的活火山——硫磺山,从山麓到山顶有很多喷气孔,喷出富含硫磺的水蒸气,整座山被硫磺气味笼罩。
自然界中既有游离态的硫单质,又有化合态的含硫化合物
本节课我们要掌握的内容:
单质硫
二氧化硫
硫酸
不同化合价的含硫物质之间的相互转化
学习一种物质,一般涉及以下几个方面
1、物理性质
2、化学性质
3、制备
4、应用
预测一种物质的化学性质,一般从以下角度思考
1、分类
2、价态
3、元素周期律
古代一些酒商在运输葡萄酒的时候,由于运输路程远、时间长,酒经常会发生氧化变酸的现象。有些酒农发现,如果这些酒被装在用硫磺蜡烛熏烤过的橡木桶里就可以避免葡萄酒变质。现代酿酒时,SO2已经成为必不可少的添加辅料,它起着至关重要的作用:1. 杀死葡萄自身携带的杂菌,防止微生物污染;2. 防止多酚、单宁、色素等物质氧化;3. 让葡萄酒的酸度保持稳定;4. 稳定葡萄酒的色泽,加快澄清过程…… SO2含量一直属于葡萄酒检测中要严格监控的项目。每个国家对酿酒过程中能加入的SO2最大限度都有专门的法律规定。根据我国标准,无论是进口还是国产,葡萄酒含硫量标准都不能超过250mg/L,甜酒为400mg/L,比欧盟标准还要严格。在这个范围内,对99%的人都是安全的。
思考:在葡萄酒生产过程中,常在酒中通入一定量的二氧化硫,否则葡萄酒很容易在短短的几个月之内坏掉。你能猜测SO2表现哪些性质和作用吗?
二、二氧化硫
1、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易溶于水
2、化学性质
(1)酸性氧化物的角度:
(2)中间价态的角度:
请写出四个盖子中涉及的相关离子方程式
(3)特性:
与水反应
与碱反应
与碱性氧化物反应
与盐反应
与氧化剂反应
与还原剂反应
与某些有机色素反应
知识细节:
关注1:
SO2+H2O H2SO3(亚硫酸)
可逆反应: 在同一条件下,向正反应方向进行,同时又向逆反应方向进行的反应。
(1)2H2O ═ 2H2↑+O2↑ 2H2+O2 ═ 2H2O
(2)CO2+H2O═H2CO3 H2CO3═CO2↑+H2O
(3)2SO2+O2 ═ 2SO3 2SO3 ═ 2SO2+O2
通电
点燃
高温
V2O5
高温
V2O5
判断下列反应是否为可逆反应:
H2SO3是二元中强酸(酸性:亚硫酸>醋酸>碳酸)
不稳定,易分解。
关注2:
(SO2少量) SO2+2NaOH=Na2SO3+H2O
(SO2过量) SO2+NaOH=NaHSO3
实验室制取SO2时,可用吸氢氧化钠溶液收尾气,防止空气污染。
工业上常用石灰石或者氨水来吸收,产生的亚硫酸盐再氧化成硫酸盐,可以做石膏或者氮肥进行利用。
关注3:
①可逆反应;②不是燃烧反应!单质硫燃烧只能得到SO2
关注4:
SO2有较强的还原性,很容易被氧化,较弱的氧化性
思考:浓硫酸有很强的氧化性,但是它无法氧化SO2
关注5:
SO2的漂白性只针对部分有机色素,另外漂白不长久,易复原。
无色的物质
某些有机色素
能使品红褪色,不能使紫色石蕊褪色
SO2气体的检验:将气体通入品红溶液中,品红溶液褪色,加热后又恢
复原色,则该气体为SO2。
思考:通入品红溶液使其褪色的气体一定是SO2吗?
关注6:
SO2通入氯化钡溶液中会产生亚硫酸钡沉淀吗?请说明理由!
在溶有SO2的氯化钡溶液中添加哪些物质可产生沉淀?(硫酸盐和硝酸银不讨论)
思考角度:1、消除弱
2、消除酸
3、另找出路
3、实验室制备
原料:亚硫酸钠固体、70%硫酸溶液
思考1:反应机理
思考2:能否用亚硫酸钠溶液来代替亚硫酸钠固体,理由?
思考3:选择70%硫酸溶液的理由?
思考4:常规制备SO2的实验需要哪些功能的装置?
练一练
请写出下列离子方程式:
1、SO2通入亚硫酸钠溶液中
2、过量SO2通入碳酸钠溶液中
3、少量SO2通入次氯酸钙溶液中
如何在混合气体中把杂质除去:
CO2中混有SO2
SO2中混有HCl
三、硫酸
1、物理性质
①纯净的硫酸是无色、黏稠、难挥发的油状液体
②沸点高:纯硫酸难挥发,沸点338℃。 (高沸点酸)
③密度大:质量分数为98.3%的硫酸的密度为1.84g/cm3
④易溶于水,稀释时放出大量的热
回忆:如何稀释浓硫酸?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
三、硫酸
2、稀硫酸化学性质
Fe+2H+===Fe2++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2++2H2O
CO32- +2H+===CO2↑+H2O
红色
运浓硫酸的铁罐车
常温下,Fe、Al 与浓 H2SO4 反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。钝化是________变化。
化学
思考:浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,Fe、Al 与浓 HNO3也会生成致密的氧化膜,发生“钝化”过程
③ 与还原性化合物反应,如H2S、HBr等(浓硫酸不能干燥H2S、HBr)
③强氧化性:
思考:该如何检验产物中的物质?
将混合气体→无水硫酸铜(变蓝)→品红溶液(褪色)→足量酸性KMnO4→品红溶液(不变化)→澄清石灰水(变浑浊)
检验SO2→除去SO2→检验SO2是否除尽→检验CO2
练一练:判断下列过程中体现了硫酸的性质:
(1)浓硫酸使蔗糖炭化并生成刺激性气味的气体
(2)浓硫酸使火柴梗变黑
(3)浓硫酸干燥氢气
(4)浓硫酸使五水硫酸铜变白
(5)用铁槽车运输浓硫酸
(6)浓硫酸敞口置于空气中浓度变稀
(浓盐酸?)
(7)浓硫酸与铜片加热反应
(8)往浓盐酸中滴加浓硫酸来快速制取HCl气体
(9)铁钉遇稀硫酸放出气泡
公元650-683年“炼石胆取精华法”(《黄帝九鼎神丹经诀》)
CuSO4·5H2O==CuO+SO3+5H2O
SO3+H2O==H2SO4
18世纪40年代前,欧洲很多地方以绿矾为原料,在蒸馏釜中煅烧制硫酸
2FeSO4·7H2O==Fe2O3+SO2+SO3+14H2O
SO3+H2O==H2SO4
△
△
思考:古代制硫酸存在很多问题,现代工业又是如何制备的呢?
能耗大
原料少
副产物多
产量小
难以大规模生产...
3、工业制备:
400~500℃
燃烧
98.3%的浓硫酸吸收
V2O5(催化剂)
硫黄或黄铁矿
空气
SO2
SO3
H2SO4
工业制备硫酸工艺中用浓硫酸吸收SO3,而不直接用水
SO3与水生成硫酸的反应,放出大量的热。用水或稀硫酸作吸收剂时容易形成酸雾, 吸收速度慢,不利于吸收三氧化硫。
FeS2
写出每一步的化学方程式:
4FeS2+11O2
2Fe2O3+8SO2
或
S+O2
SO2
2SO2+O2
2SO3
SO3+H2O=H2SO4
3、工业制备:
沸腾炉
接触室
吸收塔
无现象
4、硫酸根离子的检验
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
思考1:从横向看,相同价态的含硫物质之间可以发生哪些转化,写出对应反应的化学方程式?
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
H2S+2NaOH==Na2S+2H2O
Na2S+2HCl==2NaCl+H2S↑
H2SO3+2NaOH==Na2SO3+2H2O
Na2SO3+H2SO4(浓)==Na2SO4+SO2+H2O
SO2+H2O H2SO3
H2SO3====SO2+H2O
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
思考2:从纵向看,从低价态的硫转变为高价态的硫需要加哪一类物质?
常用的氧化剂:O2、KMnO4、HNO3、浓硫酸、氯水、溴水、碘水、H2O2、Na2O2、HClO、NaClO、Fe3+等
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
思考3:从高价态的硫转变为低价态的硫需要加哪一类物质?
常用的还原剂:I-、Br-、SO2、S2-、Fe2+、Na、Mg、Fe、C等
通过非氧化还原反应规律来转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
H2S
Na2SO4
H2SO3
SO3 H2SO4
S
Na2SO3
SO2
通过氧化还原反应规律来转化
FeS2
同价态和不同价态含硫物质之间的转化
Na2SO4
H2SO3
SO3 H2SO4
S
我国现存最早的药学专著《神农本草经》
记载:硫酸钠有清火消肿,泻热通便,软坚润燥等药效。
?
?
Na2SO3
SO2
思考:某地盛产硫磺,若以此制备硫酸钠,你能设计出哪些生产路线?
硫及其化合物
北海道阿寒国立公园里有一座千年的活火山——硫磺山,从山麓到山顶有很多喷气孔,喷出富含硫磺的水蒸气,整座山被硫磺气味笼罩。
自然界中既有游离态的硫单质,又有化合态的含硫化合物
本节课我们要掌握的内容:
单质硫
二氧化硫
硫酸
不同化合价的含硫物质之间的相互转化
学习一种物质,一般涉及以下几个方面
1、物理性质
2、化学性质
3、制备
4、应用
预测一种物质的化学性质,一般从以下角度思考
1、分类
2、价态
3、元素周期律
古代一些酒商在运输葡萄酒的时候,由于运输路程远、时间长,酒经常会发生氧化变酸的现象。有些酒农发现,如果这些酒被装在用硫磺蜡烛熏烤过的橡木桶里就可以避免葡萄酒变质。现代酿酒时,SO2已经成为必不可少的添加辅料,它起着至关重要的作用:1. 杀死葡萄自身携带的杂菌,防止微生物污染;2. 防止多酚、单宁、色素等物质氧化;3. 让葡萄酒的酸度保持稳定;4. 稳定葡萄酒的色泽,加快澄清过程…… SO2含量一直属于葡萄酒检测中要严格监控的项目。每个国家对酿酒过程中能加入的SO2最大限度都有专门的法律规定。根据我国标准,无论是进口还是国产,葡萄酒含硫量标准都不能超过250mg/L,甜酒为400mg/L,比欧盟标准还要严格。在这个范围内,对99%的人都是安全的。
思考:在葡萄酒生产过程中,常在酒中通入一定量的二氧化硫,否则葡萄酒很容易在短短的几个月之内坏掉。你能猜测SO2表现哪些性质和作用吗?
二、二氧化硫
1、物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易溶于水
2、化学性质
(1)酸性氧化物的角度:
(2)中间价态的角度:
请写出四个盖子中涉及的相关离子方程式
(3)特性:
与水反应
与碱反应
与碱性氧化物反应
与盐反应
与氧化剂反应
与还原剂反应
与某些有机色素反应
知识细节:
关注1:
SO2+H2O H2SO3(亚硫酸)
可逆反应: 在同一条件下,向正反应方向进行,同时又向逆反应方向进行的反应。
(1)2H2O ═ 2H2↑+O2↑ 2H2+O2 ═ 2H2O
(2)CO2+H2O═H2CO3 H2CO3═CO2↑+H2O
(3)2SO2+O2 ═ 2SO3 2SO3 ═ 2SO2+O2
通电
点燃
高温
V2O5
高温
V2O5
判断下列反应是否为可逆反应:
H2SO3是二元中强酸(酸性:亚硫酸>醋酸>碳酸)
不稳定,易分解。
关注2:
(SO2少量) SO2+2NaOH=Na2SO3+H2O
(SO2过量) SO2+NaOH=NaHSO3
实验室制取SO2时,可用吸氢氧化钠溶液收尾气,防止空气污染。
工业上常用石灰石或者氨水来吸收,产生的亚硫酸盐再氧化成硫酸盐,可以做石膏或者氮肥进行利用。
关注3:
①可逆反应;②不是燃烧反应!单质硫燃烧只能得到SO2
关注4:
SO2有较强的还原性,很容易被氧化,较弱的氧化性
思考:浓硫酸有很强的氧化性,但是它无法氧化SO2
关注5:
SO2的漂白性只针对部分有机色素,另外漂白不长久,易复原。
无色的物质
某些有机色素
能使品红褪色,不能使紫色石蕊褪色
SO2气体的检验:将气体通入品红溶液中,品红溶液褪色,加热后又恢
复原色,则该气体为SO2。
思考:通入品红溶液使其褪色的气体一定是SO2吗?
关注6:
SO2通入氯化钡溶液中会产生亚硫酸钡沉淀吗?请说明理由!
在溶有SO2的氯化钡溶液中添加哪些物质可产生沉淀?(硫酸盐和硝酸银不讨论)
思考角度:1、消除弱
2、消除酸
3、另找出路
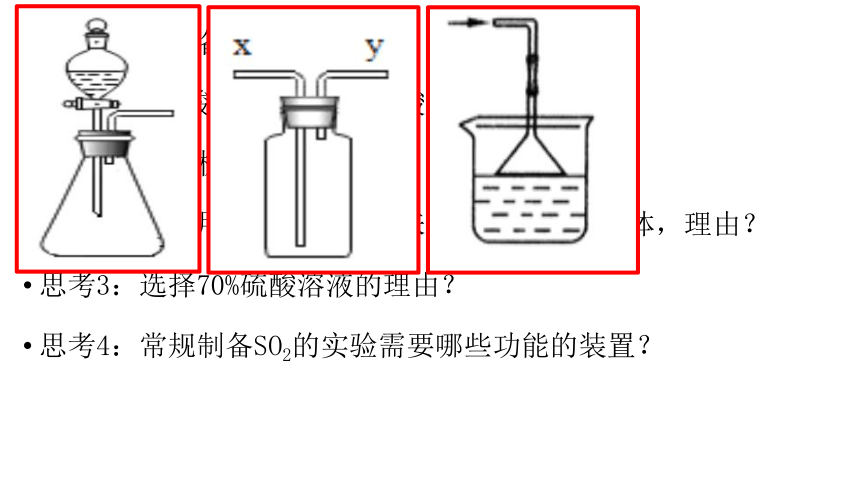
3、实验室制备
原料:亚硫酸钠固体、70%硫酸溶液
思考1:反应机理
思考2:能否用亚硫酸钠溶液来代替亚硫酸钠固体,理由?
思考3:选择70%硫酸溶液的理由?
思考4:常规制备SO2的实验需要哪些功能的装置?
练一练
请写出下列离子方程式:
1、SO2通入亚硫酸钠溶液中
2、过量SO2通入碳酸钠溶液中
3、少量SO2通入次氯酸钙溶液中
如何在混合气体中把杂质除去:
CO2中混有SO2
SO2中混有HCl
三、硫酸
1、物理性质
①纯净的硫酸是无色、黏稠、难挥发的油状液体
②沸点高:纯硫酸难挥发,沸点338℃。 (高沸点酸)
③密度大:质量分数为98.3%的硫酸的密度为1.84g/cm3
④易溶于水,稀释时放出大量的热
回忆:如何稀释浓硫酸?
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
三、硫酸
2、稀硫酸化学性质
Fe+2H+===Fe2++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2++2H2O
CO32- +2H+===CO2↑+H2O
红色
运浓硫酸的铁罐车
常温下,Fe、Al 与浓 H2SO4 反应,生成了致密的氧化膜,阻止酸与内层金属进一步反应,从而保护了金属,这个过程叫做“钝化”。钝化是________变化。
化学
思考:浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,Fe、Al 与浓 HNO3也会生成致密的氧化膜,发生“钝化”过程
③ 与还原性化合物反应,如H2S、HBr等(浓硫酸不能干燥H2S、HBr)
③强氧化性:
思考:该如何检验产物中的物质?
将混合气体→无水硫酸铜(变蓝)→品红溶液(褪色)→足量酸性KMnO4→品红溶液(不变化)→澄清石灰水(变浑浊)
检验SO2→除去SO2→检验SO2是否除尽→检验CO2
练一练:判断下列过程中体现了硫酸的性质:
(1)浓硫酸使蔗糖炭化并生成刺激性气味的气体
(2)浓硫酸使火柴梗变黑
(3)浓硫酸干燥氢气
(4)浓硫酸使五水硫酸铜变白
(5)用铁槽车运输浓硫酸
(6)浓硫酸敞口置于空气中浓度变稀
(浓盐酸?)
(7)浓硫酸与铜片加热反应
(8)往浓盐酸中滴加浓硫酸来快速制取HCl气体
(9)铁钉遇稀硫酸放出气泡
公元650-683年“炼石胆取精华法”(《黄帝九鼎神丹经诀》)
CuSO4·5H2O==CuO+SO3+5H2O
SO3+H2O==H2SO4
18世纪40年代前,欧洲很多地方以绿矾为原料,在蒸馏釜中煅烧制硫酸
2FeSO4·7H2O==Fe2O3+SO2+SO3+14H2O
SO3+H2O==H2SO4
△
△
思考:古代制硫酸存在很多问题,现代工业又是如何制备的呢?
能耗大
原料少
副产物多
产量小
难以大规模生产...
3、工业制备:
400~500℃
燃烧
98.3%的浓硫酸吸收
V2O5(催化剂)
硫黄或黄铁矿
空气
SO2
SO3
H2SO4
工业制备硫酸工艺中用浓硫酸吸收SO3,而不直接用水
SO3与水生成硫酸的反应,放出大量的热。用水或稀硫酸作吸收剂时容易形成酸雾, 吸收速度慢,不利于吸收三氧化硫。
FeS2
写出每一步的化学方程式:
4FeS2+11O2
2Fe2O3+8SO2
或
S+O2
SO2
2SO2+O2
2SO3
SO3+H2O=H2SO4
3、工业制备:
沸腾炉
接触室
吸收塔
无现象
4、硫酸根离子的检验
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
思考1:从横向看,相同价态的含硫物质之间可以发生哪些转化,写出对应反应的化学方程式?
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
H2S+2NaOH==Na2S+2H2O
Na2S+2HCl==2NaCl+H2S↑
H2SO3+2NaOH==Na2SO3+2H2O
Na2SO3+H2SO4(浓)==Na2SO4+SO2+H2O
SO2+H2O H2SO3
H2SO3====SO2+H2O
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
思考2:从纵向看,从低价态的硫转变为高价态的硫需要加哪一类物质?
常用的氧化剂:O2、KMnO4、HNO3、浓硫酸、氯水、溴水、碘水、H2O2、Na2O2、HClO、NaClO、Fe3+等
四、不同价态含硫化合物的转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
FeS2
CuFeS2
SO3 H2SO4
H2S
SO2
S
H2SO3
Na2SO3
Na2SO4
Na2S2O3
思考3:从高价态的硫转变为低价态的硫需要加哪一类物质?
常用的还原剂:I-、Br-、SO2、S2-、Fe2+、Na、Mg、Fe、C等
通过非氧化还原反应规律来转化
化合价
0
+6
+4
-2
物质类别
氢化物
氧化物
酸
盐
Na2S
H2S
Na2SO4
H2SO3
SO3 H2SO4
S
Na2SO3
SO2
通过氧化还原反应规律来转化
FeS2
同价态和不同价态含硫物质之间的转化
Na2SO4
H2SO3
SO3 H2SO4
S
我国现存最早的药学专著《神农本草经》
记载:硫酸钠有清火消肿,泻热通便,软坚润燥等药效。
?
?
Na2SO3
SO2
思考:某地盛产硫磺,若以此制备硫酸钠,你能设计出哪些生产路线?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
