专题1揭示物质结构的奥秘检测题高二下学期化学苏教版(2019)选择性必修2(含解析)
文档属性
| 名称 | 专题1揭示物质结构的奥秘检测题高二下学期化学苏教版(2019)选择性必修2(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 657.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 23:12:47 | ||
图片预览



文档简介
专题1《揭示物质结构的奥秘》检测题
一、单选题
1.已知阴离子A2-的原子核内有x个中子,A原子的质量数为m,则Wg A2-含有电子的物质的量为
A.(m-x-2)/m mol B.W(m-x)/m mol
C.W(m-x-2)/m mol D.W(m-x+2)/m mol
2.下列各项描述的判断正确的是
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家最近合成了一种新型的化合物S8 正确
C 红磷转化为白磷是物理变化 错误
D 石墨和金刚石是同素异形体 错误
A.A B.B C.C D.D
3.下列叙述错误的是
A.16O、18O属于同一种元素,它们互为同位素
B.D和T是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
4.铪具有低的中子吸收截面、优异的耐蚀性和加工性能,是核工业的重要原料,其中一种核素是,下列说法正确的是
A.的质量数为72 B.的核外电子数为72
C.的中子数为103 D.与互为同素异形体
5.1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
6.已知镓(Ga)有两种稳定的天然同位素,其一是,它在自然界中的原子百分比为60%。实验测得GaBr3的摩尔质量为309.8g/mol,则另外一种镓的同位素的原子符号为
A. B. C. D.
7.下列有关26Al和10Be的说法正确的是
A.10Be和9Be是中子数不同质子数相同的同种核素
B.10Be的质子数等于中子数
C.5.2g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数和核外电子数均不同,中子数相同
8.正确掌握化学用语是学好化学的基础.下列化学用语正确的是
A.质量数为37的氯原子:Cl
B.硫原子的结构示意图:
C.次氯酸钙的化学式:CaClO
D.HO、HO互为同位素
9.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱;同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
10.下列说法正确的是
A.碳元素的一种同位素14C可用于考古断代 B.H2、D2、T2互为同素异形体
C.C2H4、C3H6、C4H8一定互为同系物 D. 和 互为同分异构体
11.氧化氘(D2O)主要用于核反应堆的慢化剂和冷却剂。因为它比一般水重,所以又称之为“重水”。下列说法中错误的是
A.D2O的质量数是20 B.D2O与H2O中的质子数相等
C.H2和D2互为同位素 D.H2O与D2O的中子数之比为4:5
12.为延缓全球温室效应,二氧化碳捕获和封存技术已成为当今化学的前沿技术。下列捕获二氧化碳的化学反应中,其原子利用率没能达到100%的是
A.
B.
C.
D.nCO2+n
13.某元素的一种同位素原子,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是
A.(A-Z+2m)mol
B.(A+2m)mol
C.(A-Z+3m)mol
D.
14.下列物质互为同素异形体的是
A.14C和14N B.金刚石和石墨
C.H2O和H2O2 D.CO和CO2
15.根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
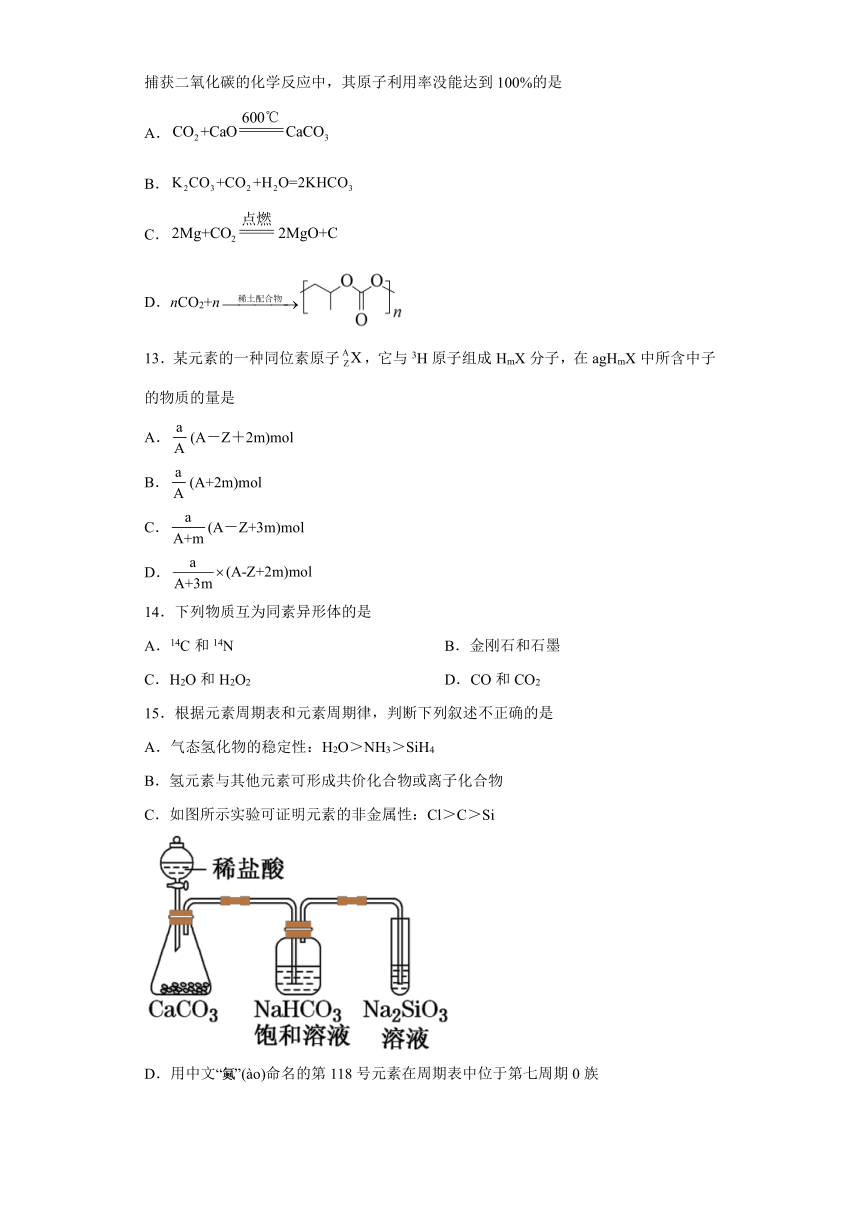
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
二、填空题
16.(I)根据取用药品的原则与方法,回答下列问题:
取用药品的基本原则是“安全、节约、防污染”。
①保证安全,严防中毒,严禁________、________、________任何化学药品。
②注意节约,如果没有说明用量,液体一般取__________,固体盖住试管底部。
③防止污染,实验后剩余的药品____________。
(II).下列各种不同粒子16O、1H、28Si、3H、O2、18O、29Si、O3、2H中:
(1)有_________________种不同的核素;
(2)有_________________种不同的元素;
(3)互为同位素的是_________________、_____________、_________________。
17.有下列几组物质,请将序号填入下列空格内:
A、CH2=CH-COOH和油酸(C17H33COOH) B、12C60和石墨 C、和 D、35Cl和37Cl E、乙醇和乙二醇
①互为同位素的是___________;
②互为同系物的是___________;
③互为同素异形体的是___________;
④互为同分异构体的是___________;
三、实验题
18.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素:_______(填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
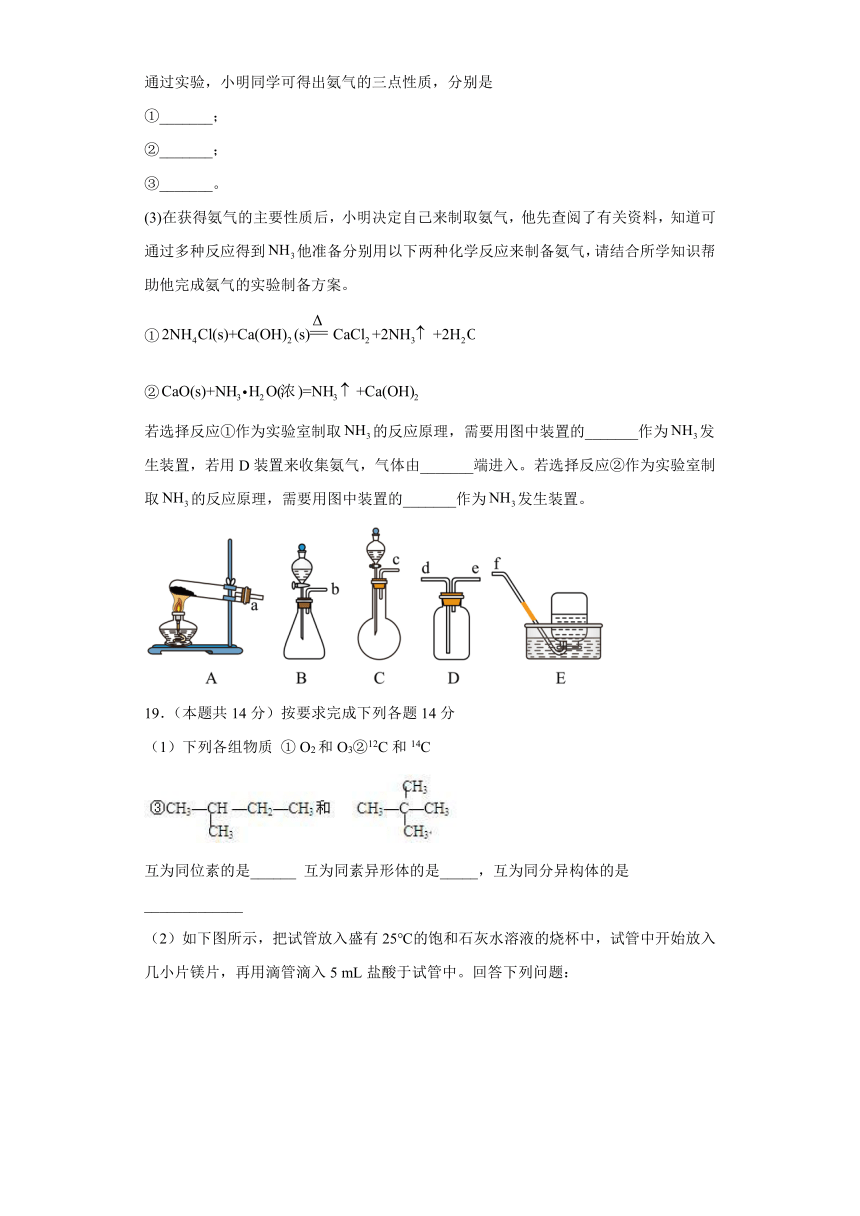
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
①_______;
②_______;
③_______。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的_______作为发生装置,若用D装置来收集氨气,气体由_______端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的_______作为发生装置。
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
四、计算题
20.完成下列基本计算:
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的摩尔质量为________,此质量的NOx在标准状况下的体积约为________;
(2)19.2g Cu与足量稀硝酸反应时,转移电子总数是_____NA(NA表示阿伏加德罗常数);
(3)元素M的某种原子,其氯化物(MCl2)11.1g配成溶液后,需用1mol/L的AgNO3溶液200mL才能把氯离子完全沉淀下来。已知该原子中:质子数=中子数。
① 该原子M的质量数A为_____________。
② 写出该原子(核素)符号___________。
③ M元素在周期表中的位置是_______________。
21.用表示原子:
(1)中性原子的中子数N=___________。
(2)共有x个电子,则该阳离子的中子数N=___________。
(3)共有x个电子,则该阴离子的中子数N=___________。
参考答案:
1.D
【详解】质量数=质子数+中子数,A的质子数为m-x,则A2-的电子数m-x+2,质量数等于同位素的近似相对原子质量,则含有的电子的物质的量W×(m-x+2)/m mol,选项D正确。
2.C
【详解】A.由同种元素组成的物质不一定是纯净物,如O2和O3的混合物,A错误;
B.S8只由一种元素组成,为单质,B错误;
C.红磷和白磷是两种不同的物质,该变化有新物质生成,为化学变化,C正确;
D.石墨和金刚石均是由C元素组成的性质不同的单质,是同素异形体,D错误。
答案选C。
3.D
【详解】A.16O、18O为O元素的两种不同核素,属于同种元素,互为同位素,A正确;
B.D和T是氢元素的不同的核素,质子数均为1,B正确;
C.14C和14N的质量数相等均为14,14C的中子数为14-6=8,14N的中子数为14-7=7,二者中子数不同,C正确;
D.6Li的中子数为6-3=3,7Li的中子数为7-3=4,中子数不同,D错误;
综上所述答案为D。
4.B
【详解】A.的质量数为185,A说法错误;
B.的质子数为72,原子核内质子数等于核外电子数,则的核外电子数为72,B说法正确;
C.的中子数为185-72=113,C说法错误;
D.与互为同位素,而不是同素异形体,D说法错误;
答案为B。
5.A
【详解】A.化学离不开实验,也需要理论的指导,故A正确;
B.化学是一门以实验为基础的科学,化学不再需要实验是错误的,故B错误;
C.化学也需要理论研究,离不开理论的指导,故C错误;
D.化学无论何时,都需要实验来验证,故D错误;
故答案为A。
6.A
【详解】已知镓(Ga)有两种稳定的天然同位素,其一是,它在自然界中的原子百分比为60%,则另一种在自然界中的原子百分比为40%,GaBr3的摩尔质量为309.8g/mol,则镓元素的相对原子质量为309.8 80×3=69.8,令镓的另一种同位素为A,则:0.4A+0.6×69=69.8,解得A=71,故该同位素为,答案选A。
7.C
【详解】A.10Be和9Be的中子数不同,质子数相同,互为同位素,是铍元素的不同核素,A错误;
B.铍的质子数为4,10Be的中子数为10-4=6,质子数不等于中子数,B错误;
C.5.2g26Al3+的物质的量为0.2mol,每个铝离子含有10个电子,故5.2g26Al3+中所含的电子数约为1.2×1024,C正确;
D.26Al和26Mg的质子数分别为13、12,核外电子数分别为13、12,中子数分别为13、14,中子数不同,D错误。
答案选C。
8.A
【详解】A.氯原子质子数为17,氯原子符合左上角数字为质量数,即37的氯原子为Cl,A用语正确;
B.硫原子最外层有6个电子,为硫离子的结构示意图,B用语错误;
C.次氯酸根离子为-1价,则次氯酸钙的化学式:Ca(ClO)2,C用语错误;
D.同位素为质子数相同而中子数不同的核素,HO、HO为化合物,D用语错误;
答案为A。
9.A
【详解】①将酸分为一元酸、多元酸是根据酸分子在水溶液中电离出的H+个数,而不是酸分子中的H个数,如H3PO3(亚磷酸)为二元酸,①不合理;
②氧化还原反应与非氧化还原反应的区别为反应中是否有电子转移,②合理;
③同位素是质子数相同而中子数不同的原子的互称,1H、2H、3H是同位素,电解质和非电解质都是化合物,区别是在熔融状态或水溶液中是否导电,干冰是固态的二氧化碳,是分子晶体,是非电解质,液氯是单质,不是非电解质,③不合理;
④明矾、冰醋酸、纯碱都是电解质,同素异形体是同种元素的不同种单质,C60、金刚石、石墨是同素异形体,④合理;
⑤分散系根据分散质粒子大小分为溶液、胶体、浊液,⑤不合理;
综上所述,只有②④合理,故选A。
10.A
【详解】A.碳元素有多种同位素,其中14C可用于考古断代,选项A正确;
B.D2、T2、H2是同一物质,都是氢气,不符合同素异形体概念,仅仅是D2、T2组成中氢原子中中子数不同,选项B错误;
C.C2H4为乙烯,含有碳碳双键,而C3H6可能为丙烯或环丙烷, C4H8可能为丁烯或环丁烷,由于三者结构不一定相似,所以三者不一定为同系物,选项C错误;
D.甲烷为正四面体结构, 和 为同种物质,选项D错误;
答案选A。
11.C
【详解】A.D含有1个中子,所以质量数为1+1=2,则D2O的质量数是22+16=20,故A正确;
B.D2O与H2O中的质子数均为12+8=10,故B正确;
C.同位素是指同种元素的不同核素,H2和D2是不同氢原子形成的氢气分子,不是核素,故C错误;
D.H2O的中子数为8,D2O的中子数为12+8=10,数量比为8:10=4:5,故D正确;
综上所述答案为C。
12.C
【分析】化合反应、加聚反应中,反应物中的原子全部进入所需产物中,原子利用率为100%,据此分析解答。
【详解】A.该反应为化合反应,原子利用率为100%,A错误;
B.该反应为化合反应,原子利用率为100%,B错误;
C.该反应产物有两种,原子利用率小于100%,C正确;
D.该反应为加聚反应,原子利用率为100%,D错误;
故答案选C。
13.D
【详解】某元素的一种同位素X的原子质量数为A,含Z个质子,则中子数为(A-Z),则每个HmX分子含有中子数为(A-Z+2m),ag HmX的物质的量为a,故含有中子物质的量为,D满足题意。
答案选D。
14.B
【分析】由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质,由此分析。
【详解】A.14C 的质子数为6,中子数为8,14N 的质子数为7,中子数为7,14C和14N是质子数不同,中子数不同的不同种元素,不属于同素异形体,故A不符合题意;
B.金刚石和石墨都是碳元素组成的不同单质,属于同素异形体,故B符合题意;
C.H2O和H2O2都是相同元素组成的化合物,不是单质,不属于同素异形体,故C不符合题意;
D.CO和CO2都是相同元素组成的化合物,不是单质,不属于同素异形体,故D不符合题意;
答案选B。
15.C
【详解】A.C、N、O属于同周期元素,从左至右,非金属性依次增强,原子序数C<N<O,非金属性O>N>C,C、Si属于同主族元素,从上到下,非金属性依次减弱,原子序数C<Si ,非金属性C>Si,则非金属性O>N>Si,非金属性越强,氢化物越稳定,气态氢化物的稳定性H2O>NH3>SiH4,故A正确;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确;
C.利用最高价含氧酸的酸性比较非金属性强弱,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误;
D.118号元素的原子序数为118,质子数为118,核外电子数为118,其原子结构示意图为,它的原子结构中有7个电子层,最外层电子数为8,则第118号元素在周期表中位于第七周期0族,故D正确。
答案为C。
16. 手触 鼻闻 口尝 1~2 mL 一般不放回原瓶 7 3 2H、3H 1H 18O、16O 28Si、29Si
【详解】(I)①保证安全,严防中毒,严禁手触、鼻闻、 口尝任何化学药品;正确答案:手触、鼻闻、口尝。
②注意节约,如果没有说明用量,液体一般取1~2 mL固体盖住试管底部;正确答案:1~2 mL。
③防止污染,实验后剩余的药品一般不放回原瓶;正确答案:一般不放回原瓶。
(II). 16O质子数为8,中子数为8;1H质子数为1,中子数为0;29Si质子数为14,中子数为15;3H质子数为1,中子数为2;18O质子数为8,中子数为10;28Si质子数为14,中子数为14;2H质子数为1,中子数为1;故共有7种核素;3种元素; O2和O3都是由氧元素形成的不同单质,互为同素异形体; 16O和18O质子数相同,中子数不同,互为同位素; 29Si和28Si质子数相同,中子数不同,互为同位素; 2H、1H和3H质子数相同,中子数不同,互为同位素;
(1) 综上所述:核素研究的对象为原子,因此共有7种核素;正确答案:7。
(2) 综上所述:共有氢、氧、硅3种元素;正确答案:3。
(3)综上所述:互为同位素的是: 1H 、2H、3H , 18O、16O, 28Si、29Si;正确答案:1H 、2H、3H , 18O、16O, 28Si、29Si。
17. D A B C
【分析】质子数相同质量数(或中子数)不同的原子互称同位素;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
同种元素形成的不同单质互为同素异形体;
具有相同分子式而结构不同的化合物互为同分异构体。
【详解】①35Cl和37Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素,故答案为D;
②CH2=CH-COOH和油酸(C17H33COOH)结构相似、通式相同,相差15个CH2原子团,互为同系物,故答案为A;
③12C60和石墨是由碳元素组成的不同单质,互为同素异形体,故答案为B;
④分子式相同,结构不同,互为同分异构体,故答案为C。
18.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1) 46g/mol 4.48L
(2)0.6
(3) 40 40Ca 第四周期第ⅡA族
【详解】(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的物质的量是0.2mol,所以摩尔质量为9.2g÷0.2mol=46g/mol;此质量的NOx在标准状况下的体积约为0.2mol×22.4L/mol=4.48L;
(2)19.2g Cu的物质的量是19.2g÷64g/mol=0.3mol,与足量稀硝酸反应时生成硝酸铜,铜元素化合价从0价升高到+2价,转移电子总数是0.6NA;
(3)由可知,n (Cl-)=n(Ag+)=0.2L×1mol/L=0.2mol,所以MCl2的物质的量是0.1mol,则M(MCl2)=11.1g÷0.1mol=111g/mol,由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,则M=111-35.5×2=40,又因为质子数=中子数,所以Z=20,则M是Ca;
①该原子M的质量数A=40;②该原子(核素)符号为;③Ca元素在周期表中的位置是第四周期第ⅡA族。
21. A-Z A-x-n A-x+n
【详解】(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,又因为中子数+质子数=质量数,据此可知中性原子的中子数N=A-Z;
(2)中性原子的核外电子数=质子数,所以如果AXn+共有x个电子,则质子数=X+n,因此该阳离子的中子数N=A-x-n;
(3)同(2)分析可知,如果AXn-共有x个电子,则质子数=X-n,因此该阴离子的中子数N=A-x+n。
一、单选题
1.已知阴离子A2-的原子核内有x个中子,A原子的质量数为m,则Wg A2-含有电子的物质的量为
A.(m-x-2)/m mol B.W(m-x)/m mol
C.W(m-x-2)/m mol D.W(m-x+2)/m mol
2.下列各项描述的判断正确的是
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家最近合成了一种新型的化合物S8 正确
C 红磷转化为白磷是物理变化 错误
D 石墨和金刚石是同素异形体 错误
A.A B.B C.C D.D
3.下列叙述错误的是
A.16O、18O属于同一种元素,它们互为同位素
B.D和T是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
4.铪具有低的中子吸收截面、优异的耐蚀性和加工性能,是核工业的重要原料,其中一种核素是,下列说法正确的是
A.的质量数为72 B.的核外电子数为72
C.的中子数为103 D.与互为同素异形体
5.1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
6.已知镓(Ga)有两种稳定的天然同位素,其一是,它在自然界中的原子百分比为60%。实验测得GaBr3的摩尔质量为309.8g/mol,则另外一种镓的同位素的原子符号为
A. B. C. D.
7.下列有关26Al和10Be的说法正确的是
A.10Be和9Be是中子数不同质子数相同的同种核素
B.10Be的质子数等于中子数
C.5.2g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数和核外电子数均不同,中子数相同
8.正确掌握化学用语是学好化学的基础.下列化学用语正确的是
A.质量数为37的氯原子:Cl
B.硫原子的结构示意图:
C.次氯酸钙的化学式:CaClO
D.HO、HO互为同位素
9.分类是学习和研究化学的一种常用的科学方法。下列分类合理的是( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③同位素:1H、2H、3H;干冰、液氯都是非电解质
④电解质:明矾、冰醋酸、纯碱;同素异形体:C60、金刚石、石墨
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
10.下列说法正确的是
A.碳元素的一种同位素14C可用于考古断代 B.H2、D2、T2互为同素异形体
C.C2H4、C3H6、C4H8一定互为同系物 D. 和 互为同分异构体
11.氧化氘(D2O)主要用于核反应堆的慢化剂和冷却剂。因为它比一般水重,所以又称之为“重水”。下列说法中错误的是
A.D2O的质量数是20 B.D2O与H2O中的质子数相等
C.H2和D2互为同位素 D.H2O与D2O的中子数之比为4:5
12.为延缓全球温室效应,二氧化碳捕获和封存技术已成为当今化学的前沿技术。下列捕获二氧化碳的化学反应中,其原子利用率没能达到100%的是
A.
B.
C.
D.nCO2+n
13.某元素的一种同位素原子,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是
A.(A-Z+2m)mol
B.(A+2m)mol
C.(A-Z+3m)mol
D.
14.下列物质互为同素异形体的是
A.14C和14N B.金刚石和石墨
C.H2O和H2O2 D.CO和CO2
15.根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
二、填空题
16.(I)根据取用药品的原则与方法,回答下列问题:
取用药品的基本原则是“安全、节约、防污染”。
①保证安全,严防中毒,严禁________、________、________任何化学药品。
②注意节约,如果没有说明用量,液体一般取__________,固体盖住试管底部。
③防止污染,实验后剩余的药品____________。
(II).下列各种不同粒子16O、1H、28Si、3H、O2、18O、29Si、O3、2H中:
(1)有_________________种不同的核素;
(2)有_________________种不同的元素;
(3)互为同位素的是_________________、_____________、_________________。
17.有下列几组物质,请将序号填入下列空格内:
A、CH2=CH-COOH和油酸(C17H33COOH) B、12C60和石墨 C、和 D、35Cl和37Cl E、乙醇和乙二醇
①互为同位素的是___________;
②互为同系物的是___________;
③互为同素异形体的是___________;
④互为同分异构体的是___________;
三、实验题
18.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素:_______(填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
①_______;
②_______;
③_______。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的_______作为发生装置,若用D装置来收集氨气,气体由_______端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的_______作为发生装置。
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
四、计算题
20.完成下列基本计算:
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的摩尔质量为________,此质量的NOx在标准状况下的体积约为________;
(2)19.2g Cu与足量稀硝酸反应时,转移电子总数是_____NA(NA表示阿伏加德罗常数);
(3)元素M的某种原子,其氯化物(MCl2)11.1g配成溶液后,需用1mol/L的AgNO3溶液200mL才能把氯离子完全沉淀下来。已知该原子中:质子数=中子数。
① 该原子M的质量数A为_____________。
② 写出该原子(核素)符号___________。
③ M元素在周期表中的位置是_______________。
21.用表示原子:
(1)中性原子的中子数N=___________。
(2)共有x个电子,则该阳离子的中子数N=___________。
(3)共有x个电子,则该阴离子的中子数N=___________。
参考答案:
1.D
【详解】质量数=质子数+中子数,A的质子数为m-x,则A2-的电子数m-x+2,质量数等于同位素的近似相对原子质量,则含有的电子的物质的量W×(m-x+2)/m mol,选项D正确。
2.C
【详解】A.由同种元素组成的物质不一定是纯净物,如O2和O3的混合物,A错误;
B.S8只由一种元素组成,为单质,B错误;
C.红磷和白磷是两种不同的物质,该变化有新物质生成,为化学变化,C正确;
D.石墨和金刚石均是由C元素组成的性质不同的单质,是同素异形体,D错误。
答案选C。
3.D
【详解】A.16O、18O为O元素的两种不同核素,属于同种元素,互为同位素,A正确;
B.D和T是氢元素的不同的核素,质子数均为1,B正确;
C.14C和14N的质量数相等均为14,14C的中子数为14-6=8,14N的中子数为14-7=7,二者中子数不同,C正确;
D.6Li的中子数为6-3=3,7Li的中子数为7-3=4,中子数不同,D错误;
综上所述答案为D。
4.B
【详解】A.的质量数为185,A说法错误;
B.的质子数为72,原子核内质子数等于核外电子数,则的核外电子数为72,B说法正确;
C.的中子数为185-72=113,C说法错误;
D.与互为同位素,而不是同素异形体,D说法错误;
答案为B。
5.A
【详解】A.化学离不开实验,也需要理论的指导,故A正确;
B.化学是一门以实验为基础的科学,化学不再需要实验是错误的,故B错误;
C.化学也需要理论研究,离不开理论的指导,故C错误;
D.化学无论何时,都需要实验来验证,故D错误;
故答案为A。
6.A
【详解】已知镓(Ga)有两种稳定的天然同位素,其一是,它在自然界中的原子百分比为60%,则另一种在自然界中的原子百分比为40%,GaBr3的摩尔质量为309.8g/mol,则镓元素的相对原子质量为309.8 80×3=69.8,令镓的另一种同位素为A,则:0.4A+0.6×69=69.8,解得A=71,故该同位素为,答案选A。
7.C
【详解】A.10Be和9Be的中子数不同,质子数相同,互为同位素,是铍元素的不同核素,A错误;
B.铍的质子数为4,10Be的中子数为10-4=6,质子数不等于中子数,B错误;
C.5.2g26Al3+的物质的量为0.2mol,每个铝离子含有10个电子,故5.2g26Al3+中所含的电子数约为1.2×1024,C正确;
D.26Al和26Mg的质子数分别为13、12,核外电子数分别为13、12,中子数分别为13、14,中子数不同,D错误。
答案选C。
8.A
【详解】A.氯原子质子数为17,氯原子符合左上角数字为质量数,即37的氯原子为Cl,A用语正确;
B.硫原子最外层有6个电子,为硫离子的结构示意图,B用语错误;
C.次氯酸根离子为-1价,则次氯酸钙的化学式:Ca(ClO)2,C用语错误;
D.同位素为质子数相同而中子数不同的核素,HO、HO为化合物,D用语错误;
答案为A。
9.A
【详解】①将酸分为一元酸、多元酸是根据酸分子在水溶液中电离出的H+个数,而不是酸分子中的H个数,如H3PO3(亚磷酸)为二元酸,①不合理;
②氧化还原反应与非氧化还原反应的区别为反应中是否有电子转移,②合理;
③同位素是质子数相同而中子数不同的原子的互称,1H、2H、3H是同位素,电解质和非电解质都是化合物,区别是在熔融状态或水溶液中是否导电,干冰是固态的二氧化碳,是分子晶体,是非电解质,液氯是单质,不是非电解质,③不合理;
④明矾、冰醋酸、纯碱都是电解质,同素异形体是同种元素的不同种单质,C60、金刚石、石墨是同素异形体,④合理;
⑤分散系根据分散质粒子大小分为溶液、胶体、浊液,⑤不合理;
综上所述,只有②④合理,故选A。
10.A
【详解】A.碳元素有多种同位素,其中14C可用于考古断代,选项A正确;
B.D2、T2、H2是同一物质,都是氢气,不符合同素异形体概念,仅仅是D2、T2组成中氢原子中中子数不同,选项B错误;
C.C2H4为乙烯,含有碳碳双键,而C3H6可能为丙烯或环丙烷, C4H8可能为丁烯或环丁烷,由于三者结构不一定相似,所以三者不一定为同系物,选项C错误;
D.甲烷为正四面体结构, 和 为同种物质,选项D错误;
答案选A。
11.C
【详解】A.D含有1个中子,所以质量数为1+1=2,则D2O的质量数是22+16=20,故A正确;
B.D2O与H2O中的质子数均为12+8=10,故B正确;
C.同位素是指同种元素的不同核素,H2和D2是不同氢原子形成的氢气分子,不是核素,故C错误;
D.H2O的中子数为8,D2O的中子数为12+8=10,数量比为8:10=4:5,故D正确;
综上所述答案为C。
12.C
【分析】化合反应、加聚反应中,反应物中的原子全部进入所需产物中,原子利用率为100%,据此分析解答。
【详解】A.该反应为化合反应,原子利用率为100%,A错误;
B.该反应为化合反应,原子利用率为100%,B错误;
C.该反应产物有两种,原子利用率小于100%,C正确;
D.该反应为加聚反应,原子利用率为100%,D错误;
故答案选C。
13.D
【详解】某元素的一种同位素X的原子质量数为A,含Z个质子,则中子数为(A-Z),则每个HmX分子含有中子数为(A-Z+2m),ag HmX的物质的量为a,故含有中子物质的量为,D满足题意。
答案选D。
14.B
【分析】由同种元素形成的不同种单质互为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质,由此分析。
【详解】A.14C 的质子数为6,中子数为8,14N 的质子数为7,中子数为7,14C和14N是质子数不同,中子数不同的不同种元素,不属于同素异形体,故A不符合题意;
B.金刚石和石墨都是碳元素组成的不同单质,属于同素异形体,故B符合题意;
C.H2O和H2O2都是相同元素组成的化合物,不是单质,不属于同素异形体,故C不符合题意;
D.CO和CO2都是相同元素组成的化合物,不是单质,不属于同素异形体,故D不符合题意;
答案选B。
15.C
【详解】A.C、N、O属于同周期元素,从左至右,非金属性依次增强,原子序数C<N<O,非金属性O>N>C,C、Si属于同主族元素,从上到下,非金属性依次减弱,原子序数C<Si ,非金属性C>Si,则非金属性O>N>Si,非金属性越强,氢化物越稳定,气态氢化物的稳定性H2O>NH3>SiH4,故A正确;
B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确;
C.利用最高价含氧酸的酸性比较非金属性强弱,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误;
D.118号元素的原子序数为118,质子数为118,核外电子数为118,其原子结构示意图为,它的原子结构中有7个电子层,最外层电子数为8,则第118号元素在周期表中位于第七周期0族,故D正确。
答案为C。
16. 手触 鼻闻 口尝 1~2 mL 一般不放回原瓶 7 3 2H、3H 1H 18O、16O 28Si、29Si
【详解】(I)①保证安全,严防中毒,严禁手触、鼻闻、 口尝任何化学药品;正确答案:手触、鼻闻、口尝。
②注意节约,如果没有说明用量,液体一般取1~2 mL固体盖住试管底部;正确答案:1~2 mL。
③防止污染,实验后剩余的药品一般不放回原瓶;正确答案:一般不放回原瓶。
(II). 16O质子数为8,中子数为8;1H质子数为1,中子数为0;29Si质子数为14,中子数为15;3H质子数为1,中子数为2;18O质子数为8,中子数为10;28Si质子数为14,中子数为14;2H质子数为1,中子数为1;故共有7种核素;3种元素; O2和O3都是由氧元素形成的不同单质,互为同素异形体; 16O和18O质子数相同,中子数不同,互为同位素; 29Si和28Si质子数相同,中子数不同,互为同位素; 2H、1H和3H质子数相同,中子数不同,互为同位素;
(1) 综上所述:核素研究的对象为原子,因此共有7种核素;正确答案:7。
(2) 综上所述:共有氢、氧、硅3种元素;正确答案:3。
(3)综上所述:互为同位素的是: 1H 、2H、3H , 18O、16O, 28Si、29Si;正确答案:1H 、2H、3H , 18O、16O, 28Si、29Si。
17. D A B C
【分析】质子数相同质量数(或中子数)不同的原子互称同位素;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
同种元素形成的不同单质互为同素异形体;
具有相同分子式而结构不同的化合物互为同分异构体。
【详解】①35Cl和37Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素,故答案为D;
②CH2=CH-COOH和油酸(C17H33COOH)结构相似、通式相同,相差15个CH2原子团,互为同系物,故答案为A;
③12C60和石墨是由碳元素组成的不同单质,互为同素异形体,故答案为B;
④分子式相同,结构不同,互为同分异构体,故答案为C。
18.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1) 46g/mol 4.48L
(2)0.6
(3) 40 40Ca 第四周期第ⅡA族
【详解】(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的物质的量是0.2mol,所以摩尔质量为9.2g÷0.2mol=46g/mol;此质量的NOx在标准状况下的体积约为0.2mol×22.4L/mol=4.48L;
(2)19.2g Cu的物质的量是19.2g÷64g/mol=0.3mol,与足量稀硝酸反应时生成硝酸铜,铜元素化合价从0价升高到+2价,转移电子总数是0.6NA;
(3)由可知,n (Cl-)=n(Ag+)=0.2L×1mol/L=0.2mol,所以MCl2的物质的量是0.1mol,则M(MCl2)=11.1g÷0.1mol=111g/mol,由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,则M=111-35.5×2=40,又因为质子数=中子数,所以Z=20,则M是Ca;
①该原子M的质量数A=40;②该原子(核素)符号为;③Ca元素在周期表中的位置是第四周期第ⅡA族。
21. A-Z A-x-n A-x+n
【详解】(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,又因为中子数+质子数=质量数,据此可知中性原子的中子数N=A-Z;
(2)中性原子的核外电子数=质子数,所以如果AXn+共有x个电子,则质子数=X+n,因此该阳离子的中子数N=A-x-n;
(3)同(2)分析可知,如果AXn-共有x个电子,则质子数=X-n,因此该阴离子的中子数N=A-x+n。
