河北省廊坊市文安县2022-2023学年高二下学期5月月考化学试题(含答案)
文档属性
| 名称 | 河北省廊坊市文安县2022-2023学年高二下学期5月月考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 324.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-15 22:52:40 | ||
图片预览


文档简介
文安县2022-2023学年高二下学期5月月考化学试题
一、选择题:本题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关。下列说法正确的是( )
A.用烧碱溶液除铁锈 B. BaCO3可用作钡餐
C.冬天应将面团置于温热处发酵 D.铝盐可用作生活用水消毒剂
2.常温下,某化学兴趣小组取1醋酸加水进行稀释,下列物理量逐渐增大的是( )
A. c(CH3COOH) B.
C. CH3COOH的电离常数 D.
3.二氧化硫的催化氧化是工业制硫酸的基础:
。下列叙述正确的是( )
A. 2molSO2和1molO2充分反应能放出196kJ的热量
B.工业上使用催化剂是通过加快反应速率提高生产效率的
C.实际工业选用的温度为400~500℃,其目的是为了提高SO2的平衡转化率
D.增大压强,正反应速率增大,逆反应速率减小
4.下列解释事实的化学用语正确的是( )
A.甲烷的燃烧热为:
B. Na2CO3溶液显碱性:
C.中和反应的反应热为
D.用FeS除去废水中的
5.下列说法正确的是( )
A.稀释0.1氨水,溶液中阳离子浓度一定减小
B.向0.1CH3COONa溶液中滴加少量浓盐酸,增大
C.向滴有酚酞的Na2CO3溶液中缓慢滴入BaCl2溶液至过量,溶液的红色褪去
D.常温下,由水电离出的的溶液中,可能大量存在
6.已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )。
A.第三周期VIII族,p区 B.第三周期VB族,d区
C.第四周期IB族,ds区 D.第四周期VB族,f区
7.类比或推理是重要的学习方法,下列类比或推理不合理的是( )
选项 已知 方法 结论
A 常温下,、 推理 NH4F溶液显酸性
B 铁制品在潮湿空气里易腐蚀 类比 铝制品在潮湿空气里也易腐蚀
C Al3+与在溶液中不能大量共存 推理 Al3+与在溶液中也不能大量共存
D 锅炉的内壁需安装若干锌块 类比 锅炉的内壁也可以安装若干镁合金
A.A B.B C.C D.D
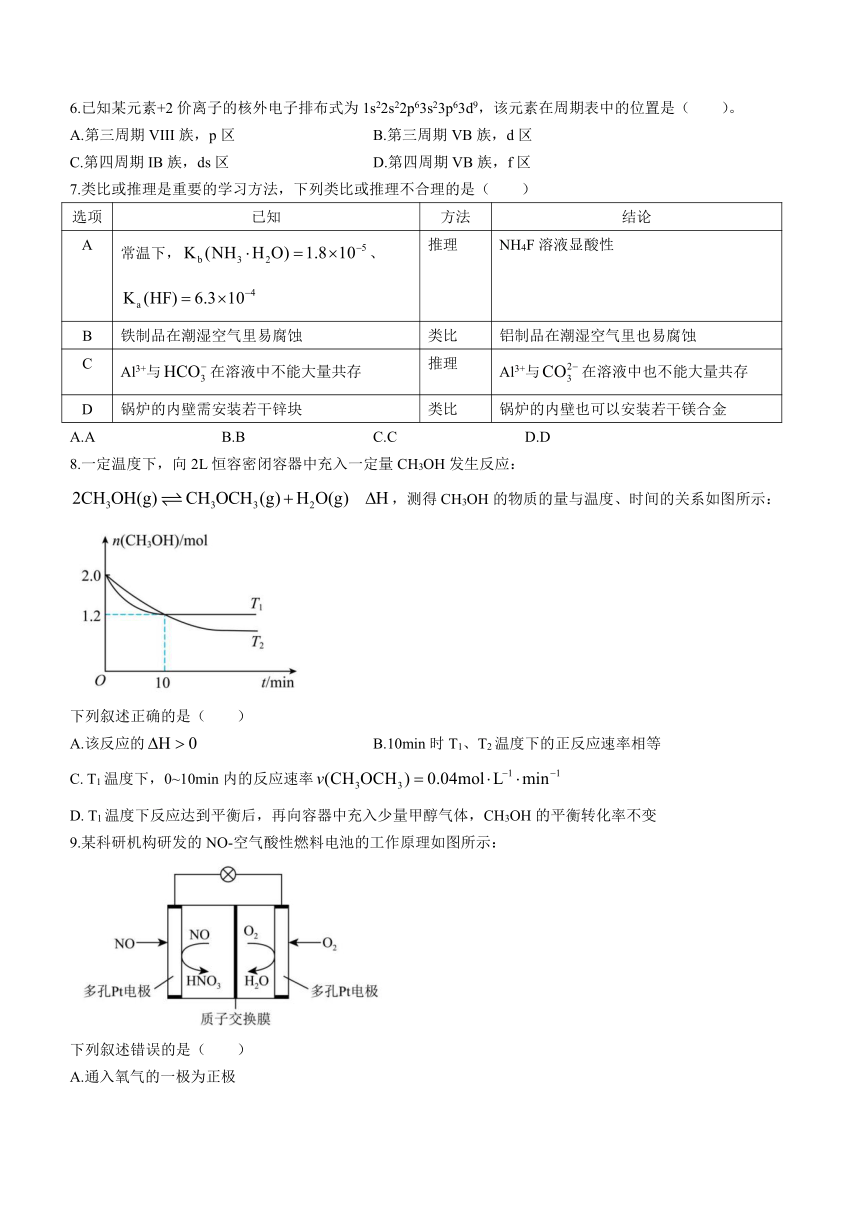
8.一定温度下,向2L恒容密闭容器中充入一定量CH3OH发生反应:
,测得CH3OH的物质的量与温度、时间的关系如图所示:
下列叙述正确的是( )
A.该反应的 B.10min时T1、T2温度下的正反应速率相等
C. T1温度下,0~10min内的反应速率
D. T1温度下反应达到平衡后,再向容器中充入少量甲醇气体,CH3OH的平衡转化率不变
9.某科研机构研发的NO-空气酸性燃料电池的工作原理如图所示:
下列叙述错误的是( )
A.通入氧气的一极为正极
B.负极的电极反应式为
C.若外电路中转移3mol电子,理论上左侧电极附近溶液增重30g
D.该装置在将化学能转化为电能的同时,还有利于环保并制硝酸
10.通过控制开关可使同一装置发生不同的化学反应。开关K置于a处时,两极均有气泡产生,U形管中的液面上升,一段时间后,再将开关K置于b处,可观察到两极的气体逐渐减少。
据此分析,下列说法正确的是( )
A.开关K置于a处时,铜电极与直流电源的正极相连
B.开关K置于a处时,产生气体的原因为
C.开关K置于b处时,阳离子通过阳离子交换膜移向石墨电极
D.开关K置于b处时,铜电极上的电极反应式为
11.某温度下,,。该温度下,下列结论正确的是( )
A.向AgCl的悬浊液中加少量KBr固体,溶液中和均增大
B. Ag2CrO4的饱和溶液比AgCl的饱和溶液中Ag+浓度大
C.向浓度均为0.1的NaCl和Na2CrO4溶液中分别逐滴加入等浓度的AgNO3溶液,Ag2CrO4先沉淀
D.向浓度均为0.1的NaCl和Na2CrO4的混合溶液中加入AgNO3溶液,当沉淀完全后,溶液中
12.下列Li原子的轨道表示式表示的状态中,能量最低的是( )。
A. B.
C. D.
13.某原子的核外电子排布式为1s22s22p3,下列说法正确的是( )。
A.该原子的轨道表示式为
B.该原子核外有3种能量不同的电子
C.该原子核外最外层电子占据3个原子轨道
D.该原子核外最外层上有3种运动状态不同的电子
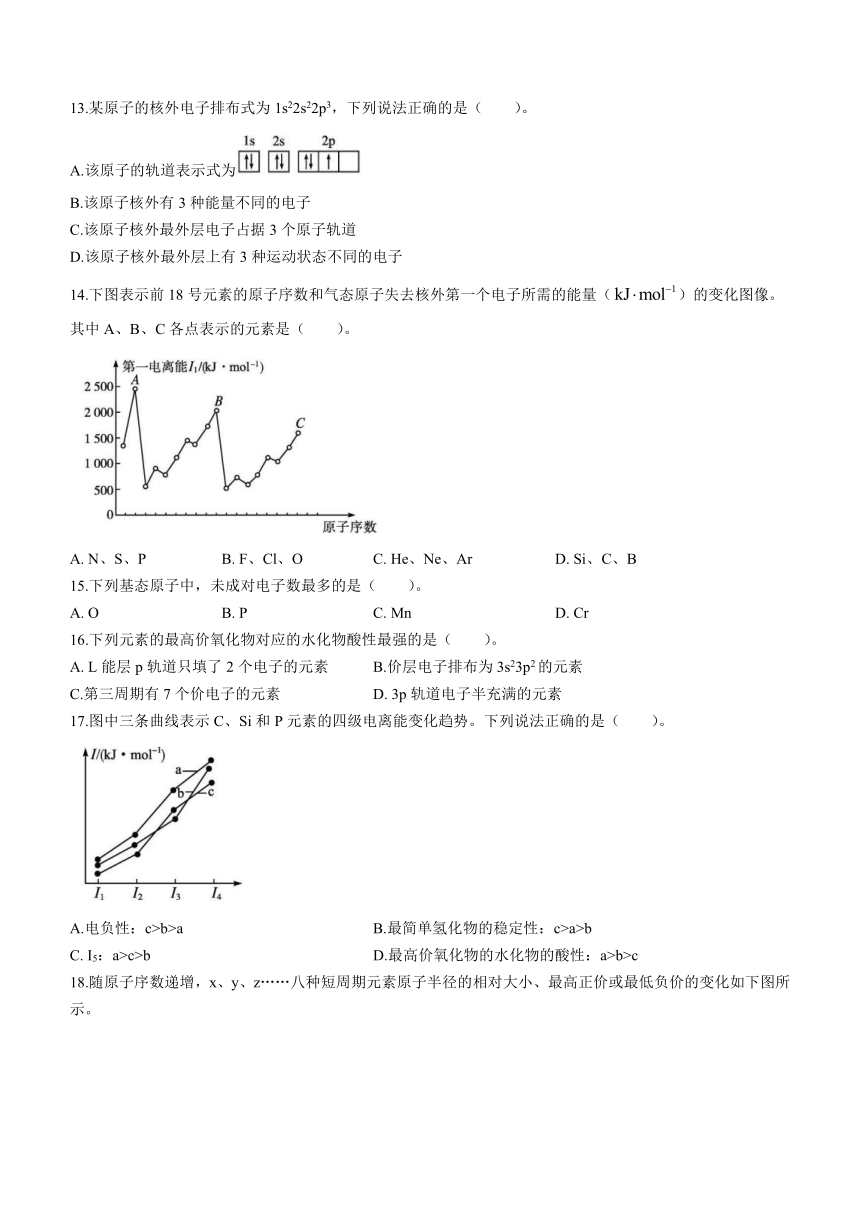
14.下图表示前18号元素的原子序数和气态原子失去核外第一个电子所需的能量()的变化图像。其中A、B、C各点表示的元素是( )。
A. N、S、P B. F、Cl、O C. He、Ne、Ar D. Si、C、B
15.下列基态原子中,未成对电子数最多的是( )。
A. O B. P C. Mn D. Cr
16.下列元素的最高价氧化物对应的水化物酸性最强的是( )。
A. L能层p轨道只填了2个电子的元素 B.价层电子排布为3s23p2的元素
C.第三周期有7个价电子的元素 D. 3p轨道电子半充满的元素
17.图中三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )。
A.电负性:c>b>a B.最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D.最高价氧化物的水化物的酸性:a>b>c
18.随原子序数递增,x、y、z……八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。
下列说法正确的是( )。
A. x元素在周期表中的位置是第二周期第IA族 B.离子半径:
C.最高价氧化物对应水化物的酸性:y>z D.气态氢化物的热稳定性:g>h
19.X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y基态原子s能级和p能级的电子数相等,下列说法正确的是( )。
A.在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
B.Z元素的氧化物对应的水化物一定是一种强酸
C.三种元素原子半径的大小顺序:X>Y>Z
D. X、Y元素原子的电负性Y>X,Y、Z元素原子的第一电离能YZ
20. X、Y、Z、W是四种短周期主族元素,在周期表中的相对位置如图,已知Z的单质可用作半导体材料,则以下说法中正确的是( )。
X Y
Z W
A. X原子的半径小于Y原子的半径 B.第一电离能X<Y
C. Z的氧化物是生产玻璃的原料之一 D. W单质的水溶液久置不会变质
二、非选择题:本题共3小题,共40分
21.(12分)某小组以含镍废料(主要含Ni、NiO,以及少量CuO、MgO、SiO2)为原料提取镍的流程如图所示:
请回答下列问题:
(1)固体2的主要成分为 (填化学式)。
(2)在“除镁”阶段,若溶液的pH太小,会显著增加NH4F的用量,其原因为 (结合勒夏特列原理解释)。
(3)NiOOH可用于镍氢电池的正极材料。某碱性镍氢电池的总反应为,该电池充电时,阳极的电极反应式为 。
(4)可利用三室双膜法进行“电沉积”制镍,其原理如下:
①“电沉积”时阳极的电极反应式为 。
②可以通过电解法提纯粗镍,粗镍作 (填“阳”或“阴”)极,阴极的电极反应式为 。
22.(12分)下列是元素周期表中的部分元素,请回答下列有关问题:
周期 族
IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
4 ⑩
(1)①元素的价层电子排布式 ,⑦元素基态原子的价层电子轨道表示式为 。
(2)上述表中的元素中,电负性最小的元素是 (填元素符号,下同),第三周期第一电离能最大的元素是 。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同),碱性最强的是 。
23.(16分)A~G是周期表中1~36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下:
A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的元素;D的基态原子2p能级上的未成对电子数与B原子相同;与E2+具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。
(1)A的元素符号为 ,基态G原子的电子排布式为 ,与G同周期的所有元素的基态原子中最外层电子数与G原子相同的元素有 (填元素符号)。
(2)B、C、D三种元素第一电离能从大到小的顺序是 ,三种元素的电负性大小顺序为 (填元素符号)。
(3)已知元素的电负性C>F,则C元素与F元素形成的化合物CF3中C的化合价为 价,CF3与水发生水解反应的化学方程式为 。
(4)E与C元素形成的化合物的化学式为 。
高二答案
1-5CBBDC 6-10CBDCC
11-15BDBCD 16-20CCBAC
21、(12分)
(1)CuS
(2)若溶液的pH太小,增大,平衡正向移动,溶液中减小,为使MgF2的溶解平衡逆向移动,NH4F用量更多
(3)
(4)①. ②.阳 ③.
22、(12分)
(1)2s22p3
(2)F Cl
(3)HClO4 KOH
23、(16分)
(1)H 1s22s22p63s23p63d54s1 K、Cu
(2)N>O>C O>N>C
(3)
(4)Mg3N2
一、选择题:本题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关。下列说法正确的是( )
A.用烧碱溶液除铁锈 B. BaCO3可用作钡餐
C.冬天应将面团置于温热处发酵 D.铝盐可用作生活用水消毒剂
2.常温下,某化学兴趣小组取1醋酸加水进行稀释,下列物理量逐渐增大的是( )
A. c(CH3COOH) B.
C. CH3COOH的电离常数 D.
3.二氧化硫的催化氧化是工业制硫酸的基础:
。下列叙述正确的是( )
A. 2molSO2和1molO2充分反应能放出196kJ的热量
B.工业上使用催化剂是通过加快反应速率提高生产效率的
C.实际工业选用的温度为400~500℃,其目的是为了提高SO2的平衡转化率
D.增大压强,正反应速率增大,逆反应速率减小
4.下列解释事实的化学用语正确的是( )
A.甲烷的燃烧热为:
B. Na2CO3溶液显碱性:
C.中和反应的反应热为
D.用FeS除去废水中的
5.下列说法正确的是( )
A.稀释0.1氨水,溶液中阳离子浓度一定减小
B.向0.1CH3COONa溶液中滴加少量浓盐酸,增大
C.向滴有酚酞的Na2CO3溶液中缓慢滴入BaCl2溶液至过量,溶液的红色褪去
D.常温下,由水电离出的的溶液中,可能大量存在
6.已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )。
A.第三周期VIII族,p区 B.第三周期VB族,d区
C.第四周期IB族,ds区 D.第四周期VB族,f区
7.类比或推理是重要的学习方法,下列类比或推理不合理的是( )
选项 已知 方法 结论
A 常温下,、 推理 NH4F溶液显酸性
B 铁制品在潮湿空气里易腐蚀 类比 铝制品在潮湿空气里也易腐蚀
C Al3+与在溶液中不能大量共存 推理 Al3+与在溶液中也不能大量共存
D 锅炉的内壁需安装若干锌块 类比 锅炉的内壁也可以安装若干镁合金
A.A B.B C.C D.D
8.一定温度下,向2L恒容密闭容器中充入一定量CH3OH发生反应:
,测得CH3OH的物质的量与温度、时间的关系如图所示:
下列叙述正确的是( )
A.该反应的 B.10min时T1、T2温度下的正反应速率相等
C. T1温度下,0~10min内的反应速率
D. T1温度下反应达到平衡后,再向容器中充入少量甲醇气体,CH3OH的平衡转化率不变
9.某科研机构研发的NO-空气酸性燃料电池的工作原理如图所示:
下列叙述错误的是( )
A.通入氧气的一极为正极
B.负极的电极反应式为
C.若外电路中转移3mol电子,理论上左侧电极附近溶液增重30g
D.该装置在将化学能转化为电能的同时,还有利于环保并制硝酸
10.通过控制开关可使同一装置发生不同的化学反应。开关K置于a处时,两极均有气泡产生,U形管中的液面上升,一段时间后,再将开关K置于b处,可观察到两极的气体逐渐减少。
据此分析,下列说法正确的是( )
A.开关K置于a处时,铜电极与直流电源的正极相连
B.开关K置于a处时,产生气体的原因为
C.开关K置于b处时,阳离子通过阳离子交换膜移向石墨电极
D.开关K置于b处时,铜电极上的电极反应式为
11.某温度下,,。该温度下,下列结论正确的是( )
A.向AgCl的悬浊液中加少量KBr固体,溶液中和均增大
B. Ag2CrO4的饱和溶液比AgCl的饱和溶液中Ag+浓度大
C.向浓度均为0.1的NaCl和Na2CrO4溶液中分别逐滴加入等浓度的AgNO3溶液,Ag2CrO4先沉淀
D.向浓度均为0.1的NaCl和Na2CrO4的混合溶液中加入AgNO3溶液,当沉淀完全后,溶液中
12.下列Li原子的轨道表示式表示的状态中,能量最低的是( )。
A. B.
C. D.
13.某原子的核外电子排布式为1s22s22p3,下列说法正确的是( )。
A.该原子的轨道表示式为
B.该原子核外有3种能量不同的电子
C.该原子核外最外层电子占据3个原子轨道
D.该原子核外最外层上有3种运动状态不同的电子
14.下图表示前18号元素的原子序数和气态原子失去核外第一个电子所需的能量()的变化图像。其中A、B、C各点表示的元素是( )。
A. N、S、P B. F、Cl、O C. He、Ne、Ar D. Si、C、B
15.下列基态原子中,未成对电子数最多的是( )。
A. O B. P C. Mn D. Cr
16.下列元素的最高价氧化物对应的水化物酸性最强的是( )。
A. L能层p轨道只填了2个电子的元素 B.价层电子排布为3s23p2的元素
C.第三周期有7个价电子的元素 D. 3p轨道电子半充满的元素
17.图中三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )。
A.电负性:c>b>a B.最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D.最高价氧化物的水化物的酸性:a>b>c
18.随原子序数递增,x、y、z……八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。
下列说法正确的是( )。
A. x元素在周期表中的位置是第二周期第IA族 B.离子半径:
C.最高价氧化物对应水化物的酸性:y>z D.气态氢化物的热稳定性:g>h
19.X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y基态原子s能级和p能级的电子数相等,下列说法正确的是( )。
A.在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
B.Z元素的氧化物对应的水化物一定是一种强酸
C.三种元素原子半径的大小顺序:X>Y>Z
D. X、Y元素原子的电负性Y>X,Y、Z元素原子的第一电离能YZ
20. X、Y、Z、W是四种短周期主族元素,在周期表中的相对位置如图,已知Z的单质可用作半导体材料,则以下说法中正确的是( )。
X Y
Z W
A. X原子的半径小于Y原子的半径 B.第一电离能X<Y
C. Z的氧化物是生产玻璃的原料之一 D. W单质的水溶液久置不会变质
二、非选择题:本题共3小题,共40分
21.(12分)某小组以含镍废料(主要含Ni、NiO,以及少量CuO、MgO、SiO2)为原料提取镍的流程如图所示:
请回答下列问题:
(1)固体2的主要成分为 (填化学式)。
(2)在“除镁”阶段,若溶液的pH太小,会显著增加NH4F的用量,其原因为 (结合勒夏特列原理解释)。
(3)NiOOH可用于镍氢电池的正极材料。某碱性镍氢电池的总反应为,该电池充电时,阳极的电极反应式为 。
(4)可利用三室双膜法进行“电沉积”制镍,其原理如下:
①“电沉积”时阳极的电极反应式为 。
②可以通过电解法提纯粗镍,粗镍作 (填“阳”或“阴”)极,阴极的电极反应式为 。
22.(12分)下列是元素周期表中的部分元素,请回答下列有关问题:
周期 族
IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
4 ⑩
(1)①元素的价层电子排布式 ,⑦元素基态原子的价层电子轨道表示式为 。
(2)上述表中的元素中,电负性最小的元素是 (填元素符号,下同),第三周期第一电离能最大的元素是 。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是 (填化学式,下同),碱性最强的是 。
23.(16分)A~G是周期表中1~36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下:
A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的元素;D的基态原子2p能级上的未成对电子数与B原子相同;与E2+具有相同的稳定的电子层结构;F元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;G元素的基态原子在前四周期中未成对电子数最多。
(1)A的元素符号为 ,基态G原子的电子排布式为 ,与G同周期的所有元素的基态原子中最外层电子数与G原子相同的元素有 (填元素符号)。
(2)B、C、D三种元素第一电离能从大到小的顺序是 ,三种元素的电负性大小顺序为 (填元素符号)。
(3)已知元素的电负性C>F,则C元素与F元素形成的化合物CF3中C的化合价为 价,CF3与水发生水解反应的化学方程式为 。
(4)E与C元素形成的化合物的化学式为 。
高二答案
1-5CBBDC 6-10CBDCC
11-15BDBCD 16-20CCBAC
21、(12分)
(1)CuS
(2)若溶液的pH太小,增大,平衡正向移动,溶液中减小,为使MgF2的溶解平衡逆向移动,NH4F用量更多
(3)
(4)①. ②.阳 ③.
22、(12分)
(1)2s22p3
(2)F Cl
(3)HClO4 KOH
23、(16分)
(1)H 1s22s22p63s23p63d54s1 K、Cu
(2)N>O>C O>N>C
(3)
(4)Mg3N2
同课章节目录
