北京市北师二附2022-2023学年高二下学期6月月考化学试题(含答案)
文档属性
| 名称 | 北京市北师二附2022-2023学年高二下学期6月月考化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 736.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-16 10:25:23 | ||
图片预览



文档简介
北师二附2022-2023学年高二下学期6月月考
化学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Si 28
第一部分(42分)
本部分共14题,每题3分,共42分。每题只有1个选项正确。
1.下列2022年北京冬奥会所用材料的成分属于有机物的是
A.火炬燃料——氢气 B.场馆制冷剂——二氧化碳
C.保暖围巾——石墨烯 D.短道速滑服——聚酯
2.下列化学用语或图示表达正确的是
A.2-丁烯的反式结构: B.聚丙烯的结构简式:
C.的VSEPR模型: D.基态N原子的轨道表示式:
3.下列说法正确的是
A.的名称为2-乙基丙烷 B.聚氯乙烯可使溴的四氯化碳溶液褪色
C.和互为同系物 D.沸点:
4.下列各组混合物能用右图方法分离的是
A.苯和甲苯 B.乙酸和乙醇 C.1-溴丁烷和水 D.甘油(丙三醇)和水
5.元素周期表中铬元素的数据见右图。下列说法中,不正确的是
A.铬元素位于第四周期ⅥB族 B.铬原子的价层电子排布式是
C.铬原子第3能层有5个未成对电子 D.Cr的第一电离能小于K的第一电离能
6.下列事实不能用有机化合物分子中基团间的相互作用解释的是
A.水与金属钠的反应速率比乙醇与金属钠的反应速率快
B.苯在50~60℃时发生硝化反应而甲苯在30℃时即可反应生成TNT
C.甲苯能使酸性溶液褪色而甲烷不能
D.乙烯能发生加成反应而乙烷不能
7.冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。18-冠-6能与形成稳定作用(如图),但不与或形成稳定作用。下列说法不正确的是
A.18-冠-6能与形成稳定作用,反映了超分子的“分子识别”的特征
B.18-冠-6中O原子与间存在离子键
C.18-冠-6中C和O的杂化轨道类型相同
D.利用该原理可以用冠醚将从水层带入甲苯中,促进与甲苯的反应
8.下列实验操作正确的是
A.检验某溶液中是否含有乙醛:在盛有2mL 10%硫酸铜溶液的试管中滴加10%氢氧化钠溶液6滴,混合均匀,滴入待检液,加热
B.实验室制乙酸乙酯加试剂顺序:先加入浓硫酸,再加乙醇,最后加入乙酸
C.配制少量银氨溶液:向盛有1毫升2%的稀氨水中逐滴加入2%硝酸银溶液边滴边振荡至最初产生的沉淀刚好消失为止
D.提取水中的碘:加入振荡、静置、分层后取出有机层,再分离出碘
9.阿托品是用于散瞳的药物,结构如图所示。它不可能具有的性质是
A.极易溶解于水 B.可与金属钠反应生成氢气
C.可在浓硫酸催化下发生消去反应 D.一定条件下可发生水解反应
10.某有机物甲经氧化后得乙(分子式为),而甲经水解可得丙。1mol丙和2mol乙反应得一种含氯的酯()。由此推断甲的结构简式为
A. B.
C. D.
11.下表中的实验操作不能达到实验目的的是
选项 实验目的 实验操作
A 鉴别苯和甲苯 分别加入酸性高锰钾酸性溶液,观察颜色变化
B 检验溴乙烷中的溴元素 将溴乙烷与NaOH溶液混合加热,静置,待溶液分层后,取上层清液用稀硝酸酸化,再加入溶液
C 分离甲醇(沸点65℃、)正丙醇(沸点97℃)、正戊醇(沸点138℃) 将混合溶液放入蒸馏烧瓶进行加热,分别收集相应的馏分
D 检验溴乙烷发生消去反应的产物乙烯 将消去反应后的气体产物通入酸性溶液中
12.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下图所示。下列说法正确的是
A.氟化钙的化学式为CaF B.每个晶胞中含有14个
C.氟化钙中只含有离子键 D.每个周围距离最近且等距的F有4个
13.高分子M和N的合成路线如下:
下列说法不正确的是
A.马来酸脱水生成A的反应为酯化反应 B.试剂B为
C.反应①为加聚反应,反应②为缩聚反应 D.物质N难溶解于水
14.采用下图装置制备乙烯并研究乙烯与一定浓度的溴水的反应。实验观察到溴水褪色,得到无色透明的溶液。进一步分析发现反应产物主要为,含少量。下列说法不正确的是
A.实验室制乙烯的方程式:
B.除杂试剂A为NaOH溶液
C.乙烯与溴水反应后的溶液近乎中性
D.与之间存在氢键
第二部分(58分)
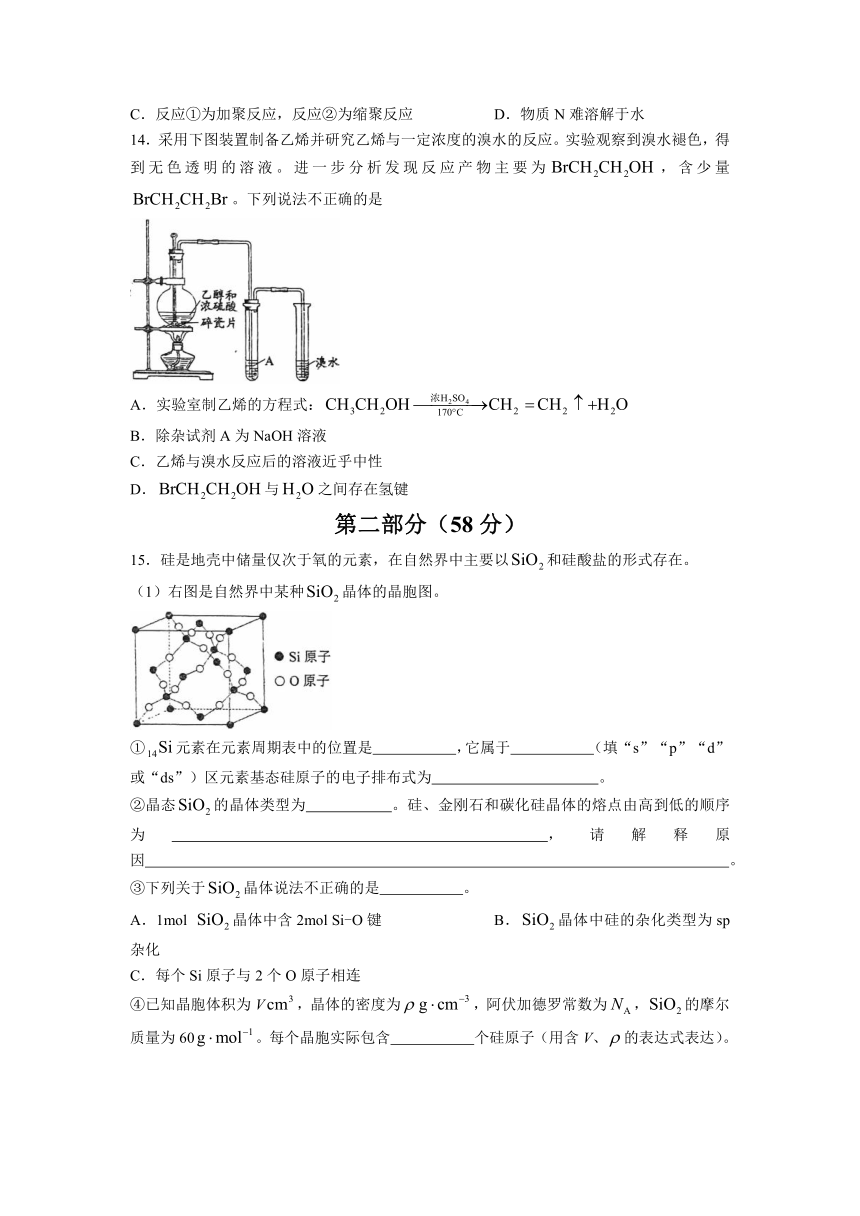
15.硅是地壳中储量仅次于氧的元素,在自然界中主要以和硅酸盐的形式存在。
(1)右图是自然界中某种晶体的晶胞图。
①元素在元素周期表中的位置是 ,它属于 (填“s”“p”“d”或“ds”)区元素基态硅原子的电子排布式为 。
②晶态的晶体类型为 。硅、金刚石和碳化硅晶体的熔点由高到低的顺序为 ,请解释原因 。
③下列关于晶体说法不正确的是 。
A.1mol 晶体中含2mol Si-O键 B.晶体中硅的杂化类型为sp杂化
C.每个Si原子与2个O原子相连
④已知晶胞体积为V,晶体的密度为,阿伏加德罗常数为,的摩尔质量为60。每个晶胞实际包含 个硅原子(用含V、的表达式表达)。
(2)硅元素最高价氧化物对应的水化物为原硅酸()。已知:原硅酸()可溶于水。原硅酸的羟基可以发生分子间脱水逐渐转化为硅酸、硅胶。
①原硅酸钠()溶液吸收空气中的会生成,结合元素周期律解释原因:
。
②从结构的角度解释脱水后溶解度降低的原因: 。
16.布洛芬具有良好的解热镇痛功效,一种缓释布洛芬M的合成路线如下:
已知:
(1)A能够发生银镜反应,写出A与银氨溶液反应的化学方程式 。
(2)下列有关B的说法正确的有 (填字母)。
a.存在顺反异构
b.与A互为同系物
c.B既可以发生氧化反应,也可以发生还原反应
(3)C→D的化学方程式是 。
(4)F是制备布洛芬的重要中间体。
①F的结构简式为 。
②获得F的操作如下:异丁基苯与乙酸酐取代反应完全后,将混合物倾入适量冰水中静置,通过 (填操作名称,下同)分出油层,油层经水洗干燥后,再经 可得到无色液体F。
(5)布洛芬的结构简式为 。
(6)将布洛芬嫁接到高分子基体E上,可制得缓释药物M。M在人体中可以水解缓慢释放出布洛芬;若1mol M完全水解,消耗水的物质的量为 mol。
17.奥昔布宁是具有解痉和抗胆碱作用的药物,其合成路线如下:
已知:
ⅰ.
ⅱ.
(1)A是芳香族化合物,A分子中含氧官能团是 。
(2)B不能使溴水褪色,写出B→C的化学方程式 。
(3)E的结构简式是 ,试剂a为 。
(4)G的结构简式为 。
(5)K→M的反应类型为 。
(6)写出M→L的化学方程式 。
(7)已知:奥昔布宁+N。请写出N物质的名称 。
(8)J可以用为原料,经过下列途径制得。
请设计由到X的合成路线。
北师二附2022-2023学年高二下学期6月月考
化学参考答案
第一部分(42分)
本部分共14题,每题3分,共42分。每题只有1个选项正确。
题号 1 2 3 4 5 6 7
参考答案 D C D C D D B
题号 8 9 10 11 12 13 14
参考答案 D A A D C A C
第二部分(58分)
15.
(1)①第三周期,第ⅣA族 p区元素
②共价晶体。
金刚石>碳化硅>硅
它们都是共价晶体,原子之间通过共价键相连接,原子半径:r(Si)>r(C)故三种晶体中共价键键长的大小比较;Si-C>C>Si>C-C,共价键键能大小的比较:Si-Si<C<Si-C-C,故它们熔点的排序为:金刚石>碳化硅>硅。
③ABC
④
(2)①C和Si同主族,非金属性C>S,空气中的溶于水形成,最高价氧化物对应水化物的酸性,故可与反应制
②原硅酸脱水后,羟基相对数量减少,与水形成氢键的数目减少,同时可能发生交联形成空间网状结构。
16.
(1)
(2)c
(3)
(4)① ②分液 蒸馏
(5)
(6)2n
17.
(1)羟基
(2)
(3),(甲醇)
(4)
(5)加成反应
(6)
(7)乙酸甲酯
(8)
化学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Si 28
第一部分(42分)
本部分共14题,每题3分,共42分。每题只有1个选项正确。
1.下列2022年北京冬奥会所用材料的成分属于有机物的是
A.火炬燃料——氢气 B.场馆制冷剂——二氧化碳
C.保暖围巾——石墨烯 D.短道速滑服——聚酯
2.下列化学用语或图示表达正确的是
A.2-丁烯的反式结构: B.聚丙烯的结构简式:
C.的VSEPR模型: D.基态N原子的轨道表示式:
3.下列说法正确的是
A.的名称为2-乙基丙烷 B.聚氯乙烯可使溴的四氯化碳溶液褪色
C.和互为同系物 D.沸点:
4.下列各组混合物能用右图方法分离的是
A.苯和甲苯 B.乙酸和乙醇 C.1-溴丁烷和水 D.甘油(丙三醇)和水
5.元素周期表中铬元素的数据见右图。下列说法中,不正确的是
A.铬元素位于第四周期ⅥB族 B.铬原子的价层电子排布式是
C.铬原子第3能层有5个未成对电子 D.Cr的第一电离能小于K的第一电离能
6.下列事实不能用有机化合物分子中基团间的相互作用解释的是
A.水与金属钠的反应速率比乙醇与金属钠的反应速率快
B.苯在50~60℃时发生硝化反应而甲苯在30℃时即可反应生成TNT
C.甲苯能使酸性溶液褪色而甲烷不能
D.乙烯能发生加成反应而乙烷不能
7.冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。18-冠-6能与形成稳定作用(如图),但不与或形成稳定作用。下列说法不正确的是
A.18-冠-6能与形成稳定作用,反映了超分子的“分子识别”的特征
B.18-冠-6中O原子与间存在离子键
C.18-冠-6中C和O的杂化轨道类型相同
D.利用该原理可以用冠醚将从水层带入甲苯中,促进与甲苯的反应
8.下列实验操作正确的是
A.检验某溶液中是否含有乙醛:在盛有2mL 10%硫酸铜溶液的试管中滴加10%氢氧化钠溶液6滴,混合均匀,滴入待检液,加热
B.实验室制乙酸乙酯加试剂顺序:先加入浓硫酸,再加乙醇,最后加入乙酸
C.配制少量银氨溶液:向盛有1毫升2%的稀氨水中逐滴加入2%硝酸银溶液边滴边振荡至最初产生的沉淀刚好消失为止
D.提取水中的碘:加入振荡、静置、分层后取出有机层,再分离出碘
9.阿托品是用于散瞳的药物,结构如图所示。它不可能具有的性质是
A.极易溶解于水 B.可与金属钠反应生成氢气
C.可在浓硫酸催化下发生消去反应 D.一定条件下可发生水解反应
10.某有机物甲经氧化后得乙(分子式为),而甲经水解可得丙。1mol丙和2mol乙反应得一种含氯的酯()。由此推断甲的结构简式为
A. B.
C. D.
11.下表中的实验操作不能达到实验目的的是
选项 实验目的 实验操作
A 鉴别苯和甲苯 分别加入酸性高锰钾酸性溶液,观察颜色变化
B 检验溴乙烷中的溴元素 将溴乙烷与NaOH溶液混合加热,静置,待溶液分层后,取上层清液用稀硝酸酸化,再加入溶液
C 分离甲醇(沸点65℃、)正丙醇(沸点97℃)、正戊醇(沸点138℃) 将混合溶液放入蒸馏烧瓶进行加热,分别收集相应的馏分
D 检验溴乙烷发生消去反应的产物乙烯 将消去反应后的气体产物通入酸性溶液中
12.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下图所示。下列说法正确的是
A.氟化钙的化学式为CaF B.每个晶胞中含有14个
C.氟化钙中只含有离子键 D.每个周围距离最近且等距的F有4个
13.高分子M和N的合成路线如下:
下列说法不正确的是
A.马来酸脱水生成A的反应为酯化反应 B.试剂B为
C.反应①为加聚反应,反应②为缩聚反应 D.物质N难溶解于水
14.采用下图装置制备乙烯并研究乙烯与一定浓度的溴水的反应。实验观察到溴水褪色,得到无色透明的溶液。进一步分析发现反应产物主要为,含少量。下列说法不正确的是
A.实验室制乙烯的方程式:
B.除杂试剂A为NaOH溶液
C.乙烯与溴水反应后的溶液近乎中性
D.与之间存在氢键
第二部分(58分)
15.硅是地壳中储量仅次于氧的元素,在自然界中主要以和硅酸盐的形式存在。
(1)右图是自然界中某种晶体的晶胞图。
①元素在元素周期表中的位置是 ,它属于 (填“s”“p”“d”或“ds”)区元素基态硅原子的电子排布式为 。
②晶态的晶体类型为 。硅、金刚石和碳化硅晶体的熔点由高到低的顺序为 ,请解释原因 。
③下列关于晶体说法不正确的是 。
A.1mol 晶体中含2mol Si-O键 B.晶体中硅的杂化类型为sp杂化
C.每个Si原子与2个O原子相连
④已知晶胞体积为V,晶体的密度为,阿伏加德罗常数为,的摩尔质量为60。每个晶胞实际包含 个硅原子(用含V、的表达式表达)。
(2)硅元素最高价氧化物对应的水化物为原硅酸()。已知:原硅酸()可溶于水。原硅酸的羟基可以发生分子间脱水逐渐转化为硅酸、硅胶。
①原硅酸钠()溶液吸收空气中的会生成,结合元素周期律解释原因:
。
②从结构的角度解释脱水后溶解度降低的原因: 。
16.布洛芬具有良好的解热镇痛功效,一种缓释布洛芬M的合成路线如下:
已知:
(1)A能够发生银镜反应,写出A与银氨溶液反应的化学方程式 。
(2)下列有关B的说法正确的有 (填字母)。
a.存在顺反异构
b.与A互为同系物
c.B既可以发生氧化反应,也可以发生还原反应
(3)C→D的化学方程式是 。
(4)F是制备布洛芬的重要中间体。
①F的结构简式为 。
②获得F的操作如下:异丁基苯与乙酸酐取代反应完全后,将混合物倾入适量冰水中静置,通过 (填操作名称,下同)分出油层,油层经水洗干燥后,再经 可得到无色液体F。
(5)布洛芬的结构简式为 。
(6)将布洛芬嫁接到高分子基体E上,可制得缓释药物M。M在人体中可以水解缓慢释放出布洛芬;若1mol M完全水解,消耗水的物质的量为 mol。
17.奥昔布宁是具有解痉和抗胆碱作用的药物,其合成路线如下:
已知:
ⅰ.
ⅱ.
(1)A是芳香族化合物,A分子中含氧官能团是 。
(2)B不能使溴水褪色,写出B→C的化学方程式 。
(3)E的结构简式是 ,试剂a为 。
(4)G的结构简式为 。
(5)K→M的反应类型为 。
(6)写出M→L的化学方程式 。
(7)已知:奥昔布宁+N。请写出N物质的名称 。
(8)J可以用为原料,经过下列途径制得。
请设计由到X的合成路线。
北师二附2022-2023学年高二下学期6月月考
化学参考答案
第一部分(42分)
本部分共14题,每题3分,共42分。每题只有1个选项正确。
题号 1 2 3 4 5 6 7
参考答案 D C D C D D B
题号 8 9 10 11 12 13 14
参考答案 D A A D C A C
第二部分(58分)
15.
(1)①第三周期,第ⅣA族 p区元素
②共价晶体。
金刚石>碳化硅>硅
它们都是共价晶体,原子之间通过共价键相连接,原子半径:r(Si)>r(C)故三种晶体中共价键键长的大小比较;Si-C>C>Si>C-C,共价键键能大小的比较:Si-Si<C<Si-C-C,故它们熔点的排序为:金刚石>碳化硅>硅。
③ABC
④
(2)①C和Si同主族,非金属性C>S,空气中的溶于水形成,最高价氧化物对应水化物的酸性,故可与反应制
②原硅酸脱水后,羟基相对数量减少,与水形成氢键的数目减少,同时可能发生交联形成空间网状结构。
16.
(1)
(2)c
(3)
(4)① ②分液 蒸馏
(5)
(6)2n
17.
(1)羟基
(2)
(3),(甲醇)
(4)
(5)加成反应
(6)
(7)乙酸甲酯
(8)
同课章节目录
