5.3无机非金属材料同步练习题高一下学期化学人教版(2019)必修第二册(含解析)
文档属性
| 名称 | 5.3无机非金属材料同步练习题高一下学期化学人教版(2019)必修第二册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 478.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-17 21:04:41 | ||
图片预览




文档简介
5.3无机非金属材料同步练习题
一、单选题
1.我国改革开放以来取得了很多世界瞩目的科技成果。下列有关说法正确的是
选项 A B C D
科技成果 “蛟龙号”潜水器探取到的多金属结核 样品中的主要成分 有锰、铜等 港珠澳大桥斜拉桥锚具材料采用的低 合金钢 国产大飞机C919用到的氮化硅陶瓷 中国天眼传输信息用的光纤材料
相关说法 这些金属元素均属于主族元素 具有强度大、密度小、耐腐蚀性高等 性能 属于新型有机材料 主要成分是单晶硅
A.A B.B C.C D.D
2.用下列装置完成相关实验,合理的是
A.图①:验证H2CO3酸性强于H2SiO3 B.图④:分离CH3CH2OH与CH3COOC2H5
C.图③:分离Na2CO3溶液与CH3COOC2H5 D.图②:收集CO2或NH3
3.化学与生活、生产密切相关,下列有关说法错误的是( )
A.高纯单质硅用于制光电池 B.酸雨是指pH<5.6的雨水
C.二氧化硫可大量用于食品增白 D.常温下,铁制容器可用于存贮浓硫酸
4.下列化学物质在实际生产生活和科技等方面的应用不正确的是
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
5.下列实验不能达到实验目的的是
A.图1制取并观察Fe(OH)2
B.图2验证酸性强弱:H2SO4>H2CO3>H2SiO3
C.图3分离溶于CCl4中的溴
D.图4验证碳酸钠与碳酸氢钠热稳定性:碳酸钠>碳酸氢钠
6.有些科学家提出硅是“21世纪的能源”,下列说法正确的是
A.晶体硅具有半导体性质,可用于生产光导纤维
B.玻璃中含有的SiO2可与NaOH溶液反应,故常用NaOH溶液雕刻玻璃纹饰
C.陶瓷、水泥、石英玻璃都属于硅酸盐材料
D.硅酸盐Na2Fe2Si3O9用氧化物的形式可表示为Na2O·2FeO·3SiO2
7.下列叙述正确的有
①、、都是形成酸雨的因素,都能和水反应生成酸
②、均不能用浓硫酸干燥
③水晶的主要成分是
④与都属于酸性氧化物,都不能与酸反应
⑤实验室可用溶液处理和废气
⑥只能用排水集气法收集,不能用排空气法收集;而只能用排空气法收集,不能用排水集气法
⑦铵盐受热分解一定都会产生氨气
⑧可用淀粉试纸鉴别红棕色的蒸气和气体
A.2项 B.3项 C.4项 D.5项
8.化学与社会、生活密切相关,对下列现象或事实的解释正确的是
选项 现 象 或 事 实 解 释
A 节日燃放的五彩缤纷的烟花 碱金属以及锶、钡等金属化合物的焰色反应
B FeCl3溶液可用于铜质印刷电路板刻制 Cu从FeCl3溶液中置换出铁
C 铝箔在酒精灯火焰上加热熔化但不滴落 氧化铝的熔点低于铝的熔点
D 氢氟酸可用于蚀刻玻璃 SiO2是碱性氧化物
A.A B.B C.C D.D
9.下列有关硅及其化合物的说法正确的是
A.新型的无机非金属材料多为硅酸盐材料
B.硅酸盐材料大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点
C.普通玻璃是以纯碱、石灰石、黏土为原料,经过复杂的反应变化制得的
D.SiO2溶于烧碱溶液中可制得水玻璃,水玻璃属于电解质
10.下列物质间的转化能实现的是
A.
B.
C.饱和NaCl溶液
D.(胶体)
11.化学与环境、材料信息、能源关系密切。下列说法正确的是
A.“地沟油”的主要成分属于烃
B.光导纤维的主要材料属于酸性氧化物
C.航母拦阻索的主要材料特种钢属于非金属材料
D.化石燃料直接燃烧产生的大量CO2会导致酸雨的发生
12.下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的性质较稳定,在自然界中存在游离态
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
13.“类比推理”是化学中常用的思维方法。下列推理正确的是
A.硅是常用的半导体元素,锗也是常用的半导体元素
B.Fe和Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
C.Cl2与水反应生成HCl和HClO,推测F2与水反应生成HF和HFO
D.CO2通入Na2O2溶液生成Na2CO3,则SO2通入Na2O2溶液生成Na2SO3
14.化学与生活密切相关,下列说法不正确的是
A.化学家采用玛瑙研钵研磨固体物质,玛瑙的主要成分是硅酸盐
B.三峡大坝使用了大量水泥,水泥是硅酸盐材料
C.太阳能电池可采用硅材料制作,该应用有利于环保、节能
D.葡萄酒中添加微量的,既可以杀菌消毒,又可以防止营养成分被氧化
15.下列说法正确的是
A.火力发电中,燃烧是使化学能转换为电能的关键
B.单晶硅太阳能电池实现了化学能和电能的转化
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.施肥时,草木灰和铵态氮肥的混合使用会影响钾肥的吸收
二、填空题
16.白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示),Si为+4价。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为_______g/mol。
(2)另取4.05g白玉粉末加入1mol/L的盐酸100mL充分溶解,过滤,得到不溶的非金属氧化物2.40g。将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(标准状况),则:
①p=______;
②白玉的化学式为:________________。
17.请回答下列问题。
(1)①写出的俗名:________;②写出熟石膏的化学式:_________。
(2)写出铜和稀硝酸反应的离子方程式__________。
(3)检验溶液中的实验方法___________。
三、实验题
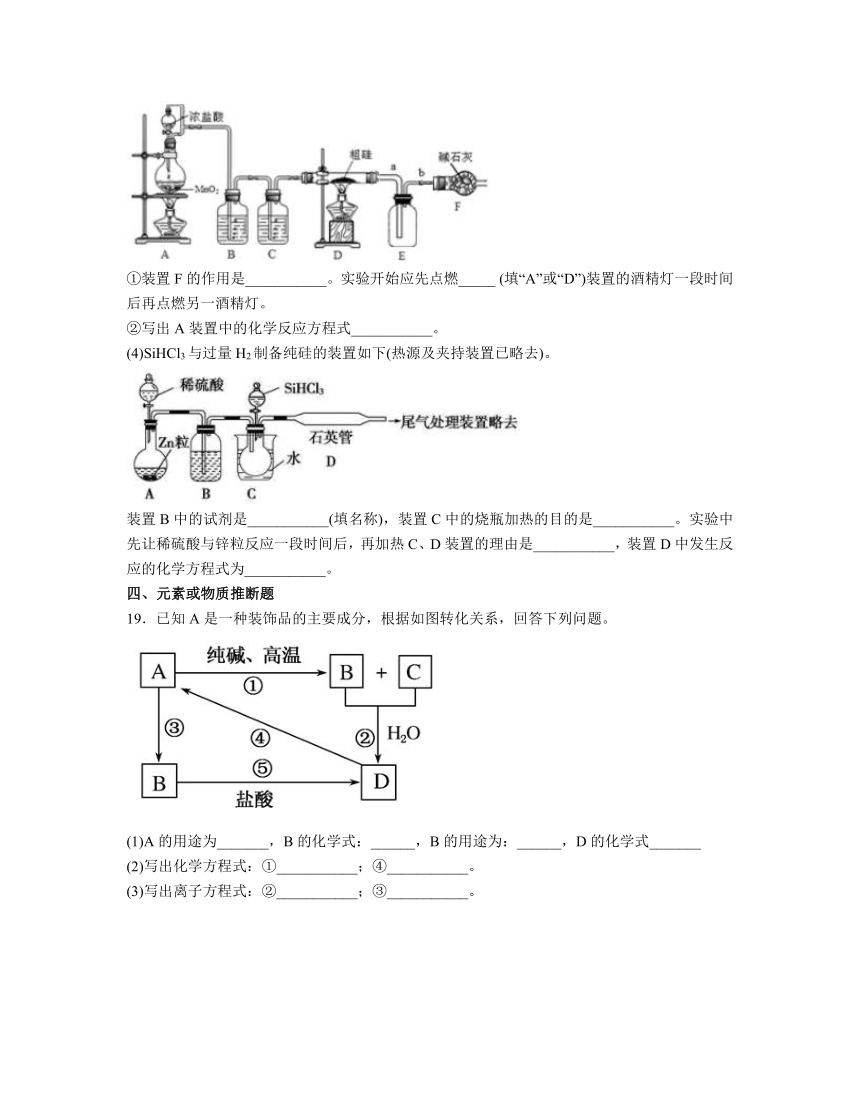
18.以粗硅(含铁、铝等杂质)为原料,工业上有以下两种制备高纯硅的工艺。已知:SiCl4沸点57.7℃,遇水强烈水解;SiHCl3沸点31.5℃,且能与H2O强烈反应,并在空气中易自燃。
(1)写出制备粗硅的化学反应方程式为___________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,操作①采用的方法为___________。
(3)实验室用如下装置制备SiCl4(反应温度在400℃~500℃)。
①装置F的作用是___________。实验开始应先点燃_____ (填“A”或“D”)装置的酒精灯一段时间后再点燃另一酒精灯。
②写出A装置中的化学反应方程式___________。
(4)SiHCl3与过量H2制备纯硅的装置如下(热源及夹持装置已略去)。
装置B中的试剂是___________(填名称),装置C中的烧瓶加热的目的是___________。实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的理由是___________,装置D中发生反应的化学方程式为___________。
四、元素或物质推断题
19.已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题。
(1)A的用途为_______,B的化学式:______,B的用途为:______,D的化学式_______
(2)写出化学方程式:①___________;④___________。
(3)写出离子方程式:②___________;③___________。
【参考答案】
一、单选题
1.B
解析:A.锰和铜均属于过渡金属,过渡金属不属于主族元素,A项错误;
B.合金与纯金属相比一般具有更好的机械强度、耐腐蚀性,B项正确;
C.氮化硅陶瓷属于新型无机非金属材料,而不是有机材料,C项错误;
D.光纤材料的主要成分是二氧化硅而不是单晶硅,D项错误;
答案选B。
2.D
解析:A.浓盐酸具有挥发性,挥发出的HCl会与Na2SiO3溶液反应产生H2SiO3沉淀,所以无法确定CO2是否与Na2SiO3反应,即无法验证H2CO3酸性强于H2SiO3,A项错误;
B.CH3CH2OH与CH3COOC2H5,均为有机物,CH3COOC2H5可溶于CH3CH2OH,无法用分液的方法分离,需采用蒸馏法分离,B项错误;
C.Na2CO3溶液与CH3COOC2H5不互溶,可用分液的方法分离,不需采用蒸馏的方法,C项错误;
D.CO2和NH3均能稳定存在于空气中,所以能用排空气法收集,当收集CO2时,气体应从左边通入,当收集NH3时,气体应从右边通入,B项正确;
答案选D。
3.C
解析:A. 单质硅制作光伏电池,故A正确;
B. 正常雨水的pH约为5.6,酸雨是指溶液pH小于5.6的雨水,故B正确;
C. 二氧化硫有一定毒性,不能用于食物漂白,故C错误;
D. 常温下,铁在浓硫酸中发生钝化现象,表面生成一层致密氧化物薄膜阻止反应进行,可以用铁制品容器盛装,故D正确。
答案选C。
4.A
解析:A. 石英坩埚的主要成分为SiO2,NaOH能与SiO2反应,故A项错误;
B. 石英砂可以用于制取高纯度的硅,硅是非常好的半导体材料,故可用作太阳能转化为电能的材料,B正确;
C. 因为氨易液化,液氨在气化时会吸收大量的热量,使环境温度降低,达到制冷目的,所以液氨可作制冷剂,C正确;
D. 硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药,D正确。
综上所述,本题答案为A。
5.C
解析:A.Fe与稀硫酸反应生成氢气,将装置中空气排出,关闭止水夹,利用氢气将硫酸亚铁压入含NaOH的试管中反应生成氢氧化亚铁,则图中装置可制备并观察氢氧化亚铁,能达到实验目的,故A不选;
B.锥形瓶内生成气体,烧杯内生成沉淀,能够说明酸性:H2SO4>H2CO3>H2SiO3,能达到实验目的,故B不选;
C.溴易溶于四氯化碳,溴和四氯化碳均为液体,蒸发不能分离,应该通过蒸馏分离,不能达到实验目的,故C选;
D.NaHCO3受热易分解,为体现对比性,小试管中应为碳酸氢钠,图示装置可以验证碳酸钠与碳酸氢钠热稳定性:碳酸钠>碳酸氢钠,故D不选;
故选C。
6.D
解析:A.晶体硅具有半导体性质,可用于生产电脑芯片,二氧化硅可用于制造光导纤维,A不正确;
B.玻璃中含有的SiO2可与NaOH溶液反应,但不能用NaOH溶液雕刻玻璃纹饰,因为玻璃表面是光滑的,该反应太慢,B不正确;
C.陶瓷、水泥属于硅酸盐材料,石英玻璃的主要成分是二氧化硅,C不正确;
D.硅酸盐Na2Fe2Si3O9中Fe元素化合价为+2,因此Na2Fe2Si3O9用氧化物的形式可表示为Na2O·2FeO·3SiO2,D正确;
综上所述,说法正确的是D项,故答案为D。
7.C
解析:一氧化氮不溶于水,与水不反应,故错误;
氨气为碱性气体,硫化氢具有强的还原性,二者都不能用浓硫酸干燥,故正确;
水晶的主要成分是二氧化硅,故正确;
二氧化硅常温下能够与氢氟酸反应生成四氟化硅和水,故错误;
氯气、二氧化硫都能够与氢氧化钠反应,被氢氧化钠溶液吸收,故正确;
一氧化氮能够被空气中氧气氧化,二氧化氮与水反应,所以只能用排水集气法收集,不能用排空气法收集;而只能用排空气法收集,不能用排水集气法,故正确;
铵盐受热分解不一定都会产生氨气,比如硝酸铵的分解,故错误;
不可用淀粉试纸鉴别红棕色的蒸气和气体,二者都有氧化性,试纸都会变蓝,故错误;
故选C。
8.A
解析:A.利用碱金属以及锶、钡等金属化合物灼烧是呈现特殊焰色的性质,可将它们用于制作节日燃放的五彩缤纷的烟花,A符合题意;
B.FeCl3溶液可用于铜质印刷电路板刻制发生的反应为2FeCl3+Cu=CuCl2+2FeCl2,并不是Cu从FeCl3溶液中置换出铁,B不合题意;
C.铝箔在酒精灯火焰上加热熔化但不滴落好像有一层膜兜着,是由于氧化铝的熔点高于铝的熔点,C不合题意;
D.氢氟酸可用于蚀刻玻璃反应方程式为:SiO2+4HF=SiF4↑+2H2O,这是HF的特性,而不是因为SiO2是碱性氧化物,事实上SiO2是酸性氧化物,D不合题意;
故答案为:A。
9.B
解析:A.传统的无机非金属材料多为硅酸盐材料,A错误;
B.硅酸盐材料玻璃、水泥、陶瓷等大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点 ,B正确;
C.普通玻璃以纯碱、石灰石、二氧化硅为原料,C错误;
D.溶于烧碱溶液中可制得水玻璃,水玻璃是的水溶液,该物质属于混合物,D错误;
故选B。
10.C
解析:A.第一步Al2O3与NaOH溶液反应生成不了Al(OH)3,而是得到NaAlO2,A不合题意;
B.盐酸不能与SiO2反应,B不合题意;
C.转化可以完成,涉及的反应分别为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O,C符合题意;
D.铁在点燃条件下与氧气生成的是;与NaOH生成沉淀,D不合题意;
故答案为:C。
11.B
解析:A.地沟油的主要成分是油脂,故A错误;
B.光导纤维的主要材料是SiO2,SiO2属于酸性氧化物,故B正确;
C.特种钢属于金属材料,故C错误;
D.CO2会导致温室效应,氮氧化物和硫氧化物才会导致酸雨,故D错误;
故答案选B。
12.C
解析:①硅元素是地壳中大量存在的元素,是许多种岩石和矿物的基本构成元素之一,故①正确;②水晶主要成分是二氧化硅,不是硅酸盐,故②错误;③硅在自然界中以化合态存在,自然界无有游离态的硅,故③错误;④陶瓷的主要成分是硅酸盐且陶瓷应用极早,故④正确。①④正确;
答案选C。
13.A
解析:A.硅在金属和非金属之间,是常用的半导体元素,锗也排在金属和非金属之间,也是常用的半导体元素,A正确;
B.和反应生成,但是氧化性较弱,与反应生成,B错误;
C.与水反应生成和,但是氧化性较强,与水反应生成HF和,C错误;
D.通入溶液生成,有强还原性,有强氧化性,二者反应生成,D错误;
故选A。
14.A
解析:A.玛瑙的主要成分是二氧化硅,故A错误;
B.水泥是硅酸盐材料,故B正确;
C.太阳能电池可采用硅材料制作,太阳能是清洁能源,该应用有利于环保、节能,故C正确;
D.葡萄酒中添加微量的,既可以杀菌消毒,常作抗氧剂,可以防止营养成分被氧化,故D正确。
综上所述,答案为A。
15.A
解析:A. 火力发电中,燃烧是使化学能转换为电能的关键,A项正确;
B. 单晶硅太阳能电池实现了太阳能和电能的转化
C. 熟石灰的主要成分为氢氧化钙,具有碱性,碳酸钠水解使溶液呈碱性,所以盐碱地中加入熟石灰不能改良土壤,可以通过加如适量的石膏粉末来降低土壤的碱性,C项错误;
D. 草木灰的主要成分是碳酸钾,氨态氮肥的主要成分是铵盐,氨根离子可以和碳酸根离子之间发生双水解生成氨气而丧失肥效,D项错误;
答案选A。
二、填空题
16.8 Ca2Mg5Si8O22(OH)2(或2CaO·5MgO·8SiO2·H2O )
解析:白玉类似的物质均是由多种金属氧化物结合得到的,故化学式可以拆分成几种金属氧化物结合的形式,白玉酸溶时,只有二氧化硅不溶解,再根据整个溶解过程中氯元素守恒求得白玉的化学式。
(1)白玉粉末灼烧过程中减少的是水的质量:根据比例关系可以求得白玉的摩尔质量为,解得M=810g/mol;
(2)①白玉粉末加酸溶解,只有二氧化硅不溶: ,则,p=8;
②4.05g白玉的物质的量为: ,又在标况下,得到气体336mL,则,根据关系式 ,则,由氯原子守恒有:2×0.005xmol+2×0.005ymol+2×0.015mol=0.1L×lmol/L ,白玉的相对原子质量为810,列方程:40x+24y+28×8+16×22+17×2=810;联立方程,解得:x=2;y=5;即该物质的化学式为Ca2Mg5Si8O22(OH)2(或2CaO·5MgO·8SiO2·H2O )。
17.(1) 金刚砂
(2)
(3)取样加入溶液并加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,说明存在
解析:(1)①的俗名是金刚砂;②熟石膏的化学式是;
(2)铜和稀硝酸反应生成硝酸铜和一氧化氮,反应的离子方程式为;
(3)铵根能与碱溶液在加热下反应生成氨气,再用湿润的红色石蕊试纸检验,则检验溶液中的实验方法为:取样加入溶液并加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,说明存在。
三、实验题
18. 分馏(或蒸馏) 吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶 A 浓硫酸 使进入烧瓶的液态SiHCl3变为气体 让H2排尽装置中的空气,防止SiHCl3水解和自燃
【分析】石英砂和焦炭先反应制备粗硅,粗硅和氯气反应生成四氯化硅,再经氢气还原得到高纯硅;粗硅和氯化氢反应生成三氯甲硅烷和四氯化硅,三氯甲硅烷再经氢气还原得到高纯硅,据此分析答题。
解析:(1)工业用二氧化硅和碳制备粗硅,制备粗硅的化学反应方程式为,,答案为:;
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,SiHCl3和SiCl4的沸点不同,所以采取蒸馏或者分馏的方法将二者分离,答案为:蒸馏或分馏;
(3) ①SiCl4能与H2O强烈反应,球形干燥管内碱石灰可以吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶装;加热条件下硅能与氧气反应,实验时应先点燃装置A的酒精灯让氯气将装置内空气排尽,所以实验开始应先点燃A装置的酒精灯一段时间后再点燃另一酒精灯,答案为:吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶;A;
②A装置中发生实验室制氯气的反应,化学反应方程式为:,答案为:;
(4)锌和稀硫酸制备的氢气中含有水蒸气,装置B中的试剂是浓硫酸;装置C中的液态SiHCl3变为气体和氢气发生反应制备纯硅,所以烧瓶加热的目的是使进入烧瓶的液态SiHCl3变为气体;根据题中信息可知SiHCl3能与H2O强烈反应,并在空气中易自燃,实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置可以让H2排尽装置中的空气,防止SiHCl3水解和自燃;装置D中氢气和SiHCl3发生反应制备高纯硅,化学方程式为:,答案为:浓硫酸;使进入烧瓶的液态SiHCl3变为气体;让H2排尽装置中的空气,防止SiHCl3水解和自燃;。
四、元素或物质推断题
19.(1) 光导纤维 Na2SiO3 粘合剂或木材的防火剂 H2SiO3
(2) Na2CO3+SiO2Na2SiO3+CO2↑ H2SiO3H2O+SiO2
(3) CO2+H2O+═+H2SiO3↓ SiO2+2OH-═+H2O
解析:已知A是一种装饰品的主要成分,高温下和纯碱反应,判断为SiO2,则B、C为Na2SiO3、CO2,二氧化碳在水溶液中和硅酸钠反应生成D为硅酸,硅酸受热分解生成二氧化硅,B和盐酸反应生成硅酸,说明B为Na2SiO3、C为CO2,据此分析解题。
(1)由分析可知,A为二氧化硅可以做传到信号的光导纤维,上述分析可知:B为Na2SiO3,Na2SiO3作粘合剂和木材的防火剂,D为H2SiO3,故答案为:光导纤维;Na2SiO3;粘合剂或木材的防火剂;H2SiO3;
(2)①是碳酸钠和二氧化硅高温反应生成硅酸钠和二氧化碳,反应的化学方程式为:Na2CO3+SiO2Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2Na2SiO3+CO2↑;
④反应为硅酸受热分解生成二氧化硅和水,反应的化学方程式为:H2SiO3H2O+SiO2 ,故答案为:H2SiO3H2O+SiO2 ;
(3)②发生的反应是二氧化碳和硅酸钠溶液反应生成硅酸沉淀的反应,离子方程式为:CO2+H2O+═+H2SiO3↓,故答案为:CO2+H2O+═+H2SiO3↓;
③反应为二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-═+H2O,故答案为:SiO2+2OH-═+H2O。
一、单选题
1.我国改革开放以来取得了很多世界瞩目的科技成果。下列有关说法正确的是
选项 A B C D
科技成果 “蛟龙号”潜水器探取到的多金属结核 样品中的主要成分 有锰、铜等 港珠澳大桥斜拉桥锚具材料采用的低 合金钢 国产大飞机C919用到的氮化硅陶瓷 中国天眼传输信息用的光纤材料
相关说法 这些金属元素均属于主族元素 具有强度大、密度小、耐腐蚀性高等 性能 属于新型有机材料 主要成分是单晶硅
A.A B.B C.C D.D
2.用下列装置完成相关实验,合理的是
A.图①:验证H2CO3酸性强于H2SiO3 B.图④:分离CH3CH2OH与CH3COOC2H5
C.图③:分离Na2CO3溶液与CH3COOC2H5 D.图②:收集CO2或NH3
3.化学与生活、生产密切相关,下列有关说法错误的是( )
A.高纯单质硅用于制光电池 B.酸雨是指pH<5.6的雨水
C.二氧化硫可大量用于食品增白 D.常温下,铁制容器可用于存贮浓硫酸
4.下列化学物质在实际生产生活和科技等方面的应用不正确的是
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
5.下列实验不能达到实验目的的是
A.图1制取并观察Fe(OH)2
B.图2验证酸性强弱:H2SO4>H2CO3>H2SiO3
C.图3分离溶于CCl4中的溴
D.图4验证碳酸钠与碳酸氢钠热稳定性:碳酸钠>碳酸氢钠
6.有些科学家提出硅是“21世纪的能源”,下列说法正确的是
A.晶体硅具有半导体性质,可用于生产光导纤维
B.玻璃中含有的SiO2可与NaOH溶液反应,故常用NaOH溶液雕刻玻璃纹饰
C.陶瓷、水泥、石英玻璃都属于硅酸盐材料
D.硅酸盐Na2Fe2Si3O9用氧化物的形式可表示为Na2O·2FeO·3SiO2
7.下列叙述正确的有
①、、都是形成酸雨的因素,都能和水反应生成酸
②、均不能用浓硫酸干燥
③水晶的主要成分是
④与都属于酸性氧化物,都不能与酸反应
⑤实验室可用溶液处理和废气
⑥只能用排水集气法收集,不能用排空气法收集;而只能用排空气法收集,不能用排水集气法
⑦铵盐受热分解一定都会产生氨气
⑧可用淀粉试纸鉴别红棕色的蒸气和气体
A.2项 B.3项 C.4项 D.5项
8.化学与社会、生活密切相关,对下列现象或事实的解释正确的是
选项 现 象 或 事 实 解 释
A 节日燃放的五彩缤纷的烟花 碱金属以及锶、钡等金属化合物的焰色反应
B FeCl3溶液可用于铜质印刷电路板刻制 Cu从FeCl3溶液中置换出铁
C 铝箔在酒精灯火焰上加热熔化但不滴落 氧化铝的熔点低于铝的熔点
D 氢氟酸可用于蚀刻玻璃 SiO2是碱性氧化物
A.A B.B C.C D.D
9.下列有关硅及其化合物的说法正确的是
A.新型的无机非金属材料多为硅酸盐材料
B.硅酸盐材料大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点
C.普通玻璃是以纯碱、石灰石、黏土为原料,经过复杂的反应变化制得的
D.SiO2溶于烧碱溶液中可制得水玻璃,水玻璃属于电解质
10.下列物质间的转化能实现的是
A.
B.
C.饱和NaCl溶液
D.(胶体)
11.化学与环境、材料信息、能源关系密切。下列说法正确的是
A.“地沟油”的主要成分属于烃
B.光导纤维的主要材料属于酸性氧化物
C.航母拦阻索的主要材料特种钢属于非金属材料
D.化石燃料直接燃烧产生的大量CO2会导致酸雨的发生
12.下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的性质较稳定,在自然界中存在游离态
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
13.“类比推理”是化学中常用的思维方法。下列推理正确的是
A.硅是常用的半导体元素,锗也是常用的半导体元素
B.Fe和Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
C.Cl2与水反应生成HCl和HClO,推测F2与水反应生成HF和HFO
D.CO2通入Na2O2溶液生成Na2CO3,则SO2通入Na2O2溶液生成Na2SO3
14.化学与生活密切相关,下列说法不正确的是
A.化学家采用玛瑙研钵研磨固体物质,玛瑙的主要成分是硅酸盐
B.三峡大坝使用了大量水泥,水泥是硅酸盐材料
C.太阳能电池可采用硅材料制作,该应用有利于环保、节能
D.葡萄酒中添加微量的,既可以杀菌消毒,又可以防止营养成分被氧化
15.下列说法正确的是
A.火力发电中,燃烧是使化学能转换为电能的关键
B.单晶硅太阳能电池实现了化学能和电能的转化
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.施肥时,草木灰和铵态氮肥的混合使用会影响钾肥的吸收
二、填空题
16.白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示),Si为+4价。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为_______g/mol。
(2)另取4.05g白玉粉末加入1mol/L的盐酸100mL充分溶解,过滤,得到不溶的非金属氧化物2.40g。将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(标准状况),则:
①p=______;
②白玉的化学式为:________________。
17.请回答下列问题。
(1)①写出的俗名:________;②写出熟石膏的化学式:_________。
(2)写出铜和稀硝酸反应的离子方程式__________。
(3)检验溶液中的实验方法___________。
三、实验题
18.以粗硅(含铁、铝等杂质)为原料,工业上有以下两种制备高纯硅的工艺。已知:SiCl4沸点57.7℃,遇水强烈水解;SiHCl3沸点31.5℃,且能与H2O强烈反应,并在空气中易自燃。
(1)写出制备粗硅的化学反应方程式为___________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,操作①采用的方法为___________。
(3)实验室用如下装置制备SiCl4(反应温度在400℃~500℃)。
①装置F的作用是___________。实验开始应先点燃_____ (填“A”或“D”)装置的酒精灯一段时间后再点燃另一酒精灯。
②写出A装置中的化学反应方程式___________。
(4)SiHCl3与过量H2制备纯硅的装置如下(热源及夹持装置已略去)。
装置B中的试剂是___________(填名称),装置C中的烧瓶加热的目的是___________。实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的理由是___________,装置D中发生反应的化学方程式为___________。
四、元素或物质推断题
19.已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题。
(1)A的用途为_______,B的化学式:______,B的用途为:______,D的化学式_______
(2)写出化学方程式:①___________;④___________。
(3)写出离子方程式:②___________;③___________。
【参考答案】
一、单选题
1.B
解析:A.锰和铜均属于过渡金属,过渡金属不属于主族元素,A项错误;
B.合金与纯金属相比一般具有更好的机械强度、耐腐蚀性,B项正确;
C.氮化硅陶瓷属于新型无机非金属材料,而不是有机材料,C项错误;
D.光纤材料的主要成分是二氧化硅而不是单晶硅,D项错误;
答案选B。
2.D
解析:A.浓盐酸具有挥发性,挥发出的HCl会与Na2SiO3溶液反应产生H2SiO3沉淀,所以无法确定CO2是否与Na2SiO3反应,即无法验证H2CO3酸性强于H2SiO3,A项错误;
B.CH3CH2OH与CH3COOC2H5,均为有机物,CH3COOC2H5可溶于CH3CH2OH,无法用分液的方法分离,需采用蒸馏法分离,B项错误;
C.Na2CO3溶液与CH3COOC2H5不互溶,可用分液的方法分离,不需采用蒸馏的方法,C项错误;
D.CO2和NH3均能稳定存在于空气中,所以能用排空气法收集,当收集CO2时,气体应从左边通入,当收集NH3时,气体应从右边通入,B项正确;
答案选D。
3.C
解析:A. 单质硅制作光伏电池,故A正确;
B. 正常雨水的pH约为5.6,酸雨是指溶液pH小于5.6的雨水,故B正确;
C. 二氧化硫有一定毒性,不能用于食物漂白,故C错误;
D. 常温下,铁在浓硫酸中发生钝化现象,表面生成一层致密氧化物薄膜阻止反应进行,可以用铁制品容器盛装,故D正确。
答案选C。
4.A
解析:A. 石英坩埚的主要成分为SiO2,NaOH能与SiO2反应,故A项错误;
B. 石英砂可以用于制取高纯度的硅,硅是非常好的半导体材料,故可用作太阳能转化为电能的材料,B正确;
C. 因为氨易液化,液氨在气化时会吸收大量的热量,使环境温度降低,达到制冷目的,所以液氨可作制冷剂,C正确;
D. 硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药,D正确。
综上所述,本题答案为A。
5.C
解析:A.Fe与稀硫酸反应生成氢气,将装置中空气排出,关闭止水夹,利用氢气将硫酸亚铁压入含NaOH的试管中反应生成氢氧化亚铁,则图中装置可制备并观察氢氧化亚铁,能达到实验目的,故A不选;
B.锥形瓶内生成气体,烧杯内生成沉淀,能够说明酸性:H2SO4>H2CO3>H2SiO3,能达到实验目的,故B不选;
C.溴易溶于四氯化碳,溴和四氯化碳均为液体,蒸发不能分离,应该通过蒸馏分离,不能达到实验目的,故C选;
D.NaHCO3受热易分解,为体现对比性,小试管中应为碳酸氢钠,图示装置可以验证碳酸钠与碳酸氢钠热稳定性:碳酸钠>碳酸氢钠,故D不选;
故选C。
6.D
解析:A.晶体硅具有半导体性质,可用于生产电脑芯片,二氧化硅可用于制造光导纤维,A不正确;
B.玻璃中含有的SiO2可与NaOH溶液反应,但不能用NaOH溶液雕刻玻璃纹饰,因为玻璃表面是光滑的,该反应太慢,B不正确;
C.陶瓷、水泥属于硅酸盐材料,石英玻璃的主要成分是二氧化硅,C不正确;
D.硅酸盐Na2Fe2Si3O9中Fe元素化合价为+2,因此Na2Fe2Si3O9用氧化物的形式可表示为Na2O·2FeO·3SiO2,D正确;
综上所述,说法正确的是D项,故答案为D。
7.C
解析:一氧化氮不溶于水,与水不反应,故错误;
氨气为碱性气体,硫化氢具有强的还原性,二者都不能用浓硫酸干燥,故正确;
水晶的主要成分是二氧化硅,故正确;
二氧化硅常温下能够与氢氟酸反应生成四氟化硅和水,故错误;
氯气、二氧化硫都能够与氢氧化钠反应,被氢氧化钠溶液吸收,故正确;
一氧化氮能够被空气中氧气氧化,二氧化氮与水反应,所以只能用排水集气法收集,不能用排空气法收集;而只能用排空气法收集,不能用排水集气法,故正确;
铵盐受热分解不一定都会产生氨气,比如硝酸铵的分解,故错误;
不可用淀粉试纸鉴别红棕色的蒸气和气体,二者都有氧化性,试纸都会变蓝,故错误;
故选C。
8.A
解析:A.利用碱金属以及锶、钡等金属化合物灼烧是呈现特殊焰色的性质,可将它们用于制作节日燃放的五彩缤纷的烟花,A符合题意;
B.FeCl3溶液可用于铜质印刷电路板刻制发生的反应为2FeCl3+Cu=CuCl2+2FeCl2,并不是Cu从FeCl3溶液中置换出铁,B不合题意;
C.铝箔在酒精灯火焰上加热熔化但不滴落好像有一层膜兜着,是由于氧化铝的熔点高于铝的熔点,C不合题意;
D.氢氟酸可用于蚀刻玻璃反应方程式为:SiO2+4HF=SiF4↑+2H2O,这是HF的特性,而不是因为SiO2是碱性氧化物,事实上SiO2是酸性氧化物,D不合题意;
故答案为:A。
9.B
解析:A.传统的无机非金属材料多为硅酸盐材料,A错误;
B.硅酸盐材料玻璃、水泥、陶瓷等大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点 ,B正确;
C.普通玻璃以纯碱、石灰石、二氧化硅为原料,C错误;
D.溶于烧碱溶液中可制得水玻璃,水玻璃是的水溶液,该物质属于混合物,D错误;
故选B。
10.C
解析:A.第一步Al2O3与NaOH溶液反应生成不了Al(OH)3,而是得到NaAlO2,A不合题意;
B.盐酸不能与SiO2反应,B不合题意;
C.转化可以完成,涉及的反应分别为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O,C符合题意;
D.铁在点燃条件下与氧气生成的是;与NaOH生成沉淀,D不合题意;
故答案为:C。
11.B
解析:A.地沟油的主要成分是油脂,故A错误;
B.光导纤维的主要材料是SiO2,SiO2属于酸性氧化物,故B正确;
C.特种钢属于金属材料,故C错误;
D.CO2会导致温室效应,氮氧化物和硫氧化物才会导致酸雨,故D错误;
故答案选B。
12.C
解析:①硅元素是地壳中大量存在的元素,是许多种岩石和矿物的基本构成元素之一,故①正确;②水晶主要成分是二氧化硅,不是硅酸盐,故②错误;③硅在自然界中以化合态存在,自然界无有游离态的硅,故③错误;④陶瓷的主要成分是硅酸盐且陶瓷应用极早,故④正确。①④正确;
答案选C。
13.A
解析:A.硅在金属和非金属之间,是常用的半导体元素,锗也排在金属和非金属之间,也是常用的半导体元素,A正确;
B.和反应生成,但是氧化性较弱,与反应生成,B错误;
C.与水反应生成和,但是氧化性较强,与水反应生成HF和,C错误;
D.通入溶液生成,有强还原性,有强氧化性,二者反应生成,D错误;
故选A。
14.A
解析:A.玛瑙的主要成分是二氧化硅,故A错误;
B.水泥是硅酸盐材料,故B正确;
C.太阳能电池可采用硅材料制作,太阳能是清洁能源,该应用有利于环保、节能,故C正确;
D.葡萄酒中添加微量的,既可以杀菌消毒,常作抗氧剂,可以防止营养成分被氧化,故D正确。
综上所述,答案为A。
15.A
解析:A. 火力发电中,燃烧是使化学能转换为电能的关键,A项正确;
B. 单晶硅太阳能电池实现了太阳能和电能的转化
C. 熟石灰的主要成分为氢氧化钙,具有碱性,碳酸钠水解使溶液呈碱性,所以盐碱地中加入熟石灰不能改良土壤,可以通过加如适量的石膏粉末来降低土壤的碱性,C项错误;
D. 草木灰的主要成分是碳酸钾,氨态氮肥的主要成分是铵盐,氨根离子可以和碳酸根离子之间发生双水解生成氨气而丧失肥效,D项错误;
答案选A。
二、填空题
16.8 Ca2Mg5Si8O22(OH)2(或2CaO·5MgO·8SiO2·H2O )
解析:白玉类似的物质均是由多种金属氧化物结合得到的,故化学式可以拆分成几种金属氧化物结合的形式,白玉酸溶时,只有二氧化硅不溶解,再根据整个溶解过程中氯元素守恒求得白玉的化学式。
(1)白玉粉末灼烧过程中减少的是水的质量:根据比例关系可以求得白玉的摩尔质量为,解得M=810g/mol;
(2)①白玉粉末加酸溶解,只有二氧化硅不溶: ,则,p=8;
②4.05g白玉的物质的量为: ,又在标况下,得到气体336mL,则,根据关系式 ,则,由氯原子守恒有:2×0.005xmol+2×0.005ymol+2×0.015mol=0.1L×lmol/L ,白玉的相对原子质量为810,列方程:40x+24y+28×8+16×22+17×2=810;联立方程,解得:x=2;y=5;即该物质的化学式为Ca2Mg5Si8O22(OH)2(或2CaO·5MgO·8SiO2·H2O )。
17.(1) 金刚砂
(2)
(3)取样加入溶液并加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,说明存在
解析:(1)①的俗名是金刚砂;②熟石膏的化学式是;
(2)铜和稀硝酸反应生成硝酸铜和一氧化氮,反应的离子方程式为;
(3)铵根能与碱溶液在加热下反应生成氨气,再用湿润的红色石蕊试纸检验,则检验溶液中的实验方法为:取样加入溶液并加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,说明存在。
三、实验题
18. 分馏(或蒸馏) 吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶 A 浓硫酸 使进入烧瓶的液态SiHCl3变为气体 让H2排尽装置中的空气,防止SiHCl3水解和自燃
【分析】石英砂和焦炭先反应制备粗硅,粗硅和氯气反应生成四氯化硅,再经氢气还原得到高纯硅;粗硅和氯化氢反应生成三氯甲硅烷和四氯化硅,三氯甲硅烷再经氢气还原得到高纯硅,据此分析答题。
解析:(1)工业用二氧化硅和碳制备粗硅,制备粗硅的化学反应方程式为,,答案为:;
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,SiHCl3和SiCl4的沸点不同,所以采取蒸馏或者分馏的方法将二者分离,答案为:蒸馏或分馏;
(3) ①SiCl4能与H2O强烈反应,球形干燥管内碱石灰可以吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶装;加热条件下硅能与氧气反应,实验时应先点燃装置A的酒精灯让氯气将装置内空气排尽,所以实验开始应先点燃A装置的酒精灯一段时间后再点燃另一酒精灯,答案为:吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶;A;
②A装置中发生实验室制氯气的反应,化学反应方程式为:,答案为:;
(4)锌和稀硫酸制备的氢气中含有水蒸气,装置B中的试剂是浓硫酸;装置C中的液态SiHCl3变为气体和氢气发生反应制备纯硅,所以烧瓶加热的目的是使进入烧瓶的液态SiHCl3变为气体;根据题中信息可知SiHCl3能与H2O强烈反应,并在空气中易自燃,实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置可以让H2排尽装置中的空气,防止SiHCl3水解和自燃;装置D中氢气和SiHCl3发生反应制备高纯硅,化学方程式为:,答案为:浓硫酸;使进入烧瓶的液态SiHCl3变为气体;让H2排尽装置中的空气,防止SiHCl3水解和自燃;。
四、元素或物质推断题
19.(1) 光导纤维 Na2SiO3 粘合剂或木材的防火剂 H2SiO3
(2) Na2CO3+SiO2Na2SiO3+CO2↑ H2SiO3H2O+SiO2
(3) CO2+H2O+═+H2SiO3↓ SiO2+2OH-═+H2O
解析:已知A是一种装饰品的主要成分,高温下和纯碱反应,判断为SiO2,则B、C为Na2SiO3、CO2,二氧化碳在水溶液中和硅酸钠反应生成D为硅酸,硅酸受热分解生成二氧化硅,B和盐酸反应生成硅酸,说明B为Na2SiO3、C为CO2,据此分析解题。
(1)由分析可知,A为二氧化硅可以做传到信号的光导纤维,上述分析可知:B为Na2SiO3,Na2SiO3作粘合剂和木材的防火剂,D为H2SiO3,故答案为:光导纤维;Na2SiO3;粘合剂或木材的防火剂;H2SiO3;
(2)①是碳酸钠和二氧化硅高温反应生成硅酸钠和二氧化碳,反应的化学方程式为:Na2CO3+SiO2Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2Na2SiO3+CO2↑;
④反应为硅酸受热分解生成二氧化硅和水,反应的化学方程式为:H2SiO3H2O+SiO2 ,故答案为:H2SiO3H2O+SiO2 ;
(3)②发生的反应是二氧化碳和硅酸钠溶液反应生成硅酸沉淀的反应,离子方程式为:CO2+H2O+═+H2SiO3↓,故答案为:CO2+H2O+═+H2SiO3↓;
③反应为二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-═+H2O,故答案为:SiO2+2OH-═+H2O。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
