5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析)
文档属性
| 名称 | 5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 863.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-17 00:00:00 | ||
图片预览


文档简介
5.1 硫及其化合物 同步练习题
一、单选题
1.在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq)Cl2(g)FeCl2(s)
B.NaBr(aq)Br2(aq)I2(s)
C.S(s) SO3(g) H2SO4(aq)
D.N2(g)NH3(g)Na2CO3(s)
2.室温下进行下列实验,根据实验操作和现象所得结论正确的是
选项 实验操作和现象 结论
A 向溶液中加足量锌粉,振荡,黄色逐渐消失,溶液呈浅绿色 活泼性:
B 向某溶液中加入溶液无明显现象,再通入,溶液变红 该溶液中含有
C 将稀盐酸滴入碳酸钠溶液中,产生能使澄清石灰水变浑浊的气体 非金属性:
D 向某溶液中加入溶液,生成白色沉淀 溶液中一定含有
A.A B.B C.C D.D
3.下列说法正确的是
A.侯氏制碱法生产流程中往饱和的食盐水先通入CO2再通入NH3
B.向某溶液中加入盐酸酸化的溶液,产生白色沉淀,该溶液一定含
C.胶体区分于其他分散系的本质特征是丁达尔效应
D.除去Fe2O3中杂质Al2O3的方法是加入足量NaOH溶液、过滤、洗涤、干燥
4.对于某些离子的检验及结论一定正确的是
A.向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,澄清石灰水变浑浊,则原溶液中一定有CO
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加足量稀硝酸,沉淀不消失,则原溶液中一定有 Ag+
C.向某溶液中先加入足量盐酸,没有明显现象,再加入BaCl2溶液;产生白色沉淀,则原溶液中一定有SO
D.向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+
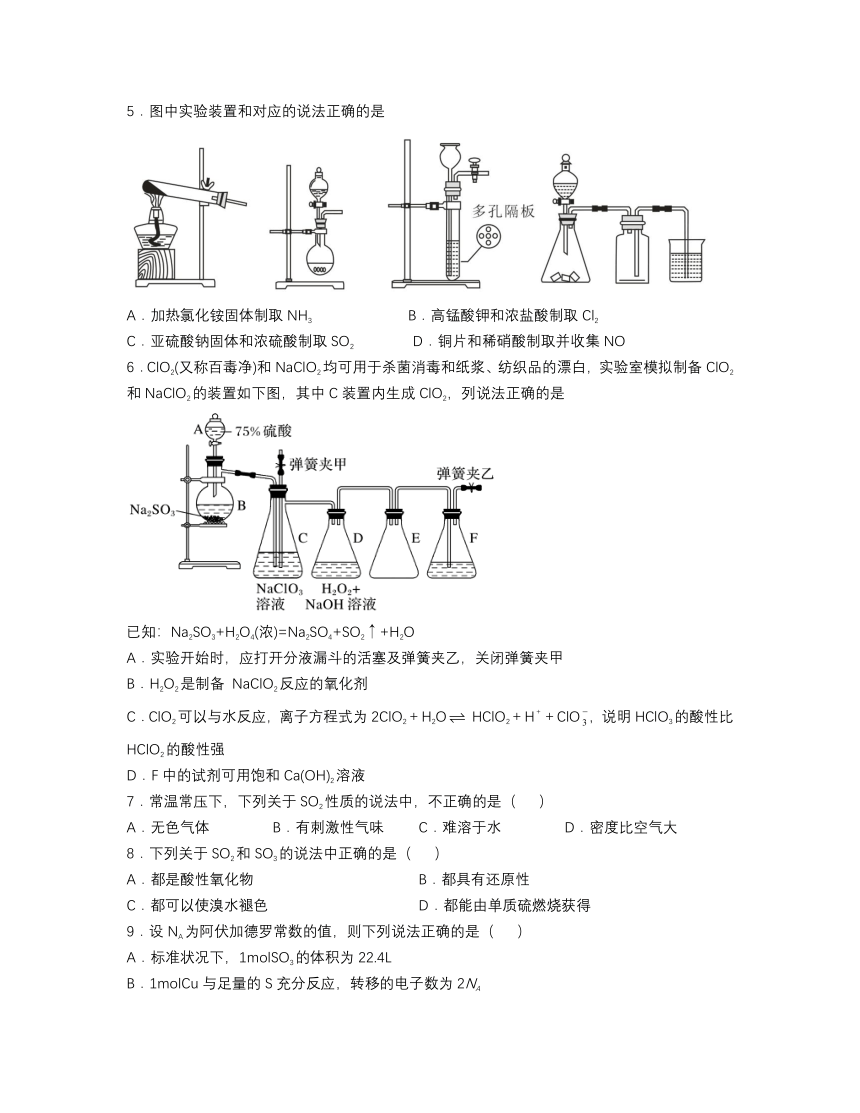
5.图中实验装置和对应的说法正确的是
A.加热氯化铵固体制取NH3 B.高锰酸钾和浓盐酸制取Cl2
C.亚硫酸钠固体和浓硫酸制取SO2 D.铜片和稀硝酸制取并收集NO
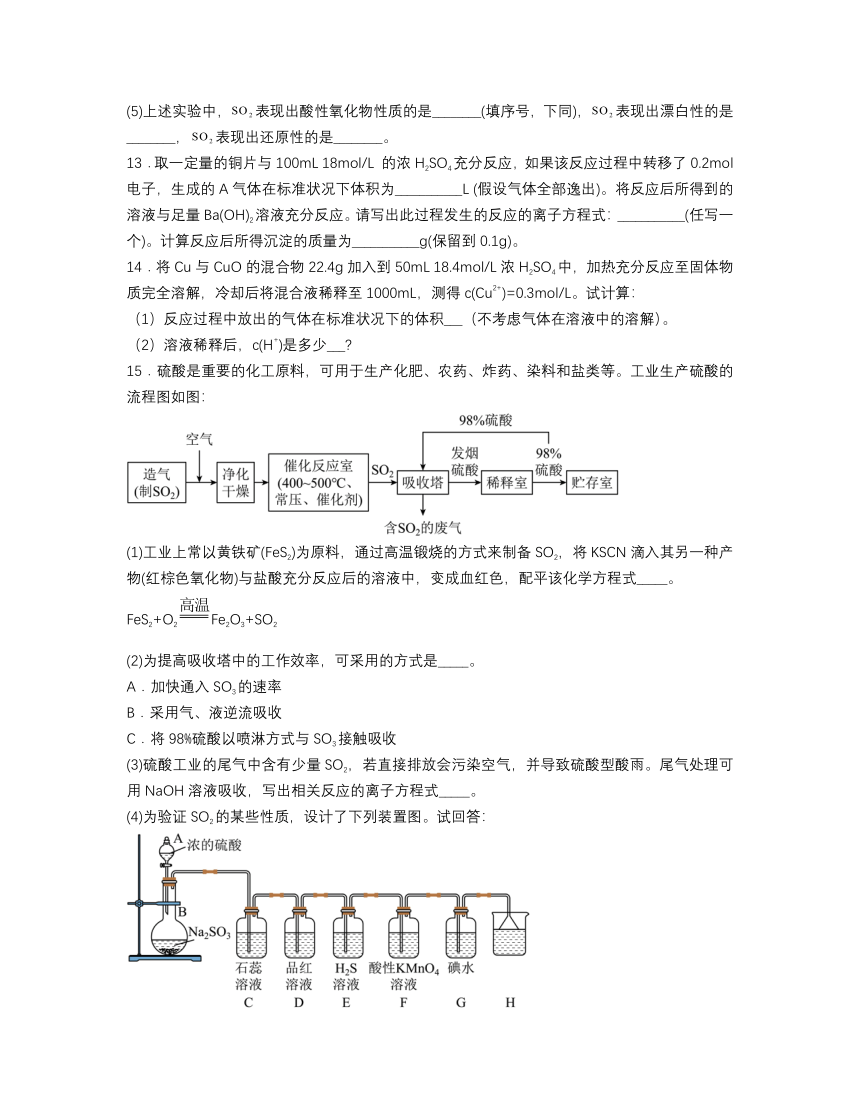
6.ClO2(又称百毒净)和NaClO2均可用于杀菌消毒和纸浆、纺织品的漂白,实验室模拟制备ClO2和NaClO2的装置如下图,其中C装置内生成ClO2,列说法正确的是
已知:Na2SO3+H2O4(浓)=Na2SO4+SO2↑+H2O
A.实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲
B.H2O2是制备 NaClO2反应的氧化剂
C.ClO2可以与水反应,离子方程式为2ClO2+H2OHClO2+H++ClO,说明HClO3的酸性比HClO2的酸性强
D.F中的试剂可用饱和Ca(OH)2溶液
7.常温常压下,下列关于SO2性质的说法中,不正确的是( )
A.无色气体 B.有刺激性气味 C.难溶于水 D.密度比空气大
8.下列关于SO2和SO3的说法中正确的是( )
A.都是酸性氧化物 B.都具有还原性
C.都可以使溴水褪色 D.都能由单质硫燃烧获得
9.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
A.标准状况下,1molSO3的体积为22.4L
B.1molCu与足量的S充分反应,转移的电子数为2NA
C.0.2molCu与含0.4molH2SO4的浓硫酸在加热的条件下反应时,生成的SO2在标准状况下的体积为4.48L
D.0.5molCu与足量浓HNO3反应时,转移的电子数为NA (信息:4HNO3(浓)+CuCu(NO3)2+2NO2↑+2H2O
10.下列说法错误的是
A.单质硫俗称硫磺是一种黄色晶体
B.游离态的硫常存在于火山喷口附近或地壳的岩层中
C.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
D.单质硫难溶于水,微溶于酒精,易溶于二硫化碳
二、填空题
11.二氧化硫的含量是空气质量监测的一个重要指标。
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;
② 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为___________________。
(2)分析上述数据变化,你认为形成这一变化的原因是__________________。
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气 、氧气 、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是_____________。
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)________
12.向盛有下列溶液的试管中分别通入气体:①紫色石蕊溶液;②NaOH溶液(滴有酚酞溶液);③品红溶液;④溴水。请回答下列问题:
(1)试管①中的现象是________,发生反应的化学方程式为________________。
(2)试管②中的现象是__________________,发生反应的化学方程式为__________________,若继续通入过量的,则发生反应的化学方程式为________________。
(3)试管③中的现象是_______若将吸收的品红溶液加热,现象是________。
(4)试管④中的现象是________________。
(5)上述实验中,表现出酸性氧化物性质的是________(填序号,下同),表现出漂白性的是________,表现出还原性的是________。
13.取一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为___________L (假设气体全部逸出)。将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:___________(任写一个)。计算反应后所得沉淀的质量为___________g(保留到0.1g)。
14.将Cu与CuO的混合物22.4g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积___(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少___
15.硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如图:
(1)工业上常以黄铁矿(FeS2)为原料,通过高温锻烧的方式来制备SO2,将KSCN滴入其另一种产物(红棕色氧化物)与盐酸充分反应后的溶液中,变成血红色,配平该化学方程式_____。
FeS2+O2Fe2O3+SO2
(2)为提高吸收塔中的工作效率,可采用的方式是_____。
A.加快通入SO3的速率
B.采用气、液逆流吸收
C.将98%硫酸以喷淋方式与SO3接触吸收
(3)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。尾气处理可用NaOH溶液吸收,写出相关反应的离子方程式_____。
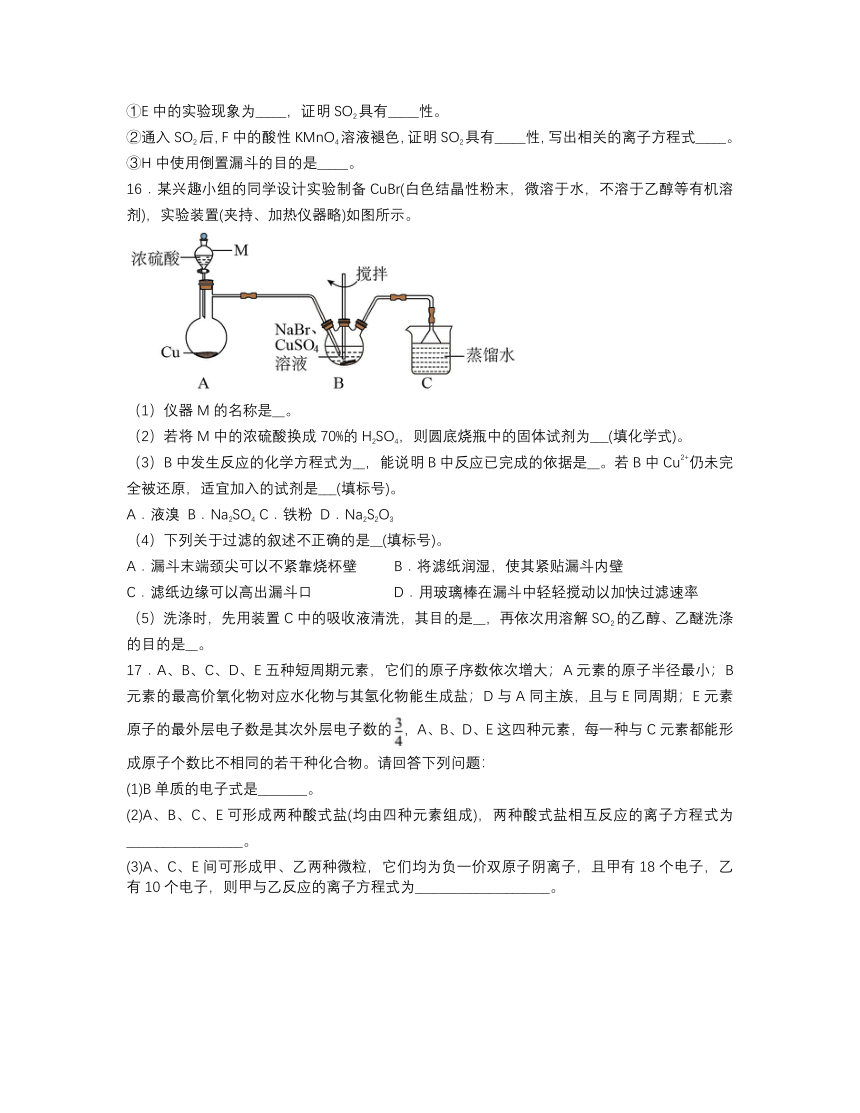
(4)为验证SO2的某些性质,设计了下列装置图。试回答:
①E中的实验现象为_____,证明SO2具有_____性。
②通入SO2后,F中的酸性KMnO4溶液褪色,证明SO2具有_____性,写出相关的离子方程式_____。
③H中使用倒置漏斗的目的是_____。
16.某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
(1)仪器M的名称是__。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为___(填化学式)。
(3)B中发生反应的化学方程式为__,能说明B中反应已完成的依据是__。若B中Cu2+仍未完全被还原,适宜加入的试剂是___(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(4)下列关于过滤的叙述不正确的是__(填标号)。
A.漏斗末端颈尖可以不紧靠烧杯壁 B.将滤纸润湿,使其紧贴漏斗内壁
C.滤纸边缘可以高出漏斗口 D.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是__,再依次用溶解SO2的乙醇、乙醚洗涤的目的是__。
17.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为___________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
【参考答案】
一、单选题
1.B
解析:A.铁与氯气反应生成氯化铁,而不是氯化亚铁,故错误;
B.氧化性:Cl2>Br2>I2,Cl2和NaBr溶液反应生成Br2,Br2和NaI反应生成I2,故正确;
C.硫在氧气中点燃只能生成二氧化硫,而不是三氧化硫,故错误;
D.高温、高压、催化剂条件下,氮气和氢气反应生成氨气,氨气、二氧化碳和氯化钠溶液反应生成碳酸氢钠,为侯氏制碱法的反应原理,反应方程式是:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故错误;
故选B。
2.B
解析:A.向FeCl3溶液中加入足量锌粉,发生反应2Fe3++Zn=2Fe2++Zn2+,无法说明活泼性Zn>Fe,A错误;
B.某溶液中加入KSCN无明显现象,说明原溶液中无铁离子,再通入Cl2溶液变红,说明此时溶液中存在铁离子,则是Cl2将Fe2+氧化成了Fe3+,原溶液中存在Fe2+,B正确;
C.盐酸不是Cl的最高价含氧酸,盐酸的酸性强于碳酸无法说明Cl的非金属性强于C,C错误;
D.某溶液中加入BaCl2生成白色沉淀,则溶液中可能有亚硫酸根离子、碳酸根离子等,不一定含有硫酸根离子,D错误;
故选B。
3.D
解析:A.侯氏制碱法生产流程中往饱和的食盐水先通入NH3再通入CO2,A错误;
B.向某溶液中加入盐酸酸化的溶液,产生白色沉淀,白色沉淀不一定是硫酸钡,也可能是氯化银等,所以该溶液中不一定含,B错误;
C.胶体区分于其他分散系的本质特征是分散质粒子直径大小不同,可以用丁达尔效应区分溶液和胶体,C错误;
D.氧化铁不溶于碱,氧化铝可溶于碱液中,除去Fe2O3中杂质Al2O3的方法是加入足量NaOH溶液、过滤、洗涤、干燥,D正确;
故选D。
4.C
解析:A.向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中可能有、、、,A错误;
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,原溶液中可能含有Ag+、、,B错误;
C.向某溶液中先加入盐酸酸化,没有明显现象,排除了Ag+、、等离子的干扰,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有,C正确;
D.向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,原溶液可能含有Ba2+、Ca2+、Ag+等,D错误;
故选C。
5.B
解析:A.NH4Cl固体受热分解产生NH3、HCl,两种气体遇冷又重新化合生成NH4Cl,因此不能用于实验室制取NH3,A错误;
B.高锰酸钾具有强氧化性,在室温下能够和浓盐酸制取Cl2,B正确;
C.亚硫酸钠固体是细小晶体颗粒,与浓硫酸反应制取SO2时易溶解在溶液中,不能阻隔在多孔隔板上,C错误;
D.NO气体容易被空气中的氧气氧化产生NO2气体,因此不能用排空气的方法收集,D错误;故合理选项是B。
6.C
解析:A.由分析可知,装置C中二氧化硫与氯酸钠溶液反应制备二氧化氯,其中带有弹簧夹甲的玻璃管起平衡气压的作用,所以实验开始时应打开分液漏斗的活塞及弹簧夹甲和弹簧夹乙,故A错误;
B.由分析可知,装置D中发生的反应为过氧化氢、氢氧化钠混合溶液反应生成亚氯酸钠、氧气和水,反应中氧元素的化合价升高被氧化,过氧化氢是反应的还原剂,故B错误;
C.由离子方程式可知,亚氯酸用分子式表示说明亚氯酸是弱酸,氯酸用离子符号表示说明氯酸是强酸,酸性强于亚氯酸,故C正确;
D.由分析可知,装置F中盛有的氢氧化钠溶液用于吸收未反应的氯气和二氧化氯,防止污染空气,若用氢氧化钙饱和溶液,溶液中氢氧根离子浓度小,不能充分吸收氯气和二氧化氯,会逸出造成空气污染,故D错误;
故选C。
7.C
解析:SO2为无色透明气体;有刺激性臭味;溶于水、乙醇和乙醚;密度为2.9275kg/m 大于空气密度1.29Kg/m ;所以选项C说法错误;
故答案选C。
8.A
解析:A.SO2、SO3对应的酸分别为H2SO3、H2SO4,二者都是酸性氧化物,A正确;
B.SO3中硫元素的价态是最高价态,只有氧化性没有还原性,B错误;
C.SO3没有还原性,不与溴水反应,C错误;
D.单质硫与氧气反应只能生成SO2,D错误;
故选A。
9.D
解析:A.标准状况下SO3不是气体,不能按气体摩尔体积计算其体积,A错误;
B.Cu与足量的S反应生成Cu2S,Cu元素从0价升高到+1价,则1molCu与足量的S充分反应,转移的电子数为NA,B错误;
C.浓硫酸在与铜反应过程中,随着反应的进行会变稀,变稀的硫酸不能继续与铜反应,所以生成SO2在标准状况下的体积小于4.48L,C错误;
D.根据反应4HNO3(浓)+CuCu(NO3)2+2NO2↑+2H2O可知,Cu元素从0价升高到+2价,则0.5molCu参与反应时,转移电子数为=NA,D正确;
故选D。
10.C
解析:A.单质硫是黄色晶体,俗称硫磺,A正确;
B.游离态即为单质硫常存于火山喷口附近或地壳的岩层中,B正确;
C.硫无论是在空气中还是纯氧中燃烧都只能生成二氧化硫,C错误;
D.单质硫主要是非极性键,易溶于非极性溶剂而少溶于极性溶剂,故微溶于酒精,易溶于二硫化碳,D正确;
故选C。
二、填空题
11. 大气中的CO2溶于雨水 H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小 在漏斗中用蒸馏水淋洗 根据SO2~H2SO4~BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.0224L,该同学样品中SO2的体积分数为2.24%
解析:I.(1)大气中的CO2溶于雨水,使正常雨水的PH为5.6。(2)酸雨含有弱酸亚硫酸,亚硫酸能被氧气氧化为强酸硫酸,雨水酸性增强,PH减小;II.(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在过滤器中加入蒸馏水,蒸馏水没过固体,让蒸馏水自然流下,重复23次;(2)产生白色沉淀是硫酸钡,硫酸钡的物质的量是0.233g÷233 g/mol = 0.001 mol ,根据SO2H2SO4BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.00100mol ×22.4 L/mol = 0.0224L,该同学样品中SO2的体积分数为0.0224L ÷1L×100%=2.24%。
12. 紫色石蕊溶液变红 溶液褪色 品红溶液褪色 溶液恢复红色 溴水褪色 ①② ③ ④
解析:(1)与反应生成,能使紫色石蕊溶液变红,反应方程式为;
(2)向NaOH溶液中通入少量可生成,若过量则生成,可观察到红色褪去,发生的反应方程式分别为、;
(3)使品红溶液褪色表现的是其漂白性,因此试管③中的现象是品红溶液褪色,但若将吸收的品红溶液加热,溶液恢复红色;
(4)具有还原性,能使溴水褪色;
(5)根据上述可知,①②体现SO2的酸性,③体现SO2的漂白性,④体现SO2的还原性;
13.24 2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓ 405.9
解析:依据方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可知,转移2mol电子生成1mol SO2气体,则反应过程中转移0.2mol电子,生成0.1mol SO2,生成的气体在标准状况下的体积为0.1mol ×22.4L/mol =2.24L;
将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,剩余的硫酸与氢氧化钡发生中和反应,生成的硫酸铜与氢氧化钡发生复分解反应,反应的离子方程式2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH-=Cu(OH)2↓+BaSO4↓;
反应后所得沉淀包括硫酸钡和氢氧化铜,已知n总(H2SO4)=0.1L×18mol/L=1.8mol,n(SO2)=0.1mol,则生成m(BaSO4)=(1.8mol-0.1mol)×233g/mol=396.1g,n(CuSO4)=0.1mol,则m[Cu(OH)2]=0.1mol×98g/mol=9.8g,则反应后所得沉淀的质量为396.1g+9.8g=405.9g,
故答案为:2.24;2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH-=Cu(OH)2↓+BaSO4↓;405.9。
14.24L 1.04mol/L
解析:设混合物中Cu的物质的量为x,CuO的物质的量为y.
根据混合物为22.4g可有:64x+80y=22.4…①
根据混合液稀释至1000mL,c(Cu2+)=0.3mol/L,可有:x+y=0.3…②
解①②得:x=0.1mol、y=0.2mol;
(1)Cu与浓硫酸反应放出SO2气体,设生成气体的物质的量为amol,根据反应:
可得:=,解得:a=0.1mol;
由于是标况下,故体积V=n Vm=0.1mol×22.4L/mol=2.24L;故答案为:2.24L;
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol,n(H2SO4)反应=2x+y=0.4mol,n(H2SO4)余=0.92mol 0.4mol=0.52mol,故c(H+)=0.52mol×2÷1L=1.04mol/L,故答案为:1.04mol/L.
15.(1)4FeS2+11O22Fe2O3+8SO2
(2)BC
(3)SO2+2OH-=SO+H2O
(4) 有淡黄色沉淀生成 氧化 还原 5SO2+2H2O+2MnO=5SO+2Mn2++4H+ 防倒吸
解析:(1)反应FeS2+O2Fe2O3+SO2中,Fe的化合价从+2价升高为+3价,S的化合价从-1价升高为+4价,O的化合价从0价降低为-2价,则FeS2为还原剂,1molFeS2失去11mol电子,O2为氧化剂,1molO2得电子为4mol,根据得失电子守恒、元素守恒可配平该化学方程式4FeS2+11O22Fe2O3+8SO2。
(2)A.加快通入SO3的速率,SO3吸收不充分,故A错误;
B.采用气、液逆流吸收,能增加接触时间,SO3能被充分吸收,故B正确;
C.将98%硫酸以喷淋方式与SO3接触吸收,接触面积大,SO3能被充分吸收,故C正确;
故选BC。
(3)SO2被NaOH溶液吸收,反应生成亚硫酸钠和水,反应离子方程式为SO2+2OH-=SO+H2O。
(4)①SO2与H2S溶液反应生成S单质,则E中的实验现象为有淡黄色沉淀生成,SO2中S元素化合价降低,证明SO2具有氧化性。
②KMnO4溶液具有强氧化性,SO2具有还原性,二者可以发生氧化还原反应,故通入SO2后,F中的酸性KMnO4溶液褪色,证明SO2具有还原性,根据得失电子守恒、电荷守恒、元素守恒配平离子方程式为5SO2+2H2O+2MnO=5SO+2Mn2++4H+。
③H中使用倒置漏斗的目的是防倒吸。
16. 分液漏斗 Na2SO3(或K2SO3或NaHSO3或KHSO3等) 2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4 溶液蓝色褪去 d acd 防止CuBr被氧化 用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥
【分析】(1)根据装置图中仪器M的结构可知该仪器的名称。
(2)根据复分解反应的规律可用70%的H2SO4与亚硫酸盐或亚硫酸氢盐反应。
(3)在B中BaBr、SO2、CuSO4、H2O会发生氧化还原反应产生CuBr沉淀,利用电子守恒、原子守恒,可得该反应的化学方程式,Cu2+的水溶液显蓝色,通过颜色变化判断反应是否完全,由于CuSO4具有氧化性,加入还原性的物质发生氧化还原反应,但不能引入新的杂质。
(4)A. 漏斗末端紧靠烧杯内壁,就可以使过滤得到的滤液沿烧杯内壁不断进入到烧杯中;B. 将滤纸润湿,使其紧贴漏斗内壁,就可以使混合物充分分离;C. 为了使难溶性的固体与液体物质分离,滤纸边缘要低于漏斗口边缘;D. 用玻璃棒引流,使混合物进入到过滤器中,在漏斗中不能用玻璃棒搅动,否则会使滤纸破损,导致不能过滤,不能分离混合物。
(5)CuBr具有还原性,用H2SO3溶液洗涤,就可以避免CuBr被空气中的氧气氧化,然后依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
解析:(1)根据装置图中仪器M的结构可知该仪器的名称是分液漏斗;故答案为:分液漏斗。
(2)根据复分解反应的规律可用70%的H2SO4与Na2SO3或K2SO3或NaHSO3或KHSO3等反应制取SO2气体,反应方程式为H2SO4+Na2SO3=Na2SO4+H2O+SO2↑;故答案为:Na2SO3(或K2SO3或NaHSO3或KHSO3等)。
(3)在B中BaBr、SO2、CuSO4、H2O会发生氧化还原反应产生CuBr沉淀,利用电子守恒、原子守恒,可得该反应的化学方程式为:2CuSO4+2NaBr + SO2 + 2H2O= 2CuBr↓ + Na2SO4 + 2H2SO4,Cu2+的水溶液显蓝色,若反应完全,则溶液中不再含有Cu2+,溶液的蓝色褪去,由于CuSO4具有氧化性,加入还原性的物质发生氧化还原反应,但不能引入新的杂质,因此若B中Cu2+仍未完全被还原,适宜加入的试剂是Na2S2O3,故答案为:2CuSO4+2NaBr + SO2 + 2H2O= 2CuBr↓ + Na2SO4 + 2H2SO4;D。
(4)A. 漏斗末端紧靠烧杯内壁,就可以使过滤得到的滤液沿烧杯内壁不断进入到烧杯中,故A错误;B. 将滤纸润湿,使其紧贴漏斗内壁,就可以使混合物充分分离,故B正确;C. 为了使难溶性的固体与液体物质分离,滤纸边缘要低于漏斗口边缘,故C错误;D. 用玻璃棒引流,使混合物进入到过滤器中,在漏斗中不能用玻璃棒搅动,否则会使滤纸破损,导致不能过滤,不能分离混合物,故D错误;故答案为:ACD。
(5)SO2是大气污染物,为防止其污染环境,用蒸馏水吸收SO2,得到H2SO3溶液,该物质具有还原性,用H2SO3溶液洗涤,就可以避免CuBr被空气中的氧气氧化,然后依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥;故答案为:防止CuBr被氧化;用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
17. HSO3-+H+=SO2↑+H2O HS-+OH-=S2-+H2O
【分析】A、 B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;D与A同主族,D原子序数大于氮,故D为Na;D与E同周期,则E处于第三周期,E元素原子的最外层电子数是其次外层电子数的,最外层电子数为6,故E为S元素;结合原子序数可知,C为O、F元素中的一种,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,可推知C为O元素。
解析:(1)B为N元素,电子式为;;
(2)A、C、D、E可形成两种酸式盐为NaHSO3和NaHSO4,离子反应为HSO3-+H+=SO2↑+H2O;
(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
一、单选题
1.在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq)Cl2(g)FeCl2(s)
B.NaBr(aq)Br2(aq)I2(s)
C.S(s) SO3(g) H2SO4(aq)
D.N2(g)NH3(g)Na2CO3(s)
2.室温下进行下列实验,根据实验操作和现象所得结论正确的是
选项 实验操作和现象 结论
A 向溶液中加足量锌粉,振荡,黄色逐渐消失,溶液呈浅绿色 活泼性:
B 向某溶液中加入溶液无明显现象,再通入,溶液变红 该溶液中含有
C 将稀盐酸滴入碳酸钠溶液中,产生能使澄清石灰水变浑浊的气体 非金属性:
D 向某溶液中加入溶液,生成白色沉淀 溶液中一定含有
A.A B.B C.C D.D
3.下列说法正确的是
A.侯氏制碱法生产流程中往饱和的食盐水先通入CO2再通入NH3
B.向某溶液中加入盐酸酸化的溶液,产生白色沉淀,该溶液一定含
C.胶体区分于其他分散系的本质特征是丁达尔效应
D.除去Fe2O3中杂质Al2O3的方法是加入足量NaOH溶液、过滤、洗涤、干燥
4.对于某些离子的检验及结论一定正确的是
A.向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,澄清石灰水变浑浊,则原溶液中一定有CO
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加足量稀硝酸,沉淀不消失,则原溶液中一定有 Ag+
C.向某溶液中先加入足量盐酸,没有明显现象,再加入BaCl2溶液;产生白色沉淀,则原溶液中一定有SO
D.向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+
5.图中实验装置和对应的说法正确的是
A.加热氯化铵固体制取NH3 B.高锰酸钾和浓盐酸制取Cl2
C.亚硫酸钠固体和浓硫酸制取SO2 D.铜片和稀硝酸制取并收集NO
6.ClO2(又称百毒净)和NaClO2均可用于杀菌消毒和纸浆、纺织品的漂白,实验室模拟制备ClO2和NaClO2的装置如下图,其中C装置内生成ClO2,列说法正确的是
已知:Na2SO3+H2O4(浓)=Na2SO4+SO2↑+H2O
A.实验开始时,应打开分液漏斗的活塞及弹簧夹乙,关闭弹簧夹甲
B.H2O2是制备 NaClO2反应的氧化剂
C.ClO2可以与水反应,离子方程式为2ClO2+H2OHClO2+H++ClO,说明HClO3的酸性比HClO2的酸性强
D.F中的试剂可用饱和Ca(OH)2溶液
7.常温常压下,下列关于SO2性质的说法中,不正确的是( )
A.无色气体 B.有刺激性气味 C.难溶于水 D.密度比空气大
8.下列关于SO2和SO3的说法中正确的是( )
A.都是酸性氧化物 B.都具有还原性
C.都可以使溴水褪色 D.都能由单质硫燃烧获得
9.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
A.标准状况下,1molSO3的体积为22.4L
B.1molCu与足量的S充分反应,转移的电子数为2NA
C.0.2molCu与含0.4molH2SO4的浓硫酸在加热的条件下反应时,生成的SO2在标准状况下的体积为4.48L
D.0.5molCu与足量浓HNO3反应时,转移的电子数为NA (信息:4HNO3(浓)+CuCu(NO3)2+2NO2↑+2H2O
10.下列说法错误的是
A.单质硫俗称硫磺是一种黄色晶体
B.游离态的硫常存在于火山喷口附近或地壳的岩层中
C.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
D.单质硫难溶于水,微溶于酒精,易溶于二硫化碳
二、填空题
11.二氧化硫的含量是空气质量监测的一个重要指标。
I.二氧化硫被雨水吸收后就形成了酸雨,某兴趣小组同学汲取热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;
② 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为___________________。
(2)分析上述数据变化,你认为形成这一变化的原因是__________________。
II.兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气 、氧气 、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)过滤时,除去沉淀中附着的过量氧化钡的方法是_____________。
(2)计算该空气样品中二氧化硫的体积分数(写出计算过程)________
12.向盛有下列溶液的试管中分别通入气体:①紫色石蕊溶液;②NaOH溶液(滴有酚酞溶液);③品红溶液;④溴水。请回答下列问题:
(1)试管①中的现象是________,发生反应的化学方程式为________________。
(2)试管②中的现象是__________________,发生反应的化学方程式为__________________,若继续通入过量的,则发生反应的化学方程式为________________。
(3)试管③中的现象是_______若将吸收的品红溶液加热,现象是________。
(4)试管④中的现象是________________。
(5)上述实验中,表现出酸性氧化物性质的是________(填序号,下同),表现出漂白性的是________,表现出还原性的是________。
13.取一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为___________L (假设气体全部逸出)。将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:___________(任写一个)。计算反应后所得沉淀的质量为___________g(保留到0.1g)。
14.将Cu与CuO的混合物22.4g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积___(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少___
15.硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如图:
(1)工业上常以黄铁矿(FeS2)为原料,通过高温锻烧的方式来制备SO2,将KSCN滴入其另一种产物(红棕色氧化物)与盐酸充分反应后的溶液中,变成血红色,配平该化学方程式_____。
FeS2+O2Fe2O3+SO2
(2)为提高吸收塔中的工作效率,可采用的方式是_____。
A.加快通入SO3的速率
B.采用气、液逆流吸收
C.将98%硫酸以喷淋方式与SO3接触吸收
(3)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨。尾气处理可用NaOH溶液吸收,写出相关反应的离子方程式_____。
(4)为验证SO2的某些性质,设计了下列装置图。试回答:
①E中的实验现象为_____,证明SO2具有_____性。
②通入SO2后,F中的酸性KMnO4溶液褪色,证明SO2具有_____性,写出相关的离子方程式_____。
③H中使用倒置漏斗的目的是_____。
16.某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
(1)仪器M的名称是__。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为___(填化学式)。
(3)B中发生反应的化学方程式为__,能说明B中反应已完成的依据是__。若B中Cu2+仍未完全被还原,适宜加入的试剂是___(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(4)下列关于过滤的叙述不正确的是__(填标号)。
A.漏斗末端颈尖可以不紧靠烧杯壁 B.将滤纸润湿,使其紧贴漏斗内壁
C.滤纸边缘可以高出漏斗口 D.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是__,再依次用溶解SO2的乙醇、乙醚洗涤的目的是__。
17.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为___________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
【参考答案】
一、单选题
1.B
解析:A.铁与氯气反应生成氯化铁,而不是氯化亚铁,故错误;
B.氧化性:Cl2>Br2>I2,Cl2和NaBr溶液反应生成Br2,Br2和NaI反应生成I2,故正确;
C.硫在氧气中点燃只能生成二氧化硫,而不是三氧化硫,故错误;
D.高温、高压、催化剂条件下,氮气和氢气反应生成氨气,氨气、二氧化碳和氯化钠溶液反应生成碳酸氢钠,为侯氏制碱法的反应原理,反应方程式是:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故错误;
故选B。
2.B
解析:A.向FeCl3溶液中加入足量锌粉,发生反应2Fe3++Zn=2Fe2++Zn2+,无法说明活泼性Zn>Fe,A错误;
B.某溶液中加入KSCN无明显现象,说明原溶液中无铁离子,再通入Cl2溶液变红,说明此时溶液中存在铁离子,则是Cl2将Fe2+氧化成了Fe3+,原溶液中存在Fe2+,B正确;
C.盐酸不是Cl的最高价含氧酸,盐酸的酸性强于碳酸无法说明Cl的非金属性强于C,C错误;
D.某溶液中加入BaCl2生成白色沉淀,则溶液中可能有亚硫酸根离子、碳酸根离子等,不一定含有硫酸根离子,D错误;
故选B。
3.D
解析:A.侯氏制碱法生产流程中往饱和的食盐水先通入NH3再通入CO2,A错误;
B.向某溶液中加入盐酸酸化的溶液,产生白色沉淀,白色沉淀不一定是硫酸钡,也可能是氯化银等,所以该溶液中不一定含,B错误;
C.胶体区分于其他分散系的本质特征是分散质粒子直径大小不同,可以用丁达尔效应区分溶液和胶体,C错误;
D.氧化铁不溶于碱,氧化铝可溶于碱液中,除去Fe2O3中杂质Al2O3的方法是加入足量NaOH溶液、过滤、洗涤、干燥,D正确;
故选D。
4.C
解析:A.向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中可能有、、、,A错误;
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,原溶液中可能含有Ag+、、,B错误;
C.向某溶液中先加入盐酸酸化,没有明显现象,排除了Ag+、、等离子的干扰,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有,C正确;
D.向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,原溶液可能含有Ba2+、Ca2+、Ag+等,D错误;
故选C。
5.B
解析:A.NH4Cl固体受热分解产生NH3、HCl,两种气体遇冷又重新化合生成NH4Cl,因此不能用于实验室制取NH3,A错误;
B.高锰酸钾具有强氧化性,在室温下能够和浓盐酸制取Cl2,B正确;
C.亚硫酸钠固体是细小晶体颗粒,与浓硫酸反应制取SO2时易溶解在溶液中,不能阻隔在多孔隔板上,C错误;
D.NO气体容易被空气中的氧气氧化产生NO2气体,因此不能用排空气的方法收集,D错误;故合理选项是B。
6.C
解析:A.由分析可知,装置C中二氧化硫与氯酸钠溶液反应制备二氧化氯,其中带有弹簧夹甲的玻璃管起平衡气压的作用,所以实验开始时应打开分液漏斗的活塞及弹簧夹甲和弹簧夹乙,故A错误;
B.由分析可知,装置D中发生的反应为过氧化氢、氢氧化钠混合溶液反应生成亚氯酸钠、氧气和水,反应中氧元素的化合价升高被氧化,过氧化氢是反应的还原剂,故B错误;
C.由离子方程式可知,亚氯酸用分子式表示说明亚氯酸是弱酸,氯酸用离子符号表示说明氯酸是强酸,酸性强于亚氯酸,故C正确;
D.由分析可知,装置F中盛有的氢氧化钠溶液用于吸收未反应的氯气和二氧化氯,防止污染空气,若用氢氧化钙饱和溶液,溶液中氢氧根离子浓度小,不能充分吸收氯气和二氧化氯,会逸出造成空气污染,故D错误;
故选C。
7.C
解析:SO2为无色透明气体;有刺激性臭味;溶于水、乙醇和乙醚;密度为2.9275kg/m 大于空气密度1.29Kg/m ;所以选项C说法错误;
故答案选C。
8.A
解析:A.SO2、SO3对应的酸分别为H2SO3、H2SO4,二者都是酸性氧化物,A正确;
B.SO3中硫元素的价态是最高价态,只有氧化性没有还原性,B错误;
C.SO3没有还原性,不与溴水反应,C错误;
D.单质硫与氧气反应只能生成SO2,D错误;
故选A。
9.D
解析:A.标准状况下SO3不是气体,不能按气体摩尔体积计算其体积,A错误;
B.Cu与足量的S反应生成Cu2S,Cu元素从0价升高到+1价,则1molCu与足量的S充分反应,转移的电子数为NA,B错误;
C.浓硫酸在与铜反应过程中,随着反应的进行会变稀,变稀的硫酸不能继续与铜反应,所以生成SO2在标准状况下的体积小于4.48L,C错误;
D.根据反应4HNO3(浓)+CuCu(NO3)2+2NO2↑+2H2O可知,Cu元素从0价升高到+2价,则0.5molCu参与反应时,转移电子数为=NA,D正确;
故选D。
10.C
解析:A.单质硫是黄色晶体,俗称硫磺,A正确;
B.游离态即为单质硫常存于火山喷口附近或地壳的岩层中,B正确;
C.硫无论是在空气中还是纯氧中燃烧都只能生成二氧化硫,C错误;
D.单质硫主要是非极性键,易溶于非极性溶剂而少溶于极性溶剂,故微溶于酒精,易溶于二硫化碳,D正确;
故选C。
二、填空题
11. 大气中的CO2溶于雨水 H2SO3与空气中的O2作用转化为H2SO4,使雨水的酸性增强,pH减小 在漏斗中用蒸馏水淋洗 根据SO2~H2SO4~BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.0224L,该同学样品中SO2的体积分数为2.24%
解析:I.(1)大气中的CO2溶于雨水,使正常雨水的PH为5.6。(2)酸雨含有弱酸亚硫酸,亚硫酸能被氧气氧化为强酸硫酸,雨水酸性增强,PH减小;II.(1)过滤时,除去沉淀中附着的过量氧化钡的方法是在过滤器中加入蒸馏水,蒸馏水没过固体,让蒸馏水自然流下,重复23次;(2)产生白色沉淀是硫酸钡,硫酸钡的物质的量是0.233g÷233 g/mol = 0.001 mol ,根据SO2H2SO4BaSO4,可得n(SO2)=0.00100mol,该1.000L空气中含有SO2的体积为0.00100mol ×22.4 L/mol = 0.0224L,该同学样品中SO2的体积分数为0.0224L ÷1L×100%=2.24%。
12. 紫色石蕊溶液变红 溶液褪色 品红溶液褪色 溶液恢复红色 溴水褪色 ①② ③ ④
解析:(1)与反应生成,能使紫色石蕊溶液变红,反应方程式为;
(2)向NaOH溶液中通入少量可生成,若过量则生成,可观察到红色褪去,发生的反应方程式分别为、;
(3)使品红溶液褪色表现的是其漂白性,因此试管③中的现象是品红溶液褪色,但若将吸收的品红溶液加热,溶液恢复红色;
(4)具有还原性,能使溴水褪色;
(5)根据上述可知,①②体现SO2的酸性,③体现SO2的漂白性,④体现SO2的还原性;
13.24 2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓ 405.9
解析:依据方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O可知,转移2mol电子生成1mol SO2气体,则反应过程中转移0.2mol电子,生成0.1mol SO2,生成的气体在标准状况下的体积为0.1mol ×22.4L/mol =2.24L;
将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,剩余的硫酸与氢氧化钡发生中和反应,生成的硫酸铜与氢氧化钡发生复分解反应,反应的离子方程式2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH-=Cu(OH)2↓+BaSO4↓;
反应后所得沉淀包括硫酸钡和氢氧化铜,已知n总(H2SO4)=0.1L×18mol/L=1.8mol,n(SO2)=0.1mol,则生成m(BaSO4)=(1.8mol-0.1mol)×233g/mol=396.1g,n(CuSO4)=0.1mol,则m[Cu(OH)2]=0.1mol×98g/mol=9.8g,则反应后所得沉淀的质量为396.1g+9.8g=405.9g,
故答案为:2.24;2H++SO+ Ba2++2OH﹣=2H2O+BaSO4↓、Cu2++SO+ Ba2++2OH-=Cu(OH)2↓+BaSO4↓;405.9。
14.24L 1.04mol/L
解析:设混合物中Cu的物质的量为x,CuO的物质的量为y.
根据混合物为22.4g可有:64x+80y=22.4…①
根据混合液稀释至1000mL,c(Cu2+)=0.3mol/L,可有:x+y=0.3…②
解①②得:x=0.1mol、y=0.2mol;
(1)Cu与浓硫酸反应放出SO2气体,设生成气体的物质的量为amol,根据反应:
可得:=,解得:a=0.1mol;
由于是标况下,故体积V=n Vm=0.1mol×22.4L/mol=2.24L;故答案为:2.24L;
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol,n(H2SO4)反应=2x+y=0.4mol,n(H2SO4)余=0.92mol 0.4mol=0.52mol,故c(H+)=0.52mol×2÷1L=1.04mol/L,故答案为:1.04mol/L.
15.(1)4FeS2+11O22Fe2O3+8SO2
(2)BC
(3)SO2+2OH-=SO+H2O
(4) 有淡黄色沉淀生成 氧化 还原 5SO2+2H2O+2MnO=5SO+2Mn2++4H+ 防倒吸
解析:(1)反应FeS2+O2Fe2O3+SO2中,Fe的化合价从+2价升高为+3价,S的化合价从-1价升高为+4价,O的化合价从0价降低为-2价,则FeS2为还原剂,1molFeS2失去11mol电子,O2为氧化剂,1molO2得电子为4mol,根据得失电子守恒、元素守恒可配平该化学方程式4FeS2+11O22Fe2O3+8SO2。
(2)A.加快通入SO3的速率,SO3吸收不充分,故A错误;
B.采用气、液逆流吸收,能增加接触时间,SO3能被充分吸收,故B正确;
C.将98%硫酸以喷淋方式与SO3接触吸收,接触面积大,SO3能被充分吸收,故C正确;
故选BC。
(3)SO2被NaOH溶液吸收,反应生成亚硫酸钠和水,反应离子方程式为SO2+2OH-=SO+H2O。
(4)①SO2与H2S溶液反应生成S单质,则E中的实验现象为有淡黄色沉淀生成,SO2中S元素化合价降低,证明SO2具有氧化性。
②KMnO4溶液具有强氧化性,SO2具有还原性,二者可以发生氧化还原反应,故通入SO2后,F中的酸性KMnO4溶液褪色,证明SO2具有还原性,根据得失电子守恒、电荷守恒、元素守恒配平离子方程式为5SO2+2H2O+2MnO=5SO+2Mn2++4H+。
③H中使用倒置漏斗的目的是防倒吸。
16. 分液漏斗 Na2SO3(或K2SO3或NaHSO3或KHSO3等) 2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4 溶液蓝色褪去 d acd 防止CuBr被氧化 用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥
【分析】(1)根据装置图中仪器M的结构可知该仪器的名称。
(2)根据复分解反应的规律可用70%的H2SO4与亚硫酸盐或亚硫酸氢盐反应。
(3)在B中BaBr、SO2、CuSO4、H2O会发生氧化还原反应产生CuBr沉淀,利用电子守恒、原子守恒,可得该反应的化学方程式,Cu2+的水溶液显蓝色,通过颜色变化判断反应是否完全,由于CuSO4具有氧化性,加入还原性的物质发生氧化还原反应,但不能引入新的杂质。
(4)A. 漏斗末端紧靠烧杯内壁,就可以使过滤得到的滤液沿烧杯内壁不断进入到烧杯中;B. 将滤纸润湿,使其紧贴漏斗内壁,就可以使混合物充分分离;C. 为了使难溶性的固体与液体物质分离,滤纸边缘要低于漏斗口边缘;D. 用玻璃棒引流,使混合物进入到过滤器中,在漏斗中不能用玻璃棒搅动,否则会使滤纸破损,导致不能过滤,不能分离混合物。
(5)CuBr具有还原性,用H2SO3溶液洗涤,就可以避免CuBr被空气中的氧气氧化,然后依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
解析:(1)根据装置图中仪器M的结构可知该仪器的名称是分液漏斗;故答案为:分液漏斗。
(2)根据复分解反应的规律可用70%的H2SO4与Na2SO3或K2SO3或NaHSO3或KHSO3等反应制取SO2气体,反应方程式为H2SO4+Na2SO3=Na2SO4+H2O+SO2↑;故答案为:Na2SO3(或K2SO3或NaHSO3或KHSO3等)。
(3)在B中BaBr、SO2、CuSO4、H2O会发生氧化还原反应产生CuBr沉淀,利用电子守恒、原子守恒,可得该反应的化学方程式为:2CuSO4+2NaBr + SO2 + 2H2O= 2CuBr↓ + Na2SO4 + 2H2SO4,Cu2+的水溶液显蓝色,若反应完全,则溶液中不再含有Cu2+,溶液的蓝色褪去,由于CuSO4具有氧化性,加入还原性的物质发生氧化还原反应,但不能引入新的杂质,因此若B中Cu2+仍未完全被还原,适宜加入的试剂是Na2S2O3,故答案为:2CuSO4+2NaBr + SO2 + 2H2O= 2CuBr↓ + Na2SO4 + 2H2SO4;D。
(4)A. 漏斗末端紧靠烧杯内壁,就可以使过滤得到的滤液沿烧杯内壁不断进入到烧杯中,故A错误;B. 将滤纸润湿,使其紧贴漏斗内壁,就可以使混合物充分分离,故B正确;C. 为了使难溶性的固体与液体物质分离,滤纸边缘要低于漏斗口边缘,故C错误;D. 用玻璃棒引流,使混合物进入到过滤器中,在漏斗中不能用玻璃棒搅动,否则会使滤纸破损,导致不能过滤,不能分离混合物,故D错误;故答案为:ACD。
(5)SO2是大气污染物,为防止其污染环境,用蒸馏水吸收SO2,得到H2SO3溶液,该物质具有还原性,用H2SO3溶液洗涤,就可以避免CuBr被空气中的氧气氧化,然后依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥;故答案为:防止CuBr被氧化;用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
17. HSO3-+H+=SO2↑+H2O HS-+OH-=S2-+H2O
【分析】A、 B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;D与A同主族,D原子序数大于氮,故D为Na;D与E同周期,则E处于第三周期,E元素原子的最外层电子数是其次外层电子数的,最外层电子数为6,故E为S元素;结合原子序数可知,C为O、F元素中的一种,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,可推知C为O元素。
解析:(1)B为N元素,电子式为;;
(2)A、C、D、E可形成两种酸式盐为NaHSO3和NaHSO4,离子反应为HSO3-+H+=SO2↑+H2O;
(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
