人教版(2019)必修一 1.3 氧化还原反应 课件(共26张PPT)
文档属性
| 名称 | 人教版(2019)必修一 1.3 氧化还原反应 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:34:45 | ||
图片预览





文档简介
(共26张PPT)
氧化还原反应
食物腐烂
铁链生锈
皮肤衰老
木材燃烧
一、氧化还原概念的发展史(书本P23)
1774年,法国化学家拉瓦锡提出燃烧的氧化学说
人们把物质与氧结合的反应叫做氧化反应
把氧化物失去氧的反应叫做还原反应
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价概念
人们把化合价升高的反应叫做氧化反应
把化合价降低的反应叫做还原反应
1897年,英国物理学家汤姆孙发现电子
人们将原子失去电子(或电子对偏离)的反应叫做氧化反应
把原子得到电子(或电子对偏离)的反应叫做还原反应
通过发展史的阅读,你能感受到什么?
表 象
特 征
本 质
辩一辩:下列哪些反应属于氧化还原反应并说出判断理由
① Na2O+H2O=2NaOH
② 2Na+Cl2=2NaCl
③ Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
④ H2SO3+I2+H2O=2HI+H2SO4
⑤ CaCO3==CaO+CO2
⑥ Mg+2HCl=MgCl2+H2
高温
判断依据:化合价发生变化
表 观 特 征
化合价为什么会发生变化呢?
-e-
+ e-
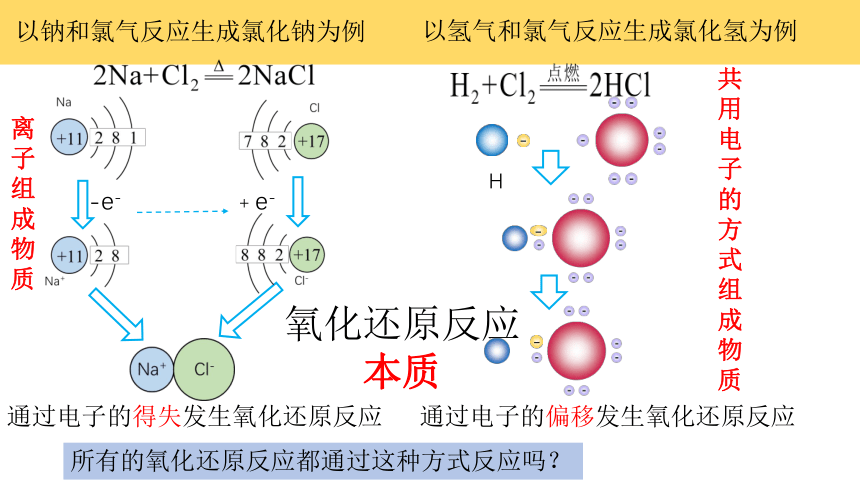
以钠和氯气反应生成氯化钠为例
﹣
H
以氢气和氯气反应生成氯化氢为例
通过电子的得失发生氧化还原反应
所有的氧化还原反应都通过这种方式反应吗?
通过电子的偏移发生氧化还原反应
氧化还原反应本质
﹣
﹣
离子组成物质
共用电子的方式组成物质
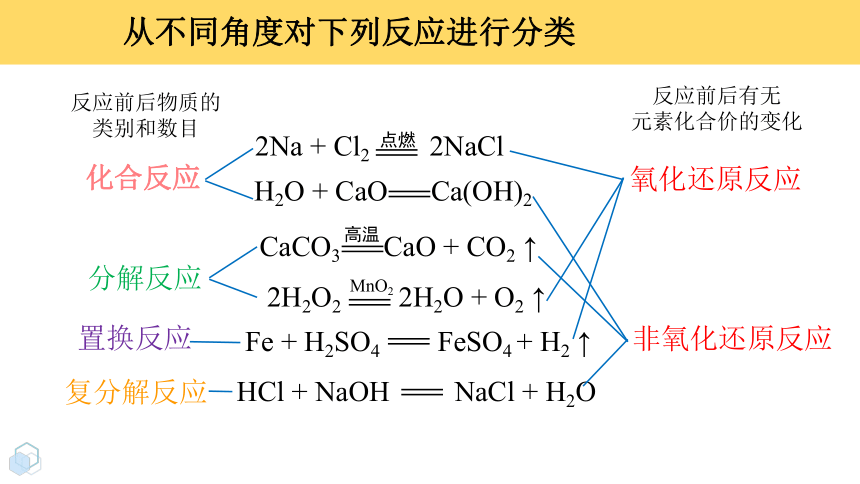
2Na + Cl2 2NaCl
点燃
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2 ↑
高温
2H2O2 2H2O + O2 ↑
MnO2
Fe + H2SO4 FeSO4 + H2 ↑
HCl + NaOH NaCl + H2O
化合反应
分解反应
置换反应
复分解反应
从不同角度对下列反应进行分类
氧化还原反应
非氧化还原反应
反应前后物质的
类别和数目
反应前后有无
元素化合价的变化
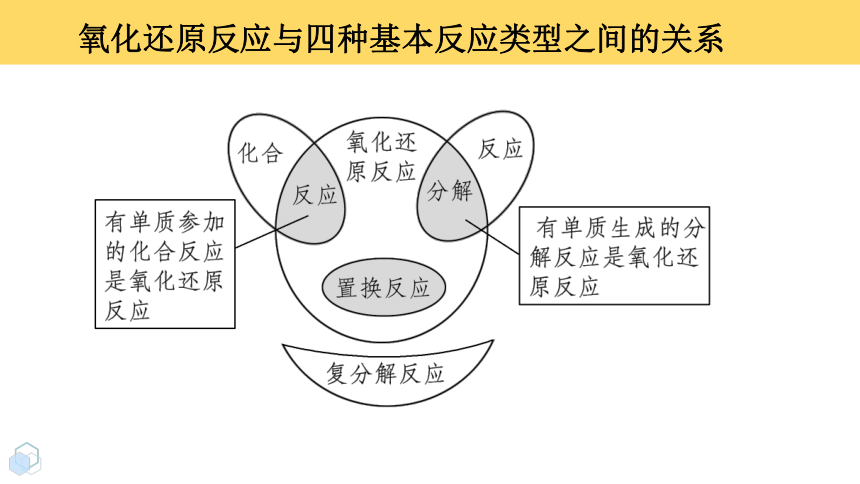
氧化还原反应与四种基本反应类型之间的关系
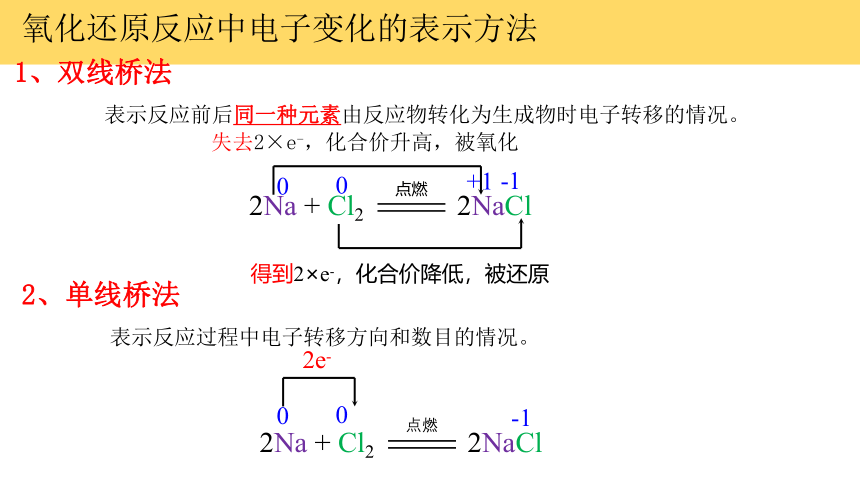
氧化还原反应中电子变化的表示方法
1、双线桥法
2、单线桥法
表示反应前后同一种元素由反应物转化为生成物时电子转移的情况。
2Na + Cl2 2NaCl
点燃
0
0
+1
-1
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
表示反应过程中电子转移方向和数目的情况。
2Na + Cl2 2NaCl
点燃
0
0
-1
2e-
练一练:请用双线桥法表示下列反应的电子变化情况
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
3CO+Fe2O3===3CO2+2Fe
加热
2FeCl3+Fe=3FeCl2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
注意:同一种元素不同价态之间的氧化还原反应需满足价态只靠拢不交叉的原则
KClO3+6HCl=KCl+3Cl2+3H2O
二、常见的氧化剂和还原剂
1、氧化剂和还原剂
氧化剂
还原剂
n e-
氧化还原反应中所含元素的化合价降低,得到电子(或电子对偏向)的物质
氧化还原反应中所含元素的化合价升高,失去电子(或电子对偏离)的物质
2、氧化性和还原性
什么剂具有什么性
氧化性:物质得电子性质,氧化剂具有氧化性。且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。且物质失电子越容易还原性越强
注意:氧化性、还原性强弱与价态、得失电子数目没有必然关联!!!
氧化剂具有 性,被 ,发生 反应,得到 产物
还原剂具有 性,被 ,发生 反应,得到 产物
氧化
还原
还原
还原
还原
氧化
氧化
氧化
想一想:初中里你所学过的反应中,氧化剂和还原剂是同一种物质有哪些?
氧化产物和还原产物是同一种物质有哪些?
Attention
没有独立存在的氧化反应或者还原反应!
在氧化还原反应中:
常见的氧化剂与还原剂
常见的氧化剂 常见的还原剂
活泼的非金属单质 活泼的金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
其他 其他
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
HClO、MnO2
浓盐酸、NH3
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(8)在同一反应中,氧化剂和还原剂不可能是同一物质( )
(9)某物质在氧化还原反应中是氧化产物,则必然有另一物质是还原产物
( )
×
√
×
×
×
×
×
×
×
辩一辩
分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
氧化剂是___,还原剂是 ;发生氧化反应的是___,发生还原反应的是___。
(2)2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是_______,还原剂是_______;被氧化的元素是 ,被还原的元素是 。
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是_____,还原剂是_____;氧化产物是_____,还原产物是____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
说一说
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
氧化性、还原性强弱比较的方法
(1)根据氧化还原反应方程式比较
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
如:2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性:FeCl3 I2
还原性:HI FeCl2
>
>
如:Cl2+2NaBr===2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
(2)根据元素的活动性顺序比较
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
还原
还原
氧化
氧化
氧化性、还原性强弱比较的方法
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
(3)根据反应进行的难易程度(反应条件)来判断
氧化性: KMnO4> MnO2
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强
氧化性、还原性强弱比较的方法
(4.)根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:_______
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+ 3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
点燃
Cl2 > S
Zn > Cu
△
氧化性、还原性强弱比较的方法
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
氧化性、还原性强弱比较的方法
【练习1】下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
【练习2】PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+==Cu2++2Fe2+
B.10Cl-+2MnO4- +16H+===2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl2 ===2Fe3++2Cl-
D.5Pb2++2 MnO4- +2H2O===5PbO2+2Mn2++4H+
【练习3】在反应3Cl2+8NH3===6NH4Cl+N2中,被氧化的NH3与未被氧化的NH3质量比为
A.3∶8 B.1∶4 C.3∶4 D.1∶3
三、氧化还原反应的配平
1.守恒规律
氧化还原反应中,(1)氧化剂得电子总数等于还原剂失电子总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2、氧化还原反应配平的基本步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
练一练:请把下列反应配平
1、C+ HNO3(浓)== CO2 + NO2 + H2O
3、Cl2+ NaOH == NaCl + NaClO3 + H2O
4、Cu+ HNO3(稀)== Cu(NO3)2 + NO + H2O
2、H2SO4 + KMnO4 + H2C2O4 == CO2 + K2SO4 + MnSO4 + H2O
5、FeS2 + O2 == Fe2O3 + SO2
6、P+CuSO4+H2O=H3PO4+Cu3P+H2SO4
【练习1】元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的
Cr2O3固体 绿色KCrO2溶液 黄色K2CrO4溶液
橙红色K2Cr2O7溶液
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应②的离子方程式为2CrO2- +3H2O2+2OHˉ=2CrO42- +4H2O
D.反应①②③中铬元素的化合价均发生了变化
【练习2】储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O:
(2)上述反应中氧化剂是_____ (填化学式),被氧化的元素是____(填元素符号)。
(3) H2SO4在上述反应中表现的性质是______(填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
【练习3】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl
②Q+H2O―→X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
四、氧化还原反应的应用
1、葡萄酒里会添加少量SO2
2、食品包装中的脱氧剂
氧化还原反应
食物腐烂
铁链生锈
皮肤衰老
木材燃烧
一、氧化还原概念的发展史(书本P23)
1774年,法国化学家拉瓦锡提出燃烧的氧化学说
人们把物质与氧结合的反应叫做氧化反应
把氧化物失去氧的反应叫做还原反应
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价概念
人们把化合价升高的反应叫做氧化反应
把化合价降低的反应叫做还原反应
1897年,英国物理学家汤姆孙发现电子
人们将原子失去电子(或电子对偏离)的反应叫做氧化反应
把原子得到电子(或电子对偏离)的反应叫做还原反应
通过发展史的阅读,你能感受到什么?
表 象
特 征
本 质
辩一辩:下列哪些反应属于氧化还原反应并说出判断理由
① Na2O+H2O=2NaOH
② 2Na+Cl2=2NaCl
③ Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
④ H2SO3+I2+H2O=2HI+H2SO4
⑤ CaCO3==CaO+CO2
⑥ Mg+2HCl=MgCl2+H2
高温
判断依据:化合价发生变化
表 观 特 征
化合价为什么会发生变化呢?
-e-
+ e-
以钠和氯气反应生成氯化钠为例
﹣
H
以氢气和氯气反应生成氯化氢为例
通过电子的得失发生氧化还原反应
所有的氧化还原反应都通过这种方式反应吗?
通过电子的偏移发生氧化还原反应
氧化还原反应本质
﹣
﹣
离子组成物质
共用电子的方式组成物质
2Na + Cl2 2NaCl
点燃
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2 ↑
高温
2H2O2 2H2O + O2 ↑
MnO2
Fe + H2SO4 FeSO4 + H2 ↑
HCl + NaOH NaCl + H2O
化合反应
分解反应
置换反应
复分解反应
从不同角度对下列反应进行分类
氧化还原反应
非氧化还原反应
反应前后物质的
类别和数目
反应前后有无
元素化合价的变化
氧化还原反应与四种基本反应类型之间的关系
氧化还原反应中电子变化的表示方法
1、双线桥法
2、单线桥法
表示反应前后同一种元素由反应物转化为生成物时电子转移的情况。
2Na + Cl2 2NaCl
点燃
0
0
+1
-1
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
表示反应过程中电子转移方向和数目的情况。
2Na + Cl2 2NaCl
点燃
0
0
-1
2e-
练一练:请用双线桥法表示下列反应的电子变化情况
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
3CO+Fe2O3===3CO2+2Fe
加热
2FeCl3+Fe=3FeCl2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
注意:同一种元素不同价态之间的氧化还原反应需满足价态只靠拢不交叉的原则
KClO3+6HCl=KCl+3Cl2+3H2O
二、常见的氧化剂和还原剂
1、氧化剂和还原剂
氧化剂
还原剂
n e-
氧化还原反应中所含元素的化合价降低,得到电子(或电子对偏向)的物质
氧化还原反应中所含元素的化合价升高,失去电子(或电子对偏离)的物质
2、氧化性和还原性
什么剂具有什么性
氧化性:物质得电子性质,氧化剂具有氧化性。且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。且物质失电子越容易还原性越强
注意:氧化性、还原性强弱与价态、得失电子数目没有必然关联!!!
氧化剂具有 性,被 ,发生 反应,得到 产物
还原剂具有 性,被 ,发生 反应,得到 产物
氧化
还原
还原
还原
还原
氧化
氧化
氧化
想一想:初中里你所学过的反应中,氧化剂和还原剂是同一种物质有哪些?
氧化产物和还原产物是同一种物质有哪些?
Attention
没有独立存在的氧化反应或者还原反应!
在氧化还原反应中:
常见的氧化剂与还原剂
常见的氧化剂 常见的还原剂
活泼的非金属单质 活泼的金属单质
高价态化合物 低价态化合物
过氧化物 某些非金属单质
其他 其他
Cl2、O2
Al、Fe、Zn
浓硫酸、KMnO4、HNO3、 FeCl3
CO、SO2、KI
Na2O2、H2O2
C、H2、S
HClO、MnO2
浓盐酸、NH3
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(8)在同一反应中,氧化剂和还原剂不可能是同一物质( )
(9)某物质在氧化还原反应中是氧化产物,则必然有另一物质是还原产物
( )
×
√
×
×
×
×
×
×
×
辩一辩
分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
氧化剂是___,还原剂是 ;发生氧化反应的是___,发生还原反应的是___。
(2)2KMnO4 K2MnO4+MnO2+O2↑
氧化剂是_______,还原剂是_______;被氧化的元素是 ,被还原的元素是 。
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是_____,还原剂是_____;氧化产物是_____,还原产物是____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
说一说
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
氧化性、还原性强弱比较的方法
(1)根据氧化还原反应方程式比较
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
>
>
如:2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性:FeCl3 I2
还原性:HI FeCl2
>
>
如:Cl2+2NaBr===2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物。
(2)根据元素的活动性顺序比较
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
还原
还原
氧化
氧化
氧化性、还原性强弱比较的方法
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
(3)根据反应进行的难易程度(反应条件)来判断
氧化性: KMnO4> MnO2
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强
氧化性、还原性强弱比较的方法
(4.)根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:_______
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+ 3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
点燃
Cl2 > S
Zn > Cu
△
氧化性、还原性强弱比较的方法
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
氧化性、还原性强弱比较的方法
【练习1】下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
【练习2】PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+==Cu2++2Fe2+
B.10Cl-+2MnO4- +16H+===2Mn2++5Cl2↑+8H2O
C.2Fe2++Cl2 ===2Fe3++2Cl-
D.5Pb2++2 MnO4- +2H2O===5PbO2+2Mn2++4H+
【练习3】在反应3Cl2+8NH3===6NH4Cl+N2中,被氧化的NH3与未被氧化的NH3质量比为
A.3∶8 B.1∶4 C.3∶4 D.1∶3
三、氧化还原反应的配平
1.守恒规律
氧化还原反应中,(1)氧化剂得电子总数等于还原剂失电子总数。
应用:氧化还原反应方程式的配平,氧化还原反应的相关计算。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2、氧化还原反应配平的基本步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
练一练:请把下列反应配平
1、C+ HNO3(浓)== CO2 + NO2 + H2O
3、Cl2+ NaOH == NaCl + NaClO3 + H2O
4、Cu+ HNO3(稀)== Cu(NO3)2 + NO + H2O
2、H2SO4 + KMnO4 + H2C2O4 == CO2 + K2SO4 + MnSO4 + H2O
5、FeS2 + O2 == Fe2O3 + SO2
6、P+CuSO4+H2O=H3PO4+Cu3P+H2SO4
【练习1】元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的
Cr2O3固体 绿色KCrO2溶液 黄色K2CrO4溶液
橙红色K2Cr2O7溶液
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应②的离子方程式为2CrO2- +3H2O2+2OHˉ=2CrO42- +4H2O
D.反应①②③中铬元素的化合价均发生了变化
【练习2】储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O:
(2)上述反应中氧化剂是_____ (填化学式),被氧化的元素是____(填元素符号)。
(3) H2SO4在上述反应中表现的性质是______(填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
【练习3】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl
②Q+H2O―→X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
四、氧化还原反应的应用
1、葡萄酒里会添加少量SO2
2、食品包装中的脱氧剂
