人教版(2019)选择性必修第二册 2.2 分子的空间结构 课件(共22张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修第二册 2.2 分子的空间结构 课件(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:35:35 | ||
图片预览



文档简介
(共22张PPT)
第二节 分子的空间结构
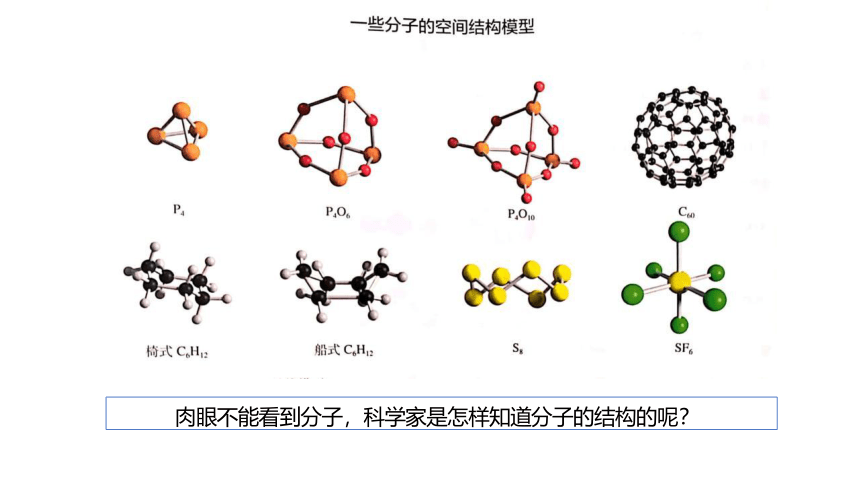
肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
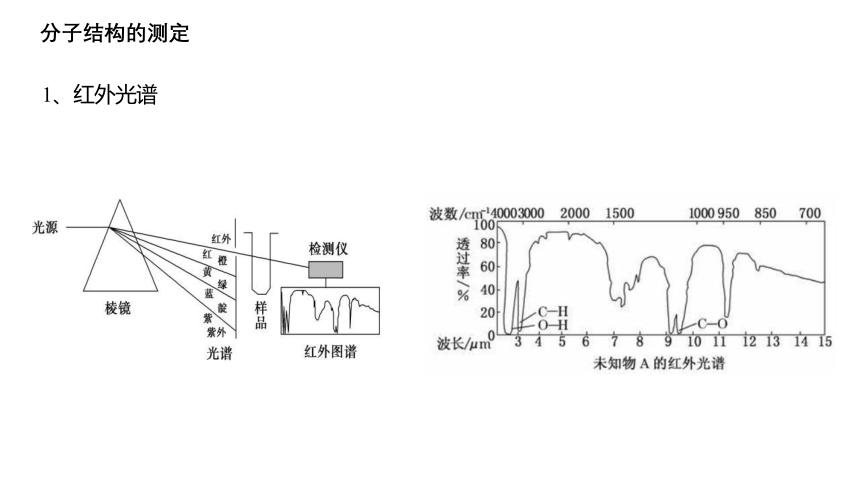
分子中的原子不是固定不动的,而是处于不断振动着的。 红外线透过分子时,分子会吸收跟它的某些化学键的振动 频率相同的红外线,再记录到谱图上呈现吸收峰。通过和 已有谱图库比对,或通过量子化学计算,可以得知分子中 含有何种化学键或官能团的信息。
一 、分子结构的测定
测定分子结构的现代仪器和方法
红外光谱
晶体X射线衍射
分子结构的测定
1、红外光谱
分子结构的测定
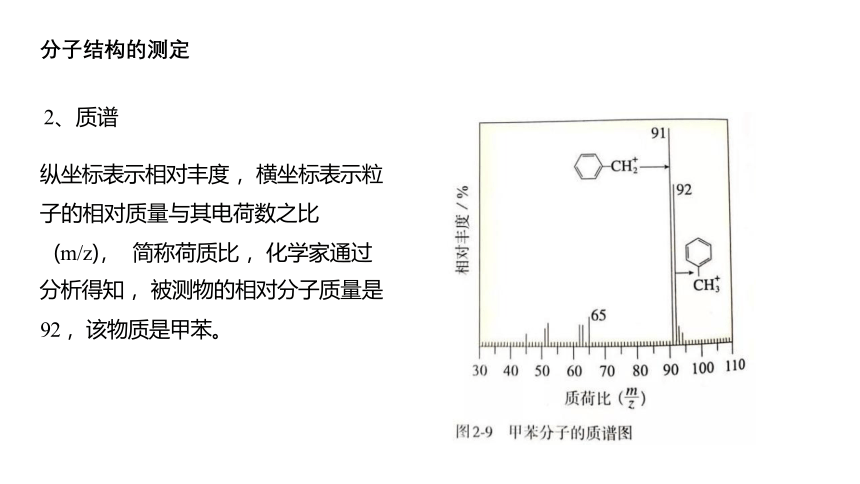
2、质谱
纵坐标表示相对丰度 ,横坐标表示粒 子的相对质量与其电荷数之比
(m/z), 简称荷质比 ,化学家通过
分析得知 ,被测物的相对分子质量是 92 ,该物质是甲苯。
B
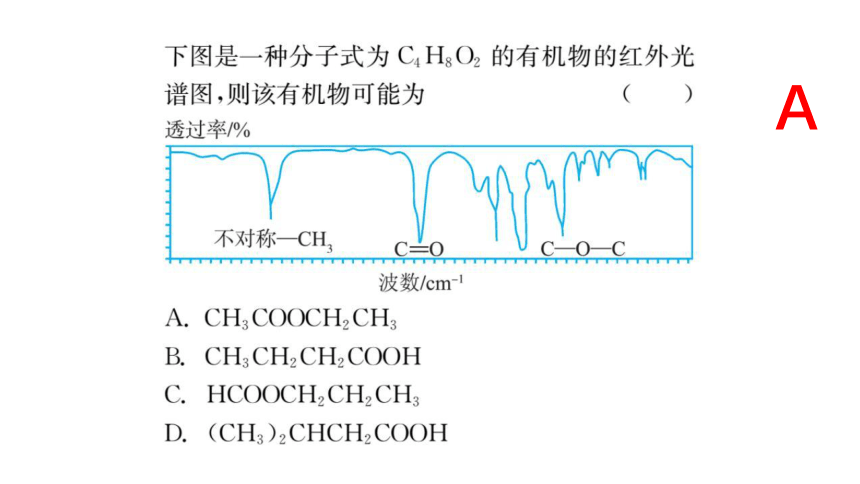
A
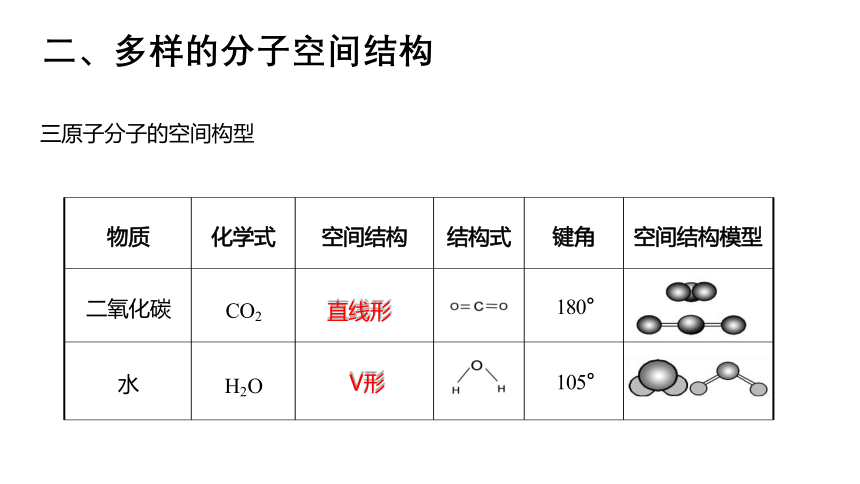
物质 化学式 空间结构 结构式 键角
空间结构模型
二氧化碳 CO2 直线形 180°
水 H2O V形 105°
二、多样的分子空间结构
三原子分子的空间构型
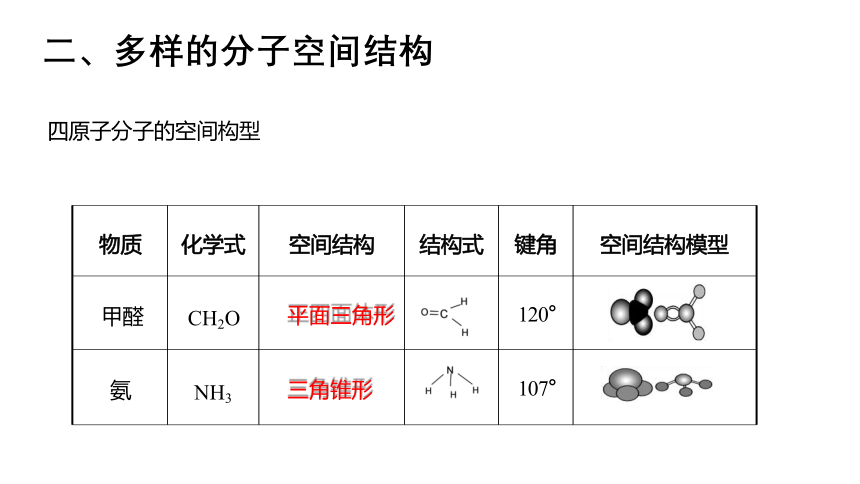
物质 化学式 空间结构 结构式 键角
空间结构模型
甲醛 CH2O 平面三角形 120°
氨 NH3 三角锥形 107°
二、多样的分子空间结构
四原子分子的空间构型
物质 化学式 空间结构 结构式 键角
空间结构模型
甲烷 CH4 正四面体形 109°28′
四氯化碳 CCl4 正四面体形 109°28′
二、多样的分子空间结构
五原子分子的空间构型
分子类型 键角 立体构型
实例
AB2 180° 直线形
CO2 、BeCl2 、CS2
<180° V形
H2O、H2 S
AB3 120° 平面三角形
BF3 、BCl3
<120° 三角锥形
NH3 、H3O+、PH3
AB4 109°28′ 正四面体形
CH4 、NH4+、CCl4
二、多样的分子空间结构
分子的立体构型与键角的关系:
C
键电子
三、价层电子对互斥模型(VSEPR)
价层电子对互斥模型:分子的空间结构是中心原子周围的“价层电子对”相 互排斥的结果。
VSEPR的“价层电子对”是指分子中的中心原子与结合原子间的
对和中心原子上的孤电子对。多重键只计其中的σ键电子对,不计π电 子对。
σ键电子对可由化学式确定
分子 中心原子 共价键 键数
键电子对数
H2O O O-H 2
2
NH3 N N-H 3
3
SO3 S S=O 2
σ
2
8
其中: a表示中心原子的价电子数
对主族元素: a= 最外层电子数;
对于阳离子: a=价电子数- ;
对于阴离子: a= + 。 x为与中心原子结合的 原子数 。 b为与中心原子结合的原子 , H为1,其他原子= ﹣ 。
中心原子上的价层电子对数的计算
最多能接受的电子数
该原子的价电子数
价电子数
电荷数
电荷数
价层电子对互斥模型(VSEPR)
以S和P为例,说明如何根据主族元素在周期表中的位置确定它
的价电子数
S的价电子数是6 ,P的价电子数是5
以N和Cl为例,说明如何根据主族元素在周期表中的位置确定 它最多能接受的电子数。
N最多能接受的电子数是3, Cl最多能接受的电子数1
价层电子对互斥模型(VSEPR)
几种分子或离子的中心原子上的孤电子对数
计算H2O、NH3、 SO3、NH4+、 CO32-分子的孤电子对数。
分子或 离子 中心原 子 a x b
中心原子上的 孤电子对数
H2O O 6 2 2
2
NH3 N 5 3 1
1
SO3 S 6 3 2
0
NH4+ N 5- 1=4 4 1
0
CO32- C
4+2=6
3
0
2
分子或离子 孤电子对数 价层电子对数 VSEPR模型名 称
分子或离子的
空间结构名称
CO2 0 2 直线形
直线形
SO2 1 3 平面三角形
V形
CO32- 0 3 平面三角形
平面三角形
H2O 2 4 正四面体
V形
NH3 1 4 正四面体
三角锥形
CH4 0 4 正四面体
正四面体
NH4+ 4 正四面体
几种分子或离子的中心原子上的空间构型
正四面体
0
实例 G键电 子对 数 孤电子 对数 价层电 子对数 电子对的排 列方式 VSEPR模 型
分子的立 体构型
BeCl2、 CO2 2 0 2 直线形
直线形
BF3 、BCl3 3 0 3 平面三角形
SO2 2 1
V形
CH4 、CCl4 4 0 4 正四面体形
四面体形
NH3 3 1
三角锥形
H2O 2 2
V形
常见分子或离子的空间构型
平面三角形
对于ABn型分子,利用VSEPR模型预测分子空间结构的思路:
根据价层电子对互斥模型判断分子的空间构型
σ键电子对数+孤电子
对数=价层电子对数
分子立体构型
VSEPR模型
第二节 分子的空间结构
肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
分子中的原子不是固定不动的,而是处于不断振动着的。 红外线透过分子时,分子会吸收跟它的某些化学键的振动 频率相同的红外线,再记录到谱图上呈现吸收峰。通过和 已有谱图库比对,或通过量子化学计算,可以得知分子中 含有何种化学键或官能团的信息。
一 、分子结构的测定
测定分子结构的现代仪器和方法
红外光谱
晶体X射线衍射
分子结构的测定
1、红外光谱
分子结构的测定
2、质谱
纵坐标表示相对丰度 ,横坐标表示粒 子的相对质量与其电荷数之比
(m/z), 简称荷质比 ,化学家通过
分析得知 ,被测物的相对分子质量是 92 ,该物质是甲苯。
B
A
物质 化学式 空间结构 结构式 键角
空间结构模型
二氧化碳 CO2 直线形 180°
水 H2O V形 105°
二、多样的分子空间结构
三原子分子的空间构型
物质 化学式 空间结构 结构式 键角
空间结构模型
甲醛 CH2O 平面三角形 120°
氨 NH3 三角锥形 107°
二、多样的分子空间结构
四原子分子的空间构型
物质 化学式 空间结构 结构式 键角
空间结构模型
甲烷 CH4 正四面体形 109°28′
四氯化碳 CCl4 正四面体形 109°28′
二、多样的分子空间结构
五原子分子的空间构型
分子类型 键角 立体构型
实例
AB2 180° 直线形
CO2 、BeCl2 、CS2
<180° V形
H2O、H2 S
AB3 120° 平面三角形
BF3 、BCl3
<120° 三角锥形
NH3 、H3O+、PH3
AB4 109°28′ 正四面体形
CH4 、NH4+、CCl4
二、多样的分子空间结构
分子的立体构型与键角的关系:
C
键电子
三、价层电子对互斥模型(VSEPR)
价层电子对互斥模型:分子的空间结构是中心原子周围的“价层电子对”相 互排斥的结果。
VSEPR的“价层电子对”是指分子中的中心原子与结合原子间的
对和中心原子上的孤电子对。多重键只计其中的σ键电子对,不计π电 子对。
σ键电子对可由化学式确定
分子 中心原子 共价键 键数
键电子对数
H2O O O-H 2
2
NH3 N N-H 3
3
SO3 S S=O 2
σ
2
8
其中: a表示中心原子的价电子数
对主族元素: a= 最外层电子数;
对于阳离子: a=价电子数- ;
对于阴离子: a= + 。 x为与中心原子结合的 原子数 。 b为与中心原子结合的原子 , H为1,其他原子= ﹣ 。
中心原子上的价层电子对数的计算
最多能接受的电子数
该原子的价电子数
价电子数
电荷数
电荷数
价层电子对互斥模型(VSEPR)
以S和P为例,说明如何根据主族元素在周期表中的位置确定它
的价电子数
S的价电子数是6 ,P的价电子数是5
以N和Cl为例,说明如何根据主族元素在周期表中的位置确定 它最多能接受的电子数。
N最多能接受的电子数是3, Cl最多能接受的电子数1
价层电子对互斥模型(VSEPR)
几种分子或离子的中心原子上的孤电子对数
计算H2O、NH3、 SO3、NH4+、 CO32-分子的孤电子对数。
分子或 离子 中心原 子 a x b
中心原子上的 孤电子对数
H2O O 6 2 2
2
NH3 N 5 3 1
1
SO3 S 6 3 2
0
NH4+ N 5- 1=4 4 1
0
CO32- C
4+2=6
3
0
2
分子或离子 孤电子对数 价层电子对数 VSEPR模型名 称
分子或离子的
空间结构名称
CO2 0 2 直线形
直线形
SO2 1 3 平面三角形
V形
CO32- 0 3 平面三角形
平面三角形
H2O 2 4 正四面体
V形
NH3 1 4 正四面体
三角锥形
CH4 0 4 正四面体
正四面体
NH4+ 4 正四面体
几种分子或离子的中心原子上的空间构型
正四面体
0
实例 G键电 子对 数 孤电子 对数 价层电 子对数 电子对的排 列方式 VSEPR模 型
分子的立 体构型
BeCl2、 CO2 2 0 2 直线形
直线形
BF3 、BCl3 3 0 3 平面三角形
SO2 2 1
V形
CH4 、CCl4 4 0 4 正四面体形
四面体形
NH3 3 1
三角锥形
H2O 2 2
V形
常见分子或离子的空间构型
平面三角形
对于ABn型分子,利用VSEPR模型预测分子空间结构的思路:
根据价层电子对互斥模型判断分子的空间构型
σ键电子对数+孤电子
对数=价层电子对数
分子立体构型
VSEPR模型
