人教版(2019)必修一 4.1.1 原子结构 元素周期表 核素 课件(共23张PPT)
文档属性
| 名称 | 人教版(2019)必修一 4.1.1 原子结构 元素周期表 核素 课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:35:51 | ||
图片预览







文档简介
(共23张PPT)
第四章 物质结构 元素周期律
第一节
原子结构与元素周期表
第一课时
一、原子结构
原子结构与元素周期表
根据初中的化学知识,同学们描述一下原子的结构
原子
原子核
核外电子
质子
中子
体积很小
质量很大
质量近似相等
质量可以忽略
一、原子结构
原子结构与元素周期表
相对原子质量:
原子的质量与一个12C原子质量的1/12的比值
已知:质子和中子的相对质量都近似等于1,则质量数应该如何计算?
质量数:
粒子中所有质子和中子的相对质量取近似整数值相加
质量数(A)=质子数(Z)+中子数(N)
为什么质子数和中子数之和会叫做质量数呢?
在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大
一、原子结构
原子结构与元素周期表
质量数(A)=质子数(Z)+中子数(N)
根据质量数的定义,可以将一个具体的原子表示如下:
原子
原子核
核外电子
质子
中子
Z个
Z个
(A-Z)个
什么是12C原子?
6个质子
6个电子
6个中子
一、原子结构
原子结构与元素周期表
K、L、M、N、O、P、Q
电子层
n=1, 2, 3, 4, 5, 6, 7
离核较近的电子层中的电子能量低,所以电子总是由内向外排列的
电子的排列还要符合什么规律呢?
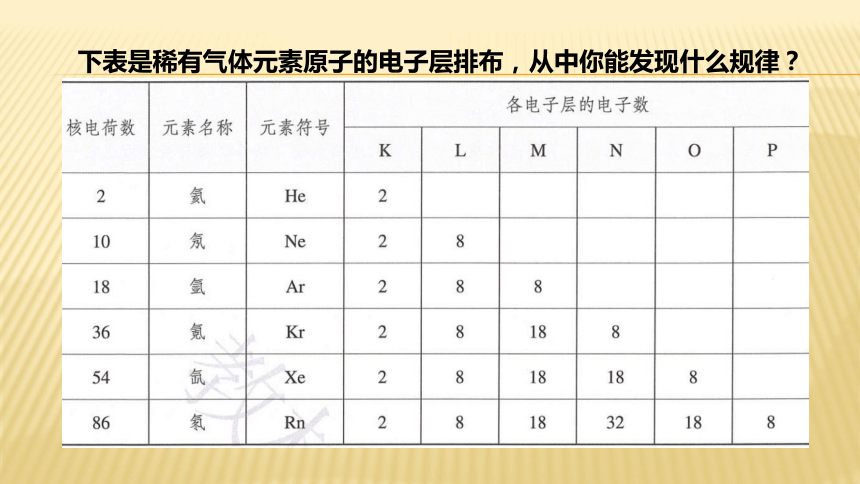
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
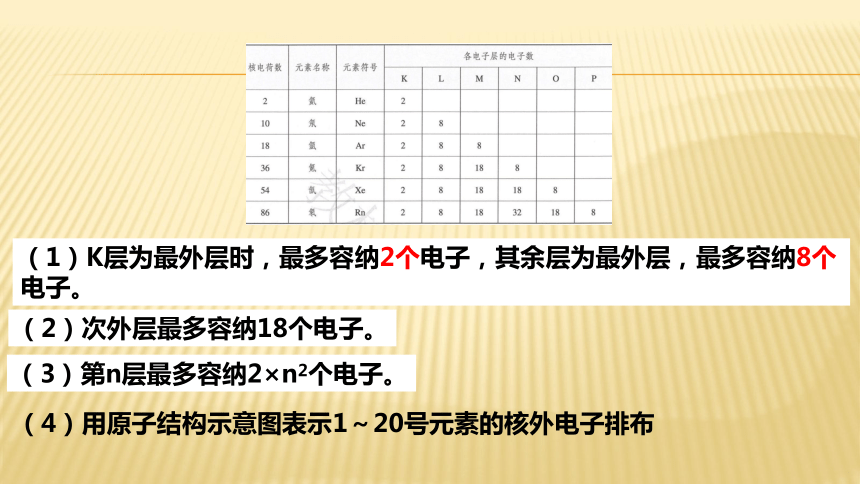
(1)K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。
(2)次外层最多容纳多少电子?
(3)第n层最多容纳多少电子?
(4)用原子结构示意图表示1~20号元素的核外电子排布
(2)次外层最多容纳18个电子。
(3)第n层最多容纳2×n2个电子。
前20号元素的核外电子排布
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
根据上述规律,写出33号元素的原子结构示意图
门捷列夫绘制的第一张元素周期表是按照元素的相对原子质量来排列的,随着科学家对原子结构认识的不断深入,元素周期表中元素的排列依据也由相对原子质量改为核电荷数。
一、原子结构
原子结构与元素周期表
二、元素周期表
原子序数=核电荷数=质子数=核外电子数
元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
一个横行作为1个周期
7个
一
二
三
四
五
六
七
一列作为1个族(第8、9、10三列统称为第Ⅷ族)
16个
第Ⅷ族
填写下表,并思考周期序数与元素的原子核外电子层数之间的关系
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
周期序数等于原子核外电子层数
短周期
长周期
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
练习:指出Si在周期表中的位置
ⅣA族
三
Si在周期表中的位置为:第三周期第ⅣA族
元素周期表中每一个格都标有元素的基本信息
最早提出原子概念的是英国化学家道尔顿,他提出了如下三个观点:
1、原子是不可再分的实心球体;
2、同种元素的原子性质和质量都相同;
3、不同元素的原子性质和质量不相同。
现在看来道尔顿的观点实际都是错误的,原子当然不是不可再分的,那么同种元素的原子性质和质量都相同吗?
一、原子结构
原子结构与元素周期表
二、元素周期表
元素是具有相同质子数(核电荷数)的一类原子的统称,即同种元素的原子一定具有相同的质子数,但是同种元素的原子的中子数不一定相同
三、核素
氢元素的原子有三种不同的组成
原子结构与元素周期表
核素:具有一定数目的质子和一定数目的中子的一种原子
三、核素
例如:
就是氢元素的不同核素
同位素:同一元素的不同核素互称同位素
质子数相同
中子数不同
和
互为同位素,则有:
Z1=Z2;A1≠A2
原子结构与元素周期表
同位素有天然存在和人工制造的区别,元素的天然同位素保持一定的比率不变,元素的平均相对原子质量就是按照该元素各种核素的比率计算的算术平均值。
三、核素
有的同位素具有放射性,称为放射性同位素。
同位素有很多用途:考古时利用14C测定文物的年代;D和T用于制造氢弹;利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,没有个数
化学反应中的最小微粒
化学性质几乎完全相同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
O2、O3互为同素异形体
项目
内容
“四素”的区别
1、质量数:
小结:
2、核素:具有一定数目的质子和一定数目的中子的一种原子
质量数(A)=质子数(Z)+中子数(N)
3、同位素:同一元素的不同核素互称同位素
4、原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
5、元素周期表:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
小结:
周期表分为7个周期(短周期和长周期),16个族
第四章 物质结构 元素周期律
第一节
原子结构与元素周期表
第一课时
一、原子结构
原子结构与元素周期表
根据初中的化学知识,同学们描述一下原子的结构
原子
原子核
核外电子
质子
中子
体积很小
质量很大
质量近似相等
质量可以忽略
一、原子结构
原子结构与元素周期表
相对原子质量:
原子的质量与一个12C原子质量的1/12的比值
已知:质子和中子的相对质量都近似等于1,则质量数应该如何计算?
质量数:
粒子中所有质子和中子的相对质量取近似整数值相加
质量数(A)=质子数(Z)+中子数(N)
为什么质子数和中子数之和会叫做质量数呢?
在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大
一、原子结构
原子结构与元素周期表
质量数(A)=质子数(Z)+中子数(N)
根据质量数的定义,可以将一个具体的原子表示如下:
原子
原子核
核外电子
质子
中子
Z个
Z个
(A-Z)个
什么是12C原子?
6个质子
6个电子
6个中子
一、原子结构
原子结构与元素周期表
K、L、M、N、O、P、Q
电子层
n=1, 2, 3, 4, 5, 6, 7
离核较近的电子层中的电子能量低,所以电子总是由内向外排列的
电子的排列还要符合什么规律呢?
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
(1)K层为最外层时,最多容纳多少电子?其余层为最外层,最多容纳多少电子?
(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。
(2)次外层最多容纳多少电子?
(3)第n层最多容纳多少电子?
(4)用原子结构示意图表示1~20号元素的核外电子排布
(2)次外层最多容纳18个电子。
(3)第n层最多容纳2×n2个电子。
前20号元素的核外电子排布
原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
根据上述规律,写出33号元素的原子结构示意图
门捷列夫绘制的第一张元素周期表是按照元素的相对原子质量来排列的,随着科学家对原子结构认识的不断深入,元素周期表中元素的排列依据也由相对原子质量改为核电荷数。
一、原子结构
原子结构与元素周期表
二、元素周期表
原子序数=核电荷数=质子数=核外电子数
元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
一个横行作为1个周期
7个
一
二
三
四
五
六
七
一列作为1个族(第8、9、10三列统称为第Ⅷ族)
16个
第Ⅷ族
填写下表,并思考周期序数与元素的原子核外电子层数之间的关系
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
Li~Ne
8
2
Na~Ar
8
3
K~Kr
18
4
Rb~Xe
18
5
Cs~Rn
32
6
32
周期序数等于原子核外电子层数
短周期
长周期
主族:由长周期元素和短周期元素共同组成的族 大写罗马数字加A
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族:完全由长周期元素组成的族 大写罗马数字加B(第Ⅷ族以外)
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
稀有气体元素化学性质不活泼,其化合价定为0,统称0族
0族
碱金属元素
卤族元素
练习:指出Si在周期表中的位置
ⅣA族
三
Si在周期表中的位置为:第三周期第ⅣA族
元素周期表中每一个格都标有元素的基本信息
最早提出原子概念的是英国化学家道尔顿,他提出了如下三个观点:
1、原子是不可再分的实心球体;
2、同种元素的原子性质和质量都相同;
3、不同元素的原子性质和质量不相同。
现在看来道尔顿的观点实际都是错误的,原子当然不是不可再分的,那么同种元素的原子性质和质量都相同吗?
一、原子结构
原子结构与元素周期表
二、元素周期表
元素是具有相同质子数(核电荷数)的一类原子的统称,即同种元素的原子一定具有相同的质子数,但是同种元素的原子的中子数不一定相同
三、核素
氢元素的原子有三种不同的组成
原子结构与元素周期表
核素:具有一定数目的质子和一定数目的中子的一种原子
三、核素
例如:
就是氢元素的不同核素
同位素:同一元素的不同核素互称同位素
质子数相同
中子数不同
和
互为同位素,则有:
Z1=Z2;A1≠A2
原子结构与元素周期表
同位素有天然存在和人工制造的区别,元素的天然同位素保持一定的比率不变,元素的平均相对原子质量就是按照该元素各种核素的比率计算的算术平均值。
三、核素
有的同位素具有放射性,称为放射性同位素。
同位素有很多用途:考古时利用14C测定文物的年代;D和T用于制造氢弹;利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的核素
同种元素形成的不同单质
同类原子
原子
原子
单质
只有种类,没有个数
化学反应中的最小微粒
化学性质几乎完全相同
元素相同
性质不同
质子数
质子数、中子数
质子数、中子数
组成元素、结构
H、C、O
三种元素
1H
1
1H
2
1H
3
三种核素
1H
1
1H
2
1H
3
互称同位素
O2、O3互为同素异形体
项目
内容
“四素”的区别
1、质量数:
小结:
2、核素:具有一定数目的质子和一定数目的中子的一种原子
质量数(A)=质子数(Z)+中子数(N)
3、同位素:同一元素的不同核素互称同位素
4、原子的核外电子排布规律:
(1)电子总是尽先由里向外排列;
(2)每个电子层最多可以容纳2×n2个电子;
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);
(4)次外层最多容纳18个电子。
5、元素周期表:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。
小结:
周期表分为7个周期(短周期和长周期),16个族
