人教版(2019)选择性必修二 2.2.3 价层电子对互斥模型 课件(共27张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 2.2.3 价层电子对互斥模型 课件(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:37:15 | ||
图片预览



文档简介
第二章 分子结构与性质
第二节 分子的空间结构
第3课时 价层电子对互斥模型
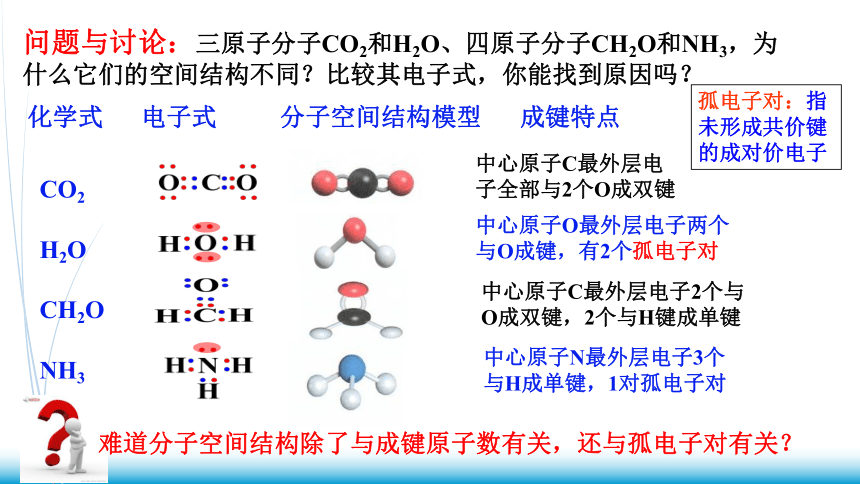
化学式 电子式 分子空间结构模型 成键特点
CO2
H2O
CH2O
NH3
孤电子对:指未形成共价键的成对价电子
中心原子C最外层电子全部与2个O成双键
中心原子O最外层电子两个与O成键,有2个孤电子对
中心原子C最外层电子2个与O成双键,2个与H键成单键
中心原子N最外层电子3个与H成单键,1对孤电子对
问题与讨论:三原子分子CO2和H2O、四原子分子CH2O和NH3,为什么它们的空间结构不同?比较其电子式,你能找到原因吗?
难道分子空间结构除了与成键原子数有关,还与孤电子对有关?
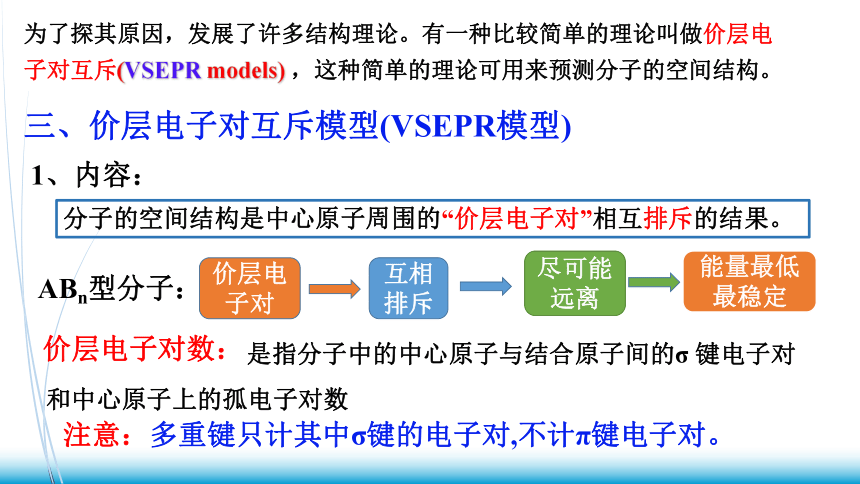
为了探其原因,发展了许多结构理论。有一种比较简单的理论叫做价层电子对互斥(VSEPR models) ,这种简单的理论可用来预测分子的空间结构。
三、价层电子对互斥模型(VSEPR模型)
1、内容:
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
ABn型分子:
价层电子对
互相排斥
尽可能远离
能量最低最稳定
注意:多重键只计其中σ键的电子对,不计π键电子对。
价层电子对数:
是指分子中的中心原子与结合原子间的σ 键电子对和中心原子上的孤电子对数
2、价层电子对数的确定:
价层电子对数=σ 键电子对+中心原子上的孤电子对数
①σ 键电子对数
由化学式确定
σ键电子对数=中心原子结合的原子数
{5940675A-B579-460E-94D1-54222C63F5DA}分子
中心原子
共价键
键数
σ键电子对数
H2O
O
O-H
2
NH3
N
N-H
3
SO3
S
2
SO42-
S
4
2
3
3
4
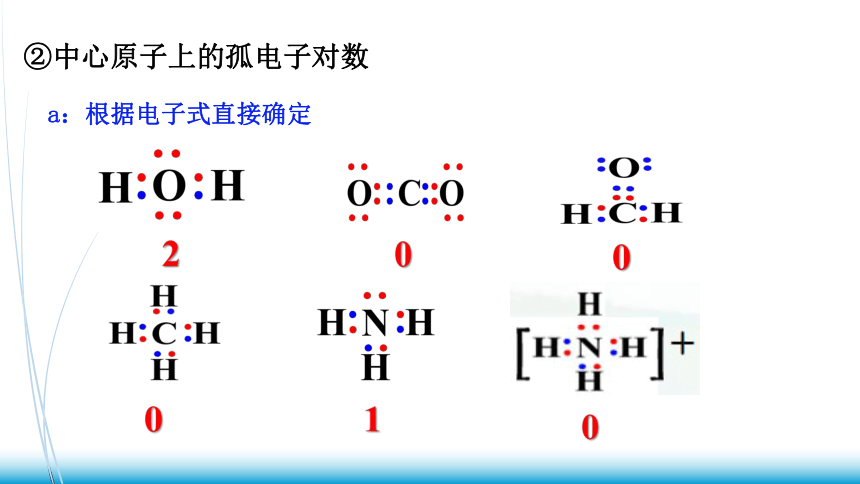
②中心原子上的孤电子对数
a:根据电子式直接确定
1
2
0
0
0
0
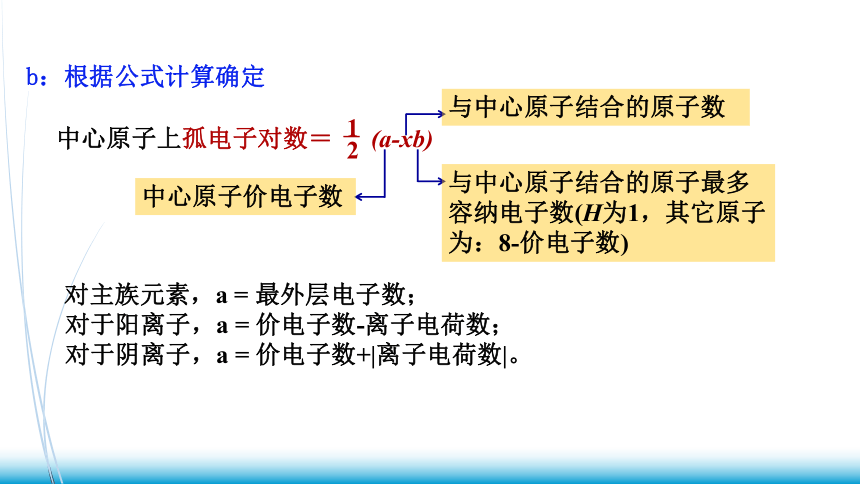
中心原子上孤电子对数= (a-xb)
2
1
中心原子价电子数
与中心原子结合的原子数
与中心原子结合的原子最多容纳电子数(H为1,其它原子为:8-价电子数)
b:根据公式计算确定
对主族元素,a = 最外层电子数;
对于阳离子,a = 价电子数-离子电荷数;
对于阴离子,a = 价电子数+|离子电荷数|。
【思考与讨论】
(1)以P和S为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。
(2)以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
主族元素价电子数=最外层电子数=主族序数
P原子价电子数为5; S原子价电子数为6
主族元素最多接受电子数=8-最外层电子数=8-主族序数(H为1)
最多接受电子数:N原子为8-5=3, S原子为8-6=2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
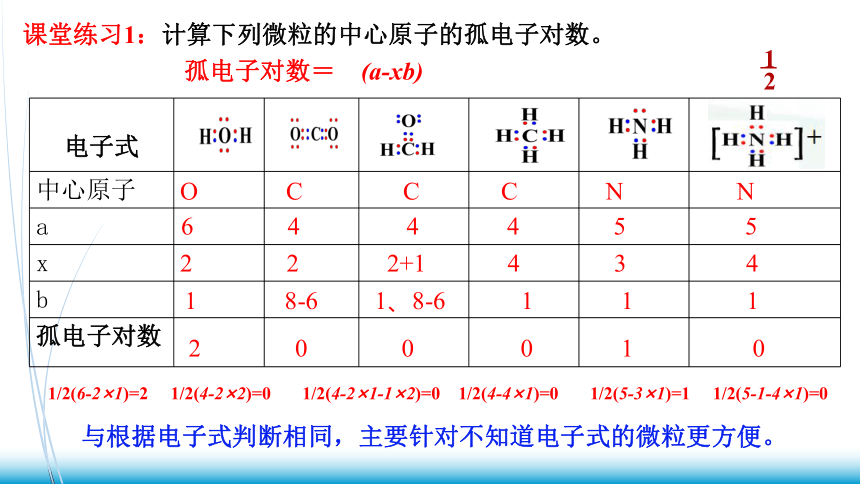
电子式
中心原子
a
x
b
孤电子对数
O C C C N N
6 4 4 4 5 5
2 2 2+1 4 3 4
1 8-6 1、8-6 1 1 1
1/2(6-2×1)=2 1/2(4-2×2)=0 1/2(4-2×1-1×2)=0 1/2(4-4×1)=0 1/2(5-3×1)=1 1/2(5-1-4×1)=0
2 0 0 0 1 0
与根据电子式判断相同,主要针对不知道电子式的微粒更方便。
课堂练习1:计算下列微粒的中心原子的孤电子对数。
孤电子对数= (a-xb)
2
1
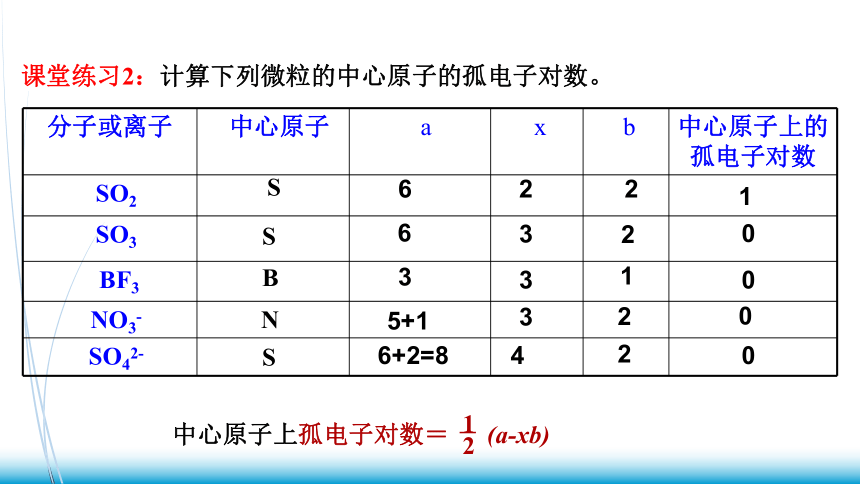
分子或离子
中心原子
a
x
b
中心原子上的孤电子对数
SO2
SO3
BF3
NO3-
SO42-
S
S
B
N
S
0
2
3
6
1
2
2
6
3
5+1
6+2=8
3
3
4
2
0
0
1
2
0
中心原子上孤电子对数= (a-xb)
2
1
课堂练习2:计算下列微粒的中心原子的孤电子对数。
③价层电子对数
价层电子对数=σ 键电子对+中心原子上的孤电子对数
化学式
价层电子对数
结合的原子数
孤电子对数
H2O
4
2
2
SO3
3
3
0
NH3
4
3
1
CO2
2
2
0
SF4
5
4
1
SF6
6
6
0
PCl5
5
5
0
PCl3
4
3
1
CH4
4
4
0
化学式
价层电子对数
结合的原子数
孤电子对数
HCN
2
2
0
SO2
3
2
1
NH2-
4
2
2
BF3
3
3
0
H3O+
4
3
1
SiCl4
4
4
0
CHCl3
4
4
0
NH4+
4
4
0
SO42-
4
4
0
3、确定VSEPR 模型
价层电子对数
n=2
n=3
n=4
n=5
n=6
VSEPR 模型
VSEPR 模型名称
直线形
平面三角形
四面体形
三角双锥
八面体形
4、确定分子空间结构
去掉VSEPR 模型中的孤对电子,得到分子的真实构型。
含孤电子对的VSEPR模型
分子空结构模型
H2O
NH3
四面体形
V形
三角锥形
分子或离子
孤电子对数
价层电子对数
VSEPR模型
VSEPR模型名称
分子或离子的空间结构
分子或离子的空间结构名称
CO2
SO2
CO32-
CH4
表2-4 根据价层电子对互斥模型对几种分子或离子的空间结构的推测
0
1
0
0
2
3
3
4
直线形
平面
三角形
平面
三角形
正四
面体形
直线形
V形
平面
三角形
正四
面体形
5、VSEPR模型应用
①预测分子立体构型
BF3
NH4+
SO32-
孤电子对数
价层电子对数
VSEPR模型
VSEPR模型名称
空间结构
空间结构名称
0
3
平面
三角形
平面
三角形
0
4
正四
面体形
正四
面体形
1
4
四面体形
三角锥形
课本P47【思考与讨论】确定BF3、NH4+和SO32-的VSEPR模型和它们的空间结构,并与同学交流。
(1)确定σ键电子对数
(2)确定中心原子上的孤电子对数
(3)得到中心原子上的价层电子对数
价层电子对数 =σ键电子对数+孤电子对数
(4)画出分子的VSEPR模型
(5)略去孤电子对,得到分子的立体构型
小结:确定分子的空间结构的步骤:
分子或离子
σ键电子对数
孤电子对数
价层电子对数
VSEPR模型
空间结构
HCN
NO2
NH2-
NO3-
H3O+
SiCl4
CHCl3
NH4+
PO43-
0
1
2
0
1
0
0
0
2
3
4
3
4
4
4
4
直线形
V 形
V 型
平面三角形
三角锥形
四面体
正四面体
正四面体
0
4
正四面体
2
2
2
3
3
4
4
4
4
直线形
平面三角形
四面体
正四面体
正四面体
正四面体
平面三角形
四面体
四面体
课堂练习3:预测下列微粒的空间结构。
②判断分子中键角的大小
5、VSEPR模型应用
课堂练习4:【2021年全国乙卷】H2O的键角小于NH3的,分析原因。
答案:H2O中含有两对孤电子对而NH3中含有一对孤电子对,H2O中孤电子对对成键电子对的排斥作用较大。
CH4
H2O
NH3
解析:CH4、H2O、NH3的价层电子对均为4,VSEPR模型均为四面体形
这是由于孤电子对有较大的斥力的原因。孤电子对越多,与成键电子对之间的排斥力越大,键角越小。
结论:价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
>成键电子对-单电子
课堂练习5:NO2与SO2空间构型均为V形,NO2键角大于120°,分析原因。
解析:NO2与SO2的价层电子对均为3,VSEPR模型均为平面三角形,但NO2中孤电子是一个单电子,NO2键角大于120°,SO2键角小于120°
说明斥力:电子对-电子对>电子对-单电子,。
课堂练习6:预测NO2、NO2-、NO2+的结构并比较键角大小
NO2价层电子对为3,VSEPR模型均为平面三角形,但NO2中孤电子是一个单电子,由于斥力:电子对-电子对>电子对-单电子,NO2键角大于120°。
NO2-价层电子对为3,VSEPR模型均为平面三角形,孤电子对数为1,由于斥力:孤电子对-成键电子对>成键电子对-成键电子对,NO2-键角小于120°。
NO2+价层电子对为2,VSEPR模型均为直线型,键角180°。
A的价层电子对数
成键电子对数
孤电子对数
VSEPR模型
分子空间构型
分子类型
实 例
2
2
0
3
3
0
2
1
直线形
AB2
CO2、BeCl2、HgCl2
平面三角形
AB3
SO3、NO3- 、BF3
V形
AB2
O3、NO2- 、PbCl2
共价分子的构型
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子类型
实 例
4
4
0
3
1
2
2
正四面体
AB4
CH4、SO42-、PO43-
三角
锥形
AB3
NH3、ClO3- 、NF3
AB2
H2O、SCl2
V形
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子
类型
实 例
5
5 0
三角
双锥
4 1
变形四
面体
3 2
ClF3
2 3
直线形
SF4
PCl5
T形
AB5
AB4
AB3
AB2
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子类型
实 例
6
6 0
正八
面体
5 1
四方
锥形
IF5
4 2
平面
正方形
AB6
AB5
AB4
SF6
1.预测分子的空间结构方法:
σ键电子对数
孤电子对数
价层电子对数
VSEPR模型
空间结构
2.比较键角的大小:
①根据VSEPR模型,直线型键角>平面三角形>四面体形
②结构相同,随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
3、价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
课堂小结
价层电子对互斥模型(VSEPR模型)
略去孤电子对
课堂达标
1、下列有关价层电子对互斥理论的描述正确的是( )
A.价层电子对就是σ键电子对 B.孤电子对数由分子式来确定
C.分子的立体构型是价层电子对互斥的结果
D.孤电子对数等于π键数
C
2、下列分子或离子的中心原子,带有一对孤电子对的是 ( )
A.H2O B.BeCl2 C.CH4 D.PCl3
D
3、多核离子所带电荷可以认为是中心原子得到电子或失去电子导致的,根据VSEPR模型,下列离子中所有原子都在同一平面的是( )
A.NO2-和NH2- B.H3O+和ClO3- C.NO3-和CH3- D.PO43-和SO42-
A
4、下列有关描述正确的是 ( )
A. N?????????为V形分子
B. Cl?????????的空间结构为平面三角形
C. N?????????的VSEPR模型、空间结构均为平面三角形
D. Cl?????????的VSEPR模型、空间结构相同
?
C
5、用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
6、运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1) BeCl2 ;? (2) SCl2 ;?
SO32-___________;? (4) PF3 ;
(5) H2Se ; (6) BBr3____________;
(7) CHCl3 ; (8) SiF4____________。?
直线形
V形
三角锥形
三角锥形
V形
平面三角形
四面体形
正四面体形
第二节 分子的空间结构
第3课时 价层电子对互斥模型
化学式 电子式 分子空间结构模型 成键特点
CO2
H2O
CH2O
NH3
孤电子对:指未形成共价键的成对价电子
中心原子C最外层电子全部与2个O成双键
中心原子O最外层电子两个与O成键,有2个孤电子对
中心原子C最外层电子2个与O成双键,2个与H键成单键
中心原子N最外层电子3个与H成单键,1对孤电子对
问题与讨论:三原子分子CO2和H2O、四原子分子CH2O和NH3,为什么它们的空间结构不同?比较其电子式,你能找到原因吗?
难道分子空间结构除了与成键原子数有关,还与孤电子对有关?
为了探其原因,发展了许多结构理论。有一种比较简单的理论叫做价层电子对互斥(VSEPR models) ,这种简单的理论可用来预测分子的空间结构。
三、价层电子对互斥模型(VSEPR模型)
1、内容:
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
ABn型分子:
价层电子对
互相排斥
尽可能远离
能量最低最稳定
注意:多重键只计其中σ键的电子对,不计π键电子对。
价层电子对数:
是指分子中的中心原子与结合原子间的σ 键电子对和中心原子上的孤电子对数
2、价层电子对数的确定:
价层电子对数=σ 键电子对+中心原子上的孤电子对数
①σ 键电子对数
由化学式确定
σ键电子对数=中心原子结合的原子数
{5940675A-B579-460E-94D1-54222C63F5DA}分子
中心原子
共价键
键数
σ键电子对数
H2O
O
O-H
2
NH3
N
N-H
3
SO3
S
2
SO42-
S
4
2
3
3
4
②中心原子上的孤电子对数
a:根据电子式直接确定
1
2
0
0
0
0
中心原子上孤电子对数= (a-xb)
2
1
中心原子价电子数
与中心原子结合的原子数
与中心原子结合的原子最多容纳电子数(H为1,其它原子为:8-价电子数)
b:根据公式计算确定
对主族元素,a = 最外层电子数;
对于阳离子,a = 价电子数-离子电荷数;
对于阴离子,a = 价电子数+|离子电荷数|。
【思考与讨论】
(1)以P和S为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。
(2)以N和Cl为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数。
主族元素价电子数=最外层电子数=主族序数
P原子价电子数为5; S原子价电子数为6
主族元素最多接受电子数=8-最外层电子数=8-主族序数(H为1)
最多接受电子数:N原子为8-5=3, S原子为8-6=2
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
电子式
中心原子
a
x
b
孤电子对数
O C C C N N
6 4 4 4 5 5
2 2 2+1 4 3 4
1 8-6 1、8-6 1 1 1
1/2(6-2×1)=2 1/2(4-2×2)=0 1/2(4-2×1-1×2)=0 1/2(4-4×1)=0 1/2(5-3×1)=1 1/2(5-1-4×1)=0
2 0 0 0 1 0
与根据电子式判断相同,主要针对不知道电子式的微粒更方便。
课堂练习1:计算下列微粒的中心原子的孤电子对数。
孤电子对数= (a-xb)
2
1
分子或离子
中心原子
a
x
b
中心原子上的孤电子对数
SO2
SO3
BF3
NO3-
SO42-
S
S
B
N
S
0
2
3
6
1
2
2
6
3
5+1
6+2=8
3
3
4
2
0
0
1
2
0
中心原子上孤电子对数= (a-xb)
2
1
课堂练习2:计算下列微粒的中心原子的孤电子对数。
③价层电子对数
价层电子对数=σ 键电子对+中心原子上的孤电子对数
化学式
价层电子对数
结合的原子数
孤电子对数
H2O
4
2
2
SO3
3
3
0
NH3
4
3
1
CO2
2
2
0
SF4
5
4
1
SF6
6
6
0
PCl5
5
5
0
PCl3
4
3
1
CH4
4
4
0
化学式
价层电子对数
结合的原子数
孤电子对数
HCN
2
2
0
SO2
3
2
1
NH2-
4
2
2
BF3
3
3
0
H3O+
4
3
1
SiCl4
4
4
0
CHCl3
4
4
0
NH4+
4
4
0
SO42-
4
4
0
3、确定VSEPR 模型
价层电子对数
n=2
n=3
n=4
n=5
n=6
VSEPR 模型
VSEPR 模型名称
直线形
平面三角形
四面体形
三角双锥
八面体形
4、确定分子空间结构
去掉VSEPR 模型中的孤对电子,得到分子的真实构型。
含孤电子对的VSEPR模型
分子空结构模型
H2O
NH3
四面体形
V形
三角锥形
分子或离子
孤电子对数
价层电子对数
VSEPR模型
VSEPR模型名称
分子或离子的空间结构
分子或离子的空间结构名称
CO2
SO2
CO32-
CH4
表2-4 根据价层电子对互斥模型对几种分子或离子的空间结构的推测
0
1
0
0
2
3
3
4
直线形
平面
三角形
平面
三角形
正四
面体形
直线形
V形
平面
三角形
正四
面体形
5、VSEPR模型应用
①预测分子立体构型
BF3
NH4+
SO32-
孤电子对数
价层电子对数
VSEPR模型
VSEPR模型名称
空间结构
空间结构名称
0
3
平面
三角形
平面
三角形
0
4
正四
面体形
正四
面体形
1
4
四面体形
三角锥形
课本P47【思考与讨论】确定BF3、NH4+和SO32-的VSEPR模型和它们的空间结构,并与同学交流。
(1)确定σ键电子对数
(2)确定中心原子上的孤电子对数
(3)得到中心原子上的价层电子对数
价层电子对数 =σ键电子对数+孤电子对数
(4)画出分子的VSEPR模型
(5)略去孤电子对,得到分子的立体构型
小结:确定分子的空间结构的步骤:
分子或离子
σ键电子对数
孤电子对数
价层电子对数
VSEPR模型
空间结构
HCN
NO2
NH2-
NO3-
H3O+
SiCl4
CHCl3
NH4+
PO43-
0
1
2
0
1
0
0
0
2
3
4
3
4
4
4
4
直线形
V 形
V 型
平面三角形
三角锥形
四面体
正四面体
正四面体
0
4
正四面体
2
2
2
3
3
4
4
4
4
直线形
平面三角形
四面体
正四面体
正四面体
正四面体
平面三角形
四面体
四面体
课堂练习3:预测下列微粒的空间结构。
②判断分子中键角的大小
5、VSEPR模型应用
课堂练习4:【2021年全国乙卷】H2O的键角小于NH3的,分析原因。
答案:H2O中含有两对孤电子对而NH3中含有一对孤电子对,H2O中孤电子对对成键电子对的排斥作用较大。
CH4
H2O
NH3
解析:CH4、H2O、NH3的价层电子对均为4,VSEPR模型均为四面体形
这是由于孤电子对有较大的斥力的原因。孤电子对越多,与成键电子对之间的排斥力越大,键角越小。
结论:价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
>成键电子对-单电子
课堂练习5:NO2与SO2空间构型均为V形,NO2键角大于120°,分析原因。
解析:NO2与SO2的价层电子对均为3,VSEPR模型均为平面三角形,但NO2中孤电子是一个单电子,NO2键角大于120°,SO2键角小于120°
说明斥力:电子对-电子对>电子对-单电子,。
课堂练习6:预测NO2、NO2-、NO2+的结构并比较键角大小
NO2价层电子对为3,VSEPR模型均为平面三角形,但NO2中孤电子是一个单电子,由于斥力:电子对-电子对>电子对-单电子,NO2键角大于120°。
NO2-价层电子对为3,VSEPR模型均为平面三角形,孤电子对数为1,由于斥力:孤电子对-成键电子对>成键电子对-成键电子对,NO2-键角小于120°。
NO2+价层电子对为2,VSEPR模型均为直线型,键角180°。
A的价层电子对数
成键电子对数
孤电子对数
VSEPR模型
分子空间构型
分子类型
实 例
2
2
0
3
3
0
2
1
直线形
AB2
CO2、BeCl2、HgCl2
平面三角形
AB3
SO3、NO3- 、BF3
V形
AB2
O3、NO2- 、PbCl2
共价分子的构型
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子类型
实 例
4
4
0
3
1
2
2
正四面体
AB4
CH4、SO42-、PO43-
三角
锥形
AB3
NH3、ClO3- 、NF3
AB2
H2O、SCl2
V形
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子
类型
实 例
5
5 0
三角
双锥
4 1
变形四
面体
3 2
ClF3
2 3
直线形
SF4
PCl5
T形
AB5
AB4
AB3
AB2
A的价层电子对数
成键电子对数
孤电子对数
A的价层电子对排布方式
分子空间构型
分子类型
实 例
6
6 0
正八
面体
5 1
四方
锥形
IF5
4 2
平面
正方形
AB6
AB5
AB4
SF6
1.预测分子的空间结构方法:
σ键电子对数
孤电子对数
价层电子对数
VSEPR模型
空间结构
2.比较键角的大小:
①根据VSEPR模型,直线型键角>平面三角形>四面体形
②结构相同,随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
3、价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
课堂小结
价层电子对互斥模型(VSEPR模型)
略去孤电子对
课堂达标
1、下列有关价层电子对互斥理论的描述正确的是( )
A.价层电子对就是σ键电子对 B.孤电子对数由分子式来确定
C.分子的立体构型是价层电子对互斥的结果
D.孤电子对数等于π键数
C
2、下列分子或离子的中心原子,带有一对孤电子对的是 ( )
A.H2O B.BeCl2 C.CH4 D.PCl3
D
3、多核离子所带电荷可以认为是中心原子得到电子或失去电子导致的,根据VSEPR模型,下列离子中所有原子都在同一平面的是( )
A.NO2-和NH2- B.H3O+和ClO3- C.NO3-和CH3- D.PO43-和SO42-
A
4、下列有关描述正确的是 ( )
A. N?????????为V形分子
B. Cl?????????的空间结构为平面三角形
C. N?????????的VSEPR模型、空间结构均为平面三角形
D. Cl?????????的VSEPR模型、空间结构相同
?
C
5、用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的立体构型,有时也能用来推测键角大小。下列判断正确的是( )
A.SO2、CS2、HI都是直线形的分子
B.BF3键角为120°,SnBr2键角大于120°
C.COCl2、BF3、SO3都是平面三角形的分子
D.PCl3、NH3、PCl5都是三角锥形的分子
C
6、运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1) BeCl2 ;? (2) SCl2 ;?
SO32-___________;? (4) PF3 ;
(5) H2Se ; (6) BBr3____________;
(7) CHCl3 ; (8) SiF4____________。?
直线形
V形
三角锥形
三角锥形
V形
平面三角形
四面体形
正四面体形
