人教版(2019)选择性必修二 2.3 分子结构与物质的性质 课件(共34张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 2.3 分子结构与物质的性质 课件(共34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 00:00:00 | ||
图片预览








文档简介
(共34张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
一、键的极性和分子的极性
1.键的极性
分类 极性共价键 非极性共价键
成键原子 ______元素的原子 ______元
素的原子
电子对 发生偏移 不发生偏移
成键原子 的电性 一个原子呈正电性(δ+), 一个原子呈负电性(δ-) 呈电中性
不同
同种
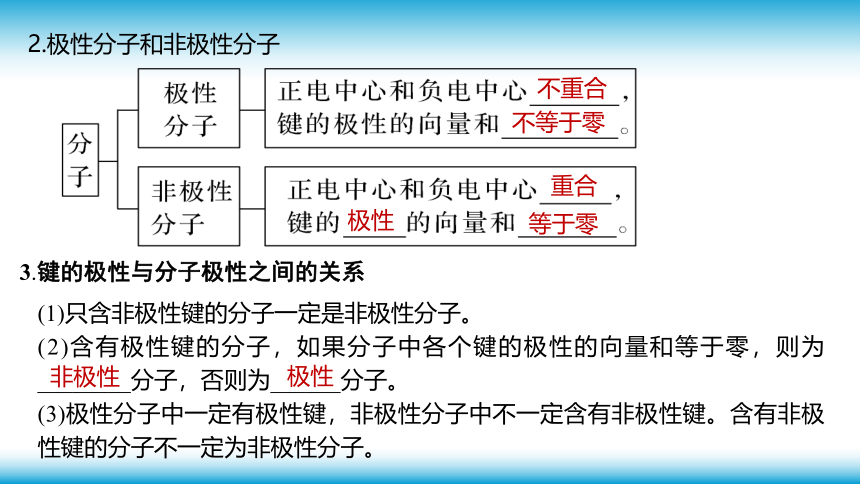
2.极性分子和非极性分子
不重合
不等于零
重合
极性
等于零
3.键的极性与分子极性之间的关系
(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为________分子,否则为______分子。
(3)极性分子中一定有极性键,非极性分子中不一定含有非极性键。含有非极性键的分子不一定为非极性分子。
非极性
极性
二、键的极性对化学性质的影响(以羧酸的酸性为例)
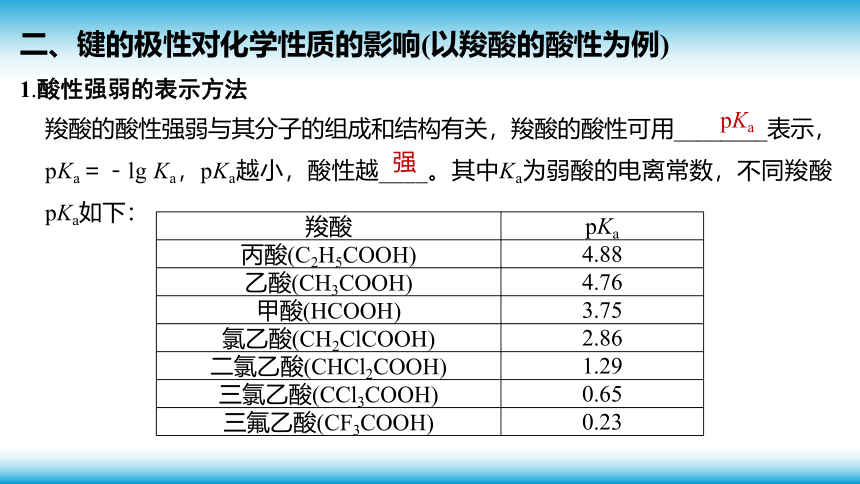
1.酸性强弱的表示方法
羧酸的酸性强弱与其分子的组成和结构有关,羧酸的酸性可用________表示,pKa=-lg Ka,pKa越小,酸性越____。其中Ka为弱酸的电离常数,不同羧酸pKa如下:
pKa
强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.两点结论
(1)三氟乙酸的酸性大于三氯乙酸,这是由于氟的电负性______氯的电负性,F—C的极性______Cl—C的极性,使F3C—的极性______Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。
(2)烷基是推电子基团,烷基越长推电子效应越大,使羧基中羟基的极性______,羧酸的酸性______,所以甲酸、乙酸、丙酸……随着烷基加长,酸性逐渐______。
大于
大于
大于
越小
越弱
减弱
深化认识键的极性与分子的极性
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,观察四氯化碳的流动方向未发生变化;再向另一酸式滴定管中加入蒸馏水,进行同样的实验,观察到水流的方向发生改变。
分子极性的实验
1.用毛皮摩擦过的橡胶棒带负电,为什么橡胶棒不能使CCl4液流的方向改变却能使水流的方向改变?
提示:CCl4尽管是由极性键构成,但CCl4是正四面体结构,正、负电荷的中心重合,极性的向量和为零,整个分子不显电性故CCl4的液流方向不变;H2O分子为V形结构,正、负电荷的中心不重合,极性的向量和不为零,水分子存在极性,故当带负电的橡胶棒靠近水流时,水流的方向发生偏移。
2.已知H2O2的空间结构如下图所示:
H2O2不是直线形的,两个H原子犹如在半展开的书的
两面纸上,书面夹角为93°52′,而两个O—H与O—O
的夹角均为96°52′。
H2O2中共价键的种类有哪些?H2O2的正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
提示:H2O2分子中存在O—H极性键和O—O非极性键;由图示结构可知,H2O2中正电中心和负电中心不重合,H2O2属于极性分子。
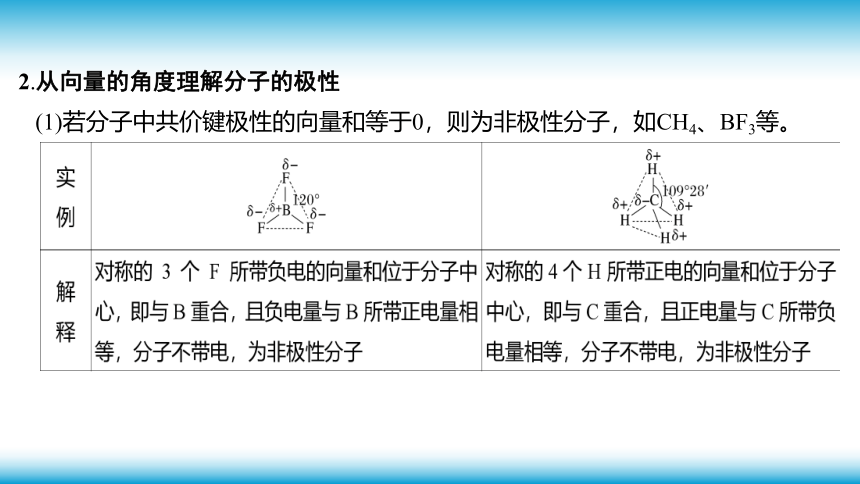
1.键的极性与分子极性的关系
2.从向量的角度理解分子的极性
(1)若分子中共价键极性的向量和等于0,则为非极性分子,如CH4、BF3等。
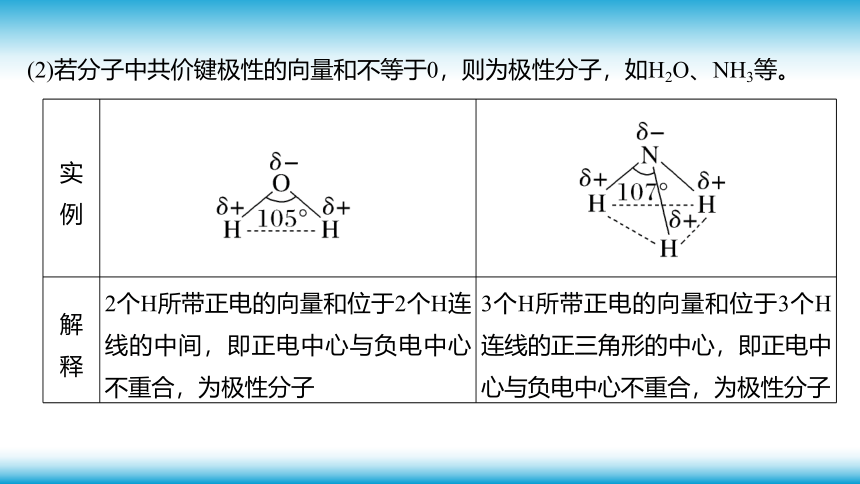
(2)若分子中共价键极性的向量和不等于0,则为极性分子,如H2O、NH3等。
实 例
解 释 2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子 3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
(1)一般情况下,单质分子为非极性分子,但O3是V形分子,空间不对称结构,故为极性分子。
(2)AB型分子均为极性分子。
(3)只含有极性键的分子不一定是极性分子(如CH4);极性分子不一定只含有极性键(如C2H5OH);含有非极性键的分子不一定是非极性分子(如H2O2)。
[方法技巧]
分子极性判断的方法
方法一:从键的极性角度判断
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。如CO2、CH4是非极性分子,H2O、NH3是极性分子。
方法二:从中心原子的化合价角度判断
对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子,实例如表:
分子 BF3 CO2 SO3(g) H2O NH3 SO2
中心原子的化合价的绝对值 3 4 6 2 3 4
中心原子所在的族序数 3 4 6 6 5 6
分子极性 非极性 非极性 非极性 极性 极性 极性
方法三:从中心原子有无孤电子对角度判断
对于ABn型分子,若中心原子A上有孤电子对,则为极性分子;若无孤电子对则为非极性分子。如CH4、BF3、SO3为非极性分子,H2S、SO2、PCl3为极性分子。
三、分子间作用力
1.范德华力及其对物质性质的影响
(1)概念:物质的分子之间存在着____________,把这类分子间作用力称为范德华力。
(2)影响因素:结构和组成相似的分子,相对分子质量越大范德华力______;分子的极性越大,范德华力也______。
(3)对物质性质的影响:范德华力主要影响物质的物理性质, 范德华力越强,物质的熔点、沸点______。
相互作用力
越大
越大
越高
2.氢键及其对物质性质的影响
(1)概念:氢键是由已经与电负性很大的原子形成共价键的____原子(如水分子中的氢)与另一个________很大的原子(如水分子中的氧)之间形成的________。
(2)表示方法:氢键通常用X—H…Y—表示,“-”表示________,“…”表示形成的______。
氢
电负性
作用力
共价键
氢键
分子内
分子间
低于
②特征:氢键不属于化学键,属于一种较弱的作用力,比化学键的键能小1~2个数量级。氢键具有方向性和饱和性。
(4)对物质性质的影响:氢键主要影响物质的熔、沸点。分子间氢键使物质熔、沸点______,分子内氢键使物质熔、沸点______。
升高
降低
3.溶解性
(1)“相似相溶”规律
①规律:非极性溶质一般能溶于________溶剂,极性溶质一般能溶于______溶剂。
②实例:蔗糖和氨____溶于水,难溶于四氯化碳。萘和碘____溶于四氯化碳,____溶于水(填“难”或“易”)。
(2)影响物质溶解性的因素
①外界因素:主要有温度、压强等。
②氢键:溶剂和溶质之间的氢键作用力越大,溶解性越____ (填“好”或“差”)。
③分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性______。如乙醇与水______,而戊醇在水中的溶解度明显______。
非极性
极性
易
易
难
好
越大
互溶
较小
四、分子的手性
1.手性异构体
具有完全相同的______和__________的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
组成
原子排列
2.手性分子
有手性异构体的分子叫做手性分子。
3.手性分子的应用
(1)医药:现今使用的药物中手性药物超过50%。对于手性药物,一个异构体可能______,而另一个异构体可能是无效,甚至是有害的。
(2)手性合成:2001年,诺贝尔化学奖授予三位用____________生产手性药物的化学家。用他们的合成方法,可以只得到或者主要得到一种__________,这种独特的合成方法称为手性合成。
(3)手性催化剂:手性催化剂只催化或者主要______一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手。
有效
手性催化剂
手性分子
催化
五、氢键对物质性质的影响总结
1.水分子间存在一种叫氢键的作用(介于范德华力与化学键之间)使彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的分子,其结构如图1所示:
2.氧族元素包括氧、硫、硒、碲等元素,它们的氢化物分别是H2O、H2S、H2Se、H2Te,其沸点如图2所示:
1.氢键的键能远大于范德华力,氢键属于化学键吗?依据图1判断1 mol冰中有多少mol氢键?
2.根据氢键的相关知识分析为什么冰浮在水面上?
提示:冰中水分子之间以氢键结合成规则的晶体,由于氢键有方向性,导致冰的结构中有空隙,造成体积膨胀,密度变小,故冰浮在水面上。
3.图2中表示的是氧族元素四种氢化物的沸点的变化,试解释水的沸点反常的原因是什么?
提示:由于水分子之间能形成氢键,在使水分子汽化的过程中需要更多的能量来破坏分子间氢键,故水的沸点出现了反常。
氢键对物质性质的影响总结
对物质熔、 沸点的影响 (1)含有分子间氢键的物质,熔、沸点往往比同系列氢化物的熔、沸点高,如ⅤA、ⅥA、ⅦA三个主族中,NH3、H2O和HF的熔、沸点反常高。
(2)含有分子内氢键的物质,熔、沸点一般会有所降低,如有分子内氢键的邻硝基苯酚熔点(45 ℃)比有分子间氢键的间硝基苯酚熔点(96 ℃)和对硝基苯酚熔点(114 ℃)都要低。
对溶解 度的影响 在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大,如HF和NH3在水中溶解度比较大。而溶质分子内如果能够形成氢键,它在极性溶剂中的溶解度则会有所降低。
对物质密 度的影响 (以水为例) 在水中,一个水分子的氧原子与另一个水分子的氢原子是沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有水分子全部缔合——结冰后,所有的水分子按一定的方向全部形成了氢键,成为晶体,因此在冰的结构中形成许多空隙,造成体积膨胀,密度减小。故冰的体积大于等质量的水的体积,冰的密度小于水的密度。
(1)氢键不属于化学键,它是一种较强的分子间作用力,其强度:共价键>氢键>范德华力。
(2)在一定条件下测定HF、H2O的相对分子质量时,测定结果偏大的原因是HF分子间及H2O分子间通过氢键形成了(HF)n、(H2O)n等缔合分子。
六、手性分子的成因与判断
1.手性分子的成因
当4个不同的原子或基团连接在同一个碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF的手性结构如图1所示。又如丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性结构如图2所示。
2.手性碳原子的判断
范德华力、氢键和共价键的比较
归纳整理 三种作用力的比较
概念 范德华力 氢键 共价键
含义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
概念 范德华力 氢键 共价键
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力 影响强度的因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y—,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
概念 范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔点、沸点、溶解度等物理性质 ②组成和结构相似的物质,随相对分子质量的增大,物质熔、沸点升高,如熔、沸点:F2<Cl2<Br2<I2,CF4<CCl4<CBr4 分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大。如熔、沸点:H2O>H2S,HF>HCl,NH3>PH3 共价键键能越大,含有该共价键分子的热稳定性越强
(1)氢键与范德华力主要影响物质的物理性质,如熔点、沸点等;化学键主要影响物质的化学性质。
(2)范德华力只存在于分子之间,但金刚石、SiO2等由共价键形成的晶体的微粒之间不存在范德华力。
[方法技巧]
由分子构成物质的熔、沸点高低的判断
(1)利用范德华力判断物质熔、沸点高低的前提是物质的组成和结构要相似。其测定方法一般有两种,一是同一主族同一类别物质的结构相似,如H2S和H2Se。二是分子空间构型相同的物质结构相似。只有结构相似的物质,其相对分子质量越大,范德华力越大,物质的熔、沸点越高。
(2)比较由分子构成物质的熔、沸点时,一定要注意氢键的存在,分子间形成氢键使熔、沸点升高,分子内形成氢键使熔、沸点降低。同时还要注意形成氢键数目的多少对物质熔、沸点的影响。如水的沸点高于乙醇的原因是水分子形成的氢键数目多于乙醇。
第二章 分子结构与性质
第三节 分子结构与物质的性质
一、键的极性和分子的极性
1.键的极性
分类 极性共价键 非极性共价键
成键原子 ______元素的原子 ______元
素的原子
电子对 发生偏移 不发生偏移
成键原子 的电性 一个原子呈正电性(δ+), 一个原子呈负电性(δ-) 呈电中性
不同
同种
2.极性分子和非极性分子
不重合
不等于零
重合
极性
等于零
3.键的极性与分子极性之间的关系
(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为________分子,否则为______分子。
(3)极性分子中一定有极性键,非极性分子中不一定含有非极性键。含有非极性键的分子不一定为非极性分子。
非极性
极性
二、键的极性对化学性质的影响(以羧酸的酸性为例)
1.酸性强弱的表示方法
羧酸的酸性强弱与其分子的组成和结构有关,羧酸的酸性可用________表示,pKa=-lg Ka,pKa越小,酸性越____。其中Ka为弱酸的电离常数,不同羧酸pKa如下:
pKa
强
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
2.两点结论
(1)三氟乙酸的酸性大于三氯乙酸,这是由于氟的电负性______氯的电负性,F—C的极性______Cl—C的极性,使F3C—的极性______Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。
(2)烷基是推电子基团,烷基越长推电子效应越大,使羧基中羟基的极性______,羧酸的酸性______,所以甲酸、乙酸、丙酸……随着烷基加长,酸性逐渐______。
大于
大于
大于
越小
越弱
减弱
深化认识键的极性与分子的极性
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,可看到四氯化碳呈直线状垂直流入烧杯中。将用毛皮摩擦过的橡胶棒靠近四氯化碳液流,观察四氯化碳的流动方向未发生变化;再向另一酸式滴定管中加入蒸馏水,进行同样的实验,观察到水流的方向发生改变。
分子极性的实验
1.用毛皮摩擦过的橡胶棒带负电,为什么橡胶棒不能使CCl4液流的方向改变却能使水流的方向改变?
提示:CCl4尽管是由极性键构成,但CCl4是正四面体结构,正、负电荷的中心重合,极性的向量和为零,整个分子不显电性故CCl4的液流方向不变;H2O分子为V形结构,正、负电荷的中心不重合,极性的向量和不为零,水分子存在极性,故当带负电的橡胶棒靠近水流时,水流的方向发生偏移。
2.已知H2O2的空间结构如下图所示:
H2O2不是直线形的,两个H原子犹如在半展开的书的
两面纸上,书面夹角为93°52′,而两个O—H与O—O
的夹角均为96°52′。
H2O2中共价键的种类有哪些?H2O2的正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
提示:H2O2分子中存在O—H极性键和O—O非极性键;由图示结构可知,H2O2中正电中心和负电中心不重合,H2O2属于极性分子。
1.键的极性与分子极性的关系
2.从向量的角度理解分子的极性
(1)若分子中共价键极性的向量和等于0,则为非极性分子,如CH4、BF3等。
(2)若分子中共价键极性的向量和不等于0,则为极性分子,如H2O、NH3等。
实 例
解 释 2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子 3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
(1)一般情况下,单质分子为非极性分子,但O3是V形分子,空间不对称结构,故为极性分子。
(2)AB型分子均为极性分子。
(3)只含有极性键的分子不一定是极性分子(如CH4);极性分子不一定只含有极性键(如C2H5OH);含有非极性键的分子不一定是非极性分子(如H2O2)。
[方法技巧]
分子极性判断的方法
方法一:从键的极性角度判断
(1)只含有非极性键的双原子分子或多原子分子大多是非极性分子。如O2、H2、P4、C60。
(2)含有极性键的双原子分子都是极性分子。如HCl、HF、HBr。
(3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的是极性分子。如CO2、CH4是非极性分子,H2O、NH3是极性分子。
方法二:从中心原子的化合价角度判断
对于ABn型分子,若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子,实例如表:
分子 BF3 CO2 SO3(g) H2O NH3 SO2
中心原子的化合价的绝对值 3 4 6 2 3 4
中心原子所在的族序数 3 4 6 6 5 6
分子极性 非极性 非极性 非极性 极性 极性 极性
方法三:从中心原子有无孤电子对角度判断
对于ABn型分子,若中心原子A上有孤电子对,则为极性分子;若无孤电子对则为非极性分子。如CH4、BF3、SO3为非极性分子,H2S、SO2、PCl3为极性分子。
三、分子间作用力
1.范德华力及其对物质性质的影响
(1)概念:物质的分子之间存在着____________,把这类分子间作用力称为范德华力。
(2)影响因素:结构和组成相似的分子,相对分子质量越大范德华力______;分子的极性越大,范德华力也______。
(3)对物质性质的影响:范德华力主要影响物质的物理性质, 范德华力越强,物质的熔点、沸点______。
相互作用力
越大
越大
越高
2.氢键及其对物质性质的影响
(1)概念:氢键是由已经与电负性很大的原子形成共价键的____原子(如水分子中的氢)与另一个________很大的原子(如水分子中的氧)之间形成的________。
(2)表示方法:氢键通常用X—H…Y—表示,“-”表示________,“…”表示形成的______。
氢
电负性
作用力
共价键
氢键
分子内
分子间
低于
②特征:氢键不属于化学键,属于一种较弱的作用力,比化学键的键能小1~2个数量级。氢键具有方向性和饱和性。
(4)对物质性质的影响:氢键主要影响物质的熔、沸点。分子间氢键使物质熔、沸点______,分子内氢键使物质熔、沸点______。
升高
降低
3.溶解性
(1)“相似相溶”规律
①规律:非极性溶质一般能溶于________溶剂,极性溶质一般能溶于______溶剂。
②实例:蔗糖和氨____溶于水,难溶于四氯化碳。萘和碘____溶于四氯化碳,____溶于水(填“难”或“易”)。
(2)影响物质溶解性的因素
①外界因素:主要有温度、压强等。
②氢键:溶剂和溶质之间的氢键作用力越大,溶解性越____ (填“好”或“差”)。
③分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性______。如乙醇与水______,而戊醇在水中的溶解度明显______。
非极性
极性
易
易
难
好
越大
互溶
较小
四、分子的手性
1.手性异构体
具有完全相同的______和__________的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
组成
原子排列
2.手性分子
有手性异构体的分子叫做手性分子。
3.手性分子的应用
(1)医药:现今使用的药物中手性药物超过50%。对于手性药物,一个异构体可能______,而另一个异构体可能是无效,甚至是有害的。
(2)手性合成:2001年,诺贝尔化学奖授予三位用____________生产手性药物的化学家。用他们的合成方法,可以只得到或者主要得到一种__________,这种独特的合成方法称为手性合成。
(3)手性催化剂:手性催化剂只催化或者主要______一种手性分子的合成,可以比喻成握手——手性催化剂像迎宾的主人伸出右手,被催化合成的手性分子像客人,总是伸出右手去握手。
有效
手性催化剂
手性分子
催化
五、氢键对物质性质的影响总结
1.水分子间存在一种叫氢键的作用(介于范德华力与化学键之间)使彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的分子,其结构如图1所示:
2.氧族元素包括氧、硫、硒、碲等元素,它们的氢化物分别是H2O、H2S、H2Se、H2Te,其沸点如图2所示:
1.氢键的键能远大于范德华力,氢键属于化学键吗?依据图1判断1 mol冰中有多少mol氢键?
2.根据氢键的相关知识分析为什么冰浮在水面上?
提示:冰中水分子之间以氢键结合成规则的晶体,由于氢键有方向性,导致冰的结构中有空隙,造成体积膨胀,密度变小,故冰浮在水面上。
3.图2中表示的是氧族元素四种氢化物的沸点的变化,试解释水的沸点反常的原因是什么?
提示:由于水分子之间能形成氢键,在使水分子汽化的过程中需要更多的能量来破坏分子间氢键,故水的沸点出现了反常。
氢键对物质性质的影响总结
对物质熔、 沸点的影响 (1)含有分子间氢键的物质,熔、沸点往往比同系列氢化物的熔、沸点高,如ⅤA、ⅥA、ⅦA三个主族中,NH3、H2O和HF的熔、沸点反常高。
(2)含有分子内氢键的物质,熔、沸点一般会有所降低,如有分子内氢键的邻硝基苯酚熔点(45 ℃)比有分子间氢键的间硝基苯酚熔点(96 ℃)和对硝基苯酚熔点(114 ℃)都要低。
对溶解 度的影响 在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大,如HF和NH3在水中溶解度比较大。而溶质分子内如果能够形成氢键,它在极性溶剂中的溶解度则会有所降低。
对物质密 度的影响 (以水为例) 在水中,一个水分子的氧原子与另一个水分子的氢原子是沿该氧原子的一个sp3杂化轨道的方向形成氢键,因此当所有水分子全部缔合——结冰后,所有的水分子按一定的方向全部形成了氢键,成为晶体,因此在冰的结构中形成许多空隙,造成体积膨胀,密度减小。故冰的体积大于等质量的水的体积,冰的密度小于水的密度。
(1)氢键不属于化学键,它是一种较强的分子间作用力,其强度:共价键>氢键>范德华力。
(2)在一定条件下测定HF、H2O的相对分子质量时,测定结果偏大的原因是HF分子间及H2O分子间通过氢键形成了(HF)n、(H2O)n等缔合分子。
六、手性分子的成因与判断
1.手性分子的成因
当4个不同的原子或基团连接在同一个碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF的手性结构如图1所示。又如丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性结构如图2所示。
2.手性碳原子的判断
范德华力、氢键和共价键的比较
归纳整理 三种作用力的比较
概念 范德华力 氢键 共价键
含义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
概念 范德华力 氢键 共价键
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力 影响强度的因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y—,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
概念 范德华力 氢键 共价键
对物质性质的影响 ①影响物质的熔点、沸点、溶解度等物理性质 ②组成和结构相似的物质,随相对分子质量的增大,物质熔、沸点升高,如熔、沸点:F2<Cl2<Br2<I2,CF4<CCl4<CBr4 分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大。如熔、沸点:H2O>H2S,HF>HCl,NH3>PH3 共价键键能越大,含有该共价键分子的热稳定性越强
(1)氢键与范德华力主要影响物质的物理性质,如熔点、沸点等;化学键主要影响物质的化学性质。
(2)范德华力只存在于分子之间,但金刚石、SiO2等由共价键形成的晶体的微粒之间不存在范德华力。
[方法技巧]
由分子构成物质的熔、沸点高低的判断
(1)利用范德华力判断物质熔、沸点高低的前提是物质的组成和结构要相似。其测定方法一般有两种,一是同一主族同一类别物质的结构相似,如H2S和H2Se。二是分子空间构型相同的物质结构相似。只有结构相似的物质,其相对分子质量越大,范德华力越大,物质的熔、沸点越高。
(2)比较由分子构成物质的熔、沸点时,一定要注意氢键的存在,分子间形成氢键使熔、沸点升高,分子内形成氢键使熔、沸点降低。同时还要注意形成氢键数目的多少对物质熔、沸点的影响。如水的沸点高于乙醇的原因是水分子形成的氢键数目多于乙醇。
