人教版(2019)选择性必修二 2.2.4 杂化轨道理论简介 课件(共29张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 2.2.4 杂化轨道理论简介 课件(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:37:51 | ||
图片预览





文档简介
(共29张PPT)
第二章 分子结构与性质
第二节 分子的空间结构
第4课时 杂化轨道理论简介
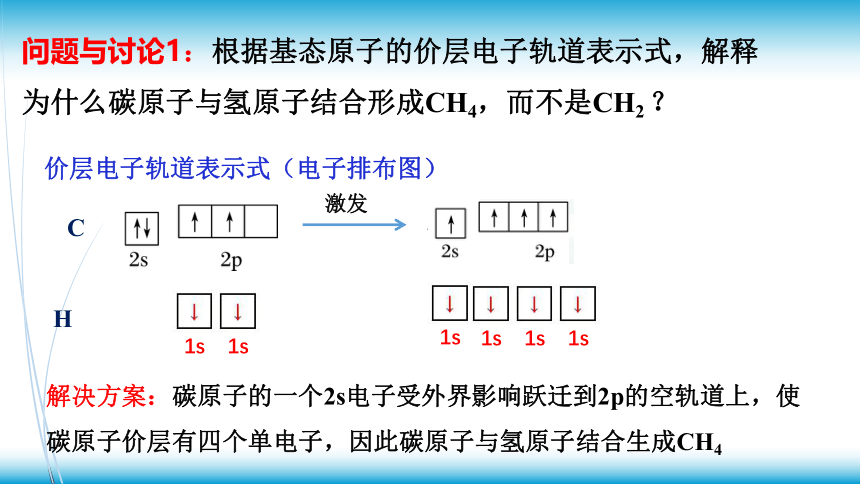
问题与讨论1:根据基态原子的价层电子轨道表示式,解释为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
价层电子轨道表示式(电子排布图)
C
H
1s
解决方案:碳原子的一个2s电子受外界影响跃迁到2p的空轨道上,使碳原子价层有四个单电子,因此碳原子与氢原子结合生成CH4
1s
激发
1s
1s
1s
1s
问题与讨论2:CH4分子为什么能形成正四面体结构?
按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子
为了解决这一矛盾,鲍林提出了杂化轨道理论,杂化轨道理论是一种价健理论模型。
甲烷分子中C原子的1个2s轨道与3个2p轨道形成4个相同的sp3杂化轨道,夹角109°28′分别与4个氢原子的1s轨道重叠,形成4个C-Hs-sp3σ键,呈正四面体形。
解决方案:
sp3杂化轨道
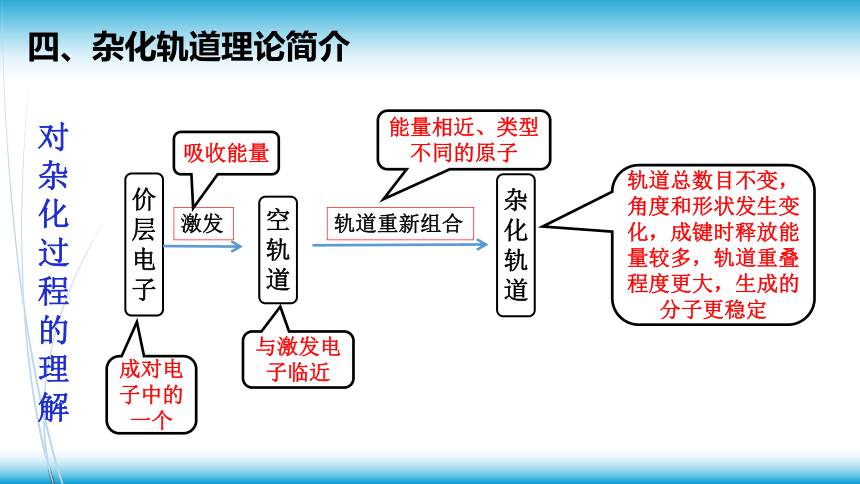
四、杂化轨道理论简介
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子中的一个
与激发电子临近
能量相近、类型不同的原子
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
对杂化过程的理解
1、概念:
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
2、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
(同一能级组或相近能级)
x
y
z
x
y
z
x
y
z
x
y
z
109°28′
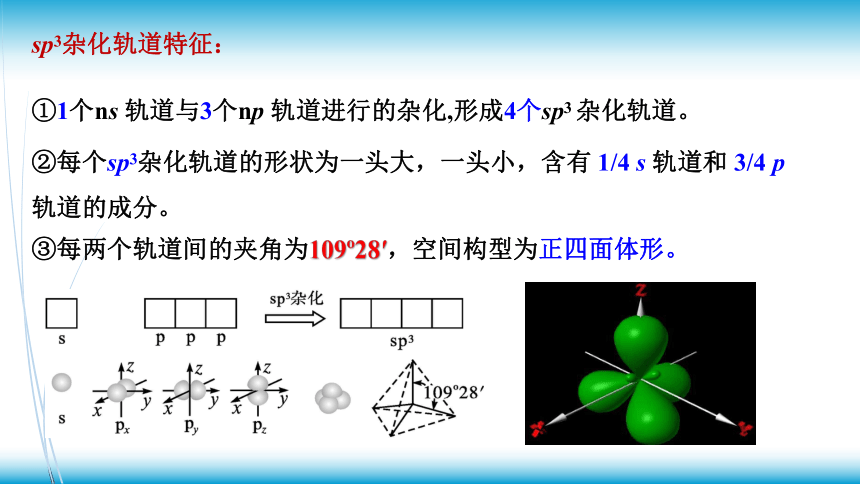
3、杂化轨道的类型
①sp3杂化
sp3杂化轨道特征:
①1个ns 轨道与3个np 轨道进行的杂化,形成4个sp3 杂化轨道。
②每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分。
③每两个轨道间的夹角为109 28′,空间构型为正四面体形。
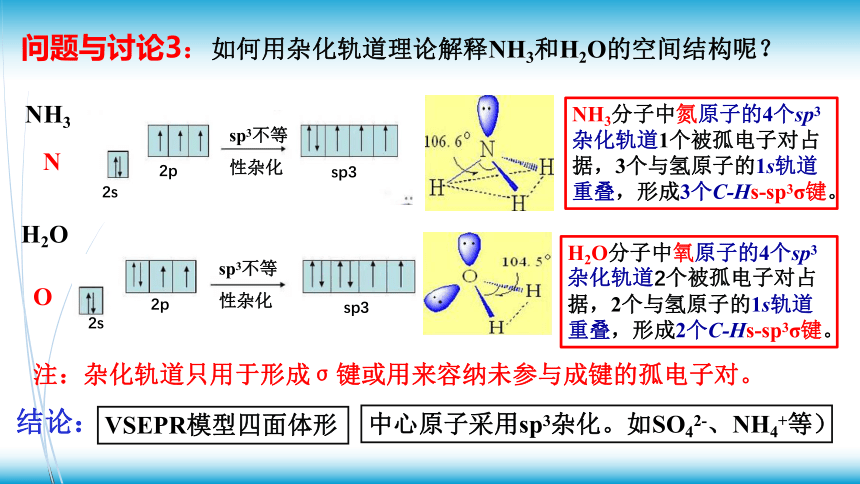
问题与讨论3:如何用杂化轨道理论解释NH3和H2O的空间结构呢?
注:杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
NH3分子中氮原子的4个sp3杂化轨道1个被孤电子对占据,3个与氢原子的1s轨道重叠,形成3个C-Hs-sp3σ键。
H2O分子中氧原子的4个sp3杂化轨道2个被孤电子对占据,2个与氢原子的1s轨道重叠,形成2个C-Hs-sp3σ键。
VSEPR模型四面体形
中心原子采用sp3杂化。如SO42-、NH4+等)
结论:
2s
2p
sp3不等性杂化
sp3
N
NH3
H2O
sp3不等性杂化
sp3
2p
2s
O
②sp2杂化
x
y
z
x
y
z
x
y
z
x
y
z
120°
②每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分。
sp2杂化轨道特征:
①1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
③每两个轨道间的夹角为120°,呈平面三角形。
④ 3个sp2杂化轨道用于形成σ键,未参与杂化的p轨道用于形成π键。
问题与讨论4:如何用杂化轨道理论解释CH2=CH2和BF3的空间结构呢?
↑
↑
↑
↓
2s
2p
↑
↑
↑
↑
sp2
sp2杂化
CH2=CH2分子中碳原子的3个sp2杂化轨道有一个相互重叠形成sp2-sp2σ键,另外2个杂化轨道与氢原子1s轨道重叠形成两个s-sp2σ键,未参与杂化的2P轨道相互重叠形成π键。
↑
↑
↓
2s
2p
↑
↑
↑
sp2
sp2杂化
120°
BF3分子中硼原子的3个sp2杂化轨道与氟原子p轨道重叠形成三个p-sp2σ键
VSEPR模型平面三角形
中心原子采用sp2杂化(CO32-、SO2等)
结论:
CH2=CH2
BF3
B
C
③sp杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
②每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分。
①1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
sp杂化轨道特征:
③两个轨道间的夹角为180°,呈直线型。
④ 2个sp杂化轨道用于形成σ键,未参与杂化的2个p轨道用于形成2个π键。
问题与讨论5:如何用杂化轨道理论解释CH≡CH和BeCl2的空间结构呢?
CH≡CH分子中碳原子的2个sp杂化轨道有一个相互重叠形成sp-spσ键,另外1个杂化轨道与氢原子1s轨道重叠形成两个s-spσ键,未参与杂化的2个2P轨道相互重叠形成2个π键。
BeCl2分子中铍原子的2个sp杂化轨道与氟原子p轨道重叠形成三个sp-pσ键
VSEPR模型直线形
中心原子采用sp杂化(CO2等)
结论:
CH≡CH
BeCl2
↑
↓
2s
2p
sp2杂化
↑
↑
sp
Be
↑
↑
↑
↓
2s
2p
sp杂化
↑
↑
sp
↑
↑
C
4、杂化轨道理论规律:
杂化轨道数等于参与杂化的原子轨道数,杂化前后轨道数不变
杂化过程中轨道的形状、方向发生变化,杂化后的新轨道能量、形状都相同
③ 杂化轨道用于形成σ键或者用来容纳未参与成键的孤电子对。未参与杂化的p轨道,可用于形成π键。
④ 杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小。故形成的键较稳定,成键能力增强。不同类型的杂化轨道之间夹角不同,成键后所形成的分子就具有不同的空间构型。
课堂练习1:正误判断
(1)发生轨道杂化的原子一定是中心原子,原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(2)凡中心原子采取sp3杂化轨道成键的分子空间结构都是正四面体形( )
(3)杂化轨道的空间结构与分子的空间结构不一定一致( )
(4)杂化轨道能量更集中,有利于牢固成键( )
(5)杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。未参与杂化的p轨道可用于形成π键( )
(6)凡AB3型的共价化合物,其中心原子A均采用sp2杂化轨道成键。( )
×
×
√
√
√
√
【思考与讨论】确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论。
第一步 计算中心原子孤电子对数:
BF3
H3O+
第二步 计算价层电子对数:
3+0=3
3+1=4
第三步 确定VSEPR模型:
第四步 确定杂化轨道类型:
sp2
sp3
第三步 确定杂轨道数:
3
4
5、VSEPR模型与中心原子的杂化轨道类型
典型例子
价层电子对数
VSEPR模型
VSEPR模型名称
杂化轨道数
中心原子的杂化轨道类型
分子空间结构
直线形
平面三角形
平面三角形
四面体
四面体
正四面体
sp
sp2
sp3
sp2
sp3
sp3
CO2
SO2
SO3
H2O
NH3
CH4
2+0=2
2+1=3
3+0=3
2+2=4
3+1=4
4+0=4
2
3
3
4
4
4
直线形
V形
平面三角形
三角锥形
正四面体
V形
①对于主族元素来说,
中心原子的杂化轨道数=价层电子数=σ键电子对数 + 孤电子对数
当中心原子的价层电子对数为4时,其杂化类型为 杂化,
当中心原子的价层电子对数为3时,其杂化类型为 杂化,
当中心原子的价层电子对数为2时,其杂化类型为 杂化。
sp3
sp2
sp
6、杂化轨道类型的判断:
化学式 H3O+ NH2- CO2 CHCl3 COCl2 PCl3
σ键电子对
孤电子对
杂化类型
课堂练习2:推测下列微粒中心原子的杂化类型:
3
1
2
2
2
0
4
0
3
0
3
1
sp3
sp3
sp
sp3
sp2
sp3
σ键电子对数
+孤电子对数
价层电子对数
价层电子互斥理论
杂化轨道类型
分子空间结构
预测
解释
杂化轨道理论
小结:
VSEPR模型
②含碳化合物中碳原子的杂化类型判断
如果碳原子形成1个三键或两个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化,如CO2、HC≡CH等;
如果碳原子形成1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化,如HCHO、CH2=CH2等;
如果全部是单键(即碳原子饱和),则形成sp3杂化,如CH4、CH3OH等。
课堂练习3:推测下列有机物中碳的杂化类型:
(1)CH3CH2CH3 (2)CH3CH=CH2 (3)CH≡CCH=CH2
sp3
sp3
sp3
sp3
sp2
sp2
sp
sp
sp2
sp2
PCl3中心原子的杂化类型为sp3,那么PCl5中心原子的杂化类型如何?
三角双锥
sp3d杂化
↑
↑
↑
↓
3s
3p
↑
3d
↑
↑
↑
↑
↑
↑
↑
↑
3s
3p
↑
3d
↑
激发
杂化
7、其他典型的杂化类型
SF6中心原子的杂化
正八面体
sp3d2杂化
↑
↑
↑
↓
3s
3p
↑
3d
↓
↑
↑
↑
↑
↑
↑
↑
激发
↑
↑
↑
3s
3p
↑
3d
↑
↑
杂化
C6H6平面形分子,键角120 。
C:sp2等性杂化 3条杂化轨道互成120°角 。未杂化的p轨道形成p-p大π键
石墨分子结构是层形结构,每层是由无限个碳六元环所形成的平面,碳原子取sp2杂化,每个碳原子尚余一个未参与杂化的p轨道,垂直于分子平面而相互平行。平行的n个p轨道形成了一个p-p大π键。电子在这个大π键中可以自由移动,所以石墨能导电。
物质 价电 子对数 中心原 子杂化 轨道类型 杂化轨道/ 电子对空 间构型 轨道 夹角 分子空 间构型 键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
2
2
3
4
4
4
4
4
sp
sp
sp2
sp3
直线形
直线形
平面三角形
正四面体
180°
180°
120°
109.5°
直线形
直线形
平面三角形
正四面体
V形
三角锥形
180°
180°
120°
109.5°
109.5°
104.5°
107.3°
107.3°
常见共价粒子的杂化方式
课堂小结
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道用于构建分子的σ轨道和孤电子对轨道
杂化轨道理论要点
杂化轨道类型
sp3杂化、sp2杂化、sp杂化……
【课堂检测】
1.以下有关杂化轨道的说法中正确的是( )
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既能形成σ键,也能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
A
2.下列分子中的中心原子采取sp2杂化的是( )
①C2H2 ②C2H4 ③C3H8 ④CO2 ⑤BeCl2 ⑥SO3 ⑦BF3
A.①⑥⑦ B.③⑤⑦ C. ② ⑥⑦ D.③⑤⑥
C
3.下列分子中,中心原子的杂化轨道类型相同的是( )
A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H4与C2H2
B
5.甲醛分子的结构式为 ,下列描述正确的是( )
A.甲醛分子中有4个σ键 B.甲醛分子中的C原子为sp3杂化
C.甲醛分子中的O原子为sp杂化
D.甲醛分子为平面三角形,有一个π键垂直于三角形平面
D
6. (1)Xe 是第五周期的稀有气体元素,与 F 形成的 XeF2室温下易升华。XeF2中心原子的价层电子对数为 ,下列对 XeF2中心原子杂化方式推断合理的是_______(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
5
D
(2)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。
sp3
(3)PH3中P采取的杂化类型为 。
sp3
第二章 分子结构与性质
第二节 分子的空间结构
第4课时 杂化轨道理论简介
问题与讨论1:根据基态原子的价层电子轨道表示式,解释为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
价层电子轨道表示式(电子排布图)
C
H
1s
解决方案:碳原子的一个2s电子受外界影响跃迁到2p的空轨道上,使碳原子价层有四个单电子,因此碳原子与氢原子结合生成CH4
1s
激发
1s
1s
1s
1s
问题与讨论2:CH4分子为什么能形成正四面体结构?
按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子
为了解决这一矛盾,鲍林提出了杂化轨道理论,杂化轨道理论是一种价健理论模型。
甲烷分子中C原子的1个2s轨道与3个2p轨道形成4个相同的sp3杂化轨道,夹角109°28′分别与4个氢原子的1s轨道重叠,形成4个C-Hs-sp3σ键,呈正四面体形。
解决方案:
sp3杂化轨道
四、杂化轨道理论简介
价层电子
空轨道
激发
杂化轨道
轨道重新组合
成对电子中的一个
与激发电子临近
能量相近、类型不同的原子
吸收能量
轨道总数目不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度更大,生成的分子更稳定
对杂化过程的理解
1、概念:
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
2、杂化的条件:
(1)只有在形成化学键时才能杂化
(2)只有能量相近的轨道间才能杂化
(同一能级组或相近能级)
x
y
z
x
y
z
x
y
z
x
y
z
109°28′
3、杂化轨道的类型
①sp3杂化
sp3杂化轨道特征:
①1个ns 轨道与3个np 轨道进行的杂化,形成4个sp3 杂化轨道。
②每个sp3杂化轨道的形状为一头大,一头小,含有 1/4 s 轨道和 3/4 p 轨道的成分。
③每两个轨道间的夹角为109 28′,空间构型为正四面体形。
问题与讨论3:如何用杂化轨道理论解释NH3和H2O的空间结构呢?
注:杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
NH3分子中氮原子的4个sp3杂化轨道1个被孤电子对占据,3个与氢原子的1s轨道重叠,形成3个C-Hs-sp3σ键。
H2O分子中氧原子的4个sp3杂化轨道2个被孤电子对占据,2个与氢原子的1s轨道重叠,形成2个C-Hs-sp3σ键。
VSEPR模型四面体形
中心原子采用sp3杂化。如SO42-、NH4+等)
结论:
2s
2p
sp3不等性杂化
sp3
N
NH3
H2O
sp3不等性杂化
sp3
2p
2s
O
②sp2杂化
x
y
z
x
y
z
x
y
z
x
y
z
120°
②每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分。
sp2杂化轨道特征:
①1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
③每两个轨道间的夹角为120°,呈平面三角形。
④ 3个sp2杂化轨道用于形成σ键,未参与杂化的p轨道用于形成π键。
问题与讨论4:如何用杂化轨道理论解释CH2=CH2和BF3的空间结构呢?
↑
↑
↑
↓
2s
2p
↑
↑
↑
↑
sp2
sp2杂化
CH2=CH2分子中碳原子的3个sp2杂化轨道有一个相互重叠形成sp2-sp2σ键,另外2个杂化轨道与氢原子1s轨道重叠形成两个s-sp2σ键,未参与杂化的2P轨道相互重叠形成π键。
↑
↑
↓
2s
2p
↑
↑
↑
sp2
sp2杂化
120°
BF3分子中硼原子的3个sp2杂化轨道与氟原子p轨道重叠形成三个p-sp2σ键
VSEPR模型平面三角形
中心原子采用sp2杂化(CO32-、SO2等)
结论:
CH2=CH2
BF3
B
C
③sp杂化
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
②每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分。
①1个s 轨道与1个p 轨道进行的杂化,形成2个sp杂化轨道。
sp杂化轨道特征:
③两个轨道间的夹角为180°,呈直线型。
④ 2个sp杂化轨道用于形成σ键,未参与杂化的2个p轨道用于形成2个π键。
问题与讨论5:如何用杂化轨道理论解释CH≡CH和BeCl2的空间结构呢?
CH≡CH分子中碳原子的2个sp杂化轨道有一个相互重叠形成sp-spσ键,另外1个杂化轨道与氢原子1s轨道重叠形成两个s-spσ键,未参与杂化的2个2P轨道相互重叠形成2个π键。
BeCl2分子中铍原子的2个sp杂化轨道与氟原子p轨道重叠形成三个sp-pσ键
VSEPR模型直线形
中心原子采用sp杂化(CO2等)
结论:
CH≡CH
BeCl2
↑
↓
2s
2p
sp2杂化
↑
↑
sp
Be
↑
↑
↑
↓
2s
2p
sp杂化
↑
↑
sp
↑
↑
C
4、杂化轨道理论规律:
杂化轨道数等于参与杂化的原子轨道数,杂化前后轨道数不变
杂化过程中轨道的形状、方向发生变化,杂化后的新轨道能量、形状都相同
③ 杂化轨道用于形成σ键或者用来容纳未参与成键的孤电子对。未参与杂化的p轨道,可用于形成π键。
④ 杂化前后原子轨道在空间取最大夹角分布,能使相互间排斥力最小。故形成的键较稳定,成键能力增强。不同类型的杂化轨道之间夹角不同,成键后所形成的分子就具有不同的空间构型。
课堂练习1:正误判断
(1)发生轨道杂化的原子一定是中心原子,原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的( )
(2)凡中心原子采取sp3杂化轨道成键的分子空间结构都是正四面体形( )
(3)杂化轨道的空间结构与分子的空间结构不一定一致( )
(4)杂化轨道能量更集中,有利于牢固成键( )
(5)杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。未参与杂化的p轨道可用于形成π键( )
(6)凡AB3型的共价化合物,其中心原子A均采用sp2杂化轨道成键。( )
×
×
√
√
√
√
【思考与讨论】确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论。
第一步 计算中心原子孤电子对数:
BF3
H3O+
第二步 计算价层电子对数:
3+0=3
3+1=4
第三步 确定VSEPR模型:
第四步 确定杂化轨道类型:
sp2
sp3
第三步 确定杂轨道数:
3
4
5、VSEPR模型与中心原子的杂化轨道类型
典型例子
价层电子对数
VSEPR模型
VSEPR模型名称
杂化轨道数
中心原子的杂化轨道类型
分子空间结构
直线形
平面三角形
平面三角形
四面体
四面体
正四面体
sp
sp2
sp3
sp2
sp3
sp3
CO2
SO2
SO3
H2O
NH3
CH4
2+0=2
2+1=3
3+0=3
2+2=4
3+1=4
4+0=4
2
3
3
4
4
4
直线形
V形
平面三角形
三角锥形
正四面体
V形
①对于主族元素来说,
中心原子的杂化轨道数=价层电子数=σ键电子对数 + 孤电子对数
当中心原子的价层电子对数为4时,其杂化类型为 杂化,
当中心原子的价层电子对数为3时,其杂化类型为 杂化,
当中心原子的价层电子对数为2时,其杂化类型为 杂化。
sp3
sp2
sp
6、杂化轨道类型的判断:
化学式 H3O+ NH2- CO2 CHCl3 COCl2 PCl3
σ键电子对
孤电子对
杂化类型
课堂练习2:推测下列微粒中心原子的杂化类型:
3
1
2
2
2
0
4
0
3
0
3
1
sp3
sp3
sp
sp3
sp2
sp3
σ键电子对数
+孤电子对数
价层电子对数
价层电子互斥理论
杂化轨道类型
分子空间结构
预测
解释
杂化轨道理论
小结:
VSEPR模型
②含碳化合物中碳原子的杂化类型判断
如果碳原子形成1个三键或两个双键,则其中有2个π键,用去2个p轨道,形成的是sp杂化,如CO2、HC≡CH等;
如果碳原子形成1个双键则其中必有1个π键,用去1个p轨道,形成的是sp2杂化,如HCHO、CH2=CH2等;
如果全部是单键(即碳原子饱和),则形成sp3杂化,如CH4、CH3OH等。
课堂练习3:推测下列有机物中碳的杂化类型:
(1)CH3CH2CH3 (2)CH3CH=CH2 (3)CH≡CCH=CH2
sp3
sp3
sp3
sp3
sp2
sp2
sp
sp
sp2
sp2
PCl3中心原子的杂化类型为sp3,那么PCl5中心原子的杂化类型如何?
三角双锥
sp3d杂化
↑
↑
↑
↓
3s
3p
↑
3d
↑
↑
↑
↑
↑
↑
↑
↑
3s
3p
↑
3d
↑
激发
杂化
7、其他典型的杂化类型
SF6中心原子的杂化
正八面体
sp3d2杂化
↑
↑
↑
↓
3s
3p
↑
3d
↓
↑
↑
↑
↑
↑
↑
↑
激发
↑
↑
↑
3s
3p
↑
3d
↑
↑
杂化
C6H6平面形分子,键角120 。
C:sp2等性杂化 3条杂化轨道互成120°角 。未杂化的p轨道形成p-p大π键
石墨分子结构是层形结构,每层是由无限个碳六元环所形成的平面,碳原子取sp2杂化,每个碳原子尚余一个未参与杂化的p轨道,垂直于分子平面而相互平行。平行的n个p轨道形成了一个p-p大π键。电子在这个大π键中可以自由移动,所以石墨能导电。
物质 价电 子对数 中心原 子杂化 轨道类型 杂化轨道/ 电子对空 间构型 轨道 夹角 分子空 间构型 键角
气态BeCl2
CO2
BF3
CH4
NH4+
H2O
NH3
PCl3
2
2
3
4
4
4
4
4
sp
sp
sp2
sp3
直线形
直线形
平面三角形
正四面体
180°
180°
120°
109.5°
直线形
直线形
平面三角形
正四面体
V形
三角锥形
180°
180°
120°
109.5°
109.5°
104.5°
107.3°
107.3°
常见共价粒子的杂化方式
课堂小结
原子轨道杂化
杂化轨道
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道,叫做杂化轨道。
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道用于构建分子的σ轨道和孤电子对轨道
杂化轨道理论要点
杂化轨道类型
sp3杂化、sp2杂化、sp杂化……
【课堂检测】
1.以下有关杂化轨道的说法中正确的是( )
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既能形成σ键,也能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
A
2.下列分子中的中心原子采取sp2杂化的是( )
①C2H2 ②C2H4 ③C3H8 ④CO2 ⑤BeCl2 ⑥SO3 ⑦BF3
A.①⑥⑦ B.③⑤⑦ C. ② ⑥⑦ D.③⑤⑥
C
3.下列分子中,中心原子的杂化轨道类型相同的是( )
A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H4与C2H2
B
5.甲醛分子的结构式为 ,下列描述正确的是( )
A.甲醛分子中有4个σ键 B.甲醛分子中的C原子为sp3杂化
C.甲醛分子中的O原子为sp杂化
D.甲醛分子为平面三角形,有一个π键垂直于三角形平面
D
6. (1)Xe 是第五周期的稀有气体元素,与 F 形成的 XeF2室温下易升华。XeF2中心原子的价层电子对数为 ,下列对 XeF2中心原子杂化方式推断合理的是_______(填标号)。
A.sp B.sp2 C.sp3 D.sp3d
5
D
(2)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为 。
sp3
(3)PH3中P采取的杂化类型为 。
sp3
