人教版(2019)选择性必修三 3.2.1 醇 课件(共18张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修三 3.2.1 醇 课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:40:36 | ||
图片预览



文档简介
(共18张PPT)
学习目标:
1.能辨识醇的类别,知道醇的物理性质;
2.能探析掌握乙醇的氧化反应、取代反应、消去反应等化学性质;
3.能化学方程式表征醇的氧化反应、取代反应和消去反应。
第1课时 醇
素养目标:
第二节 醇 酚
1.宏观辨识与微观探析:能辨识醇的类别及相关实验宏观现象,能从分子结构视角微观探析醇可能具有的化学性质,并能正确表征;
2.科学探究与创新意识:能对醇的性质进行实验验证,结合分子结构进行探究。
3.科学态度与社会责任:能认识到醇的用途,体会化学学科的社会价值。
4.证据推理与模型认知:能基于分子结构证据推理醇的性质,能认知醇的结构。
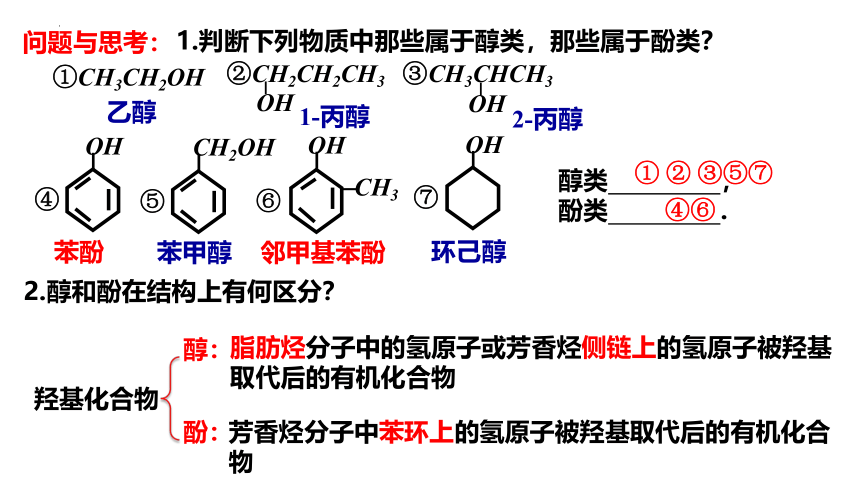
问题与思考:
①CH3CH2OH
③CH3CHCH3
OH
OH
CH3
⑥
OH
④
醇类 ,
酚类 .
① ② ③⑤⑦
④⑥
2.醇和酚在结构上有何区分?
羟基化合物
醇:
酚:
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物
②CH2CH2CH3
OH
CH2OH
⑤
OH
⑦
乙醇
1-丙醇
2-丙醇
苯酚
苯甲醇
邻甲基苯酚
环己醇
1.判断下列物质中那些属于醇类,那些属于酚类?
一、醇
1.醇的分类:
(1)根据烃基的种类分
脂肪醇
脂环醇
芳香醇
饱和
不饱和
如:CH3CH3OH
如:CH2=CHCH2OH
OH
CH2OH
如:
如:
乙醇
丙烯醇
环己醇
苯甲醇
(2)根据羟基的数目分
CH3CH2CH2OH
1-丙醇(正丙醇)
乙二醇
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
一元醇:
二元醇:
三元醇:
如:
如:
如:
CnH2n+1OH 或 CnH2n+2O(n≥1)(R-OH)
(3)饱和一元醇:
2.甲醇: P58
3.醇的用途:P58
乙二醇用作汽油防冻液
丙三醇等用于配制化妆品
图3-5 乙二醇和丙三醇的用途
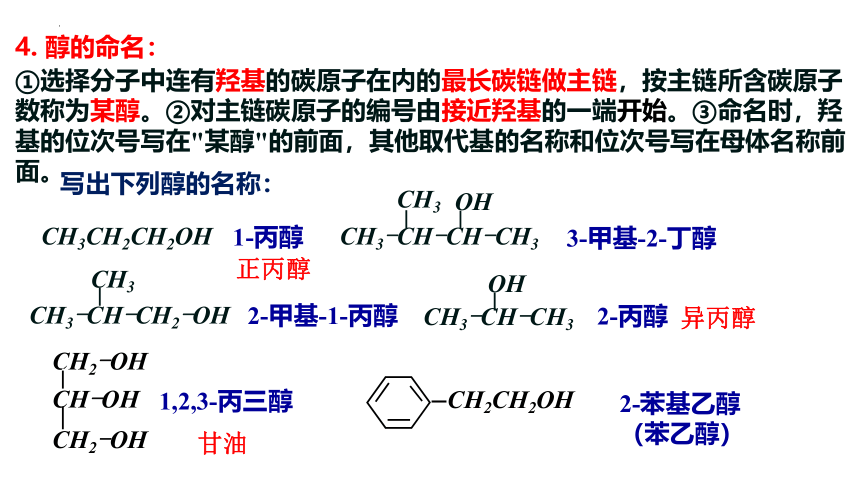
4. 醇的命名:
写出下列醇的名称:
CH3-CH-CH3
OH
CH3-CH-CH2-OH
CH3
2-甲基-1-丙醇
2-丙醇
①选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。②对主链碳原子的编号由接近羟基的一端开始。③命名时,羟基的位次号写在"某醇"的前面,其他取代基的名称和位次号写在母体名称前面。
CH3CH2CH2OH
1-丙醇
1,2,3-丙三醇
CH2-OH
CH2-OH
CH-OH
CH2CH2OH
2-苯基乙醇(苯乙醇)
3-甲基-2-丁醇
CH3-CH-CH-CH3
CH3
OH
正丙醇
异丙醇
甘油
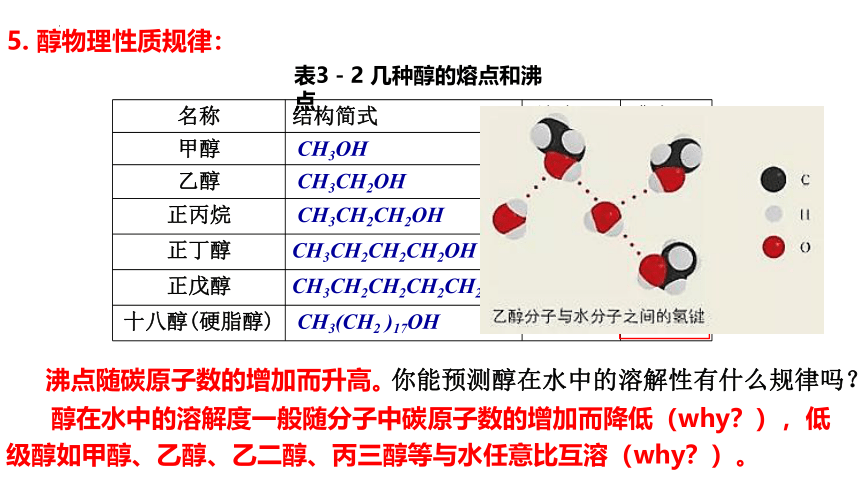
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙烷 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2 )17OH 59 211
表3-2 几种醇的熔点和沸点
5. 醇物理性质规律:
醇在水中的溶解度一般随分子中碳原子数的增加而降低(why?),低级醇如甲醇、乙醇、乙二醇、丙三醇等与水任意比互溶(why?)。
沸点随碳原子数的增加而升高。
你能预测醇在水中的溶解性有什么规律吗?
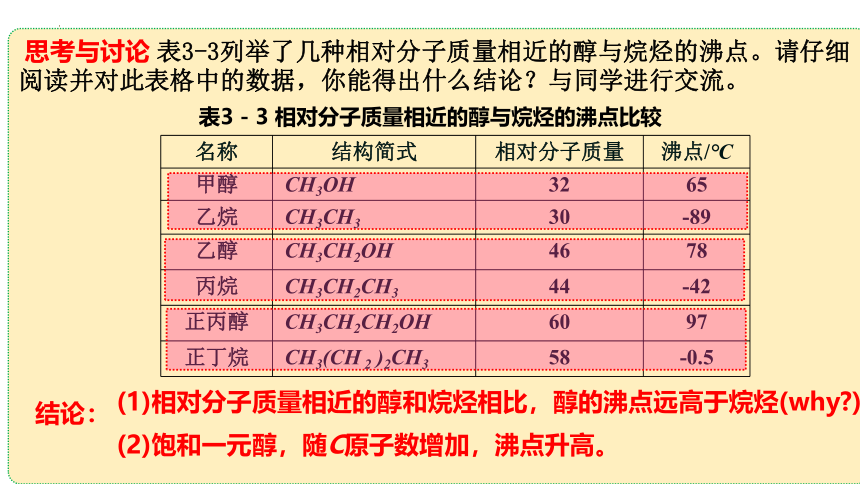
思考与讨论 表3-3列举了几种相对分子质量相近的醇与烷烃的沸点。请仔细阅读并对此表格中的数据,你能得出什么结论?与同学进行交流。
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3(CH 2 )2CH3 58 -0.5
表3-3 相对分子质量相近的醇与烷烃的沸点比较
结论:
(1)相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃(why )。
(2)饱和一元醇,随C原子数增加,沸点升高。
图3-6 醇分子间形成氢键
R
O
H
H
R
O
R
O
H
H
R
O
R
O
H
H
R
O
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间的相互作用增强,致使沸点升高;
为什么相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃?
问题与思考:
二、乙醇的化学性质
回忆乙醇的化学性质,写出相应的化学方程式。
上述反应中分别打断了什么化学键?
H—C—C—O—H
H
H
H
H
从键的极性角度分析,为什么乙醇分子中上述化学键容易断裂?
α
β
氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的氧
原子对共用电子对的吸引力强,共用电子对偏向氧,使C-O键、O-H键和
C-H键都显示出极性,在反应中容易断裂。
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
CH3CH2OH CH2= CH2↑+H2O
浓H2SO4
170℃
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
1.置换反应:
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
描述钠与乙醇反应的实验现象?(对照钠与水的反应)
2.消去反应:
CH2-CH2 CH2= CH2↑+H2O
浓H2SO4
170℃
H OH
分子内脱水
请设计实验装置制备乙烯,并检验乙烯。
现象:生成无色气体,液体轻微变黑,溴的四氯化
碳溶液、酸性高锰钾溶液褪色。
①浓硫酸的作用:催化剂和脱水剂;浓硫酸与乙醇
体积比3:1。
②温度要迅速升高到170°C,温度计水银球位置浸没
在液体中部,不能接触底部。
③NaOH溶液:除去混在乙烯中的CO2、SO2等气体。
④碎瓷片防止暴沸。
β碳上有H。
醇的消去反应条件:
CH3OH
CH3
C
CH3
CH3
CH2OH
不能发生消去反应。
问题与思考:
下列两种醇能发生消去反应吗?为什么?
思考与讨论 :溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同?
溴乙烷是在强碱醇溶液、加热下条件下断裂C-Br、C-H,生成CH2=CH2、 NaBr、 H2O;乙醇是在浓硫酸、加热到170℃条件下断裂C-O、C-H,生成CH2=CH2、 H2O。
3.取代反应:
C2H5-OH + H-Br C2H5Br + H2O
△
制取溴乙烷
CH3CH2O-H+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
(2)酯化反应
(1)与卤化氢取代
(3)分子间脱水成醚
C2H5 - OH + H-O-C2H5
浓H2SO4
140℃
C2H5 -O-C2H5 + H2O
乙醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R-O-R′来表示,R和R′都是烃基,可以相同,也可以不同。醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
能被催化氧化吗?如能被
氧化,氧化产物是什么?
O—H
H
H—C—C—
H
H
H
+ CuO
H—C—C=O
H
H
H
+ Cu + H2O
Δ
4.氧化反应:
(1)催化氧化:
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
Ag2O
Ag
问题与思考:
CH3—CH—CH3
OH
CH3—C—CH3
OH
—
CH3
和
2CH3—C—CH3
O—H
+O2
H
Cu或Ag
2CH3—C—CH3
O
=
+2H2O
丙酮
乙醛
R-CH2 OH
-
(伯醇)
/Cu或Ag
O2
R-CHO
R-CH OH
R′
-
(仲醇)
/Cu或Ag
O2
R-C
R′
=
O
R-C OH
R′
R″
-
(叔醇)
羟基碳上无氢,不能被催化氧化
醛
酮
小结:醇催化氧化的规律
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
(2)强氧化剂氧化:
强氧化剂酸性高锰酸钾、重铬酸钾等氧化乙醇的过程分两个阶段:
(3)燃烧氧化:
CH3CH2OH+3O2 2CO2+3H2O
点燃
乙醇 乙醛 乙酸
有机氧化反应:
加氧脱氢的反应
有机还原反应:
加氢脱氧的反应
写出乙醇被酸化的重铬酸钾氧化成乙酸的离子方程式。
上述两个氧化反应从本质上看有什么区别?归纳总结如何判断有机反应中的
氧化反应和还原反应。
资料卡片
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢?
酒精在人体内的代谢主要靠两种酶:一种是乙醇脱氢酶,另一种是乙醛脱氢酶。乙醇脱氢酶使乙醇氧化成乙醛,而乙醛脱氢酶能使乙醛氧化为乙酸。乙酸参与体内代谢,转化为二氧化碳和水排出体外。人体内若是具备这两种酶,就能较快地分解酒精。一般人的体内都有乙醇脱氢酶,但不少人缺少乙醛脱氢酶,这使体内的乙醛不易被氧化为乙酸,从而让人脸部甚至体表毛细血管扩张充血,并产生其他醉酒症状。
思考:市面上售卖的解酒药从化学角度分析其主要的作用是什么?
H―C―C―O―H
H
H
H
H
②
①
⑤
③
④
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
②④
②
①③
①②
①
①
小结1:
小结2:
醇
分类
按烃基分:脂肪醇、芳香醇
羟基数分:一、二、三元醇
物性
代表物-乙醇
物性
命名
结构
化性
与活泼金属反应
消去反应
取代反应
分子间脱水成醚
与卤化氢取代
与酸酯化取代
氧化反应
催化氧化
强氧化剂氧化
燃烧氧化
学习目标:
1.能辨识醇的类别,知道醇的物理性质;
2.能探析掌握乙醇的氧化反应、取代反应、消去反应等化学性质;
3.能化学方程式表征醇的氧化反应、取代反应和消去反应。
第1课时 醇
素养目标:
第二节 醇 酚
1.宏观辨识与微观探析:能辨识醇的类别及相关实验宏观现象,能从分子结构视角微观探析醇可能具有的化学性质,并能正确表征;
2.科学探究与创新意识:能对醇的性质进行实验验证,结合分子结构进行探究。
3.科学态度与社会责任:能认识到醇的用途,体会化学学科的社会价值。
4.证据推理与模型认知:能基于分子结构证据推理醇的性质,能认知醇的结构。
问题与思考:
①CH3CH2OH
③CH3CHCH3
OH
OH
CH3
⑥
OH
④
醇类 ,
酚类 .
① ② ③⑤⑦
④⑥
2.醇和酚在结构上有何区分?
羟基化合物
醇:
酚:
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物
芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物
②CH2CH2CH3
OH
CH2OH
⑤
OH
⑦
乙醇
1-丙醇
2-丙醇
苯酚
苯甲醇
邻甲基苯酚
环己醇
1.判断下列物质中那些属于醇类,那些属于酚类?
一、醇
1.醇的分类:
(1)根据烃基的种类分
脂肪醇
脂环醇
芳香醇
饱和
不饱和
如:CH3CH3OH
如:CH2=CHCH2OH
OH
CH2OH
如:
如:
乙醇
丙烯醇
环己醇
苯甲醇
(2)根据羟基的数目分
CH3CH2CH2OH
1-丙醇(正丙醇)
乙二醇
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH2-OH
CH-OH
一元醇:
二元醇:
三元醇:
如:
如:
如:
CnH2n+1OH 或 CnH2n+2O(n≥1)(R-OH)
(3)饱和一元醇:
2.甲醇: P58
3.醇的用途:P58
乙二醇用作汽油防冻液
丙三醇等用于配制化妆品
图3-5 乙二醇和丙三醇的用途
4. 醇的命名:
写出下列醇的名称:
CH3-CH-CH3
OH
CH3-CH-CH2-OH
CH3
2-甲基-1-丙醇
2-丙醇
①选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。②对主链碳原子的编号由接近羟基的一端开始。③命名时,羟基的位次号写在"某醇"的前面,其他取代基的名称和位次号写在母体名称前面。
CH3CH2CH2OH
1-丙醇
1,2,3-丙三醇
CH2-OH
CH2-OH
CH-OH
CH2CH2OH
2-苯基乙醇(苯乙醇)
3-甲基-2-丁醇
CH3-CH-CH-CH3
CH3
OH
正丙醇
异丙醇
甘油
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙烷 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2 )17OH 59 211
表3-2 几种醇的熔点和沸点
5. 醇物理性质规律:
醇在水中的溶解度一般随分子中碳原子数的增加而降低(why?),低级醇如甲醇、乙醇、乙二醇、丙三醇等与水任意比互溶(why?)。
沸点随碳原子数的增加而升高。
你能预测醇在水中的溶解性有什么规律吗?
思考与讨论 表3-3列举了几种相对分子质量相近的醇与烷烃的沸点。请仔细阅读并对此表格中的数据,你能得出什么结论?与同学进行交流。
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3(CH 2 )2CH3 58 -0.5
表3-3 相对分子质量相近的醇与烷烃的沸点比较
结论:
(1)相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃(why )。
(2)饱和一元醇,随C原子数增加,沸点升高。
图3-6 醇分子间形成氢键
R
O
H
H
R
O
R
O
H
H
R
O
R
O
H
H
R
O
因为醇分子中羟基的氧原子与另一醇分子羟基氢原子间存在着氢键,分子间的相互作用增强,致使沸点升高;
为什么相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃?
问题与思考:
二、乙醇的化学性质
回忆乙醇的化学性质,写出相应的化学方程式。
上述反应中分别打断了什么化学键?
H—C—C—O—H
H
H
H
H
从键的极性角度分析,为什么乙醇分子中上述化学键容易断裂?
α
β
氧元素的电负性比氢元素和碳元素的电负性都大,醇分子中羟基上的氧
原子对共用电子对的吸引力强,共用电子对偏向氧,使C-O键、O-H键和
C-H键都显示出极性,在反应中容易断裂。
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
CH3CH2OH+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
CH3CH2OH CH2= CH2↑+H2O
浓H2SO4
170℃
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
1.置换反应:
2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑
描述钠与乙醇反应的实验现象?(对照钠与水的反应)
2.消去反应:
CH2-CH2 CH2= CH2↑+H2O
浓H2SO4
170℃
H OH
分子内脱水
请设计实验装置制备乙烯,并检验乙烯。
现象:生成无色气体,液体轻微变黑,溴的四氯化
碳溶液、酸性高锰钾溶液褪色。
①浓硫酸的作用:催化剂和脱水剂;浓硫酸与乙醇
体积比3:1。
②温度要迅速升高到170°C,温度计水银球位置浸没
在液体中部,不能接触底部。
③NaOH溶液:除去混在乙烯中的CO2、SO2等气体。
④碎瓷片防止暴沸。
β碳上有H。
醇的消去反应条件:
CH3OH
CH3
C
CH3
CH3
CH2OH
不能发生消去反应。
问题与思考:
下列两种醇能发生消去反应吗?为什么?
思考与讨论 :溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同?
溴乙烷是在强碱醇溶液、加热下条件下断裂C-Br、C-H,生成CH2=CH2、 NaBr、 H2O;乙醇是在浓硫酸、加热到170℃条件下断裂C-O、C-H,生成CH2=CH2、 H2O。
3.取代反应:
C2H5-OH + H-Br C2H5Br + H2O
△
制取溴乙烷
CH3CH2O-H+HOOCCH3 CH3CH2OOCCH3+H2O
浓硫酸
△
(2)酯化反应
(1)与卤化氢取代
(3)分子间脱水成醚
C2H5 - OH + H-O-C2H5
浓H2SO4
140℃
C2H5 -O-C2H5 + H2O
乙醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R-O-R′来表示,R和R′都是烃基,可以相同,也可以不同。醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
能被催化氧化吗?如能被
氧化,氧化产物是什么?
O—H
H
H—C—C—
H
H
H
+ CuO
H—C—C=O
H
H
H
+ Cu + H2O
Δ
4.氧化反应:
(1)催化氧化:
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
Ag2O
Ag
问题与思考:
CH3—CH—CH3
OH
CH3—C—CH3
OH
—
CH3
和
2CH3—C—CH3
O—H
+O2
H
Cu或Ag
2CH3—C—CH3
O
=
+2H2O
丙酮
乙醛
R-CH2 OH
-
(伯醇)
/Cu或Ag
O2
R-CHO
R-CH OH
R′
-
(仲醇)
/Cu或Ag
O2
R-C
R′
=
O
R-C OH
R′
R″
-
(叔醇)
羟基碳上无氢,不能被催化氧化
醛
酮
小结:醇催化氧化的规律
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
(2)强氧化剂氧化:
强氧化剂酸性高锰酸钾、重铬酸钾等氧化乙醇的过程分两个阶段:
(3)燃烧氧化:
CH3CH2OH+3O2 2CO2+3H2O
点燃
乙醇 乙醛 乙酸
有机氧化反应:
加氧脱氢的反应
有机还原反应:
加氢脱氧的反应
写出乙醇被酸化的重铬酸钾氧化成乙酸的离子方程式。
上述两个氧化反应从本质上看有什么区别?归纳总结如何判断有机反应中的
氧化反应和还原反应。
资料卡片
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢?
酒精在人体内的代谢主要靠两种酶:一种是乙醇脱氢酶,另一种是乙醛脱氢酶。乙醇脱氢酶使乙醇氧化成乙醛,而乙醛脱氢酶能使乙醛氧化为乙酸。乙酸参与体内代谢,转化为二氧化碳和水排出体外。人体内若是具备这两种酶,就能较快地分解酒精。一般人的体内都有乙醇脱氢酶,但不少人缺少乙醛脱氢酶,这使体内的乙醛不易被氧化为乙酸,从而让人脸部甚至体表毛细血管扩张充血,并产生其他醉酒症状。
思考:市面上售卖的解酒药从化学角度分析其主要的作用是什么?
H―C―C―O―H
H
H
H
H
②
①
⑤
③
④
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃
浓硫酸加热到140℃
浓硫酸条件下与乙酸加热
与HX加热反应
②④
②
①③
①②
①
①
小结1:
小结2:
醇
分类
按烃基分:脂肪醇、芳香醇
羟基数分:一、二、三元醇
物性
代表物-乙醇
物性
命名
结构
化性
与活泼金属反应
消去反应
取代反应
分子间脱水成醚
与卤化氢取代
与酸酯化取代
氧化反应
催化氧化
强氧化剂氧化
燃烧氧化
