人教版(2019)选择性必修三 3.1.1 卤代烃 课件(共64张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修三 3.1.1 卤代烃 课件(共64张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:43:25 | ||
图片预览





文档简介
(共64张PPT)
第三章 烃的衍生物
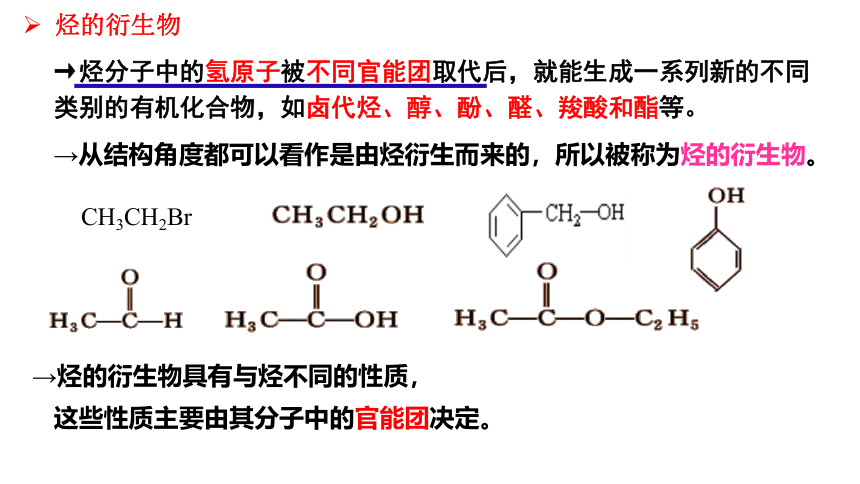
烃的衍生物
CH3CH2Br
→从结构角度都可以看作是由烃衍生而来的,所以被称为烃的衍生物。
→烃分子中的氢原子被不同官能团取代后,就能生成一系列新的不同
类别的有机化合物,如卤代烃、醇、酚、醛、羧酸和酯等。
→烃的衍生物具有与烃不同的性质,
这些性质主要由其分子中的官能团决定。
第一节 卤代烃
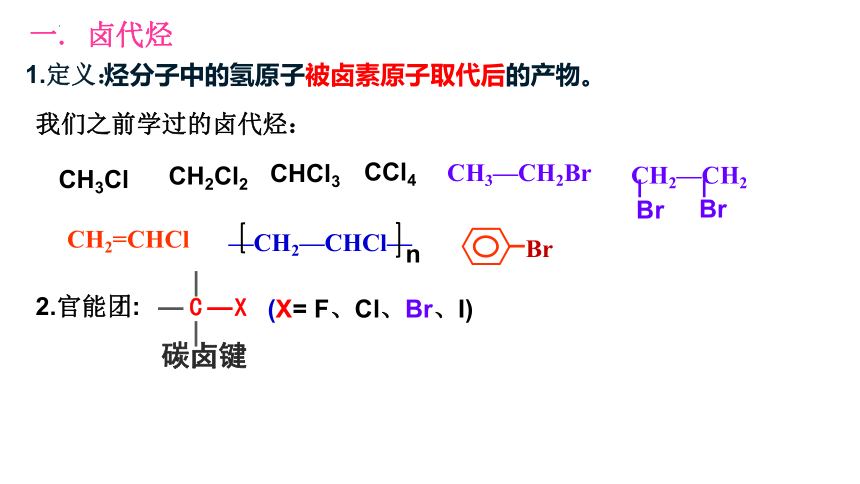
一. 卤代烃
1.定义:
烃分子中的氢原子被卤素原子取代后的产物。
CH3Cl
CH2Cl2
CHCl3
CCl4
CH3—CH2Br
CH2—CH2
Br
Br
CH2=CHCl
Br
—CH2—CHCl—
n
2.官能团:
(X= F、Cl、Br、I)
我们之前学过的卤代烃:
碳卤键
X
C
下列物质中,不属于卤代烃的是( )
A、CH2Cl2 B、CCl2F2
C、 D、CH3COCl
-Br
卤代烃只能含有C、H、X(H不一定),不含其它原子。
D
练一练
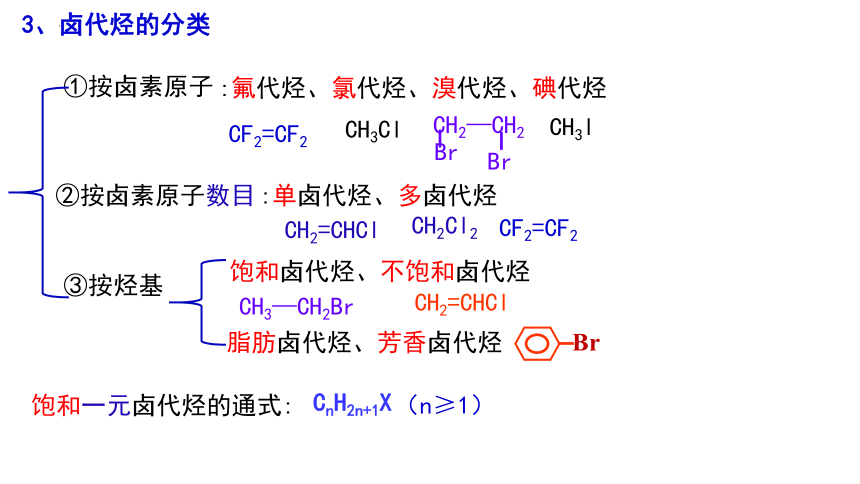
3、卤代烃的分类
①按卤素原子
②按卤素原子数目
③按烃基
:单卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃
:氟代烃、氯代烃、溴代烃、碘代烃
脂肪卤代烃、芳香卤代烃
CF2=CF2
CH3Cl
CH2—CH2
Br
Br
CH3l
CH3—CH2Br
CH2=CHCl
Br
饱和一元卤代烃的通式:
CnH2n+1X
(n≥1)
CH2=CHCl
CH2Cl2
CF2=CF2
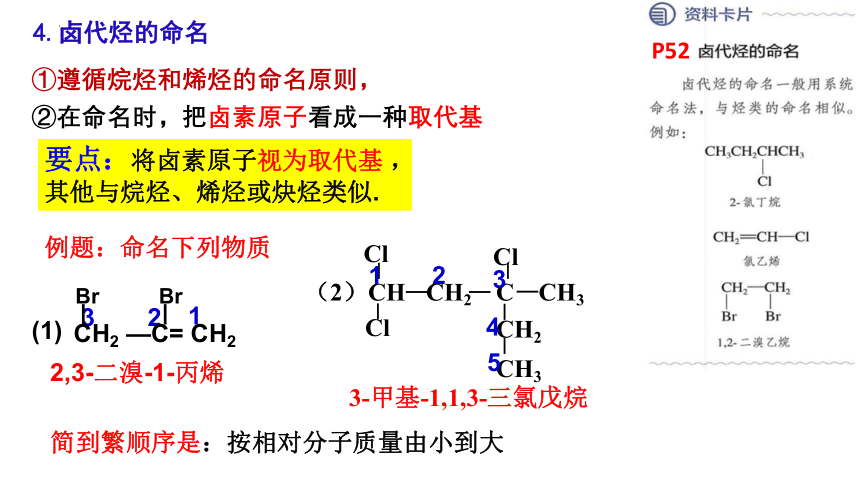
①遵循烷烃和烯烃的命名原则,
②在命名时,把卤素原子看成一种取代基
例题:命名下列物质
(2)CH CH2 C CH3
Cl
Cl
CH2
CH3
Cl
3-甲基-1,1,3-三氯戊烷
1
2
3
4
5
3
2
1
要点:将卤素原子视为取代基 ,
其他与烷烃、烯烃或炔烃类似.
CH2 —C= CH2
Br Br
2,3-二溴-1-丙烯
(1)
简到繁顺序是:按相对分子质量由小到大
4.卤代烃的命名
P52
CH—CH2—CH—CH2—CH3
Br
Br
CH3
3-甲基- 1,1-二溴戊烷
CH2—C—C≡CH
Cl
CH3
Cl
3-甲基- 3,4-二氯-1-丁炔
CH3—C—CH2—CH—CH3
Cl
CH2F
Cl
2-甲基- 1-氟-2,4-二氯戊烷
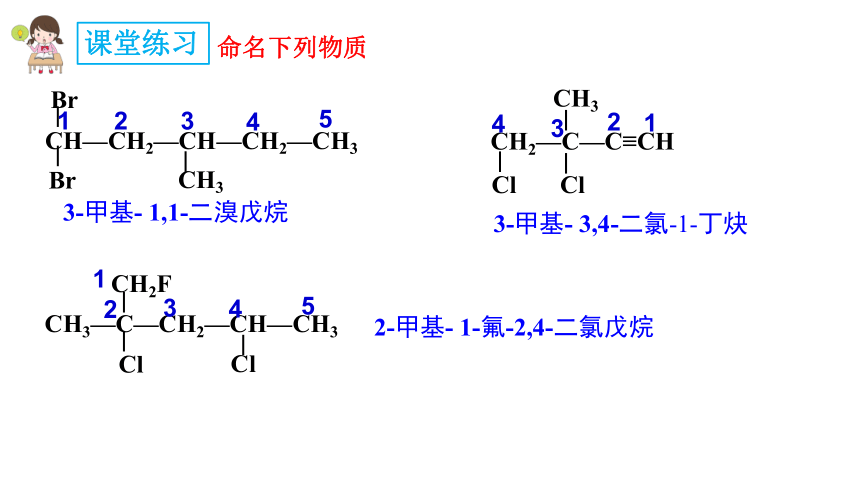
课堂练习
命名下列物质
1
2
3
4
5
1
2
3
4
1
2
3
4
5
5.同分异构体
(1)一氯代烷:
找等效氢
(2)二氯代烷:
定一移二
(3)芳香卤代烃:
找邻、间、对三个位置和取代基位置上的氢
如:CH3CH2CH2CH2CH3的一氯代物有多少种
如: CH3CH2CH2CH2CH3的二氯代物有多少种
如: 的一氯代物、二氯代物各有多少种
9种
4种
10种
3种
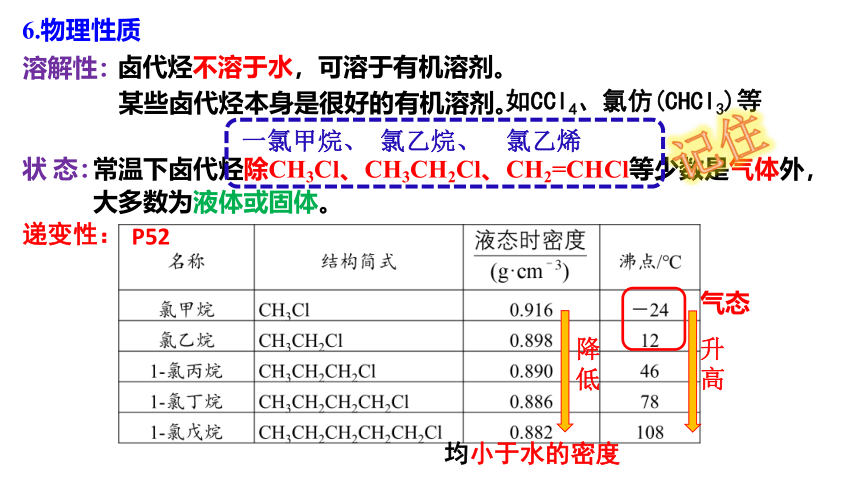
6.物理性质
常温下卤代烃除CH3Cl、CH3CH2Cl、CH2=CHCl等少数是气体外,
状 态:
溶解性:
卤代烃不溶于水,可溶于有机溶剂。
某些卤代烃本身是很好的有机溶剂。
降低
一氯甲烷、 氯乙烷、 氯乙烯
如CCl4、氯仿(CHCl3)等
P52
大多数为液体或固体。
递变性:
升高
均小于水的密度
气态
记住
②同分异构体的密度随分子中支链的增多而降低
①沸点随碳原子数目的增加而升高;
密度
沸点
②同分异构体中,支链越多沸点越低
①随烃基中碳原子数的增多而减小;
递变性:
卤代烃沸点、密度均高于相应的烃
6.物理性质
如,氯乙烷>乙烷
→脂肪一氟代烃(R-F)和一氯代烃(R-Cl)密度比水小;
溴代烃、碘代烃及多卤代烃:均大于水的密度
CCl4
CHCl3
C2H5Br
CH3I
其余卤代烃都比水大。
Br
如ρ(CH3Cl)>ρ(CH3CH2Cl)
如沸点CH3Cl<CH3CH2Cl。
讨论:氯乙烷的沸点比溴乙烷的沸点是高还是低?为什么?
→低。氯乙烷常温下是气体,溴乙烷常温下是液体。
烷烃分子中的氢原子被卤素原子取代后,其相对分子质量变大,分子间作用力变大,卤代烃溶沸点升高,密度变大。
卤代烃只有极少数是气体,大多数为固体或液体,不溶于水,可溶于大多数的有机溶剂。
小结:
人教版化学选修五2.3卤代烃(共61张PPT)
CH3Cl、CH3CH2Cl、CH2=CHCl等
理由:氯乙烷与溴乙烷的结构相似,而相对分子质量小于溴乙烷,分子间作用力小,故沸点低。
氯乙烷的应用
复方氯乙烷气雾剂
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用,可在身体局部产生快速镇痛效果。因此常用氯乙烷与其他药物制成“复方氯乙烷喷雾剂”,用于运动中的急性损伤,如肌肉拉伤,关节扭伤等的阵痛
资料卡片:
P53
卤代烃是一类特殊的烃。可分为单卤代烃和多卤代烃。( )
卤代烃中一定含有的元素为C、H和卤素。( )
卤代烃不一定是由烃分子和卤素单质发生取代反应得到的( )
分子中碳原子数少于4的烃,在常温下为气体,溴乙烷分子中含2个碳原子,所以其在常温下也是气体( )
卤代烃属于有机化合物,都易燃烧。( )
×
×
√
×
×
1、判断对错
课堂练习
课堂练习
2. 均不溶于水且比水轻的一组液体是( )
A.苯、 一氯丙烷 B.溴苯 、四氯化碳
C.溴乙烷 、氯乙烷 D.硝基苯 、一氯丙烷
3.下列有机物中沸点最高的是( )
A、乙烷 B、一氯甲烷
C、一氯乙烷 D、一氯丁烷
A
D
4、下列关于卤代烃的叙述中正确的是 ( )
A、所有卤代烃都是难溶于水,密度比水小的液体
B、所有卤代烃的沸点比相应烃的沸点低
C、CH3CH2Cl与CH3CH2CH2Cl的沸点前者低
D、CH3CH2Cl与CH3CH2CH2Cl的密度前者小
C
课堂练习
→只有脂肪一氟代烃(R-F)和一氯代烃(R-Cl)密度比水小。
高
卤代烃沸点随碳原子数目的增加而升高。
卤代烃密度随碳原子数的增多而减小。
大
√
二.溴乙烷
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
核磁共振氢谱图
1.分子组成与结构
(碳溴键)
(代表物)
球棍模型
空间填充模型
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3:2
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
2. C2H5Br物理性质
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
二.溴乙烷
(代表物)
C—Br 键具有较强的极性,易断裂。
对比:乙烷与溴乙烷结构有何不同?
3. C2H5Br化学性质
结构决定性质
因此溴乙烷的反应活性比乙烷增强。
导致化学性质有何不同 ?
二.溴乙烷
(代表物)
元素 H C Br
电负性 2.1 2.5 2.8
δ+
δ-
δ+
δ-
提出问题2:CH3CH3+水→不反应, CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
实验探索:
Br-
怎样证明有Br-产生?
资料卡片:C2H5Br与水的反应要在碱性环境下才容易进行
对CH3CH2Br化学性质的探索
实验装置
实验现象
实验解释
实验3-1
P53
实验装置
实验现象
实验解释
①中溶液分层。
溴乙烷与NaOH溶液共热,产生了Br-
实验3-1
C2H5Br+NaOH C2H5OH+NaBr,
NaBr+AgNO3===AgBr↓+NaNO3
④中有淡黄色沉淀生成。
②中有机层厚度减小。
(1)溴乙烷的取代反应
C2H5—Br + H--OH C2H5—OH + HBr
△
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
NaOH + HBr == NaBr + H2O
CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
总反应:
推广:所有卤代烃在碱性水溶液中都会发生水解反应
(也叫水解反应)
实质:
① CH3CH2—Br + H—OH
CH3CH2OH + HBr
NaOH△
② NaOH + HBr = NaBr + H2O
总:CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
③AgNO3 + NaBr = AgBr↓ + NaNO3
(1)水解反应
--取代反应
推广:所有卤代烃在碱性水溶液中都会发生水解反应
3. C2H5Br化学性质
二.溴乙烷
(代表物)
1.NaOH的作用是什么?
2.采取什么措施可以加快水解反应的速率?
3.溴乙烷在什么条件下发生水解反应?
4.溴乙烷水解时在什么位置断键?
5.加入过量稀硝酸的目的是什么?
中和水解产物HBr,使平衡正向移动
NaOH水溶液,加热
C-Br键
①中和过量的NaOH溶液
②检验生成的沉淀是否溶于稀HNO3
加热
思考与交流:
6.若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
7.用何种波谱可以方便地检验产物中有乙醇生成?
②核磁共振氢谱
①红外光谱
思考与交流:
2个峰
3个峰
CH3CH2Br
CH3CH2OH
水
△
+ NaOH
水
△
+ NaOH
+ NaBr
+ 2 NaBr
2
1、写出下列卤代烃的水解方程式
练习
2.已知NH3和H2O在与卤代烃反应时的性质很相似,在一定条件下能使卤代烃发生氨解,写出溴乙烷的氨解方程式。
CH3CH2—Br + H—NH2
CH3CH2NH2 + HBr
△
→ 所有卤代烃在碱性水溶液中都会发生水解反应
(2)消去反应
条件:与NaOH的醇溶液共热
C2H5Br
NaOH+乙醇
作为溶剂
溴水
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
(2)消去反应
条件:与NaOH的醇溶液共热
C2H5Br
NaOH+乙醇
作为溶剂
现象:
溴水橙黄色逐渐褪去
溴水
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
CH2=CH2↑+ HBr
醇、NaOH
△
NaOH + HBr = NaBr + H2O
CH2—CH2
|
|
H Br
CH2=CH2↑+ NaBr + H2O
+ NaOH
CH2—CH2
|
|
H Br
醇
△
消去反应
消去反应:有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HX等),而生成不饱和(含双键或三键)化合物的反应。P54
总:
(2)消去反应
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
实质:相邻的两个C上脱去HX形成不饱和键!
[回顾] 我们还学过哪个消去反应?
CH2=CH2↑ + H2O
浓H2SO4
170℃
CH2—CH2
|
|
H OH
【归纳总结】C2H5Br的消去反应:
强碱的醇溶液、加热
将产生的气体通入溴水或溴/CCl4中,溶液褪色。
1.反应条件:
问题:
生成的乙烯气体能否用酸性KMnO4溶液检验?
除去乙醇,排除干扰。
因为乙醇也能使KMnO4(H+aq)褪色,水能除去挥发出来的乙醇,
产生的气体乙烯(含 等杂质气体)
分析:
乙醇、溴乙烷、水蒸气
没必要事先水洗
能。但必须将气体先通入盛水的试管,再通入酸性KMnO4溶液中。
为什么?
2.产物检验:
水解反应(取代反应) 消去反应
反应物
反应条件
断键
生成物
结论 CH3CH2Br
CH3CH2Br
C-Br
C-Br,邻碳C-H
CH3CH2OH、 NaBr
CH2=CH2 、NaBr、H2O
C2H5Br和NaOH在不同条件下发生不同类型的反应
小 结
比较溴乙烷的取代反应和消去反应,并完成下表。
水
NaOH水溶液,加热
NaOH醇溶液,加热
口诀:“有醇则无醇,无醇则有醇”
消去反应
水解反应
运用第一章所学的波谱方法检验取代产物1-丁醇
P54
生成醇
生成烯烃
P54
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+ 水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
2-丁烯
CH3-CH2-CH-CH3
Br
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
练、下列卤代烃能否发生消去反应?
A、CH3Cl
B、CH3-CH-CH3
Br
C、CH3-C-CH2-I
CH3
CH3
F 、
Cl
√
√
√
–Cl
D 、
×
×
×
CH2=CH-CH3
若能,请写出有机产物的结构简式:
(主产物)
CH2Cl
= CH2
无H
无相邻C
关键:抓住断键方式
苯环上为独特的碳碳键
E、CH3-CH2-C-CH3
Cl
CH3
CH3-CH2-C=CH2
CH3
CH3-CH=C-CH3
CH3
H X
-C-C- -C=C-
归纳总结:卤代烃的消去反应
反应条件:
与强碱的醇溶液共热
结构要求:
与卤原子相连C原子的相邻C上必须有H
无相邻C或相邻C上无H的不能发生消去反应
CH3X
–X
CH3-C-CH2X
CH3
CH3
–CH2X
CH3-C-X
CH3
CH3
CH2= C
CH3
CH3
关键:抓住断键方式
强碱的醇溶液
+ HX
练习
1.下列物质与NaOH醇溶液共热可制得烯烃的是:
A.C6H5CH2Cl B.(CH3)3CBr C.CH3CHBrCH3 D.CH3Cl
2.写出由CH2BrCH2Br与NaOH醇溶液共热的反应化学方程式
C
B
CH2BrCH2Br CH2=CH2 +Br2
NaOH、醇
△
↑
CH2—CH2
|
|
Br Br
+NaOH
醇
△
CH=CH2
Br
+ NaBr + H2O
CH=CH2
Br
+NaOH
醇
△
CH ≡ CH↑
+ NaBr + H2O
×
注意:不能同时消去2个卤素原子!!!
二卤代烃发生消去反应后可能在有机化合物中引入碳碳三键或两个碳碳双键。
推广:卤代烃的化学性质
(1)取代反应(水解反应)
R-X + NaOH R-OH + NaX
H2O
△
CHCl2
①CH3CHClCH2Cl
练:分析下列物质发生水解反应之后的产物。
规 律:
1)所有的卤代烃都能发生水解反应!
②
2)卤代烃水解可以形成一元醇、二元醇、多元醇等;
还可能生成醛、酮、羧酸等!
③ CH3CCl3
反应条件:强碱的水溶液,加热
CH3CH(OH)CH2OH
二元醇
CHO
CH3COOH
醛
羧酸
--与溴乙烷相似
(2)消去反应
+ NaOH
—C—C—
H
X
△
醇
C=C
+NaX +H2O
应用:制备烯烃或炔烃
推广:卤代烃的化学性质
要求卤代烃的结构特点:与卤原子相连C原子的相邻C上必须有H
二卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。
①CH3CHClCH2Cl
③CH3CHCl2
②CH3CHClCHClCH3
练:分析下列物质完全消去卤原子之后,可能的产物。
CH3CH≡CH
CH3C≡CCH3
CH2=CH-CH=CH2
CH≡CH
如何用实验验证C2H5Br分子中含有溴原子?
思考:
①C2H5Br
AgNO3溶液
无明显现象
×
溴乙烷是非电解质,不含有Br-
②C2H5Br
NaOH溶液
AgNO3溶液
×
暗褐色沉淀Ag2O
③C2H5Br
取上层清液
硝酸酸化
AgNO3溶液
NaOH溶液
√
浅黄色沉淀
HNO3中和过量的NaOH溶液
防止生成Ag2O暗褐色沉淀,影响X-检验。
AgNO3溶液
NaOH水溶液
△
过量HNO3溶液
酸化
R-X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
卤代烃中卤素原子的检验方法:
扩展:
不能利用消去反应检验卤素原子,
因为不是所有的卤代烃都能发生消去反应。
×
能否改为“NaOH醇溶液”?
AgF 无沉淀
①原理:通过水解反应将卤素原子转化为卤素离子
②操作过程:
取上层清液
该步骤必不可少
1.下列化合物在一定条件下,
既能发生水解反应,又能发生消去反应的有 。
① CH3Cl
② CH3CHBrCH3
③ (CH3)3CCl
CH2Br
但卤代烃中无相邻C或相邻C上无H的不能发生消去反应
CH2I
④
⑤
⑥
√
√
×
√
×
√
所有的卤代烃都能发生水解反应!
注意:
练一练
2、检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液 ②加入NaOH溶液 ③加入适量HNO3
④加热煮沸一段时间 ⑤冷却
A、②④⑤③① B、①②④
C、②④① D、②④⑤①
A
练一练
3、为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验:
(1)准确量取11.40 mL液体所用仪器是___________;
(2)加入过量硝酸的作用是___________;
(3)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是___;
酸式滴定管
中和NaOH
溴
3、为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验:
(4)已知此卤代烃的密度是1.65 g/mL,其蒸气对甲烷的相对密度是11.75,则此每个卤代烃分子中卤原子的数目为____;此卤代烃的结构简式为____________________.
2
CH2BrCH2Br或CH3CHBr2
11.40ml卤代烃质量为:
11.40ml× 1.65 g/mL=18.81 g
该卤代烃的摩尔质量为:
11.75×16g/mol=188 g/mol
即样品中含卤代烃0.1mol
实验测得生成AgBr为:
37.6g
M(AgBr)
=0.2mol
溴原子的数目为2
三、卤代烯烃、炔烃的化学性质
含有不饱和键(如 )的卤代烃也可以发生加成反应和加聚反应。
氯乙烯
聚氯乙烯
四氟乙烯
聚四氟乙烯
→ 聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
乙烯-四氟乙烯共聚物(ETFE)
卤代烃的功与过
溶剂
卤代烃
致冷剂
医用
灭火剂
麻醉剂
农药
氟氯烃——造成臭氧空洞的“罪魁祸首”
卤代烃的“功”:
1)作溶剂:CHCl3(氯仿);CCl4;CH2Cl2
2)农药: “六六六”, DDT
3)制冷剂:氟氯代烷(商品名氟利昂) CHClF2、CCl2F2(冰箱用)
4)灭火剂: CCl4灭火剂 (电器类起火)
5)麻醉剂: CHCl3、氯乙烷
6)塑料: 聚四氟乙烯 (塑料王)、聚氯乙烯(PVC)
人造血液
碳氟化合物
部分干洗剂
四氯乙烯
氟里昂
灭火剂
致冷剂
运动场上的
“化学大夫”
氯乙烷
聚四氟乙烯
[ C C ]n
F
F
F
F
不粘锅涂层
“塑料王”
聚氯乙烯
[ CH-CH2 ]n
Cl
生活中的保鲜膜
既可用于冰箱保鲜(-60℃),也可用于微波炉(+140℃)。
PVDC保鲜膜
聚偏二氯乙烯
PE保鲜膜
聚乙烯
PVC保鲜膜
聚氯乙烯
虽可用于食品包装,但在生产过程中需添加塑化剂。如在生产过程中添加了有毒塑化剂DEHA,则危害很大。
DDT
P.H.米勒
(瑞士化学家)
( P.H.M Muller)
1939年,米勒发现DDT具有优异的广谱杀虫作用,因此获得1948年诺贝尔奖。
DDT在某地区土壤中的残留
DDT是人类合成的第一种有机农药
→危害:氟氯烃——造成臭氧空洞的“罪魁祸首”
→卤代烃破坏臭氧层原理(了解):氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以CCl3F为例,它破坏臭氧层的反应过程可表示为
卤代烃的“过”:
→实际上氯原子起了催化作用。
P55
臭氧层的保护
作业多多
老是写错
找到帮手
身体不适
医院就医
明白事因
涂改液中含有二氯乙烷、三氯乙烷、四氯乙烷等有机氯化合物对眼睛有明显胡刺激作用,严重时会导恶心、呕吐、浑身不舒服等。
原来如此
课堂小结
第三章 烃的衍生物
烃的衍生物
CH3CH2Br
→从结构角度都可以看作是由烃衍生而来的,所以被称为烃的衍生物。
→烃分子中的氢原子被不同官能团取代后,就能生成一系列新的不同
类别的有机化合物,如卤代烃、醇、酚、醛、羧酸和酯等。
→烃的衍生物具有与烃不同的性质,
这些性质主要由其分子中的官能团决定。
第一节 卤代烃
一. 卤代烃
1.定义:
烃分子中的氢原子被卤素原子取代后的产物。
CH3Cl
CH2Cl2
CHCl3
CCl4
CH3—CH2Br
CH2—CH2
Br
Br
CH2=CHCl
Br
—CH2—CHCl—
n
2.官能团:
(X= F、Cl、Br、I)
我们之前学过的卤代烃:
碳卤键
X
C
下列物质中,不属于卤代烃的是( )
A、CH2Cl2 B、CCl2F2
C、 D、CH3COCl
-Br
卤代烃只能含有C、H、X(H不一定),不含其它原子。
D
练一练
3、卤代烃的分类
①按卤素原子
②按卤素原子数目
③按烃基
:单卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃
:氟代烃、氯代烃、溴代烃、碘代烃
脂肪卤代烃、芳香卤代烃
CF2=CF2
CH3Cl
CH2—CH2
Br
Br
CH3l
CH3—CH2Br
CH2=CHCl
Br
饱和一元卤代烃的通式:
CnH2n+1X
(n≥1)
CH2=CHCl
CH2Cl2
CF2=CF2
①遵循烷烃和烯烃的命名原则,
②在命名时,把卤素原子看成一种取代基
例题:命名下列物质
(2)CH CH2 C CH3
Cl
Cl
CH2
CH3
Cl
3-甲基-1,1,3-三氯戊烷
1
2
3
4
5
3
2
1
要点:将卤素原子视为取代基 ,
其他与烷烃、烯烃或炔烃类似.
CH2 —C= CH2
Br Br
2,3-二溴-1-丙烯
(1)
简到繁顺序是:按相对分子质量由小到大
4.卤代烃的命名
P52
CH—CH2—CH—CH2—CH3
Br
Br
CH3
3-甲基- 1,1-二溴戊烷
CH2—C—C≡CH
Cl
CH3
Cl
3-甲基- 3,4-二氯-1-丁炔
CH3—C—CH2—CH—CH3
Cl
CH2F
Cl
2-甲基- 1-氟-2,4-二氯戊烷
课堂练习
命名下列物质
1
2
3
4
5
1
2
3
4
1
2
3
4
5
5.同分异构体
(1)一氯代烷:
找等效氢
(2)二氯代烷:
定一移二
(3)芳香卤代烃:
找邻、间、对三个位置和取代基位置上的氢
如:CH3CH2CH2CH2CH3的一氯代物有多少种
如: CH3CH2CH2CH2CH3的二氯代物有多少种
如: 的一氯代物、二氯代物各有多少种
9种
4种
10种
3种
6.物理性质
常温下卤代烃除CH3Cl、CH3CH2Cl、CH2=CHCl等少数是气体外,
状 态:
溶解性:
卤代烃不溶于水,可溶于有机溶剂。
某些卤代烃本身是很好的有机溶剂。
降低
一氯甲烷、 氯乙烷、 氯乙烯
如CCl4、氯仿(CHCl3)等
P52
大多数为液体或固体。
递变性:
升高
均小于水的密度
气态
记住
②同分异构体的密度随分子中支链的增多而降低
①沸点随碳原子数目的增加而升高;
密度
沸点
②同分异构体中,支链越多沸点越低
①随烃基中碳原子数的增多而减小;
递变性:
卤代烃沸点、密度均高于相应的烃
6.物理性质
如,氯乙烷>乙烷
→脂肪一氟代烃(R-F)和一氯代烃(R-Cl)密度比水小;
溴代烃、碘代烃及多卤代烃:均大于水的密度
CCl4
CHCl3
C2H5Br
CH3I
其余卤代烃都比水大。
Br
如ρ(CH3Cl)>ρ(CH3CH2Cl)
如沸点CH3Cl<CH3CH2Cl。
讨论:氯乙烷的沸点比溴乙烷的沸点是高还是低?为什么?
→低。氯乙烷常温下是气体,溴乙烷常温下是液体。
烷烃分子中的氢原子被卤素原子取代后,其相对分子质量变大,分子间作用力变大,卤代烃溶沸点升高,密度变大。
卤代烃只有极少数是气体,大多数为固体或液体,不溶于水,可溶于大多数的有机溶剂。
小结:
人教版化学选修五2.3卤代烃(共61张PPT)
CH3Cl、CH3CH2Cl、CH2=CHCl等
理由:氯乙烷与溴乙烷的结构相似,而相对分子质量小于溴乙烷,分子间作用力小,故沸点低。
氯乙烷的应用
复方氯乙烷气雾剂
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用,可在身体局部产生快速镇痛效果。因此常用氯乙烷与其他药物制成“复方氯乙烷喷雾剂”,用于运动中的急性损伤,如肌肉拉伤,关节扭伤等的阵痛
资料卡片:
P53
卤代烃是一类特殊的烃。可分为单卤代烃和多卤代烃。( )
卤代烃中一定含有的元素为C、H和卤素。( )
卤代烃不一定是由烃分子和卤素单质发生取代反应得到的( )
分子中碳原子数少于4的烃,在常温下为气体,溴乙烷分子中含2个碳原子,所以其在常温下也是气体( )
卤代烃属于有机化合物,都易燃烧。( )
×
×
√
×
×
1、判断对错
课堂练习
课堂练习
2. 均不溶于水且比水轻的一组液体是( )
A.苯、 一氯丙烷 B.溴苯 、四氯化碳
C.溴乙烷 、氯乙烷 D.硝基苯 、一氯丙烷
3.下列有机物中沸点最高的是( )
A、乙烷 B、一氯甲烷
C、一氯乙烷 D、一氯丁烷
A
D
4、下列关于卤代烃的叙述中正确的是 ( )
A、所有卤代烃都是难溶于水,密度比水小的液体
B、所有卤代烃的沸点比相应烃的沸点低
C、CH3CH2Cl与CH3CH2CH2Cl的沸点前者低
D、CH3CH2Cl与CH3CH2CH2Cl的密度前者小
C
课堂练习
→只有脂肪一氟代烃(R-F)和一氯代烃(R-Cl)密度比水小。
高
卤代烃沸点随碳原子数目的增加而升高。
卤代烃密度随碳原子数的增多而减小。
大
√
二.溴乙烷
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
核磁共振氢谱图
1.分子组成与结构
(碳溴键)
(代表物)
球棍模型
空间填充模型
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3:2
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
2. C2H5Br物理性质
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
二.溴乙烷
(代表物)
C—Br 键具有较强的极性,易断裂。
对比:乙烷与溴乙烷结构有何不同?
3. C2H5Br化学性质
结构决定性质
因此溴乙烷的反应活性比乙烷增强。
导致化学性质有何不同 ?
二.溴乙烷
(代表物)
元素 H C Br
电负性 2.1 2.5 2.8
δ+
δ-
δ+
δ-
提出问题2:CH3CH3+水→不反应, CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
实验探索:
Br-
怎样证明有Br-产生?
资料卡片:C2H5Br与水的反应要在碱性环境下才容易进行
对CH3CH2Br化学性质的探索
实验装置
实验现象
实验解释
实验3-1
P53
实验装置
实验现象
实验解释
①中溶液分层。
溴乙烷与NaOH溶液共热,产生了Br-
实验3-1
C2H5Br+NaOH C2H5OH+NaBr,
NaBr+AgNO3===AgBr↓+NaNO3
④中有淡黄色沉淀生成。
②中有机层厚度减小。
(1)溴乙烷的取代反应
C2H5—Br + H--OH C2H5—OH + HBr
△
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
NaOH + HBr == NaBr + H2O
CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
总反应:
推广:所有卤代烃在碱性水溶液中都会发生水解反应
(也叫水解反应)
实质:
① CH3CH2—Br + H—OH
CH3CH2OH + HBr
NaOH△
② NaOH + HBr = NaBr + H2O
总:CH3CH2Br + NaOH
CH3CH2OH + NaBr
H2O
△
③AgNO3 + NaBr = AgBr↓ + NaNO3
(1)水解反应
--取代反应
推广:所有卤代烃在碱性水溶液中都会发生水解反应
3. C2H5Br化学性质
二.溴乙烷
(代表物)
1.NaOH的作用是什么?
2.采取什么措施可以加快水解反应的速率?
3.溴乙烷在什么条件下发生水解反应?
4.溴乙烷水解时在什么位置断键?
5.加入过量稀硝酸的目的是什么?
中和水解产物HBr,使平衡正向移动
NaOH水溶液,加热
C-Br键
①中和过量的NaOH溶液
②检验生成的沉淀是否溶于稀HNO3
加热
思考与交流:
6.若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
7.用何种波谱可以方便地检验产物中有乙醇生成?
②核磁共振氢谱
①红外光谱
思考与交流:
2个峰
3个峰
CH3CH2Br
CH3CH2OH
水
△
+ NaOH
水
△
+ NaOH
+ NaBr
+ 2 NaBr
2
1、写出下列卤代烃的水解方程式
练习
2.已知NH3和H2O在与卤代烃反应时的性质很相似,在一定条件下能使卤代烃发生氨解,写出溴乙烷的氨解方程式。
CH3CH2—Br + H—NH2
CH3CH2NH2 + HBr
△
→ 所有卤代烃在碱性水溶液中都会发生水解反应
(2)消去反应
条件:与NaOH的醇溶液共热
C2H5Br
NaOH+乙醇
作为溶剂
溴水
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
(2)消去反应
条件:与NaOH的醇溶液共热
C2H5Br
NaOH+乙醇
作为溶剂
现象:
溴水橙黄色逐渐褪去
溴水
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
CH2=CH2↑+ HBr
醇、NaOH
△
NaOH + HBr = NaBr + H2O
CH2—CH2
|
|
H Br
CH2=CH2↑+ NaBr + H2O
+ NaOH
CH2—CH2
|
|
H Br
醇
△
消去反应
消去反应:有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HX等),而生成不饱和(含双键或三键)化合物的反应。P54
总:
(2)消去反应
3. C2H5Br化学性质
二.溴乙烷
(消除反应)
实质:相邻的两个C上脱去HX形成不饱和键!
[回顾] 我们还学过哪个消去反应?
CH2=CH2↑ + H2O
浓H2SO4
170℃
CH2—CH2
|
|
H OH
【归纳总结】C2H5Br的消去反应:
强碱的醇溶液、加热
将产生的气体通入溴水或溴/CCl4中,溶液褪色。
1.反应条件:
问题:
生成的乙烯气体能否用酸性KMnO4溶液检验?
除去乙醇,排除干扰。
因为乙醇也能使KMnO4(H+aq)褪色,水能除去挥发出来的乙醇,
产生的气体乙烯(含 等杂质气体)
分析:
乙醇、溴乙烷、水蒸气
没必要事先水洗
能。但必须将气体先通入盛水的试管,再通入酸性KMnO4溶液中。
为什么?
2.产物检验:
水解反应(取代反应) 消去反应
反应物
反应条件
断键
生成物
结论 CH3CH2Br
CH3CH2Br
C-Br
C-Br,邻碳C-H
CH3CH2OH、 NaBr
CH2=CH2 、NaBr、H2O
C2H5Br和NaOH在不同条件下发生不同类型的反应
小 结
比较溴乙烷的取代反应和消去反应,并完成下表。
水
NaOH水溶液,加热
NaOH醇溶液,加热
口诀:“有醇则无醇,无醇则有醇”
消去反应
水解反应
运用第一章所学的波谱方法检验取代产物1-丁醇
P54
生成醇
生成烯烃
P54
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+ 水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
2-丁烯
CH3-CH2-CH-CH3
Br
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
练、下列卤代烃能否发生消去反应?
A、CH3Cl
B、CH3-CH-CH3
Br
C、CH3-C-CH2-I
CH3
CH3
F 、
Cl
√
√
√
–Cl
D 、
×
×
×
CH2=CH-CH3
若能,请写出有机产物的结构简式:
(主产物)
CH2Cl
= CH2
无H
无相邻C
关键:抓住断键方式
苯环上为独特的碳碳键
E、CH3-CH2-C-CH3
Cl
CH3
CH3-CH2-C=CH2
CH3
CH3-CH=C-CH3
CH3
H X
-C-C- -C=C-
归纳总结:卤代烃的消去反应
反应条件:
与强碱的醇溶液共热
结构要求:
与卤原子相连C原子的相邻C上必须有H
无相邻C或相邻C上无H的不能发生消去反应
CH3X
–X
CH3-C-CH2X
CH3
CH3
–CH2X
CH3-C-X
CH3
CH3
CH2= C
CH3
CH3
关键:抓住断键方式
强碱的醇溶液
+ HX
练习
1.下列物质与NaOH醇溶液共热可制得烯烃的是:
A.C6H5CH2Cl B.(CH3)3CBr C.CH3CHBrCH3 D.CH3Cl
2.写出由CH2BrCH2Br与NaOH醇溶液共热的反应化学方程式
C
B
CH2BrCH2Br CH2=CH2 +Br2
NaOH、醇
△
↑
CH2—CH2
|
|
Br Br
+NaOH
醇
△
CH=CH2
Br
+ NaBr + H2O
CH=CH2
Br
+NaOH
醇
△
CH ≡ CH↑
+ NaBr + H2O
×
注意:不能同时消去2个卤素原子!!!
二卤代烃发生消去反应后可能在有机化合物中引入碳碳三键或两个碳碳双键。
推广:卤代烃的化学性质
(1)取代反应(水解反应)
R-X + NaOH R-OH + NaX
H2O
△
CHCl2
①CH3CHClCH2Cl
练:分析下列物质发生水解反应之后的产物。
规 律:
1)所有的卤代烃都能发生水解反应!
②
2)卤代烃水解可以形成一元醇、二元醇、多元醇等;
还可能生成醛、酮、羧酸等!
③ CH3CCl3
反应条件:强碱的水溶液,加热
CH3CH(OH)CH2OH
二元醇
CHO
CH3COOH
醛
羧酸
--与溴乙烷相似
(2)消去反应
+ NaOH
—C—C—
H
X
△
醇
C=C
+NaX +H2O
应用:制备烯烃或炔烃
推广:卤代烃的化学性质
要求卤代烃的结构特点:与卤原子相连C原子的相邻C上必须有H
二卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。
①CH3CHClCH2Cl
③CH3CHCl2
②CH3CHClCHClCH3
练:分析下列物质完全消去卤原子之后,可能的产物。
CH3CH≡CH
CH3C≡CCH3
CH2=CH-CH=CH2
CH≡CH
如何用实验验证C2H5Br分子中含有溴原子?
思考:
①C2H5Br
AgNO3溶液
无明显现象
×
溴乙烷是非电解质,不含有Br-
②C2H5Br
NaOH溶液
AgNO3溶液
×
暗褐色沉淀Ag2O
③C2H5Br
取上层清液
硝酸酸化
AgNO3溶液
NaOH溶液
√
浅黄色沉淀
HNO3中和过量的NaOH溶液
防止生成Ag2O暗褐色沉淀,影响X-检验。
AgNO3溶液
NaOH水溶液
△
过量HNO3溶液
酸化
R-X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
卤代烃中卤素原子的检验方法:
扩展:
不能利用消去反应检验卤素原子,
因为不是所有的卤代烃都能发生消去反应。
×
能否改为“NaOH醇溶液”?
AgF 无沉淀
①原理:通过水解反应将卤素原子转化为卤素离子
②操作过程:
取上层清液
该步骤必不可少
1.下列化合物在一定条件下,
既能发生水解反应,又能发生消去反应的有 。
① CH3Cl
② CH3CHBrCH3
③ (CH3)3CCl
CH2Br
但卤代烃中无相邻C或相邻C上无H的不能发生消去反应
CH2I
④
⑤
⑥
√
√
×
√
×
√
所有的卤代烃都能发生水解反应!
注意:
练一练
2、检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液 ②加入NaOH溶液 ③加入适量HNO3
④加热煮沸一段时间 ⑤冷却
A、②④⑤③① B、①②④
C、②④① D、②④⑤①
A
练一练
3、为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验:
(1)准确量取11.40 mL液体所用仪器是___________;
(2)加入过量硝酸的作用是___________;
(3)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是___;
酸式滴定管
中和NaOH
溴
3、为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验:
(4)已知此卤代烃的密度是1.65 g/mL,其蒸气对甲烷的相对密度是11.75,则此每个卤代烃分子中卤原子的数目为____;此卤代烃的结构简式为____________________.
2
CH2BrCH2Br或CH3CHBr2
11.40ml卤代烃质量为:
11.40ml× 1.65 g/mL=18.81 g
该卤代烃的摩尔质量为:
11.75×16g/mol=188 g/mol
即样品中含卤代烃0.1mol
实验测得生成AgBr为:
37.6g
M(AgBr)
=0.2mol
溴原子的数目为2
三、卤代烯烃、炔烃的化学性质
含有不饱和键(如 )的卤代烃也可以发生加成反应和加聚反应。
氯乙烯
聚氯乙烯
四氟乙烯
聚四氟乙烯
→ 聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
乙烯-四氟乙烯共聚物(ETFE)
卤代烃的功与过
溶剂
卤代烃
致冷剂
医用
灭火剂
麻醉剂
农药
氟氯烃——造成臭氧空洞的“罪魁祸首”
卤代烃的“功”:
1)作溶剂:CHCl3(氯仿);CCl4;CH2Cl2
2)农药: “六六六”, DDT
3)制冷剂:氟氯代烷(商品名氟利昂) CHClF2、CCl2F2(冰箱用)
4)灭火剂: CCl4灭火剂 (电器类起火)
5)麻醉剂: CHCl3、氯乙烷
6)塑料: 聚四氟乙烯 (塑料王)、聚氯乙烯(PVC)
人造血液
碳氟化合物
部分干洗剂
四氯乙烯
氟里昂
灭火剂
致冷剂
运动场上的
“化学大夫”
氯乙烷
聚四氟乙烯
[ C C ]n
F
F
F
F
不粘锅涂层
“塑料王”
聚氯乙烯
[ CH-CH2 ]n
Cl
生活中的保鲜膜
既可用于冰箱保鲜(-60℃),也可用于微波炉(+140℃)。
PVDC保鲜膜
聚偏二氯乙烯
PE保鲜膜
聚乙烯
PVC保鲜膜
聚氯乙烯
虽可用于食品包装,但在生产过程中需添加塑化剂。如在生产过程中添加了有毒塑化剂DEHA,则危害很大。
DDT
P.H.米勒
(瑞士化学家)
( P.H.M Muller)
1939年,米勒发现DDT具有优异的广谱杀虫作用,因此获得1948年诺贝尔奖。
DDT在某地区土壤中的残留
DDT是人类合成的第一种有机农药
→危害:氟氯烃——造成臭氧空洞的“罪魁祸首”
→卤代烃破坏臭氧层原理(了解):氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以CCl3F为例,它破坏臭氧层的反应过程可表示为
卤代烃的“过”:
→实际上氯原子起了催化作用。
P55
臭氧层的保护
作业多多
老是写错
找到帮手
身体不适
医院就医
明白事因
涂改液中含有二氯乙烷、三氯乙烷、四氯乙烷等有机氯化合物对眼睛有明显胡刺激作用,严重时会导恶心、呕吐、浑身不舒服等。
原来如此
课堂小结
