2022-2023学年江苏省盐城市、扬州市联考高二(下)期中化学试卷(含解析)
文档属性
| 名称 | 2022-2023学年江苏省盐城市、扬州市联考高二(下)期中化学试卷(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 214.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:47:26 | ||
图片预览




文档简介
2022-2023学年江苏省盐城市、扬州市联考高二(下)期中化学试卷
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用签字笔或钢笔将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 如图为某晶体的一个晶胞。该晶体由、、三种基本粒子组成。试根据图示判断,该晶体的化学式是( )
A. B. C. D.
2. 下列表示物质结构的化学用语正确的是( )
A. ,,表示同一种核素 B. 个中子的碳原子的核素符号:
C. 的结构示意图: D. 的电子式:
3. 设为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况条件下,中含有极性键数目为
B. 中含键数目为
C. 白磷分子正四面体构型中含有的键数目为
D. 水蒸气中含有氢键数目为
4. 现有三种元素的基态原子的电子排布式如下:;;。则下列有关比较中正确的是( )
A. 第一电离能: B. 原子半径:
C. 电负性: D. 最高正化合价:
5. 下列说法不正确的是
A. 乙烯分子中的键和键之比为
B. 某元素气态基态原子的逐级电离能分别为、、、、、、,当它与氯气反应时可能生成的阳离子是
C. 、、的电负性依次增大
D. 向配合物溶液中加入足量的溶液,所有均被完全沉淀
6. 甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
A. 甲烷晶胞中的球只代表个原子
B. 晶体中个分子周围有个紧邻的分子
C. 甲烷晶体熔化时需克服共价键
D. 个晶胞中含有个分子
7. 下列有关性质比较不正确的是( )
A. 晶体熔点的高低:
B. 硬度由大到小:金刚石碳化硅晶体硅
C. 熔点由高到低:
D. 晶格能由大到小:
8. 下列四种元素中,其单质氧化性最强的是( )
A. 基态原子含有未成对电子数最多的第二周期元素
B. 位于周期表中第三周期第Ⅲ族的元素
C. 基态原子的层电子排满的元素
D. 基态原子的最外电子层排布为的元素
9. 短周期主族元素、、、的原子序数依次增大。的原子半径最小,是空气中含量最多的元素,基态时原子能级和能级的电子总数相等,原子核外无未成对电子。下列说法正确的是( )
A. 半径大小:
B. 电离能大小:
C. 电负性大小:
D. 由、、三种元素组成的化合物一定是碱
10. 下列描述中正确的是( )
A. 为形的极性分子 B. 的空间构型为平面三角形
C. 分子的空间构型为平面三角形 D. 分子的空间构型为平面正方形
11. 、、、均为短周期主族元素,原子序数依次增大。原子的次外层电子数为、最外层电子数为;原子的层电子数为、层电子数为;和原子的最外层电子数分别为和。有关说法正确的是( )
A. 气态氢化物的稳定性:
B. 、元素不可能形成或共价化合物
C. 在一定条件下,与反应生成
D. 与形成的化合物常温下不能与盐酸反应
12. 下列物质,都能与反应放出 ,其产生的速率排列顺序正确的是 ( )
溶液
A. B. C. D.
13. 如图是某无机化合物的二聚分子,该分子中、两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到个电子的稳定结构。下列说法不正确的是( )
A. 该化合物的化学式是
B. 该化合物在固态时所形成的晶体是分子晶体
C. 该化合物是离子化合物,在熔融状态下能导电
D. 该化合物中存在共价键,且不含有非极性共价键
第II卷(非选择题)
二、非选择题:本题共4小题,共61分。
14. (16分)氮化铬常用于薄膜涂层,是一种良好的耐磨材料,同时在超级电容器领域有良好的应用前景。工业上以铬铁矿为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
基态铬原子的价层电子轨道表示式为 ______ 。
是短周期金属元素,的部分电离能数据如表所示:
电离能
则是 ______ 填元素符号。
制备时,发生的主要反应为。
溶于水得到配合物一一氯化二氯四水合铬Ⅲ,其中提供电子对形成配位键的原子是 ______ ,中心离子配位数为 ______ 。
的熔点比的熔点低得多,这是由于 ______ 。
氨解制备氮化铬:先将装入石英舟,再将石英舟放入反应炉中,通入氨气,在高温下保温小时,即得到结晶性能良好的纯立方相粉末。氮化铬的熔点为,它的一种晶体的立方晶胞结构如图所示,则该晶胞中含有的数目为 ______ ,晶胞中的配位数是 ______ 。
15. (13分)在介质中,简记为催化氧化的过程如下:
基态核外电子排布式为__________________________________________。
分子中氮原子轨道的杂化类型是______________________________,分子中含有键的数目为___________。
、、三种元素的电负性由小到大的顺序为________________________。
的空间构型为_________。
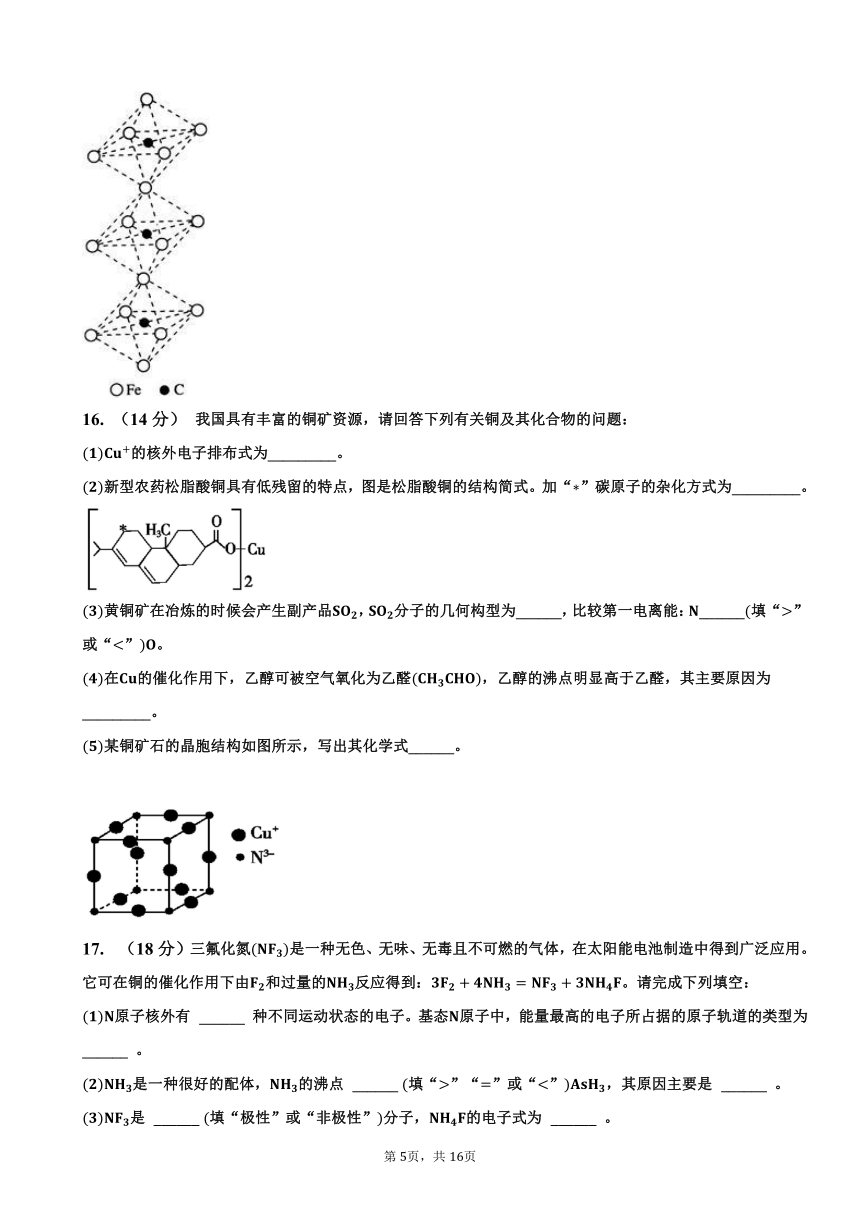
一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。
16. (14分) 我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
的核外电子排布式为_________。
新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“”碳原子的杂化方式为_________。
黄铜矿在冶炼的时候会产生副产品,分子的几何构型为______,比较第一电离能:______填“”或“”。
在的催化作用下,乙醇可被空气氧化为乙醛,乙醇的沸点明显高于乙醛,其主要原因为_________。
某铜矿石的晶胞结构如图所示,写出其化学式______。
17. (18分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由和过量的反应得到:。请完成下列填空:
原子核外有 ______ 种不同运动状态的电子。基态原子中,能量最高的电子所占据的原子轨道的类型为 ______ 。
是一种很好的配体,的沸点 ______ 填“”“”或“”,其原因主要是 ______ 。
是 ______ 填“极性”或“非极性”分子,的电子式为 ______ 。
分子中原子杂化方式为 ______ ,的键角比的键角小,其原因是 ______ 。
往硫酸铜溶液中加入过量氨水,可生成。请写出该反应的离子方程式: ______ ,不考虑空间构型,的结构可用示意图表示为 __ ____ 。
答案和解析
1.【答案】
【解析】
【分析】
本题主要考查了均摊法计算晶体的化学式,难度较小,注重对基本方法的考查。
【解答】
根据晶胞图可知,原子分布在立方体的六个面心上,所以晶胞中含有原子的数目为,原子分布在立方体的八个顶点上,所以晶胞含有原子数目为,原子位于立方体的体心,数目为,所以在晶胞中三种原子的个数比为::,所以晶体的化学式为:,
故答案选C。
2.【答案】
【解析】
【分析】
本题考查常用化学用语的书写,难度不大,注意离子结构示意图和原子结构示意图的区别。
【解答】
A.,,质子数相同、中子数不同,表示不同的核素,故A错误;
B.个中子的碳原子质量数为,表示为,故B正确;
C.氯离子核内有个质子,核外含有个电子,结构示意图为,故C错误;
D.氯化铵属于离子化合物,电子式为,故D错误。
故选B。
3.【答案】
【解析】解:标况条件下,中含有极性键数目为,故A错误;
B.个中水分子内存在个键,铜离子与水分子存在个配位键,所以中含键数目为,故B正确;
C.白磷分子的物质的量为,存在的共价键数目,故C错误;
D.水蒸气分子之间距离较大,不存在氢键,故D错误;
故选:。
A.个含有条极性共价键;
B.中水分子内存在个键,铜离子与水分子存在个配位键,配位键也是键;
C.每个白磷分子含有个原子,每个白磷分子中键数目为;
D.水蒸气分子间不存在氢键。
本题考查阿伏加德罗常数的应用及相关计算,明确气体摩尔体积使用对象,白磷分子的结构,氢键形成条件是解题关键,题目难度中等。
4.【答案】
【解析】解:由核外电子排布式可知,为元素, 为元素,为元素,
A.同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能,即,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径,即:,故B正确;
C.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性,即,故C错误;
D.、元素无最高正化合价,元素最高正化合价为,故最高正化合价:错误,故D错误;
故选:。
由核外电子排布式可知,为元素, 为元素,为元素,
A.同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下第一电离能减小;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.同周期自左而右电负性增大,同主族自上而下电负性减小;
D.最高正化合价等于最外层电子数,注意、元素一般没有正化合价。
本题考查原子结构与元素周期律,为高频考点,把握电子排布规律推断元素、元素周期律为解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
5.【答案】
【解析】解:、乙烯含个键、个键,单键均为键,碳碳双键中含个键、个键,则键和键个数比为:,故A正确;
B、根据逐级电离能数据,该元素的第三电离能剧增,说明最外层有个电子,为第Ⅱ族元素,与氯气反应时易失去最外层个电子,形成离子,故B正确;
C、同周期从左往右元素电负性逐渐增大,故、、 的电负性依次增大,故C正确;
D、加入足量溶液,外界与反应,内界不与反应,故D错误;
故选:。
A、乙烯含个键、个键,单键均为键,双键中含个键、个键;
B、根据逐级电离能判断,该原子最外层有个电子,易形成二价阳离子;
C、同周期从左往右元素电负性逐渐增大;
D、配合物內界不能电离,外界可以电离。
本题考查了结构与性质,涉及化学键、电负性、电离能、配合物的结构,题目综合,难度中等,理解定义并能够灵活运用是解题的关键。
6.【答案】
【解析】解:甲烷晶体的构成微粒是甲烷分子,所以甲烷晶胞中的球表示甲烷分子,故A错误;
B.晶体中个分子周围紧邻的分子个数,故B正确;
C.甲烷晶体为分子晶体,所以甲烷晶体熔化时需要克服分子间作用力,故C错误;
D.个晶胞中分子个数,故D错误;
故选:。
A.甲烷晶胞中的球表示甲烷分子;
B.晶体中个分子周围紧邻的分子个数;
C.甲烷晶体为分子晶体;
D.个晶胞中分子个数。
本题考查晶胞计算,侧重考查空间想象能力及计算能力,明确晶体构成微粒、均摊法在晶胞计算中的灵活运用是解本题关键,知道分子晶体和原子晶体区别,题目难度不大。
7.【答案】
【解析】解:因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低:,故A正确;
B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长,所以硬度:金刚石碳化硅晶体硅,故B正确;
C、、、原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:,故C错误;
D、晶格能与离子半径成反比,与电荷成正比,离子半径,,则晶格能,故D正确;
故选:。
A.根据分子间氢键增大熔点,分子内氢键降低熔点判断;
B、都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;
C、金属单质熔沸点与其金属键成正比,金属键与半径成反比,与电荷成正比;
D、离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强。
本题考查晶体熔沸点高低判断,侧重考查晶体类型判断及晶体熔沸点高低影响因素,注意晶格能、金属键与离子半径、离子所带电荷关系,题目难度不大。
8.【答案】
【解析】解:第二周期元素含有未成对电子数最多的元素的电子排布式为,为元素;
B.位于周期表中第三周期第Ⅲ族的元素为元素;
C.第三周期及以后的元素基态原子的层电子均排满,故无法确定该元素的种类,但无论是哪种,元素的非金属性均弱于;
D.基态原子的最外电子层排布为的元素为元素;
四种元素中非金属性最强的元素为,则单质的氧化性最强的元素为,
故选:。
元素的非金属性越强,则单质的氧化性越强,同周期主族元素从左到右,元素的非金属性逐渐增强,同主族元素从上到下,元素的非金属性逐渐减弱,据此分析。
本题考查了元素核外电子排布的规律,难度不大,应注意元素周期律的应用。
9.【答案】
【解析】解:由分析可知,为元素、为元素、为元素、为元素;
A.同周期主族元素自左而右原子半径减小,同主族自上而下原子半径减小,所有元素中氢原子半径最小,故原子半径:,故A正确;
B.氮的轨道处于半满稳定状态,导致其第一电离能比同周期相邻元素的大,故B错误;
C.为元素,属于非金属元素,而为元素,是金属元素,故H元素电负性比大,故C错误;
D.、、三种元素还可以组成盐、酸,如、,故D错误;
故选:。
短周期主族元素、、、的原子序数依次增大,是空气中含量最多的元素,则为元素;而的原子半径最小,其原子序数又小于氮,故为元素;原子核外无未成对电子,其原子序数大于氮,故为元素;原子核外能级与能级的电子总数相等,其原子序数大于氮且小于镁,则其原子核外电子排布式为,故为元素。
本题考查原子结构与元素周期律,推断元素是解题的关键,熟练知识元素周期律与元素化合物知识,注意同周期主族元素第一电离能变化异常情况。
10.【答案】
【解析】
【分析】
本题考查了杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力。
【解答】
A.依据价层电子对互斥理论可知,中原子的价层电子对数,为杂化,为直线形,由于结构对称属于非极性分子,故A错误;
B.由价层电子对互斥理论可知中原子的价层电子对数,为杂化,由于含有对孤电子对,所以是三角锥形,故B错误;
C.中原子的价层电子对数,为杂化,分子构型为平面三角形,故C正确;
D.价层电子对数,立体结构为正四面体,故D错误。
11.【答案】
【解析】
【分析】
本题考查结构位置关系、核外电子排布规律、元素周期律,题目难度一般,根据电子排布规律推断元素是关键。
【解答】
短周期元素和元素,元素的次外层电子数为,最外层电子数为,原子的层电子数为,层电子数为,则层电子数为,所以,所以元素原子有个电子层,故,所以,故为元素;所以元素原子的层电子数为,故为元素;的最外层电子数为,即最外层电子数为,则是元素;原子的最外层电子数为,即最外层电子数为,则为元素。
A. 非金属性越强对应气态氢化物的稳定性越强,非金属性:,气态氢化物稳定性:,故A错误;
B.的化合价有多种,、元素可能形成或共价化合物,故B错误;
C. 在一定条件下,与反应生成,而不能生成,故C错误;
D.与形成的化合物为,常温下不能与盐酸反应,故D正确。
故选:。
12.【答案】
【解析】
【分析】
本题考查钠与含羟基的乙醇、水和碳酸溶液反应产生氢气的快慢,把握钠与的反应及羟基的活泼性为解答的关键,注意酸性越强,反应速率越快,题目难度不大。
【解答】
乙醇中的羟基氢能和钠反应生成氢气,碳酸中的氢离子能和金属钠反应生成氢气,水电离出的氢离子可以和金属钠反应产生氢气,三者的氢的活泼性顺序是,所以产生速率顺序是。
故选D。
13.【答案】
【解析】解:、将二聚分子变成单分子,得化学式,根据两种元素都处于第三周期,可能是或,而在所有原子已达稳定结构,形成二聚分子的话不可能符合,故只可能是,该化合物的化学式是,故A正确;
B、该化合物是无机化合物的二聚分子,属于共价化合物,是分子晶体,故B正确;
C、该化合物是无机化合物的二聚分子,属于共价化合物,不存在离子键,也不是离子化合物,在熔融状态下不能导电,故C错误;
D、该化合物是无机化合物的二聚分子,属于共价化合物,与之间没有形成非极性共价键,故D正确;
故选C。
本题考查化学键,判断化合物的化学式是解答的关键,难度不大,但应注意特例,如氯化铝为共价化合物。
14.【答案】 、 固态时,为分子晶体,为离子晶体,离子键比范德华力强得多
【解析】解:基态铬原子的价电子排布式为,轨道表示式为,
故答案为:;
根据表中数据可知,失去第、、个电子的电离能较小且相差较小,失去第个电子时,电离能突跃式变大,说明的最外层有个电子,则为,
故答案为:;
中,水中的原子和原子均含有孤电子对,因此提供电子对形成配位键的原子是、;中心离子配位数为,
故答案为:、;;
固态时,为分子晶体,为离子晶体,离子键比范德华力强得多,因此的熔点比的熔点低得多,
故答案为:固态时,为分子晶体,为离子晶体,离子键比范德华力强得多;
该晶胞中原子数目为,原子数目为,含有的数目为,则以位于中心的原子为研究对象,原子周围距离最近的原子有个,晶胞中的配位数为,
故答案为:;。
基态铬原子的价电子排布式为,据此书写;
根据表中数据可知,失去第、、个电子的电离能较小且相差较小,失去第个电子时,电离能突跃式变大,说明的最外层有个电子;
含有孤电子对的原子能提供电子对形成配位键;
固态时,为分子晶体,为离子晶体,分子间作用力不同;
该晶胞中原子数目为,原子数目为,则以位于中心的原子为研究对象,原子周围距离最近的原子有个。
本题考查物质的制备和晶胞计算,侧重考查学生分析计算能力、理解能力、知识迁移运用能力,需要学生具备扎实的基础,理解熟记中学常见晶胞结构特点,掌握均摊法进行晶胞有关计算。
15.【答案】
;或
正四面体形
【解析】
【分析】本题考查物质结构方面的知识,比较综合,涉及核外电子排布式的书写、电负性等,难度一般,解题的关键是对相关知识的灵活运用。
【解答】为号元素,原子的基态电子排布式为,则基态核外电子排布式为。
氮原子形成三个单键,为杂化;分子中有键、键、键,共 键,所以分子中含有键的数目为。
非金属性越强,电负性越大,所以、、三种元素的电负性由小到大的顺序为。
中为杂化,所以为正四面体结构。
每个八面体的顶点被两个八面体共有,所以每个八面体中,原子个数为,化合物的化学式为。
16.【答案】或
形
乙醇分子间存在氢键
【解析】
【分析】
本题考查晶胞计算、微粒空间构型判断、原子杂化方式判断、原子核外电子排布等知识点,侧重考查分析、计算、空间想象能力,明确均摊法、价层电子对互斥理论、构造原理等知识点即可解答,难点是晶胞计算方法,题目难度中等。
【解答】
核外电子排布式要遵循构造原理,当原子轨道电子排布为全满、半满或全空时,能量最低。故C的基态原子的核外电子排布为,当原子失去电子形成阳离子时,失电子的顺序则从最外层开始,故C核外电子排布式为,也可简化为,
故答案为:或;
加“”碳原子形成个键,原子杂化类型为杂化;
故答案为:;
分子中硫原子的价层电子对数为,含有一个孤电子对,故其空间结构为形;元素原子能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素,故第一电离能;
故答案为:形,;
乙醇分子间可形成氢键,增加了分子之间的作用,乙醛不能形成氢键,所以乙醇的沸点高于乙醛;
故答案为:乙醇分子间存在氢键;
依据晶胞结构图可知:个数,个数,化学式为:;
故答案为:。
17.【答案】 哑铃型 分子间可以形成氢键 极性 氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小
【解析】解:基态原子的电子排布式为,核外每个电子的运动状态均不相同,所以共有种不同运动状态的电子;能量最高的电子所占据的原子轨道为轨道,为哑铃型,
故答案为:;哑铃型;
分子间可以形成氢键,使其沸点升高,故的沸点高于,与均为三角锥形,整个分子正负电荷重心不重合,是极性分子,
故答案为:;分子间可以形成氢键;
分子中正负电荷中心不能重合为极性分子;氟化铵是和构成的离子化合物,电子式:,
故答案为:;
分子中中心原子形成个键、有个孤对电子,则为杂化;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小,
故答案为:;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小;
硫酸铜溶液与氨水反应可生成氢氧化铜沉淀和硫酸铵,氢氧化铜沉淀能溶于过量的氨水;则该反应为
,其离子反应为: ;中铜离子提供空轨道、原子提供孤电子对而形成配位键,中含有个配位键,的结构可用示意图表示为,
故答案为: ;。
核外每个电子的运动状态均不相同;基态原子的电子排布式为;基态原子中,能量最高的电子所占据的原子轨道为轨道;
氢键可以使物质的沸点升高,若整个分子正负电荷重心重合,则为非极性分子,反之为极性分子;
正负电荷中心不能重合的分子为极性分子;为离子化合物,铵根离子与氟离子通过离子键结合;
分子中中心原子形成个键、有个孤对电子;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小;
硫酸铜溶液与氨水反应可生成氢氧化铜沉淀和硫酸铵,氢氧化铜沉淀能溶于过量的氨水;中铜离子提供空轨道、原子提供孤电子对而形成配位键,中含有个配位键。
本题考查微粒空间构型判断、原子杂化类型判断、电子式、离子方程式等知识点,侧重考查基础知识的理解和灵活应用能力,明确价层电子对互斥理论内涵及价层电子对个数计算方法是解本题关键,题目难度中等。
第16页,共16页
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,用签字笔或钢笔将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题:本题共13小题,每小题3分,共39分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 如图为某晶体的一个晶胞。该晶体由、、三种基本粒子组成。试根据图示判断,该晶体的化学式是( )
A. B. C. D.
2. 下列表示物质结构的化学用语正确的是( )
A. ,,表示同一种核素 B. 个中子的碳原子的核素符号:
C. 的结构示意图: D. 的电子式:
3. 设为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况条件下,中含有极性键数目为
B. 中含键数目为
C. 白磷分子正四面体构型中含有的键数目为
D. 水蒸气中含有氢键数目为
4. 现有三种元素的基态原子的电子排布式如下:;;。则下列有关比较中正确的是( )
A. 第一电离能: B. 原子半径:
C. 电负性: D. 最高正化合价:
5. 下列说法不正确的是
A. 乙烯分子中的键和键之比为
B. 某元素气态基态原子的逐级电离能分别为、、、、、、,当它与氯气反应时可能生成的阳离子是
C. 、、的电负性依次增大
D. 向配合物溶液中加入足量的溶液,所有均被完全沉淀
6. 甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
A. 甲烷晶胞中的球只代表个原子
B. 晶体中个分子周围有个紧邻的分子
C. 甲烷晶体熔化时需克服共价键
D. 个晶胞中含有个分子
7. 下列有关性质比较不正确的是( )
A. 晶体熔点的高低:
B. 硬度由大到小:金刚石碳化硅晶体硅
C. 熔点由高到低:
D. 晶格能由大到小:
8. 下列四种元素中,其单质氧化性最强的是( )
A. 基态原子含有未成对电子数最多的第二周期元素
B. 位于周期表中第三周期第Ⅲ族的元素
C. 基态原子的层电子排满的元素
D. 基态原子的最外电子层排布为的元素
9. 短周期主族元素、、、的原子序数依次增大。的原子半径最小,是空气中含量最多的元素,基态时原子能级和能级的电子总数相等,原子核外无未成对电子。下列说法正确的是( )
A. 半径大小:
B. 电离能大小:
C. 电负性大小:
D. 由、、三种元素组成的化合物一定是碱
10. 下列描述中正确的是( )
A. 为形的极性分子 B. 的空间构型为平面三角形
C. 分子的空间构型为平面三角形 D. 分子的空间构型为平面正方形
11. 、、、均为短周期主族元素,原子序数依次增大。原子的次外层电子数为、最外层电子数为;原子的层电子数为、层电子数为;和原子的最外层电子数分别为和。有关说法正确的是( )
A. 气态氢化物的稳定性:
B. 、元素不可能形成或共价化合物
C. 在一定条件下,与反应生成
D. 与形成的化合物常温下不能与盐酸反应
12. 下列物质,都能与反应放出 ,其产生的速率排列顺序正确的是 ( )
溶液
A. B. C. D.
13. 如图是某无机化合物的二聚分子,该分子中、两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到个电子的稳定结构。下列说法不正确的是( )
A. 该化合物的化学式是
B. 该化合物在固态时所形成的晶体是分子晶体
C. 该化合物是离子化合物,在熔融状态下能导电
D. 该化合物中存在共价键,且不含有非极性共价键
第II卷(非选择题)
二、非选择题:本题共4小题,共61分。
14. (16分)氮化铬常用于薄膜涂层,是一种良好的耐磨材料,同时在超级电容器领域有良好的应用前景。工业上以铬铁矿为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
基态铬原子的价层电子轨道表示式为 ______ 。
是短周期金属元素,的部分电离能数据如表所示:
电离能
则是 ______ 填元素符号。
制备时,发生的主要反应为。
溶于水得到配合物一一氯化二氯四水合铬Ⅲ,其中提供电子对形成配位键的原子是 ______ ,中心离子配位数为 ______ 。
的熔点比的熔点低得多,这是由于 ______ 。
氨解制备氮化铬:先将装入石英舟,再将石英舟放入反应炉中,通入氨气,在高温下保温小时,即得到结晶性能良好的纯立方相粉末。氮化铬的熔点为,它的一种晶体的立方晶胞结构如图所示,则该晶胞中含有的数目为 ______ ,晶胞中的配位数是 ______ 。
15. (13分)在介质中,简记为催化氧化的过程如下:
基态核外电子排布式为__________________________________________。
分子中氮原子轨道的杂化类型是______________________________,分子中含有键的数目为___________。
、、三种元素的电负性由小到大的顺序为________________________。
的空间构型为_________。
一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。
16. (14分) 我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
的核外电子排布式为_________。
新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。加“”碳原子的杂化方式为_________。
黄铜矿在冶炼的时候会产生副产品,分子的几何构型为______,比较第一电离能:______填“”或“”。
在的催化作用下,乙醇可被空气氧化为乙醛,乙醇的沸点明显高于乙醛,其主要原因为_________。
某铜矿石的晶胞结构如图所示,写出其化学式______。
17. (18分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由和过量的反应得到:。请完成下列填空:
原子核外有 ______ 种不同运动状态的电子。基态原子中,能量最高的电子所占据的原子轨道的类型为 ______ 。
是一种很好的配体,的沸点 ______ 填“”“”或“”,其原因主要是 ______ 。
是 ______ 填“极性”或“非极性”分子,的电子式为 ______ 。
分子中原子杂化方式为 ______ ,的键角比的键角小,其原因是 ______ 。
往硫酸铜溶液中加入过量氨水,可生成。请写出该反应的离子方程式: ______ ,不考虑空间构型,的结构可用示意图表示为 __ ____ 。
答案和解析
1.【答案】
【解析】
【分析】
本题主要考查了均摊法计算晶体的化学式,难度较小,注重对基本方法的考查。
【解答】
根据晶胞图可知,原子分布在立方体的六个面心上,所以晶胞中含有原子的数目为,原子分布在立方体的八个顶点上,所以晶胞含有原子数目为,原子位于立方体的体心,数目为,所以在晶胞中三种原子的个数比为::,所以晶体的化学式为:,
故答案选C。
2.【答案】
【解析】
【分析】
本题考查常用化学用语的书写,难度不大,注意离子结构示意图和原子结构示意图的区别。
【解答】
A.,,质子数相同、中子数不同,表示不同的核素,故A错误;
B.个中子的碳原子质量数为,表示为,故B正确;
C.氯离子核内有个质子,核外含有个电子,结构示意图为,故C错误;
D.氯化铵属于离子化合物,电子式为,故D错误。
故选B。
3.【答案】
【解析】解:标况条件下,中含有极性键数目为,故A错误;
B.个中水分子内存在个键,铜离子与水分子存在个配位键,所以中含键数目为,故B正确;
C.白磷分子的物质的量为,存在的共价键数目,故C错误;
D.水蒸气分子之间距离较大,不存在氢键,故D错误;
故选:。
A.个含有条极性共价键;
B.中水分子内存在个键,铜离子与水分子存在个配位键,配位键也是键;
C.每个白磷分子含有个原子,每个白磷分子中键数目为;
D.水蒸气分子间不存在氢键。
本题考查阿伏加德罗常数的应用及相关计算,明确气体摩尔体积使用对象,白磷分子的结构,氢键形成条件是解题关键,题目难度中等。
4.【答案】
【解析】解:由核外电子排布式可知,为元素, 为元素,为元素,
A.同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能,即,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径,即:,故B正确;
C.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性,即,故C错误;
D.、元素无最高正化合价,元素最高正化合价为,故最高正化合价:错误,故D错误;
故选:。
由核外电子排布式可知,为元素, 为元素,为元素,
A.同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下第一电离能减小;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.同周期自左而右电负性增大,同主族自上而下电负性减小;
D.最高正化合价等于最外层电子数,注意、元素一般没有正化合价。
本题考查原子结构与元素周期律,为高频考点,把握电子排布规律推断元素、元素周期律为解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
5.【答案】
【解析】解:、乙烯含个键、个键,单键均为键,碳碳双键中含个键、个键,则键和键个数比为:,故A正确;
B、根据逐级电离能数据,该元素的第三电离能剧增,说明最外层有个电子,为第Ⅱ族元素,与氯气反应时易失去最外层个电子,形成离子,故B正确;
C、同周期从左往右元素电负性逐渐增大,故、、 的电负性依次增大,故C正确;
D、加入足量溶液,外界与反应,内界不与反应,故D错误;
故选:。
A、乙烯含个键、个键,单键均为键,双键中含个键、个键;
B、根据逐级电离能判断,该原子最外层有个电子,易形成二价阳离子;
C、同周期从左往右元素电负性逐渐增大;
D、配合物內界不能电离,外界可以电离。
本题考查了结构与性质,涉及化学键、电负性、电离能、配合物的结构,题目综合,难度中等,理解定义并能够灵活运用是解题的关键。
6.【答案】
【解析】解:甲烷晶体的构成微粒是甲烷分子,所以甲烷晶胞中的球表示甲烷分子,故A错误;
B.晶体中个分子周围紧邻的分子个数,故B正确;
C.甲烷晶体为分子晶体,所以甲烷晶体熔化时需要克服分子间作用力,故C错误;
D.个晶胞中分子个数,故D错误;
故选:。
A.甲烷晶胞中的球表示甲烷分子;
B.晶体中个分子周围紧邻的分子个数;
C.甲烷晶体为分子晶体;
D.个晶胞中分子个数。
本题考查晶胞计算,侧重考查空间想象能力及计算能力,明确晶体构成微粒、均摊法在晶胞计算中的灵活运用是解本题关键,知道分子晶体和原子晶体区别,题目难度不大。
7.【答案】
【解析】解:因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低:,故A正确;
B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长,所以硬度:金刚石碳化硅晶体硅,故B正确;
C、、、原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:,故C错误;
D、晶格能与离子半径成反比,与电荷成正比,离子半径,,则晶格能,故D正确;
故选:。
A.根据分子间氢键增大熔点,分子内氢键降低熔点判断;
B、都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;
C、金属单质熔沸点与其金属键成正比,金属键与半径成反比,与电荷成正比;
D、离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强。
本题考查晶体熔沸点高低判断,侧重考查晶体类型判断及晶体熔沸点高低影响因素,注意晶格能、金属键与离子半径、离子所带电荷关系,题目难度不大。
8.【答案】
【解析】解:第二周期元素含有未成对电子数最多的元素的电子排布式为,为元素;
B.位于周期表中第三周期第Ⅲ族的元素为元素;
C.第三周期及以后的元素基态原子的层电子均排满,故无法确定该元素的种类,但无论是哪种,元素的非金属性均弱于;
D.基态原子的最外电子层排布为的元素为元素;
四种元素中非金属性最强的元素为,则单质的氧化性最强的元素为,
故选:。
元素的非金属性越强,则单质的氧化性越强,同周期主族元素从左到右,元素的非金属性逐渐增强,同主族元素从上到下,元素的非金属性逐渐减弱,据此分析。
本题考查了元素核外电子排布的规律,难度不大,应注意元素周期律的应用。
9.【答案】
【解析】解:由分析可知,为元素、为元素、为元素、为元素;
A.同周期主族元素自左而右原子半径减小,同主族自上而下原子半径减小,所有元素中氢原子半径最小,故原子半径:,故A正确;
B.氮的轨道处于半满稳定状态,导致其第一电离能比同周期相邻元素的大,故B错误;
C.为元素,属于非金属元素,而为元素,是金属元素,故H元素电负性比大,故C错误;
D.、、三种元素还可以组成盐、酸,如、,故D错误;
故选:。
短周期主族元素、、、的原子序数依次增大,是空气中含量最多的元素,则为元素;而的原子半径最小,其原子序数又小于氮,故为元素;原子核外无未成对电子,其原子序数大于氮,故为元素;原子核外能级与能级的电子总数相等,其原子序数大于氮且小于镁,则其原子核外电子排布式为,故为元素。
本题考查原子结构与元素周期律,推断元素是解题的关键,熟练知识元素周期律与元素化合物知识,注意同周期主族元素第一电离能变化异常情况。
10.【答案】
【解析】
【分析】
本题考查了杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力。
【解答】
A.依据价层电子对互斥理论可知,中原子的价层电子对数,为杂化,为直线形,由于结构对称属于非极性分子,故A错误;
B.由价层电子对互斥理论可知中原子的价层电子对数,为杂化,由于含有对孤电子对,所以是三角锥形,故B错误;
C.中原子的价层电子对数,为杂化,分子构型为平面三角形,故C正确;
D.价层电子对数,立体结构为正四面体,故D错误。
11.【答案】
【解析】
【分析】
本题考查结构位置关系、核外电子排布规律、元素周期律,题目难度一般,根据电子排布规律推断元素是关键。
【解答】
短周期元素和元素,元素的次外层电子数为,最外层电子数为,原子的层电子数为,层电子数为,则层电子数为,所以,所以元素原子有个电子层,故,所以,故为元素;所以元素原子的层电子数为,故为元素;的最外层电子数为,即最外层电子数为,则是元素;原子的最外层电子数为,即最外层电子数为,则为元素。
A. 非金属性越强对应气态氢化物的稳定性越强,非金属性:,气态氢化物稳定性:,故A错误;
B.的化合价有多种,、元素可能形成或共价化合物,故B错误;
C. 在一定条件下,与反应生成,而不能生成,故C错误;
D.与形成的化合物为,常温下不能与盐酸反应,故D正确。
故选:。
12.【答案】
【解析】
【分析】
本题考查钠与含羟基的乙醇、水和碳酸溶液反应产生氢气的快慢,把握钠与的反应及羟基的活泼性为解答的关键,注意酸性越强,反应速率越快,题目难度不大。
【解答】
乙醇中的羟基氢能和钠反应生成氢气,碳酸中的氢离子能和金属钠反应生成氢气,水电离出的氢离子可以和金属钠反应产生氢气,三者的氢的活泼性顺序是,所以产生速率顺序是。
故选D。
13.【答案】
【解析】解:、将二聚分子变成单分子,得化学式,根据两种元素都处于第三周期,可能是或,而在所有原子已达稳定结构,形成二聚分子的话不可能符合,故只可能是,该化合物的化学式是,故A正确;
B、该化合物是无机化合物的二聚分子,属于共价化合物,是分子晶体,故B正确;
C、该化合物是无机化合物的二聚分子,属于共价化合物,不存在离子键,也不是离子化合物,在熔融状态下不能导电,故C错误;
D、该化合物是无机化合物的二聚分子,属于共价化合物,与之间没有形成非极性共价键,故D正确;
故选C。
本题考查化学键,判断化合物的化学式是解答的关键,难度不大,但应注意特例,如氯化铝为共价化合物。
14.【答案】 、 固态时,为分子晶体,为离子晶体,离子键比范德华力强得多
【解析】解:基态铬原子的价电子排布式为,轨道表示式为,
故答案为:;
根据表中数据可知,失去第、、个电子的电离能较小且相差较小,失去第个电子时,电离能突跃式变大,说明的最外层有个电子,则为,
故答案为:;
中,水中的原子和原子均含有孤电子对,因此提供电子对形成配位键的原子是、;中心离子配位数为,
故答案为:、;;
固态时,为分子晶体,为离子晶体,离子键比范德华力强得多,因此的熔点比的熔点低得多,
故答案为:固态时,为分子晶体,为离子晶体,离子键比范德华力强得多;
该晶胞中原子数目为,原子数目为,含有的数目为,则以位于中心的原子为研究对象,原子周围距离最近的原子有个,晶胞中的配位数为,
故答案为:;。
基态铬原子的价电子排布式为,据此书写;
根据表中数据可知,失去第、、个电子的电离能较小且相差较小,失去第个电子时,电离能突跃式变大,说明的最外层有个电子;
含有孤电子对的原子能提供电子对形成配位键;
固态时,为分子晶体,为离子晶体,分子间作用力不同;
该晶胞中原子数目为,原子数目为,则以位于中心的原子为研究对象,原子周围距离最近的原子有个。
本题考查物质的制备和晶胞计算,侧重考查学生分析计算能力、理解能力、知识迁移运用能力,需要学生具备扎实的基础,理解熟记中学常见晶胞结构特点,掌握均摊法进行晶胞有关计算。
15.【答案】
;或
正四面体形
【解析】
【分析】本题考查物质结构方面的知识,比较综合,涉及核外电子排布式的书写、电负性等,难度一般,解题的关键是对相关知识的灵活运用。
【解答】为号元素,原子的基态电子排布式为,则基态核外电子排布式为。
氮原子形成三个单键,为杂化;分子中有键、键、键,共 键,所以分子中含有键的数目为。
非金属性越强,电负性越大,所以、、三种元素的电负性由小到大的顺序为。
中为杂化,所以为正四面体结构。
每个八面体的顶点被两个八面体共有,所以每个八面体中,原子个数为,化合物的化学式为。
16.【答案】或
形
乙醇分子间存在氢键
【解析】
【分析】
本题考查晶胞计算、微粒空间构型判断、原子杂化方式判断、原子核外电子排布等知识点,侧重考查分析、计算、空间想象能力,明确均摊法、价层电子对互斥理论、构造原理等知识点即可解答,难点是晶胞计算方法,题目难度中等。
【解答】
核外电子排布式要遵循构造原理,当原子轨道电子排布为全满、半满或全空时,能量最低。故C的基态原子的核外电子排布为,当原子失去电子形成阳离子时,失电子的顺序则从最外层开始,故C核外电子排布式为,也可简化为,
故答案为:或;
加“”碳原子形成个键,原子杂化类型为杂化;
故答案为:;
分子中硫原子的价层电子对数为,含有一个孤电子对,故其空间结构为形;元素原子能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素,故第一电离能;
故答案为:形,;
乙醇分子间可形成氢键,增加了分子之间的作用,乙醛不能形成氢键,所以乙醇的沸点高于乙醛;
故答案为:乙醇分子间存在氢键;
依据晶胞结构图可知:个数,个数,化学式为:;
故答案为:。
17.【答案】 哑铃型 分子间可以形成氢键 极性 氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小
【解析】解:基态原子的电子排布式为,核外每个电子的运动状态均不相同,所以共有种不同运动状态的电子;能量最高的电子所占据的原子轨道为轨道,为哑铃型,
故答案为:;哑铃型;
分子间可以形成氢键,使其沸点升高,故的沸点高于,与均为三角锥形,整个分子正负电荷重心不重合,是极性分子,
故答案为:;分子间可以形成氢键;
分子中正负电荷中心不能重合为极性分子;氟化铵是和构成的离子化合物,电子式:,
故答案为:;
分子中中心原子形成个键、有个孤对电子,则为杂化;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小,
故答案为:;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小;
硫酸铜溶液与氨水反应可生成氢氧化铜沉淀和硫酸铵,氢氧化铜沉淀能溶于过量的氨水;则该反应为
,其离子反应为: ;中铜离子提供空轨道、原子提供孤电子对而形成配位键,中含有个配位键,的结构可用示意图表示为,
故答案为: ;。
核外每个电子的运动状态均不相同;基态原子的电子排布式为;基态原子中,能量最高的电子所占据的原子轨道为轨道;
氢键可以使物质的沸点升高,若整个分子正负电荷重心重合,则为非极性分子,反之为极性分子;
正负电荷中心不能重合的分子为极性分子;为离子化合物,铵根离子与氟离子通过离子键结合;
分子中中心原子形成个键、有个孤对电子;氟原子含有较多的孤电子对,受到氮原子的一对孤电子对的斥力较大,故的键角比小;
硫酸铜溶液与氨水反应可生成氢氧化铜沉淀和硫酸铵,氢氧化铜沉淀能溶于过量的氨水;中铜离子提供空轨道、原子提供孤电子对而形成配位键,中含有个配位键。
本题考查微粒空间构型判断、原子杂化类型判断、电子式、离子方程式等知识点,侧重考查基础知识的理解和灵活应用能力,明确价层电子对互斥理论内涵及价层电子对个数计算方法是解本题关键,题目难度中等。
第16页,共16页
同课章节目录
