5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析)
文档属性
| 名称 | 5.1硫及其化合物同步练习题高一下学期化学人教版(2019)必修第二册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 341.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:49:08 | ||
图片预览



文档简介
5.1 硫及其化合物 同步练习题
一、单选题
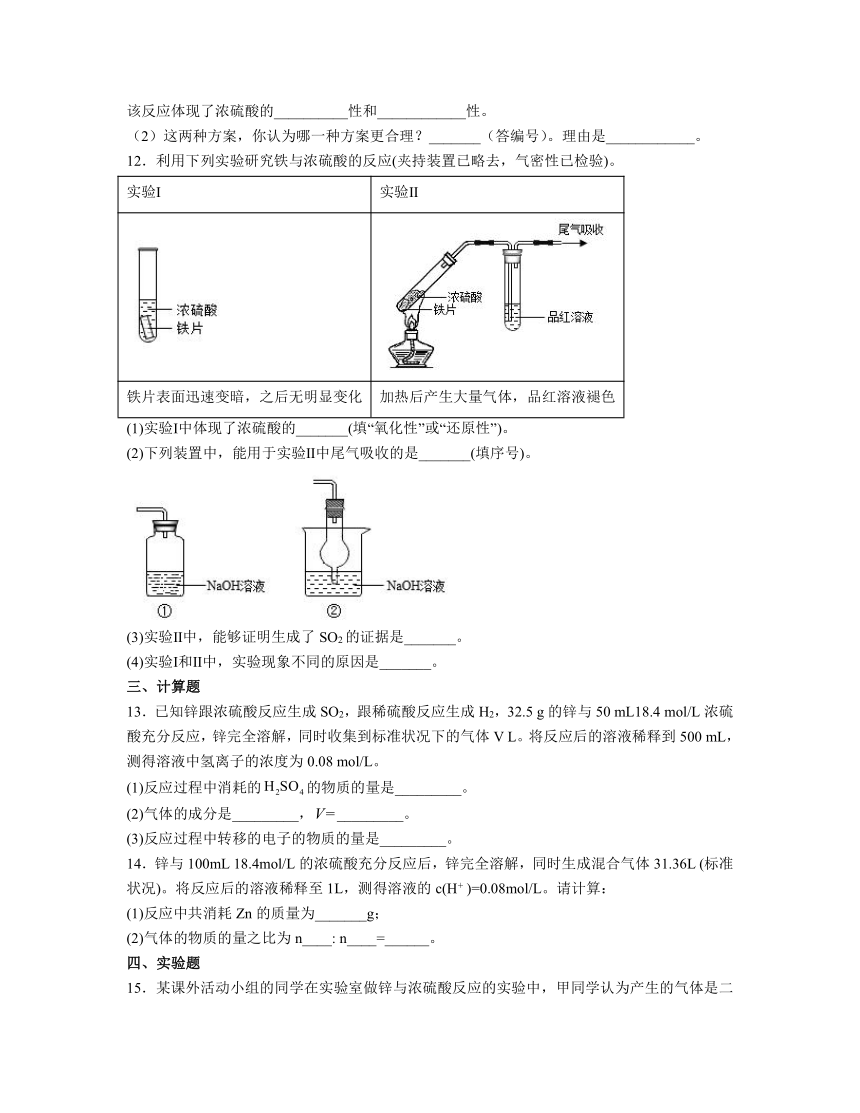
1.实验室隔绝空气加热硫酸亚铁铵[]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、和,气体产物可能有、、、和)。下列说法中正确的是
A.取①中固体残留物与稀硫酸反应并滴加KSCN溶液,溶液变为血红色,则残留物一定含有
B.装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C.装置③中若有白色沉淀生成,则分解产物中有气体
D.装置④用于检验分解产物中是否有气体
2.下列实验设计方案或判断中正确的是
A.加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3
B.通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体
C.某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42-
D.未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32-
3.下列有关物质的性质与用途具有对应关系的是
A.MgO熔点高,可用作耐高温材料
B.浓H2SO4具有脱水性,可用作干燥剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.Na具有还原性,可用于制作高压钠灯
4.铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是
A.稀硫酸 B.浓硫酸 C.Al(NO3)3 D.Fe2(SO4)3
5.已知,该反应中浓硫酸主要体现的性质是
A.酸性 B.脱水性 C.吸水性 D.强氧化性
6.设NA为阿伏加德罗常数的值,下列说法正确的是
(1)1molNH质子数为10NA
(2)通常状况下,11.2LH2所含的氢原子数为NA
(3)将0.1mol Cl2通入到足量的水中,溶液中Cl-、HClO、ClO-微粒总数为0.2NA
(4)0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积等于22.4L
(5)常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
(6)0.2mol/L的NH4NO3溶液中所含N原子的数目为0.4NA
(7)常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
(8)100克质量分数46%的乙醇(C2H6O)溶液中含有的氢原子数为12NA
A.(3)(4)(5) B.(1)(3)(8) C.(2)(5)(6)(7) D.(5)(8)
7.下列物质的性质与应用关系的描述不正确的是
A.氧化镁的熔点高,是优质的耐高温材料
B.金属钠着火,不可用泡沫灭火器灭火
C.氯气有强氧化性,可用氯气漂白干燥的有色布条
D.二氧化硫有漂白性,可用于漂白毛,丝,纸浆
8.下列有关制备硫酸工艺的说法正确的是
A.在沸腾炉中发生的反应为:2SO2+O22SO3
B.在吸收塔中为了充分吸收SO3,常选用蒸馏水作吸收剂
C.尾气中的SO2不属于“城市空气质量日报”报道的内容
D.进入接触室之前,气体需经过净化处理,防止催化剂中毒
9.下列说法正确的是
A.可在葡萄酒中添加适量的二氧化硫
B.NaHCO3固体可以做干粉灭火剂,金属钠着火可以用其来灭火
C.常温下,浓硫酸和铁不反应,所以可用铁质槽罐车运输浓硫酸
D.铁丝在氯气中燃烧,可观察到集气瓶内有红棕色的雾出现
10.下列现象和用途中,浓硫酸表现脱水性的是( )
A.实验室制取氯气时浓硫酸做干燥剂
B.浓硫酸使火柴梗变黑
C.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与碳单质反应
二、填空题
11.甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案:
方案①:铜与浓硫酸加热直接反应,即
方案②:由
请回答下列问题:
(1)“方案①”中铜和浓硫酸反应的化学方程式是______________________。
该反应体现了浓硫酸的__________性和____________性。
(2)这两种方案,你认为哪一种方案更合理?_______(答编号)。理由是____________。
12.利用下列实验研究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
实验Ⅰ 实验Ⅱ
铁片表面迅速变暗,之后无明显变化 加热后产生大量气体,品红溶液褪色
(1)实验Ⅰ中体现了浓硫酸的_______(填“氧化性”或“还原性”)。
(2)下列装置中,能用于实验Ⅱ中尾气吸收的是_______(填序号)。
(3)实验Ⅱ中,能够证明生成了SO2的证据是_______。
(4)实验Ⅰ和Ⅱ中,实验现象不同的原因是_______。
三、计算题
13.已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2,32.5 g的锌与50 mL18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体V L。将反应后的溶液稀释到500 mL,测得溶液中氢离子的浓度为0.08 mol/L。
(1)反应过程中消耗的的物质的量是_________。
(2)气体的成分是_________,_________。
(3)反应过程中转移的电子的物质的量是_________。
14.锌与100mL 18.4mol/L的浓硫酸充分反应后,锌完全溶解,同时生成混合气体31.36L (标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+ )=0.08mol/L。请计算:
(1)反应中共消耗Zn的质量为_______g;
(2)气体的物质的量之比为n____: n____=______。
四、实验题
15.某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应加热装置略去)。
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为_______。
(2)乙同学认为还可能产生氢气的理由是_______。
(3)A中加入的试剂可能是_______,作用是_______;E中加入的试剂可能是_______,作用是_______。
(4)可以证明气体X中含有氢气的实验现象:C中_______,D中_______。
16.以下是实验室制SO2并检验SO2某些性质的装置图,已知:2H2S+SO2===3S↓+2H2O。
请回答下列问题:
(1)⑥中发生反应的化学方程式为_________。
(2)①中的实验现象为_________,证明SO2的水溶液具有________性。
(3)②中的品红溶液__________,证明SO2具有________性。
(4)③中的实验现象为__________,证明SO2具有________性。
(5)④中的实验现象为__________,证明SO2具有________性。
(6)⑤的作用是_________,反应的化学方程式为________。
五、元素或物质推断题
17.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C和D2C2;C、E同主族。
(1)D在周期表中的位置为_______;B的原子结构示意图为_______。
(2)E元素形成的最高价氧化物对应水化物的化学式为_______,C、E元素气态氢化物中较稳定的是_______(写化学式)。
(3)元素C、D、E的原子半径大小关系是_______(用元素符号表示)。
(4)写出化合物D2C2和C的气态氢化物反应化学方程式_______。
(5)写出A2C2和C、E组成的一种化合物发生氧化还原反应的化学方程式_______。
【参考答案】
一、单选题
1.D
解析:A.硫酸与固体残留物反应后滴加KSCN溶液,溶液变红,说明有三价铁离子,残留物中氧化铁和四氧化三铁至少有一种,故A错误;
B.根据分析可知,无水硫酸铜遇到水变蓝,所以通过无水硫酸铜是否变色判断是否产生水,故B错误;
C.根据分析可知,装置③中若有白色沉淀生成,则分解产物中有气体,故C错误;
D.二氧化硫具有漂白性,装置④盛放品红可用于检验气体中的SO2,故D正确;
故选D。
2.A
解析:A、利用置换反应,故A正确;
B、同时除去了CO2,故B错误;
C、还可能是CO32-、Ag+,故C错误;
D、可能是HCO3-、SO32-、HSO3-,故D错误;选A。
3.A
解析:A.MgO熔点高,可用作耐高温材料,故A符合题意;
B.浓硫酸有吸水性,故可用做干燥剂,不是脱水性,故B不符合题意;
C.漂白粉具有漂白性,能漂白纸张,与漂白粉的稳定性强弱无关,故 C 不符合题意;
D.钠光为黄色,穿透力强,可用于制作高压钠灯,与 Na 具有还原性无关,故 D 不符合题意;故选A。
4.D
解析:A.铁片与稀硫酸反应会生成氢气,有气体放出,故A不符合题意;
B.铁片在浓硫酸中会钝化,表面形成氧化膜,质量会增加,故B不符合题意;
C.铁不如铝活泼,与硝酸铝不反应,故C不符合题意;
D.Fe与Fe3+反应生成Fe2+,无气体放出,且质量减轻,故D符合题意;
综上所述答案为D。
5.D
解析:该反应中,浓硫酸中的S元素化合价从+6价降低到+4价,浓硫酸作氧化剂,将C氧化为CO2,表现出强氧化性,故选D;
答案选D。
6.D
解析:(1)1molNH质子数为11NA,说法错误;
(2)通常状况下,11.2LH2的物质的量小于0.5mol、所含的氢原子数小于NA,说法错误;
(3)将0.1mol Cl2通入到足量的水中,发生可逆反应,氯气没有完全反应,溶液中Cl-、HClO、ClO-微粒总数小于0.2NA,说法错误;
(4)0℃,101kPa即标况, SO3呈固态,故混合气体的体积小于22.4L,说法错误;
(5) 氧气和臭氧是同素异形体,常温常压下,6.4g氧气和臭氧混合气体中含有4molO、则原子总数为0.4NA,说法正确;
(6)0.2mol/L的NH4NO3溶液的体积不知道,故难以计算所含N原子的数目,说法错误;
(7)常温下,2.7 g铝片投入足量的浓硫酸中发生钝化,铝没有溶解,铝失去的电子数远小于0.3NA,说法错误;
(8)100克质量分数46%的乙醇(C2H6O)溶液中含有的氢原子数为含有氢原子数=12NA,说法正确;
综上,(5)(8)正确,答案选D。
7.C
解析:A.氧化镁的熔点高,是优质的耐高温材料,A正确;
B.金属钠性质活泼,可以与水、氧气等物质发生反应,着火时不可用泡沫灭火器灭火,应该用沙土来灭火,B正确;
C.氯气没有漂白性,有漂白性的是氯气与水反应生成的次氯酸,氯气不能漂白干燥的有色布条,C错误;
D.二氧化硫有漂白性,但对人体有害,只能用于工业漂白,可用于漂白毛,丝,纸浆,D正确。
答案选C。
8.D
解析:A.沸腾炉制取二氧化硫,经净化后,进入接触室发生2SO2+O2 2SO3,A错误;
B.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收,用水吸收容易形成酸雾,B错误;
C.二氧化硫是酸雨的来源,属于“城市空气质量日报”报道的内容,C错误;
D.制备硫酸过程中,从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,D正确;
故选D。
9.A
解析:A.二氧化硫具有还原性,可以与葡萄酒中的氧气发生反应,因而可以可以保持葡萄酒的品质,同时也可以对葡萄糖进行杀菌作用,A正确;
B.NaHCO3固体受热分解产生Na2CO3、CO2、H2O,CO2、H2O不助燃,同时物质分解吸收热量,使温度降低,从而具有灭火作用,故NaHCO3可以做干粉灭火剂;金属钠着火燃烧产物是Na2O2,Na2O2与NaHCO3分解产生的CO2、H2O反应会放出氧气,使物质燃烧更旺,因此不可以用其来灭火,B错误;
C.常温下,浓硫酸遇铁时,会在金属表面氧化产生一层致密的氧化物保护膜,阻止金属进一步氧化,所以可用铁质槽罐车运输浓硫酸,而不是铁与浓硫酸不能发生反应,C错误;
D.铁丝在氯气中燃烧产生FeCl3固体,因此会观察到集气瓶内有红棕色烟而不是雾,D错误;
故合理选项是A。
10.B
解析:A. 用浓硫酸干燥氯气时浓硫酸表现吸水性,A不符合题意;
B. 浓硫酸使火柴梗变黑,浓硫酸表现脱水性,B符合题意;
C. 浓硫酸滴到胆矾上,蓝色晶体变成白色粉末,浓硫酸表现吸水性,C不符合题意;
D. 浓硫酸与碳单质反应,浓硫酸表现强氧化性,D不符合题意;
答案选B。
二、填空题
11. 强氧化性 酸性 ② 无污染产生,原料利用率高
解析:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,
反应中硫元素的化合价部分降低生成二氧化硫,部分不变存在与硫酸铜中,浓硫酸表现强氧化性与酸性;
(2)方案①生成二氧化硫,污染空气,硫元素不能完全利用,方案②与方案①相比,没有污染产生且原料的利用率高,故方案②更合理。
12. 氧化性 ② Ⅱ中品红溶液褪色 温度不同
解析:(1)实验Ⅰ中铁片表面迅速变暗,说明铁和浓硫酸发生了反应,之后无明显变化,则铁被钝化,铁的表面产生了一层致密的氧化物保护膜,体现了浓硫酸的氧化性。
(2)装置①气体能进不能出,不安全,①错误;装置②中,气体和氢氧化钠溶液反应、干燥管有容纳液体的空间可以防倒吸,则能用于实验Ⅱ中尾气吸收的是②。
(3)二氧化硫具有漂白性,能使品红溶液褪色,故实验Ⅱ中,能够证明生成了SO2的证据是Ⅱ中品红溶液褪色。
(4)实验Ⅰ和Ⅱ的反应物均相同,只有温度不同,故实验现象不同的原因是温度不同。
三、计算题
13.9 mol 二氧化硫和氢气 11.2 1 mol
解析:(1)的物质的量为,原硫酸的物质的量为;反应后,氢离子浓度为,则此时硫酸的浓度为;反应后硫酸的物质的量为;则反应消耗的硫酸的物质的量为。故答案为:0.9 mol。
(2)假设生成二氧化硫的物质的量为,生成氢气的物质的量为,根据化学方程式,可得:
,解得;则生成气体的体积为。故答案为:二氧化硫和氢气;11.2。
(3)反应共消耗的物质的量为,反应中被氧化为,故反应过程中转移的电子的物质的量是。故答案为:1 mol。
14.2:5
解析:(1)生成气体的物质的量为,根据化学方程式可知生成1.4mol气体,消耗1.4mol Zn,Zn的质量为;
(2)溶液剩余硫酸的物质的量为,参加反应的,设反应生成SO2的物质的量为x mol,生成H2的物质的量为y mol,则生成SO2消耗H2SO4的物质的量为2x mol,生成H2消耗H2SO4的物质的量为y mol,则有,解得,所以。
四、实验题
15.(1)
(2)浓硫酸有酸性,电离出的H+能被Zn还原而得到氢气
(3) 品红溶液 检验X气体中是否有SO2 碱石灰 防止空气中的水分进入装置D,影响对C中产物是否有水的检验
(4) 红色固体 白色固体变蓝色
【分析】锌与浓硫酸共热时产生的气体,进入装置A中的品红溶液检验是否含有二氧化硫,通过KMnO4溶液除去可能有的二氧化硫后,将气体通入装置B中的浓硫酸干燥,干燥后的气体通入装置C中,与CuO共热,用装置D中的无色硫酸铜检验产物是否含水。
解析: (1)生成二氧化硫的反应是锌与浓硫酸反应,化学方程式为:。
(2)还可能产生氢气的理由是浓硫酸有酸性,电离出的H+能被Zn还原而得到氢气,离子方程式:Zn + 2H+ =Zn2+ +H2↑。
(3)据分析,A中试剂的目的是检验X气体中是否有SO2,故该试剂可能是品红溶液;作用是检验X气体中是否有SO2;用装置D中的无色硫酸铜检验C中产物是否含水,故E中加入的试剂可能是碱石灰,作用是防止空气中的水分进入装置D,影响C中产物是否有水的检验。
(4)可以证明气体X中含有氢气的实验是H2还原C中的CuO,反应的产物是Cu和H2O,H2O与白色的无色硫酸铜结合得到蓝色的五水硫酸铜,故现象:C中出现红色固体,D中白色固体变蓝色。
16. Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O 溶液变红 酸 褪色 漂白 溶液变浑浊 氧化 溶液褪色 还原 吸收多余的SO2,防止污染空气 SO2+2NaOH===Na2SO3+H2O
解析:(1)⑥中浓硫酸与亚硫酸钠反应生成二氧化硫气体、硫酸钠和水,方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O;
(2)①中二氧化硫溶于水,生成亚硫酸,溶液显酸性,能使石蕊变红,但不能使石蕊褪色;
(3)②中二氧化硫具有漂白性,能使品红溶液褪色;
(4)③中二氧化硫具有氧化性,与硫化氢反应生成单质硫和水,产生淡黄色沉淀;
(5)④中二氧化硫具有还原性,能使高锰酸钾溶液褪色;
(6)⑤二氧化硫有毒,用NaOH吸收,反应的方程式为SO2+2NaOH===Na2SO3+H2O。
五、元素或物质推断题
17.(1) 第三周期 IA
(2) H2SO4 H2O
(3)Na> S >O
(4)2Na2O2+2H2O= 4NaOH + O2↑
(5)H2O2+ SO2=H2SO4
【分析】A元素的原子核内只有1个质子,则A为H,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为,则B的最高化合价为+5,位于周期表中第ⅤA族,应为N,C元素原子的最外层电子数比次外层电子数多4,则原子核外电子排布为2、6,应为O,C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C和D2C2,则D的化合价为+1,应为Na,C、E同主族,则E为S。
解析:(1)D为Na,核电荷数为11,在周期表中的位置为第三周期I A族,B为N,原子结构示意图为;
(2)E为S,其最高价氧化物对应的水化物是;同主族元素对应氢化物稳定性逐渐降低,所以氢化物较稳定的是H2O;
(3)同主族元素的原子半径从上到下逐渐增大,同周期元素的原子半径从左到右逐渐减小,所以原子半径大小关系为;
(4)D2C2为Na2O2,C的气态氢化物为H2O,反应方程式为;
(5)H2O2与 SO2反应方程式为。
一、单选题
1.实验室隔绝空气加热硫酸亚铁铵[]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、和,气体产物可能有、、、和)。下列说法中正确的是
A.取①中固体残留物与稀硫酸反应并滴加KSCN溶液,溶液变为血红色,则残留物一定含有
B.装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
C.装置③中若有白色沉淀生成,则分解产物中有气体
D.装置④用于检验分解产物中是否有气体
2.下列实验设计方案或判断中正确的是
A.加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3
B.通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体
C.某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42-
D.未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32-
3.下列有关物质的性质与用途具有对应关系的是
A.MgO熔点高,可用作耐高温材料
B.浓H2SO4具有脱水性,可用作干燥剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.Na具有还原性,可用于制作高压钠灯
4.铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是
A.稀硫酸 B.浓硫酸 C.Al(NO3)3 D.Fe2(SO4)3
5.已知,该反应中浓硫酸主要体现的性质是
A.酸性 B.脱水性 C.吸水性 D.强氧化性
6.设NA为阿伏加德罗常数的值,下列说法正确的是
(1)1molNH质子数为10NA
(2)通常状况下,11.2LH2所含的氢原子数为NA
(3)将0.1mol Cl2通入到足量的水中,溶液中Cl-、HClO、ClO-微粒总数为0.2NA
(4)0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积等于22.4L
(5)常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
(6)0.2mol/L的NH4NO3溶液中所含N原子的数目为0.4NA
(7)常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
(8)100克质量分数46%的乙醇(C2H6O)溶液中含有的氢原子数为12NA
A.(3)(4)(5) B.(1)(3)(8) C.(2)(5)(6)(7) D.(5)(8)
7.下列物质的性质与应用关系的描述不正确的是
A.氧化镁的熔点高,是优质的耐高温材料
B.金属钠着火,不可用泡沫灭火器灭火
C.氯气有强氧化性,可用氯气漂白干燥的有色布条
D.二氧化硫有漂白性,可用于漂白毛,丝,纸浆
8.下列有关制备硫酸工艺的说法正确的是
A.在沸腾炉中发生的反应为:2SO2+O22SO3
B.在吸收塔中为了充分吸收SO3,常选用蒸馏水作吸收剂
C.尾气中的SO2不属于“城市空气质量日报”报道的内容
D.进入接触室之前,气体需经过净化处理,防止催化剂中毒
9.下列说法正确的是
A.可在葡萄酒中添加适量的二氧化硫
B.NaHCO3固体可以做干粉灭火剂,金属钠着火可以用其来灭火
C.常温下,浓硫酸和铁不反应,所以可用铁质槽罐车运输浓硫酸
D.铁丝在氯气中燃烧,可观察到集气瓶内有红棕色的雾出现
10.下列现象和用途中,浓硫酸表现脱水性的是( )
A.实验室制取氯气时浓硫酸做干燥剂
B.浓硫酸使火柴梗变黑
C.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与碳单质反应
二、填空题
11.甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案:
方案①:铜与浓硫酸加热直接反应,即
方案②:由
请回答下列问题:
(1)“方案①”中铜和浓硫酸反应的化学方程式是______________________。
该反应体现了浓硫酸的__________性和____________性。
(2)这两种方案,你认为哪一种方案更合理?_______(答编号)。理由是____________。
12.利用下列实验研究铁与浓硫酸的反应(夹持装置已略去,气密性已检验)。
实验Ⅰ 实验Ⅱ
铁片表面迅速变暗,之后无明显变化 加热后产生大量气体,品红溶液褪色
(1)实验Ⅰ中体现了浓硫酸的_______(填“氧化性”或“还原性”)。
(2)下列装置中,能用于实验Ⅱ中尾气吸收的是_______(填序号)。
(3)实验Ⅱ中,能够证明生成了SO2的证据是_______。
(4)实验Ⅰ和Ⅱ中,实验现象不同的原因是_______。
三、计算题
13.已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2,32.5 g的锌与50 mL18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体V L。将反应后的溶液稀释到500 mL,测得溶液中氢离子的浓度为0.08 mol/L。
(1)反应过程中消耗的的物质的量是_________。
(2)气体的成分是_________,_________。
(3)反应过程中转移的电子的物质的量是_________。
14.锌与100mL 18.4mol/L的浓硫酸充分反应后,锌完全溶解,同时生成混合气体31.36L (标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+ )=0.08mol/L。请计算:
(1)反应中共消耗Zn的质量为_______g;
(2)气体的物质的量之比为n____: n____=______。
四、实验题
15.某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应加热装置略去)。
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为_______。
(2)乙同学认为还可能产生氢气的理由是_______。
(3)A中加入的试剂可能是_______,作用是_______;E中加入的试剂可能是_______,作用是_______。
(4)可以证明气体X中含有氢气的实验现象:C中_______,D中_______。
16.以下是实验室制SO2并检验SO2某些性质的装置图,已知:2H2S+SO2===3S↓+2H2O。
请回答下列问题:
(1)⑥中发生反应的化学方程式为_________。
(2)①中的实验现象为_________,证明SO2的水溶液具有________性。
(3)②中的品红溶液__________,证明SO2具有________性。
(4)③中的实验现象为__________,证明SO2具有________性。
(5)④中的实验现象为__________,证明SO2具有________性。
(6)⑤的作用是_________,反应的化学方程式为________。
五、元素或物质推断题
17.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C和D2C2;C、E同主族。
(1)D在周期表中的位置为_______;B的原子结构示意图为_______。
(2)E元素形成的最高价氧化物对应水化物的化学式为_______,C、E元素气态氢化物中较稳定的是_______(写化学式)。
(3)元素C、D、E的原子半径大小关系是_______(用元素符号表示)。
(4)写出化合物D2C2和C的气态氢化物反应化学方程式_______。
(5)写出A2C2和C、E组成的一种化合物发生氧化还原反应的化学方程式_______。
【参考答案】
一、单选题
1.D
解析:A.硫酸与固体残留物反应后滴加KSCN溶液,溶液变红,说明有三价铁离子,残留物中氧化铁和四氧化三铁至少有一种,故A错误;
B.根据分析可知,无水硫酸铜遇到水变蓝,所以通过无水硫酸铜是否变色判断是否产生水,故B错误;
C.根据分析可知,装置③中若有白色沉淀生成,则分解产物中有气体,故C错误;
D.二氧化硫具有漂白性,装置④盛放品红可用于检验气体中的SO2,故D正确;
故选D。
2.A
解析:A、利用置换反应,故A正确;
B、同时除去了CO2,故B错误;
C、还可能是CO32-、Ag+,故C错误;
D、可能是HCO3-、SO32-、HSO3-,故D错误;选A。
3.A
解析:A.MgO熔点高,可用作耐高温材料,故A符合题意;
B.浓硫酸有吸水性,故可用做干燥剂,不是脱水性,故B不符合题意;
C.漂白粉具有漂白性,能漂白纸张,与漂白粉的稳定性强弱无关,故 C 不符合题意;
D.钠光为黄色,穿透力强,可用于制作高压钠灯,与 Na 具有还原性无关,故 D 不符合题意;故选A。
4.D
解析:A.铁片与稀硫酸反应会生成氢气,有气体放出,故A不符合题意;
B.铁片在浓硫酸中会钝化,表面形成氧化膜,质量会增加,故B不符合题意;
C.铁不如铝活泼,与硝酸铝不反应,故C不符合题意;
D.Fe与Fe3+反应生成Fe2+,无气体放出,且质量减轻,故D符合题意;
综上所述答案为D。
5.D
解析:该反应中,浓硫酸中的S元素化合价从+6价降低到+4价,浓硫酸作氧化剂,将C氧化为CO2,表现出强氧化性,故选D;
答案选D。
6.D
解析:(1)1molNH质子数为11NA,说法错误;
(2)通常状况下,11.2LH2的物质的量小于0.5mol、所含的氢原子数小于NA,说法错误;
(3)将0.1mol Cl2通入到足量的水中,发生可逆反应,氯气没有完全反应,溶液中Cl-、HClO、ClO-微粒总数小于0.2NA,说法错误;
(4)0℃,101kPa即标况, SO3呈固态,故混合气体的体积小于22.4L,说法错误;
(5) 氧气和臭氧是同素异形体,常温常压下,6.4g氧气和臭氧混合气体中含有4molO、则原子总数为0.4NA,说法正确;
(6)0.2mol/L的NH4NO3溶液的体积不知道,故难以计算所含N原子的数目,说法错误;
(7)常温下,2.7 g铝片投入足量的浓硫酸中发生钝化,铝没有溶解,铝失去的电子数远小于0.3NA,说法错误;
(8)100克质量分数46%的乙醇(C2H6O)溶液中含有的氢原子数为含有氢原子数=12NA,说法正确;
综上,(5)(8)正确,答案选D。
7.C
解析:A.氧化镁的熔点高,是优质的耐高温材料,A正确;
B.金属钠性质活泼,可以与水、氧气等物质发生反应,着火时不可用泡沫灭火器灭火,应该用沙土来灭火,B正确;
C.氯气没有漂白性,有漂白性的是氯气与水反应生成的次氯酸,氯气不能漂白干燥的有色布条,C错误;
D.二氧化硫有漂白性,但对人体有害,只能用于工业漂白,可用于漂白毛,丝,纸浆,D正确。
答案选C。
8.D
解析:A.沸腾炉制取二氧化硫,经净化后,进入接触室发生2SO2+O2 2SO3,A错误;
B.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收,用水吸收容易形成酸雾,B错误;
C.二氧化硫是酸雨的来源,属于“城市空气质量日报”报道的内容,C错误;
D.制备硫酸过程中,从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,D正确;
故选D。
9.A
解析:A.二氧化硫具有还原性,可以与葡萄酒中的氧气发生反应,因而可以可以保持葡萄酒的品质,同时也可以对葡萄糖进行杀菌作用,A正确;
B.NaHCO3固体受热分解产生Na2CO3、CO2、H2O,CO2、H2O不助燃,同时物质分解吸收热量,使温度降低,从而具有灭火作用,故NaHCO3可以做干粉灭火剂;金属钠着火燃烧产物是Na2O2,Na2O2与NaHCO3分解产生的CO2、H2O反应会放出氧气,使物质燃烧更旺,因此不可以用其来灭火,B错误;
C.常温下,浓硫酸遇铁时,会在金属表面氧化产生一层致密的氧化物保护膜,阻止金属进一步氧化,所以可用铁质槽罐车运输浓硫酸,而不是铁与浓硫酸不能发生反应,C错误;
D.铁丝在氯气中燃烧产生FeCl3固体,因此会观察到集气瓶内有红棕色烟而不是雾,D错误;
故合理选项是A。
10.B
解析:A. 用浓硫酸干燥氯气时浓硫酸表现吸水性,A不符合题意;
B. 浓硫酸使火柴梗变黑,浓硫酸表现脱水性,B符合题意;
C. 浓硫酸滴到胆矾上,蓝色晶体变成白色粉末,浓硫酸表现吸水性,C不符合题意;
D. 浓硫酸与碳单质反应,浓硫酸表现强氧化性,D不符合题意;
答案选B。
二、填空题
11. 强氧化性 酸性 ② 无污染产生,原料利用率高
解析:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,
反应中硫元素的化合价部分降低生成二氧化硫,部分不变存在与硫酸铜中,浓硫酸表现强氧化性与酸性;
(2)方案①生成二氧化硫,污染空气,硫元素不能完全利用,方案②与方案①相比,没有污染产生且原料的利用率高,故方案②更合理。
12. 氧化性 ② Ⅱ中品红溶液褪色 温度不同
解析:(1)实验Ⅰ中铁片表面迅速变暗,说明铁和浓硫酸发生了反应,之后无明显变化,则铁被钝化,铁的表面产生了一层致密的氧化物保护膜,体现了浓硫酸的氧化性。
(2)装置①气体能进不能出,不安全,①错误;装置②中,气体和氢氧化钠溶液反应、干燥管有容纳液体的空间可以防倒吸,则能用于实验Ⅱ中尾气吸收的是②。
(3)二氧化硫具有漂白性,能使品红溶液褪色,故实验Ⅱ中,能够证明生成了SO2的证据是Ⅱ中品红溶液褪色。
(4)实验Ⅰ和Ⅱ的反应物均相同,只有温度不同,故实验现象不同的原因是温度不同。
三、计算题
13.9 mol 二氧化硫和氢气 11.2 1 mol
解析:(1)的物质的量为,原硫酸的物质的量为;反应后,氢离子浓度为,则此时硫酸的浓度为;反应后硫酸的物质的量为;则反应消耗的硫酸的物质的量为。故答案为:0.9 mol。
(2)假设生成二氧化硫的物质的量为,生成氢气的物质的量为,根据化学方程式,可得:
,解得;则生成气体的体积为。故答案为:二氧化硫和氢气;11.2。
(3)反应共消耗的物质的量为,反应中被氧化为,故反应过程中转移的电子的物质的量是。故答案为:1 mol。
14.2:5
解析:(1)生成气体的物质的量为,根据化学方程式可知生成1.4mol气体,消耗1.4mol Zn,Zn的质量为;
(2)溶液剩余硫酸的物质的量为,参加反应的,设反应生成SO2的物质的量为x mol,生成H2的物质的量为y mol,则生成SO2消耗H2SO4的物质的量为2x mol,生成H2消耗H2SO4的物质的量为y mol,则有,解得,所以。
四、实验题
15.(1)
(2)浓硫酸有酸性,电离出的H+能被Zn还原而得到氢气
(3) 品红溶液 检验X气体中是否有SO2 碱石灰 防止空气中的水分进入装置D,影响对C中产物是否有水的检验
(4) 红色固体 白色固体变蓝色
【分析】锌与浓硫酸共热时产生的气体,进入装置A中的品红溶液检验是否含有二氧化硫,通过KMnO4溶液除去可能有的二氧化硫后,将气体通入装置B中的浓硫酸干燥,干燥后的气体通入装置C中,与CuO共热,用装置D中的无色硫酸铜检验产物是否含水。
解析: (1)生成二氧化硫的反应是锌与浓硫酸反应,化学方程式为:。
(2)还可能产生氢气的理由是浓硫酸有酸性,电离出的H+能被Zn还原而得到氢气,离子方程式:Zn + 2H+ =Zn2+ +H2↑。
(3)据分析,A中试剂的目的是检验X气体中是否有SO2,故该试剂可能是品红溶液;作用是检验X气体中是否有SO2;用装置D中的无色硫酸铜检验C中产物是否含水,故E中加入的试剂可能是碱石灰,作用是防止空气中的水分进入装置D,影响C中产物是否有水的检验。
(4)可以证明气体X中含有氢气的实验是H2还原C中的CuO,反应的产物是Cu和H2O,H2O与白色的无色硫酸铜结合得到蓝色的五水硫酸铜,故现象:C中出现红色固体,D中白色固体变蓝色。
16. Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O 溶液变红 酸 褪色 漂白 溶液变浑浊 氧化 溶液褪色 还原 吸收多余的SO2,防止污染空气 SO2+2NaOH===Na2SO3+H2O
解析:(1)⑥中浓硫酸与亚硫酸钠反应生成二氧化硫气体、硫酸钠和水,方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O;
(2)①中二氧化硫溶于水,生成亚硫酸,溶液显酸性,能使石蕊变红,但不能使石蕊褪色;
(3)②中二氧化硫具有漂白性,能使品红溶液褪色;
(4)③中二氧化硫具有氧化性,与硫化氢反应生成单质硫和水,产生淡黄色沉淀;
(5)④中二氧化硫具有还原性,能使高锰酸钾溶液褪色;
(6)⑤二氧化硫有毒,用NaOH吸收,反应的方程式为SO2+2NaOH===Na2SO3+H2O。
五、元素或物质推断题
17.(1) 第三周期 IA
(2) H2SO4 H2O
(3)Na> S >O
(4)2Na2O2+2H2O= 4NaOH + O2↑
(5)H2O2+ SO2=H2SO4
【分析】A元素的原子核内只有1个质子,则A为H,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为,则B的最高化合价为+5,位于周期表中第ⅤA族,应为N,C元素原子的最外层电子数比次外层电子数多4,则原子核外电子排布为2、6,应为O,C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C和D2C2,则D的化合价为+1,应为Na,C、E同主族,则E为S。
解析:(1)D为Na,核电荷数为11,在周期表中的位置为第三周期I A族,B为N,原子结构示意图为;
(2)E为S,其最高价氧化物对应的水化物是;同主族元素对应氢化物稳定性逐渐降低,所以氢化物较稳定的是H2O;
(3)同主族元素的原子半径从上到下逐渐增大,同周期元素的原子半径从左到右逐渐减小,所以原子半径大小关系为;
(4)D2C2为Na2O2,C的气态氢化物为H2O,反应方程式为;
(5)H2O2与 SO2反应方程式为。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
