1.3氧化还原反应同步练习题高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 1.3氧化还原反应同步练习题高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 449.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:49:18 | ||
图片预览




文档简介
1.3 氧化还原反应 同步练习题
一、选择题
1.关于反应,下列说法正确的是
A.生成1mol的ZnO,共转移5mol电子 B.只做氧化剂
C.该反应中氧化产物只有ZnO D.每产生,生成
2.关于反应Zn+(极稀),下列说法正确的是
A.生成1 mol ,转移个电子
B.氧化剂和还原剂之比为1∶2
C.是还原产物
D.该反应只体现了硝酸的强氧化性
3.当溶液中X2O与MnO离子个数比为5∶2时,溶液中X2O离子中X元素恰好被氧化为较低价态,同时生成Mn2+,则反应后X 元素的化合价为
A.+1 B.+2 C.+3 D.+4
4.下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
实验 Na在坩埚中加热燃烧 将NaOH溶液滴入溶液中 将湿润的红色布条放入盛有的集气瓶中 向溶液中加入足量铁粉
现象 有淡黄色固体生成 有红褐色沉淀生成 红色布条褪色 溶液由棕黄色变为浅绿色
A.A B.B C.C D.D
5.反应2Mg+CO22MgO+C中,还原剂是
A.Mg B.CO2 C.MgO D.C
6.是大气污染的主要元凶之一,工业上常用碱液吸收法来处理:,使废气得以净化,下列有关说法正确的是
A.NaOH在该反应中作氧化剂
B.在反应过程中仅失去电子
C.反应后溶液的pH增大
D.上述反应中还原剂与氧化剂的物质的量之比为1∶1
7.苹果汁中含有,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
A.碱性 B.氧化性 C.还原性 D.酸性
8.磷酸亚铁锂(,简称LFP),是一种锂离子电池电极材料,主要用于各种锂离子电池。可通过以下反应制得:。下列说法正确的是
A.CO为还原产物
B.是造成酸雨的主要污染物之一
C.生成1mol气体时,转移的电子的物质的量为1mol
D.中的阴阳离子个数之比为
9.从海水中获取溴单质涉及反应:。下列有关该反应的说法正确的是
A.SO2发生还原反应 B.Br2是还原剂
C.Br2得到电子 D.中的氧元素被氧化
10.尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室中可通过如下反应制备:,下列关于该反应的说法错误的是
A.MnO2为氧化剂,O2为氧化产物
B.反应中Mn元素被还原,O元素部分被氧化
C.每制备1molLiMn2O4,反应转移
D.为节能减排,用NaOH溶液吸收CO2转化为正盐,理论上消耗的MnO2和NaOH的物质的量之比为4:1
11.周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3,下列有关该反应的说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.由此反应可知,化合反应一定是氧化还原反应
D.Cu是还原剂,在反应中化合价升高,失去4个电子,发生氧化反应
12.下列反应中,H2O既作氧化剂又作还原剂的是
A.SO2+H2O=H2SO4 B.3Fe+4H2OFe3O4+4H2
C.C+H2OCO+H2 D.2H2O2H2↑ +O2 ↑
13.高铁酸钠(Na2FeO4)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成Fe(OH)3能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
。下列说法错误的是
A.该反应中氧化剂和还原剂的物质的量之比为3∶2
B.碱性条件下NaClO氧化性强于Na2FeO4
C.每生成1mol Na2FeO4转移6mol电子
D.在水处理中,Na2FeO4兼具消毒和净水两种功能
14.在二氧化氮与水的反应中,氧化剂与还原剂的质量之比为
A. B. C. D.
15.下列反应必须加入氧化剂且一步反应就能完成的是
①N2→NO2②Al→NaAlO2③NO2→HNO3④N2→NO⑤FeCl3→FeCl2
A.①④ B.②⑤ C.②④ D.②③④
二、填空题
16.分析下列氧化还原反应,指出氧化剂和还原剂、氧化产物和还原产物。
(1)氧化还原反应的本质是_______
(2)CuO+COCu+CO2中,氧化剂:_______,还原剂:_______,氧化产物:_______,还原产物:_______。
(3)2H2S+SO2=3S↓+2H2O,氧化剂是_______,还原剂是_______;发生氧化反应的是_______,被还原的元素是_______。
17.回答下列问题
(1)鉴别可选用的物质有①水、②淀粉试纸、③淀粉、④白酒、⑤食醋。根据上述反应,你认为必须选用的物质有_______(填序号)。
(2)某厂废液中,含有的,直接排放会造成污染,下列试剂能使转化为的是_______(填字母)。
A. B. C. D.浓
(3)已知反应。若该反应过程中转移,则生成标准状况下的体积为_______L。
三、计算题
18.爆竹中的化学原料是黑火药,其主要成分是硝石(硝酸钾)、硫磺及木炭。三者按一定比例混合点燃后生成硫化物、氮气和二氧化碳。
(1)请写出反应的化学方程式,并用双线桥标出该反应中电子转移的方向和数目__。
(2)该反应中氧化剂是__,氧化产物是__,当生成2 mol K2S时,转移电子数为__。
四、元素或物质推断题
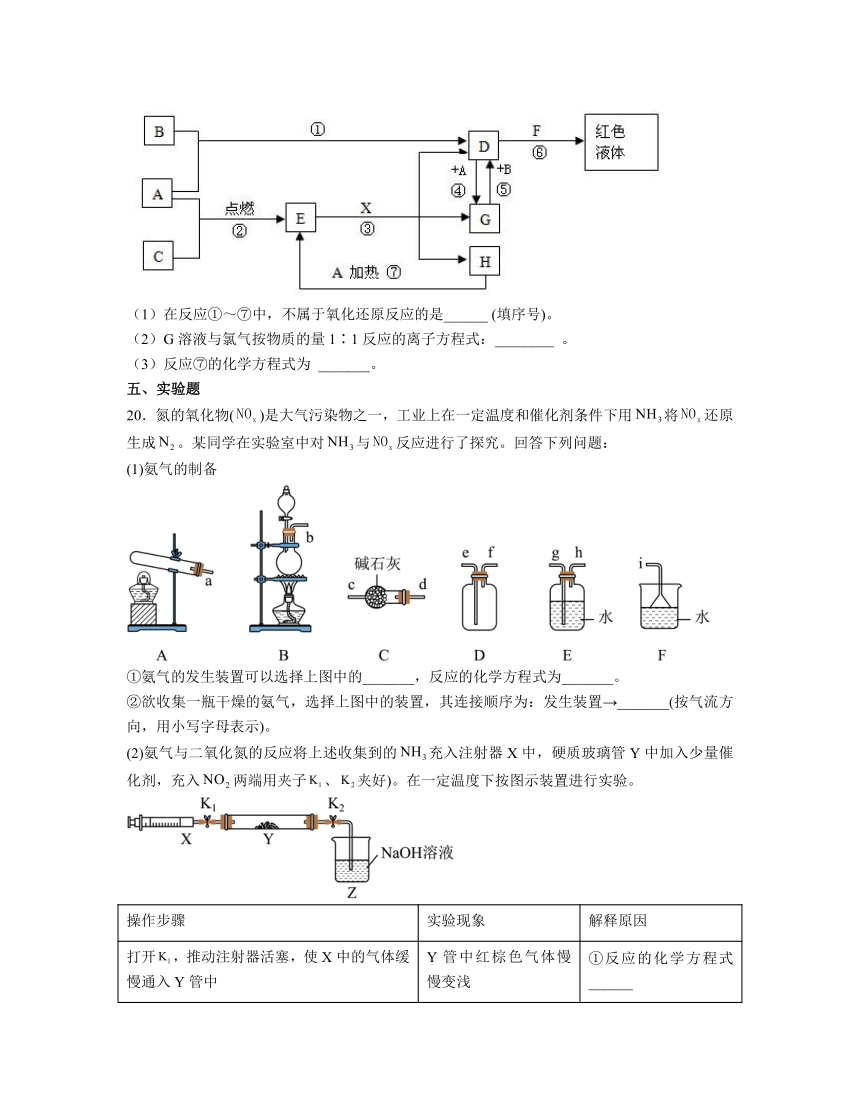
19.A、B、C均为中学化学常见的单质, 其中一种是常见金属,通常状况下,A为固体,B为深红棕色液体,C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色晶体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
(1)在反应①~⑦中,不属于氧化还原反应的是______ (填序号)。
(2)G溶液与氯气按物质的量1∶1反应的离子方程式:________ 。
(3)反应⑦的化学方程式为 _______。
五、实验题
20.氮的氧化物()是大气污染物之一,工业上在一定温度和催化剂条件下用将还原生成。某同学在实验室中对与反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的_______,反应的化学方程式为_______。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入两端用夹子、夹好)。在一定温度下按图示装置进行实验。
操作步骤 实验现象 解释原因
打开,推动注射器活塞,使X中的气体缓慢通入Y管中 Y管中红棕色气体慢慢变浅 ①反应的化学方程式______
将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝集
打开 ②______ ③______
【参考答案】
一、选择题
1.A
【分析】该反应中铵根中N元素化合价升高,Zn元素化合价也升高,硝酸根中N元素化合价降低。
解析:A.当生成1mol的ZnO时,有1mol的硝酸根得电子转为氮气,所以转移5mol电子,A项正确;
B.该反应中氧化剂为硝酸根,还原剂有铵根和单质锌,所以既作氧化剂又作还原剂,B错误;
C.、Zn都被氧化,所以N2、ZnO都氧化产物,C错误;
D.没说明是标况下,无法计算,D错误;
故选A。
2.A
【分析】反应中Zn失电子,做还原剂,硝酸一部分表现酸性,一部分表现氧化性。
解析:A.N元素由+5价降低到-3价,生成1 mol ,转移个电子,A正确;
B.氧化剂是硝酸,还原剂是锌,1mol硝酸做氧化剂得8mol电子,1mol锌做还原剂失2mol电子,根据得失电子守恒,氧化剂和还原剂之比为1∶4,B错误;
C.是氧化产物,C错误;
D.该反应体现了硝酸的强氧化性和酸性,D错误;
故正确答案选A。
3.D
解析:X2O离子中X元素恰好被氧化,则MnO是氧化剂,Mn2+是还原产物,X2O是还原剂,假设反应后X的化合价为x,则根据得失电子守恒有5×2×(x-3)=2×1×5,解得x=+4,即反应后X 元素的化合价为+4;
答案选D。
4.B
解析:A.Na在坩埚中加热燃烧,发生反应,是氧化还原反应,A错误;
B.溶液滴入溶液,是复分解反应,B正确;
C.将湿润的红色布条放入盛有的集气瓶中,与水反应,的强氧化性使有色布条褪色,与氧化还原反应有关,C错误;
D.向溶液中加入足量铁粉,发生反应:,使氧化还原反应,D错误;
故选B。
5.A
解析:该反应中,镁元素化合价由镁单质中0价升高到氧化镁中+2价,因此Mg失电子做还原剂,碳元素由二氧化碳中的+4价降低到碳单质中的0价,因此二氧化碳得电子做氧化剂,A正确;
故选A。
6.D
解析:A.NaOH在反应中没有元素发生化合价变化,不是氧化剂,A错误;
B.NO2在反应过程中失电子也得电子,B错误;
C.反应消耗NaOH溶液,pH减小,C错误;
D.NO2在反应过程中既作还原剂又作氧化剂,还原剂与氧化剂的物质的量之比为1∶1,D正确;
故选D。
7.C
解析:苹果汁中含有,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色,说明被氧化为,若榨汁时加入维生素C,可以防止这种现象发生,即防止被氧化,这说明维生素C有还原性,故C正确;
故选C。
8.C
解析:A.,该反应中C元素由0价升至价,故C失电子,作还原剂,被氧化,CO为氧化产物,故A错误;
B.不是造成酸雨的主要污染物之一,故B错误;
C.由方程式可知生成1molCO转移2mol电子。题目中生成1mol气体为CO、的混合气体,其中CO和各为0.5mol,所以转移1mol个电子,故C正确;
D.中有、、,所以中阴阳离子个数之比为,故D错误;
故答案选C。
9.C
解析:A.由题干反应方程式可知,SO2中硫元素化合价由+4价升高到+6价,化合价升高被氧化,故SO2发生氧化反应,A错误;
B.由题干反应方程式可知,Br的化合价由0价降低到-1价,被还原,故Br2是氧化剂,B错误;
C.由题干反应方程式可知,Br的化合价由0价降低到-1价,被还原,Br2得到电子,C正确;
D.由题干反应方程式可知,H2O中的氧元素的化合价未改变,故H2O既不被氧化也不被还原,D错误;
故答案为:C。
10.D
解析:A.该反应中Mn元素化合价由+4降至+,被还原,MnO2是氧化剂,部分O元素化合价从-1升至0价被氧化生成O2,O2为氧化产物,A正确;
B.根据Mn、O元素化合价变化可知反应中Mn元素被还原,O元素部分被氧化,B正确;
C.根据方程式,每制备4molLiMn2O4,反应转移电子,因此每制备1molLiMn2O4,反应转移,C正确;
D.根据方程式,每生成消耗,根据原子守恒,每转化成正盐,需要消耗,因此理论上消耗的MnO2和NaOH的物质的量之比为2:1,D错误;
故选D。
11.C
【分析】2Cu+O2+CO2+H2O=Cu2(OH)2CO3中,Cu元素的化合价升高被氧化,氧气中O元素的化合价降低被还原;
解析:A.反应中存在元素化合价的变化,其中Cu元素的化合价升高,氧气中O元素的化合价降低,属于氧化还原反应,变价的只有Cu、O两种元素,故A正确;
B.该反应中铜失去电子,发生氧化反应,O2得到电子,发生还原反应,故B正确;
C.化合反应不一定是还原反应,例如氧化钠与水生成氢氧化钠为非氧化还原反应,故C错误;
D.Cu是还原剂,在反应中化合价升高,失去4个电子,发生氧化反应,故D正确。
故选C。
12.D
解析:A.H2O中的H、O元素化合价没有变化,A错误;
B.H元素化合价降低,只作氧化剂,B错误;
C.H元素化合价降低,只作氧化剂,C错误;
D.H元素化合价降低,O元素化合价升高,D正确;
故答案为:D。
13.C
解析:A.该反应中,NaClO是氧化剂,Fe(OH)3是还原剂,氧化剂和还原剂的物质的量之比为3∶2,A正确;
B.反应中,NaClO是氧化剂,Na2FeO4是氧化产物,则在碱性条件下,NaClO氧化性强于Na2FeO4,B正确;
C.从反应式中可以得出如下关系式,Na2FeO4——3e-,则每生成1mol Na2FeO4转移3mol电子,C错误;
D.在水处理中,Na2FeO4表现强氧化性,具有消毒功能,生成的Fe(OH)3胶体能吸附水中的悬浮颗粒物,具有净水功能,D正确;
故选C。
14.B
解析:二氧化氮与水的反应生成硝酸和一氧化氮,,1分子二氧化氮中氮元素化合价降低,作为氧化剂;2分子二氧化氮中氮元素化合价升高,作为还原剂;故氧化剂与还原剂的质量之比为1:2。
15.C
解析:该题有两个要求:(1)必须加入氧化剂;(2)一步反应就能完成。反应①、②、③、④从化合价角度来看都升高,但反应①N2→NO2不能一步反应就完成;而反应③NO2→HNO3虽然氮的化合价升高,但不加氧化剂也能实现,如3NO2+H2O=2HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应②Al→NaAlO2必须加入氧化剂且一步反应就能完成2Al+2H2O+2NaOH=2NaAlO2+3H2↑,④N2→NO必须加入氧化剂且一步反应就能完成N2+O22NO;
答案选C。
二、填空题
16.(1)有电子转移或共用电子对偏移
(2) CuO CO CO2 Cu
(3) SO2 H2S S S
解析:(1)氧化还原反应的本质是有电子转移或共用电子对偏移;
(2)在反应CuO+COCu+CO2中,Cu元素化合价由反应前CuO中的+2价变为反应后Cu单质的0价,化合价降低,得到电子被还原,所以CuO为氧化剂,Cu是还原产物;C元素化合价由反应前CO中的+2价变为反应后CO2中的+4价,化合价升高,失去电子被氧化,所以CO是还原剂,CO2是氧化产物;
(3)在反应2H2S+SO2=3S↓+2H2O,S元素化合价由反应前SO2中的+4价变为反应后S单质的0价,化合价降低,得到电子被还原,所以SO2为氧化剂,S是还原产物;S元素化合价由反应前H2S中的-2价变为反应后S单质的0价,化合价升高,失去电子被氧化,所以H2S是还原剂,S是氧化产物。
17.(1)②⑤(2)B(3)11.2
解析:(1)水、淀粉、白酒与都不反应,所以无明显现象;与必须在酸性条件下才能反应得到,食醋会电离出氢离子,故必须选用的物质有②⑤;
(2),被还原,必须加还原剂,故选;
(3)在反应中溶解转移电子,同时生成。若反应过程中转移,则生成标准状况下的体积为。
三、计算题
18. S、KNO3 CO2 24NA
【分析】硝石(硝酸钾)、硫磺及木炭按一定比例混合点燃后生成硫化物、氮气和二氧化碳,反应方程式为S+2KNO3+3C═K2S+N2↑+3CO2↑,该反应中,硫元素化合价由0价变为﹣2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,以此解答。
解析:(1)硝石(硝酸钾)、硫磺及木炭按一定比例混合点燃后生成硫化物、氮气和二氧化碳,反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到﹣2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,当1个硫原子参加反应时,反应中3个C失去电子,该反应转移电子总数为12e﹣,则用双桥法标出电子转移的方向及数目为;
(2)反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到﹣2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,还原剂对应的氧化产物为CO2;当1个硫原子参加反应时,反应中3个C失去电子,生成1个K2S,该反应转移电子总数为12e﹣,则当生成2mol K2S时,转移电子数为24NA;
故答案为:S、KNO3;24NA。
四、元素或物质推断题
19. ③⑥ 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- 3Fe+4H2OFe3O4+4H2
【分析】根据转化关系的特征和物质性质分析判断,单质A和H反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中D、G之间可以实现相互转化,说明A为变价金属Fe,铁和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,根据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,H为H2O;根据G+B=D分析判断B是强氧化剂,常温下为液体的氧化剂单质判断为:Br2,所以推断D为FeBr3,得到G为FeBr2,X为HBr,据以上分析解答。
解析:(1) 通过以上分析知:③⑥的反应中各元素的化合价不变,所以不属于氧化还原反应,故选③⑥;故为③⑥。
(2)G溶液为FeBr2,还原性:Fe2+>Br-,1mol Fe2+完全被氧化转移电子1mol,1mol Br-全完被氧化转移电子1mol;因此Fe2+、Br-、Cl2按1:1:1发生氧化还原反应,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-;故为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-。
(3)铁与水蒸气高温下反应生成四氧化三铁和氢气,化学方程式为:3Fe+4H2OFe3O4+4H2;故为3Fe+4H2OFe3O4+4H2。
【点睛】根据还原性Fe2+>Br-规律可知:FeBr2和少量Cl2反应:2Fe2++Cl2=2Fe3++2Cl-;FeBr2和足量的Cl2反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-;FeBr2和Cl2(1:1)反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-。
五、实验题
20.(1) A(或B) (或B) d→c→f→e→i
(2) Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
解析:(1)①实验室可用氢氧化钙固体和氯化铵固体加热条件下反应生成氨气,也可用加热浓氨水的方式制取氨气,故发生装置可以选择上图中的A或B。反应的化学方程式分别为(或B)。
②欲收集一瓶干燥的氨气,生成的氨气中含有水蒸气,需要先干燥,故先连接d,氨气密度小于空气,采用向下排空气法收集,故c连接f,剩余的氨气需要进行尾气处理,氨气极易溶于水需进行防倒吸处理,则e连接i,故连接顺序为d→c→f→e→i。
(2)X中的NH3缓慢通入Y中,在催化剂作用下与NO2反应生成N2和H2O,导致Y管中红棕色气体慢慢变浅,化学方程式为。
氨气与二氧化氮的反应是气体体积减小的反应,随着反应进行,Y中压强减小,打开K2,Z中的NaOH溶液在大气压作用下进入导管中,产生倒吸现象。
一、选择题
1.关于反应,下列说法正确的是
A.生成1mol的ZnO,共转移5mol电子 B.只做氧化剂
C.该反应中氧化产物只有ZnO D.每产生,生成
2.关于反应Zn+(极稀),下列说法正确的是
A.生成1 mol ,转移个电子
B.氧化剂和还原剂之比为1∶2
C.是还原产物
D.该反应只体现了硝酸的强氧化性
3.当溶液中X2O与MnO离子个数比为5∶2时,溶液中X2O离子中X元素恰好被氧化为较低价态,同时生成Mn2+,则反应后X 元素的化合价为
A.+1 B.+2 C.+3 D.+4
4.下列实验中的颜色变化,与氧化还原反应无关的是
A B C D
实验 Na在坩埚中加热燃烧 将NaOH溶液滴入溶液中 将湿润的红色布条放入盛有的集气瓶中 向溶液中加入足量铁粉
现象 有淡黄色固体生成 有红褐色沉淀生成 红色布条褪色 溶液由棕黄色变为浅绿色
A.A B.B C.C D.D
5.反应2Mg+CO22MgO+C中,还原剂是
A.Mg B.CO2 C.MgO D.C
6.是大气污染的主要元凶之一,工业上常用碱液吸收法来处理:,使废气得以净化,下列有关说法正确的是
A.NaOH在该反应中作氧化剂
B.在反应过程中仅失去电子
C.反应后溶液的pH增大
D.上述反应中还原剂与氧化剂的物质的量之比为1∶1
7.苹果汁中含有,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
A.碱性 B.氧化性 C.还原性 D.酸性
8.磷酸亚铁锂(,简称LFP),是一种锂离子电池电极材料,主要用于各种锂离子电池。可通过以下反应制得:。下列说法正确的是
A.CO为还原产物
B.是造成酸雨的主要污染物之一
C.生成1mol气体时,转移的电子的物质的量为1mol
D.中的阴阳离子个数之比为
9.从海水中获取溴单质涉及反应:。下列有关该反应的说法正确的是
A.SO2发生还原反应 B.Br2是还原剂
C.Br2得到电子 D.中的氧元素被氧化
10.尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室中可通过如下反应制备:,下列关于该反应的说法错误的是
A.MnO2为氧化剂,O2为氧化产物
B.反应中Mn元素被还原,O元素部分被氧化
C.每制备1molLiMn2O4,反应转移
D.为节能减排,用NaOH溶液吸收CO2转化为正盐,理论上消耗的MnO2和NaOH的物质的量之比为4:1
11.周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3,下列有关该反应的说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.由此反应可知,化合反应一定是氧化还原反应
D.Cu是还原剂,在反应中化合价升高,失去4个电子,发生氧化反应
12.下列反应中,H2O既作氧化剂又作还原剂的是
A.SO2+H2O=H2SO4 B.3Fe+4H2OFe3O4+4H2
C.C+H2OCO+H2 D.2H2O2H2↑ +O2 ↑
13.高铁酸钠(Na2FeO4)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成Fe(OH)3能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
。下列说法错误的是
A.该反应中氧化剂和还原剂的物质的量之比为3∶2
B.碱性条件下NaClO氧化性强于Na2FeO4
C.每生成1mol Na2FeO4转移6mol电子
D.在水处理中,Na2FeO4兼具消毒和净水两种功能
14.在二氧化氮与水的反应中,氧化剂与还原剂的质量之比为
A. B. C. D.
15.下列反应必须加入氧化剂且一步反应就能完成的是
①N2→NO2②Al→NaAlO2③NO2→HNO3④N2→NO⑤FeCl3→FeCl2
A.①④ B.②⑤ C.②④ D.②③④
二、填空题
16.分析下列氧化还原反应,指出氧化剂和还原剂、氧化产物和还原产物。
(1)氧化还原反应的本质是_______
(2)CuO+COCu+CO2中,氧化剂:_______,还原剂:_______,氧化产物:_______,还原产物:_______。
(3)2H2S+SO2=3S↓+2H2O,氧化剂是_______,还原剂是_______;发生氧化反应的是_______,被还原的元素是_______。
17.回答下列问题
(1)鉴别可选用的物质有①水、②淀粉试纸、③淀粉、④白酒、⑤食醋。根据上述反应,你认为必须选用的物质有_______(填序号)。
(2)某厂废液中,含有的,直接排放会造成污染,下列试剂能使转化为的是_______(填字母)。
A. B. C. D.浓
(3)已知反应。若该反应过程中转移,则生成标准状况下的体积为_______L。
三、计算题
18.爆竹中的化学原料是黑火药,其主要成分是硝石(硝酸钾)、硫磺及木炭。三者按一定比例混合点燃后生成硫化物、氮气和二氧化碳。
(1)请写出反应的化学方程式,并用双线桥标出该反应中电子转移的方向和数目__。
(2)该反应中氧化剂是__,氧化产物是__,当生成2 mol K2S时,转移电子数为__。
四、元素或物质推断题
19.A、B、C均为中学化学常见的单质, 其中一种是常见金属,通常状况下,A为固体,B为深红棕色液体,C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色晶体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。
(1)在反应①~⑦中,不属于氧化还原反应的是______ (填序号)。
(2)G溶液与氯气按物质的量1∶1反应的离子方程式:________ 。
(3)反应⑦的化学方程式为 _______。
五、实验题
20.氮的氧化物()是大气污染物之一,工业上在一定温度和催化剂条件下用将还原生成。某同学在实验室中对与反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的_______,反应的化学方程式为_______。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入两端用夹子、夹好)。在一定温度下按图示装置进行实验。
操作步骤 实验现象 解释原因
打开,推动注射器活塞,使X中的气体缓慢通入Y管中 Y管中红棕色气体慢慢变浅 ①反应的化学方程式______
将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝集
打开 ②______ ③______
【参考答案】
一、选择题
1.A
【分析】该反应中铵根中N元素化合价升高,Zn元素化合价也升高,硝酸根中N元素化合价降低。
解析:A.当生成1mol的ZnO时,有1mol的硝酸根得电子转为氮气,所以转移5mol电子,A项正确;
B.该反应中氧化剂为硝酸根,还原剂有铵根和单质锌,所以既作氧化剂又作还原剂,B错误;
C.、Zn都被氧化,所以N2、ZnO都氧化产物,C错误;
D.没说明是标况下,无法计算,D错误;
故选A。
2.A
【分析】反应中Zn失电子,做还原剂,硝酸一部分表现酸性,一部分表现氧化性。
解析:A.N元素由+5价降低到-3价,生成1 mol ,转移个电子,A正确;
B.氧化剂是硝酸,还原剂是锌,1mol硝酸做氧化剂得8mol电子,1mol锌做还原剂失2mol电子,根据得失电子守恒,氧化剂和还原剂之比为1∶4,B错误;
C.是氧化产物,C错误;
D.该反应体现了硝酸的强氧化性和酸性,D错误;
故正确答案选A。
3.D
解析:X2O离子中X元素恰好被氧化,则MnO是氧化剂,Mn2+是还原产物,X2O是还原剂,假设反应后X的化合价为x,则根据得失电子守恒有5×2×(x-3)=2×1×5,解得x=+4,即反应后X 元素的化合价为+4;
答案选D。
4.B
解析:A.Na在坩埚中加热燃烧,发生反应,是氧化还原反应,A错误;
B.溶液滴入溶液,是复分解反应,B正确;
C.将湿润的红色布条放入盛有的集气瓶中,与水反应,的强氧化性使有色布条褪色,与氧化还原反应有关,C错误;
D.向溶液中加入足量铁粉,发生反应:,使氧化还原反应,D错误;
故选B。
5.A
解析:该反应中,镁元素化合价由镁单质中0价升高到氧化镁中+2价,因此Mg失电子做还原剂,碳元素由二氧化碳中的+4价降低到碳单质中的0价,因此二氧化碳得电子做氧化剂,A正确;
故选A。
6.D
解析:A.NaOH在反应中没有元素发生化合价变化,不是氧化剂,A错误;
B.NO2在反应过程中失电子也得电子,B错误;
C.反应消耗NaOH溶液,pH减小,C错误;
D.NO2在反应过程中既作还原剂又作氧化剂,还原剂与氧化剂的物质的量之比为1∶1,D正确;
故选D。
7.C
解析:苹果汁中含有,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色,说明被氧化为,若榨汁时加入维生素C,可以防止这种现象发生,即防止被氧化,这说明维生素C有还原性,故C正确;
故选C。
8.C
解析:A.,该反应中C元素由0价升至价,故C失电子,作还原剂,被氧化,CO为氧化产物,故A错误;
B.不是造成酸雨的主要污染物之一,故B错误;
C.由方程式可知生成1molCO转移2mol电子。题目中生成1mol气体为CO、的混合气体,其中CO和各为0.5mol,所以转移1mol个电子,故C正确;
D.中有、、,所以中阴阳离子个数之比为,故D错误;
故答案选C。
9.C
解析:A.由题干反应方程式可知,SO2中硫元素化合价由+4价升高到+6价,化合价升高被氧化,故SO2发生氧化反应,A错误;
B.由题干反应方程式可知,Br的化合价由0价降低到-1价,被还原,故Br2是氧化剂,B错误;
C.由题干反应方程式可知,Br的化合价由0价降低到-1价,被还原,Br2得到电子,C正确;
D.由题干反应方程式可知,H2O中的氧元素的化合价未改变,故H2O既不被氧化也不被还原,D错误;
故答案为:C。
10.D
解析:A.该反应中Mn元素化合价由+4降至+,被还原,MnO2是氧化剂,部分O元素化合价从-1升至0价被氧化生成O2,O2为氧化产物,A正确;
B.根据Mn、O元素化合价变化可知反应中Mn元素被还原,O元素部分被氧化,B正确;
C.根据方程式,每制备4molLiMn2O4,反应转移电子,因此每制备1molLiMn2O4,反应转移,C正确;
D.根据方程式,每生成消耗,根据原子守恒,每转化成正盐,需要消耗,因此理论上消耗的MnO2和NaOH的物质的量之比为2:1,D错误;
故选D。
11.C
【分析】2Cu+O2+CO2+H2O=Cu2(OH)2CO3中,Cu元素的化合价升高被氧化,氧气中O元素的化合价降低被还原;
解析:A.反应中存在元素化合价的变化,其中Cu元素的化合价升高,氧气中O元素的化合价降低,属于氧化还原反应,变价的只有Cu、O两种元素,故A正确;
B.该反应中铜失去电子,发生氧化反应,O2得到电子,发生还原反应,故B正确;
C.化合反应不一定是还原反应,例如氧化钠与水生成氢氧化钠为非氧化还原反应,故C错误;
D.Cu是还原剂,在反应中化合价升高,失去4个电子,发生氧化反应,故D正确。
故选C。
12.D
解析:A.H2O中的H、O元素化合价没有变化,A错误;
B.H元素化合价降低,只作氧化剂,B错误;
C.H元素化合价降低,只作氧化剂,C错误;
D.H元素化合价降低,O元素化合价升高,D正确;
故答案为:D。
13.C
解析:A.该反应中,NaClO是氧化剂,Fe(OH)3是还原剂,氧化剂和还原剂的物质的量之比为3∶2,A正确;
B.反应中,NaClO是氧化剂,Na2FeO4是氧化产物,则在碱性条件下,NaClO氧化性强于Na2FeO4,B正确;
C.从反应式中可以得出如下关系式,Na2FeO4——3e-,则每生成1mol Na2FeO4转移3mol电子,C错误;
D.在水处理中,Na2FeO4表现强氧化性,具有消毒功能,生成的Fe(OH)3胶体能吸附水中的悬浮颗粒物,具有净水功能,D正确;
故选C。
14.B
解析:二氧化氮与水的反应生成硝酸和一氧化氮,,1分子二氧化氮中氮元素化合价降低,作为氧化剂;2分子二氧化氮中氮元素化合价升高,作为还原剂;故氧化剂与还原剂的质量之比为1:2。
15.C
解析:该题有两个要求:(1)必须加入氧化剂;(2)一步反应就能完成。反应①、②、③、④从化合价角度来看都升高,但反应①N2→NO2不能一步反应就完成;而反应③NO2→HNO3虽然氮的化合价升高,但不加氧化剂也能实现,如3NO2+H2O=2HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应②Al→NaAlO2必须加入氧化剂且一步反应就能完成2Al+2H2O+2NaOH=2NaAlO2+3H2↑,④N2→NO必须加入氧化剂且一步反应就能完成N2+O22NO;
答案选C。
二、填空题
16.(1)有电子转移或共用电子对偏移
(2) CuO CO CO2 Cu
(3) SO2 H2S S S
解析:(1)氧化还原反应的本质是有电子转移或共用电子对偏移;
(2)在反应CuO+COCu+CO2中,Cu元素化合价由反应前CuO中的+2价变为反应后Cu单质的0价,化合价降低,得到电子被还原,所以CuO为氧化剂,Cu是还原产物;C元素化合价由反应前CO中的+2价变为反应后CO2中的+4价,化合价升高,失去电子被氧化,所以CO是还原剂,CO2是氧化产物;
(3)在反应2H2S+SO2=3S↓+2H2O,S元素化合价由反应前SO2中的+4价变为反应后S单质的0价,化合价降低,得到电子被还原,所以SO2为氧化剂,S是还原产物;S元素化合价由反应前H2S中的-2价变为反应后S单质的0价,化合价升高,失去电子被氧化,所以H2S是还原剂,S是氧化产物。
17.(1)②⑤(2)B(3)11.2
解析:(1)水、淀粉、白酒与都不反应,所以无明显现象;与必须在酸性条件下才能反应得到,食醋会电离出氢离子,故必须选用的物质有②⑤;
(2),被还原,必须加还原剂,故选;
(3)在反应中溶解转移电子,同时生成。若反应过程中转移,则生成标准状况下的体积为。
三、计算题
18. S、KNO3 CO2 24NA
【分析】硝石(硝酸钾)、硫磺及木炭按一定比例混合点燃后生成硫化物、氮气和二氧化碳,反应方程式为S+2KNO3+3C═K2S+N2↑+3CO2↑,该反应中,硫元素化合价由0价变为﹣2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,以此解答。
解析:(1)硝石(硝酸钾)、硫磺及木炭按一定比例混合点燃后生成硫化物、氮气和二氧化碳,反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到﹣2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,当1个硫原子参加反应时,反应中3个C失去电子,该反应转移电子总数为12e﹣,则用双桥法标出电子转移的方向及数目为;
(2)反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到﹣2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,还原剂对应的氧化产物为CO2;当1个硫原子参加反应时,反应中3个C失去电子,生成1个K2S,该反应转移电子总数为12e﹣,则当生成2mol K2S时,转移电子数为24NA;
故答案为:S、KNO3;24NA。
四、元素或物质推断题
19. ③⑥ 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- 3Fe+4H2OFe3O4+4H2
【分析】根据转化关系的特征和物质性质分析判断,单质A和H反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中D、G之间可以实现相互转化,说明A为变价金属Fe,铁和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,根据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,H为H2O;根据G+B=D分析判断B是强氧化剂,常温下为液体的氧化剂单质判断为:Br2,所以推断D为FeBr3,得到G为FeBr2,X为HBr,据以上分析解答。
解析:(1) 通过以上分析知:③⑥的反应中各元素的化合价不变,所以不属于氧化还原反应,故选③⑥;故为③⑥。
(2)G溶液为FeBr2,还原性:Fe2+>Br-,1mol Fe2+完全被氧化转移电子1mol,1mol Br-全完被氧化转移电子1mol;因此Fe2+、Br-、Cl2按1:1:1发生氧化还原反应,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-;故为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-。
(3)铁与水蒸气高温下反应生成四氧化三铁和氢气,化学方程式为:3Fe+4H2OFe3O4+4H2;故为3Fe+4H2OFe3O4+4H2。
【点睛】根据还原性Fe2+>Br-规律可知:FeBr2和少量Cl2反应:2Fe2++Cl2=2Fe3++2Cl-;FeBr2和足量的Cl2反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-;FeBr2和Cl2(1:1)反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-。
五、实验题
20.(1) A(或B) (或B) d→c→f→e→i
(2) Z中NaOH溶液产生倒吸现象 反应后气体分子数减少,Y管中压强小于外压
解析:(1)①实验室可用氢氧化钙固体和氯化铵固体加热条件下反应生成氨气,也可用加热浓氨水的方式制取氨气,故发生装置可以选择上图中的A或B。反应的化学方程式分别为(或B)。
②欲收集一瓶干燥的氨气,生成的氨气中含有水蒸气,需要先干燥,故先连接d,氨气密度小于空气,采用向下排空气法收集,故c连接f,剩余的氨气需要进行尾气处理,氨气极易溶于水需进行防倒吸处理,则e连接i,故连接顺序为d→c→f→e→i。
(2)X中的NH3缓慢通入Y中,在催化剂作用下与NO2反应生成N2和H2O,导致Y管中红棕色气体慢慢变浅,化学方程式为。
氨气与二氧化氮的反应是气体体积减小的反应,随着反应进行,Y中压强减小,打开K2,Z中的NaOH溶液在大气压作用下进入导管中,产生倒吸现象。
