5.1硫及其化合物同步练习题高一下学期人教版(2019)化学必修第二册(含解析)
文档属性
| 名称 | 5.1硫及其化合物同步练习题高一下学期人教版(2019)化学必修第二册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 666.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:49:37 | ||
图片预览




文档简介
5.1 硫及其化合物 同步练习题
一、单选题
1.下列“类比”合理的是
A.与反应生成,则与反应生成
B.在足量的中燃烧生成,则在足量的中燃烧生成
C.与水反应生成和,则与水反应生成和
D.与反应生成和,则与反应生成和
2.下图装置可用于检验木炭与浓硫酸反应的产物,下列说法正确的是
A.①③④②可以检出,检不出、
B.①④③②可以检出、、
C.①④②③可以检出、,检不出
D.①②③④可以检出,检不出、
3.向50mL18mol/L的浓硫酸中加入足量的铜片并加热,产生SO2(标准状况)6.72L,被还原的硫酸的物质的量为( )
A.0.9mol B.0.3mol C.0.6mol D.0.45mol
4.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.浓硫酸可用来干燥某些气体(脱水性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.在加热条件下铜与浓硫酸反应(氧化性、酸性)
5.S2Cl2常用于制作橡胶的粘结剂,S2Cl2分子中各原子最外层均有8个电子,S2Cl2遇水会产生淡黄色沉淀和无色刺激性气味气体,下列说法正确的是
A.S2Cl2可使品红溶液褪色
B.S2Cl2只做还原剂
C.S2Cl2结构式为Cl-S-Cl-S
D.1mol S2Cl2与水完全反应,转移电子的个数为2NA
6.下图是硫元素的常见化合价与部分含硫物质类别的对应关系图,下列说法正确的是
A.W的浓溶液使胆矾变白,说明W的浓溶液具有吸水性
B.X与Z反应时,氧化剂与还原剂物质的量之比为
C.Z具有漂白性,所以可以使酸性高锰酸钾溶液褪色
D.X、Z都可以被W的浓溶液氧化
7.下列各组物质反应时,只能发生一个反应的是( )
A.铁与硫 B.碳与氧气
C.二氧化硫和氢氧化钠溶液 D.氯化铝溶液和氢氧化钠溶液
8.对于下列实验现象的描述中,正确的是( )
A.铁丝在氧气中燃烧,生成四氧化三铁 B.碳在氧气中燃烧,有红色的火焰
C.硫在空气中燃烧,发出明亮的蓝紫色火焰 D.红磷在空气中燃烧,生成大量白烟
9.离子检验的常用方法有三种:
检验方法 沉淀法 显色法 气体法
含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
下列离子检验的方法不合理的是
A.CO32-—气体法 B.Cl-—沉淀法 C.Fe3+—显色法 D.SO42-—气体法
10.下列有关物质性质和用途具有对应关系的是
A.二氧化硅熔点高,可用于制光导纤维
B.浓硫酸具有脱水性,可用于干燥气体
C.二氧化硫有还原性,可用于漂白纸浆
D.稀硫酸具有酸性,可用于除去铁锈
二、填空题
11.矾是各种金属(如铜、铁、锌)的硫酸盐,在生活和生产中有着重要应用。
(1)蓝矾(CuSO4 5H2O)属于的物质类别有___________(填序号)。
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4 7H2O)溶于水后水溶液显___________性,绿矾水溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式:___________。
(3)黄矾[FexS2Oy zH2O]中Fe,S的化合价分别为+3、+6,x=2时,y=___________,采用热重分析法测定该黄矾样品所含结晶水数,将样品加热到110℃时,只失掉3个结晶水,失重10.8%,黄矾的化学式为___________。
12.回答下列问题:
(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___________(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___________性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
通入Cl2后,集气瓶A中的现象是___________,集气瓶B中湿润的红色布条的现象可得出的结论是___________,最后的NaOH装置中发生的主要化学方程式是___________。
三、计算题
13.在加热条件下,6.4g铜与20mL 18mol/L硫酸(足量)反应,反应后稀释溶液至200mL。计算:
(1)生成气体的体积为_____(标准状况下)
(2)被还原的硫酸的物质的量为_____
(3)反应后溶液中硫酸根离子的物质的量浓度为_____
14.锌与100mL 18.4mol/L的浓硫酸充分反应后,锌完全溶解,同时生成混合气体31.36L (标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+ )=0.08mol/L。请计算:
(1)反应中共消耗Zn的质量为_______g;
(2)气体的物质的量之比为n____: n____=______。
四、实验题
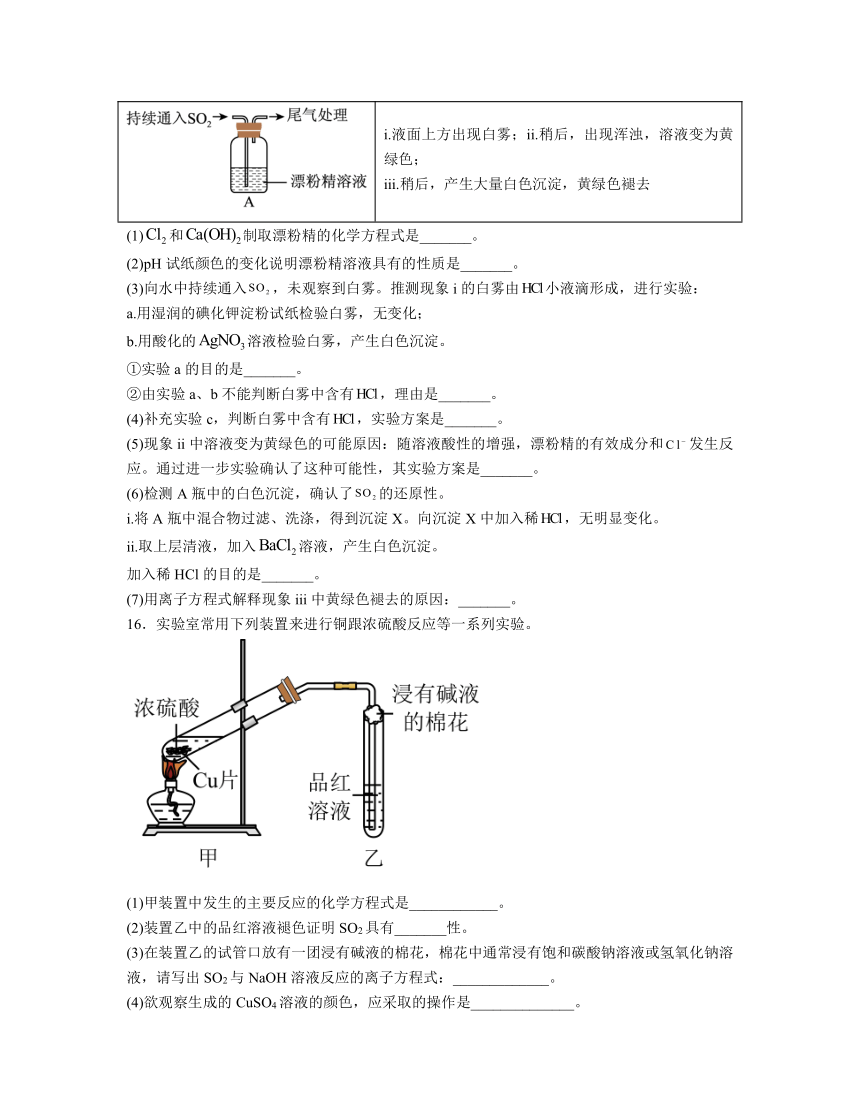
15.某学生对与漂粉精的反应进行实验探究:
操作 现象
取4g漂粉精固体,加入100mL水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色
i.液面上方出现白雾;ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去
(1)和制取漂粉精的化学方程式是_______。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_______。
(3)向水中持续通入,未观察到白雾。推测现象i的白雾由小液滴形成,进行实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的溶液检验白雾,产生白色沉淀。
①实验a的目的是_______。
②由实验a、b不能判断白雾中含有,理由是_______。
(4)补充实验c,判断白雾中含有,实验方案是_______。
(5)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和发生反应。通过进一步实验确认了这种可能性,其实验方案是_______。
(6)检测A瓶中的白色沉淀,确认了的还原性。
i.将A瓶中混合物过滤、洗涤,得到沉淀X。向沉淀X中加入稀,无明显变化。
ii.取上层清液,加入溶液,产生白色沉淀。
加入稀HCl的目的是_______。
(7)用离子方程式解释现象iii中黄绿色褪去的原因:_______。
16.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)甲装置中发生的主要反应的化学方程式是____________。
(2)装置乙中的品红溶液褪色证明SO2具有_______性。
(3)在装置乙的试管口放有一团浸有碱液的棉花,棉花中通常浸有饱和碳酸钠溶液或氢氧化钠溶液,请写出SO2与NaOH溶液反应的离子方程式:_____________。
(4)欲观察生成的CuSO4溶液的颜色,应采取的操作是______________。
五、元素或物质推断题
17.A是由两种元素组成的矿物,测定A的组成流程如图:
已知:B、D均为纯净物。请回答:
(1)写出反应A的化学式:_______。
(2)写出反应②的化学方程式:_______。
(3)写出反应③的离子方程式:_______。
(4)检验无色气体D常用的方法是:_______。
【参考答案】
一、单选题
1.A
解析:A.与反应生成,与反应生成,A正确;
B.在足量的中燃烧生成,在足量的中燃烧生成,B错误;
C.与水反应生成和,与水反应生成和,C错误;
D.与反应生成和,与反应生成,D错误;
故选A。
2.B
解析:A.据分析,①③④②可以检出,可以检出,检验出的来源无法确定,A错误;
B.据分析,①④③②可以检出、、,B正确;
C.据分析,①④②③可以检出,检不出、,二者均能使澄清石灰水变浑浊,C错误;
D.据分析,①②③④检不出、、,、均被澄清石灰水吸收,D错误;
故选B。
3.B
解析:标准状况下6.72LSO2的物质的量为:=0.3mol,铜与浓硫酸的反应中,浓硫酸被还原生成SO2,则被还原的硫酸的物质的量等于SO2的物质的量,故被还原的硫酸的物质的量为0.3mol,故选:B。
4.D
解析:A.浓硫酸具有吸水性,在空气敞口久置吸收空气中的水分导致质量变大,与脱水性无关,故A错误;
B.浓硫酸具有吸水性,可以干燥某些气体,与脱水性无关,故B错误;
C.蔗糖与浓硫酸反应中有海绵状的碳生成,这是浓硫酸的脱水性导致,故C错误;
D.加热条件下铜与浓硫酸反应生成硫酸铜、水和二氧化硫,表现了浓硫酸的酸性和强氧化性,故D正确;
综上所述答案为D。
5.A
解析:A.由分析可知,S2Cl2与水反应生成硫、二氧化硫和氯化氢,生成二氧化硫具有漂白性,可使品红溶液褪色,故A正确;
B.由分析可知,S2Cl2与水反应时硫元素的化合价即升高被氧化又降低被还原,既是反应的氧化剂又是反应的还原剂,故B错误;
C.由分析可知,S2Cl2结构式为Cl—S—S—Cl,故C错误;
D.由反应的方程式可知,2molS2Cl2与水完全反应,转移电子3mol电子,则1mol S2Cl2与水完全反应,转移电子的个数为1.5NA,故D错误;
故选A。
6.A
解析:A.W为H2SO4,浓硫酸具有吸水性,能吸收胆矾中的结晶水,使胆矾变白,A项正确;
B.X为H2S,Z为SO2,H2S与SO2反应生成S和H2O,H2S中S元素的化合价由-2价升至0价,H2S为还原剂,SO2中S元素的化合价由+4价降至0价,SO2为氧化剂,根据得失电子守恒,氧化剂与还原剂物质的量之比为1∶2,B项错误;
C.Z为SO2,SO2使酸性高锰酸钾溶液褪色时发生反应5SO2+2+2H2O=5+2Mn2++4H+,SO2表现还原性、表示漂白性,C项错误;
D.X为H2S,Z为SO2,W为H2SO4,H2S能被浓硫酸氧化,但SO2与浓硫酸不反应,即SO2不能被浓硫酸氧化,D项错误;
答案选A。
7.A
解析:A.铁与硫反应生成硫化亚铁,只能发生一个反应, A符合题意;
B.碳与氧气反应,氧气足量生成二氧化碳,氧气不足生成一氧化碳,B不符合题意;
C.二氧化硫和氢氧化钠溶液,二氧化硫少量时生成亚硫酸钠和水,二氧化硫过量产物为亚硫酸氢钠和水,C不符合题意;
D.氯化铝溶液和氢氧化钠溶液,氢氧化钠少量生成氢氧化铝沉淀,氢氧化钠过量,产物为偏铝酸钠和水,D不符合题意;
故选:A。
8.D
解析:A.铁丝在氧气中燃烧,生成四氧化三铁,是实验结论而不是实验现象,故A错误;
B.碳在氧气中燃烧,发出白光,而不是红色的火焰,故B错误;
C.硫在空气中燃烧,产生淡蓝色火焰,故C错误;
D.红磷在空气中燃烧,产生大量的白烟,故D正确;
答案选D。
9.D
解析:A.CO32-的检验方法:取样品于试管中,加入稀盐酸,若产生无色无味且能使澄清石灰水变浑浊的气体,则含有CO32-,属于气体法,A选项正确;
B.检验Cl-利用的是生成AgCl白色沉淀,属于沉淀法,B选项正确;
C.Fe3+的检验方法是滴加KSCN溶液,若出现红色,则含有Fe3+,属于显色法,C选项正确;
D.SO42-的检验利用的是生成BaSO4白色沉淀,属于沉淀法,D选项错误;选D。
10.D
解析:A.二氧化硅晶体能对光产生全反射,能传递光信号,所以二氧化硅晶体可用于制光导纤维,与其熔点无关,A错误;
B.浓硫酸具有吸水性,可用作干燥剂,B错误;
C.二氧化硫有漂白性,可用于漂白纸浆,与其还原性无关,C错误;
D.铁锈的主要成分是,可用稀硫酸除去,D正确;
故选D。
二、填空题
11.(1)bd
(2) 酸
(3) 9 Fe2S2O9 10H2O
解析:(1)CuSO4 5H2O属于盐,为电解质、属于离子化合物,故选bd;
(2)FeSO4 7H2O溶于水产生Fe2+,亚铁离子水解使溶液显酸性;久置出现红褐色沉淀,说明亚铁离子被空气中的氧气氧化,生成氢氧化铁成,根据电子守恒、元素守恒可得离子方程式为
(3)各元素化合价之和为0,所以3x+6×2-2y=0,其中x=2,解得y=9;该物质的化学式为:Fe2S2O9 zH2O,将样品加热到110℃时,只失掉3个结晶水,失重10.8%,所以有×100%=10.8%,解得z=10,所以黄矾的化学式为:Fe2S2O9 10H2O。
12.(1)氧化剂
(2)漂白性
(3) 干燥的红布条不褪色 氯气和水反应的产物次氯酸具有漂白性
解析:(1)反应C+2H2SO4CO2↑+2SO2↑+2H2O,浓硫酸中S元素化合价由+6降低为+4,浓硫酸作氧化剂。
(2)SO2能够使品红溶液褪色,体现了二氧化硫的漂白性。
(3)氯气没有漂白性,通入Cl2后,集气瓶A中干燥的红布条不褪色,集气瓶B中湿润的红色布条褪色,可得出的结论是氯气和水反应的产物次氯酸具有漂白性;最后的NaOH溶液中氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水,发生反应的主要化学方程式是。
三、计算题
13.24L 0.1mol 1.3mol/L
解析:(1) V(SO2)= 0.1mol×22.4L/mol=2.24L;
(2)根据硫元素化合价可知2mol硫酸参加反应时被还原的硫酸为1mol,则被还原的硫酸的物质的量为=0.1mol;
(3)反应时硫酸根减少的物质的量为生成的二氧化硫的物质的量,则反应后溶液中硫酸根离子的物质的量为0.36mol-0.1mol=0.26mol,浓度为=1.3mol/L。
14.2:5
解析:(1)生成气体的物质的量为,根据化学方程式可知生成1.4mol气体,消耗1.4mol Zn,Zn的质量为;
(2)溶液剩余硫酸的物质的量为,参加反应的,设反应生成SO2的物质的量为x mol,生成H2的物质的量为y mol,则生成SO2消耗H2SO4的物质的量为2x mol,生成H2消耗H2SO4的物质的量为y mol,则有,解得,所以。
四、实验题
15.(1)
(2)碱性、漂白性
(3) 检验白雾中是否含有,排除干扰 白雾中混有,可与酸化的反应产生白色沉淀
(4)将白雾通入足量的溶液中,过滤。向滤液中滴加至溶液呈酸性,滴入溶液,产生白色沉淀
(5)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
(6)排除的干扰
(7)
【分析】本题对SO2与漂粉精的反应进行实验探究,取4g漂粉精溶于水,部分固体溶解,次氯酸钙在水中溶解度较小,故有部分无法溶解。过滤测溶液的pH,pH试纸先因溶液呈碱性而变蓝,后被漂粉精漂白褪色。往漂粉精溶液中持续通入SO2,二氧化硫会与次氯酸钙反应生成硫酸钙、HCl和HClO,液面上方出现白雾,稍后出现浑浊,溶液变黄绿色,黄绿色气体为氯气,后产生大量白色沉淀,黄绿色褪去是因为氯气与过量的二氧化硫反应。
解析:(1)Cl2和Ca(OH)2制取漂粉精的化学方程式为
(2)pH试纸先变蓝,体现了漂粉精溶液的碱性,后褪色体现了漂粉精溶液漂白性。
(3)①向漂粉精溶液中通入二氧化硫,生成硫酸钙、HCl和HClO,而HCl和HClO反应会生成氯气,用湿润的碘化钾淀粉试纸检验白雾中是否含有Cl2,排除Cl2的干扰。②白雾中含有SO2,可以被硝酸氧化成硫酸,硫酸与AgNO3溶液反应产生硫酸银白色沉淀,故SO2可以使酸化的硝酸银溶液产生白色沉淀。
(4)要判断白雾中含有HCl,排除SO2的干扰即可,将白雾通入足量的Ba(OH)2溶液中,过滤,向滤液中滴加HNO3至溶液呈酸性,再滴入AgNO3溶液,产生白色沉淀即可证明白雾中含有HCl。
(5)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和氯离子发生反应,通过进一步实验确认了这种可能性,漂粉精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,故可向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。
(6)亚硫酸钙也是白色沉淀,加入HCl如果是亚硫酸钙则会溶解,无明显变化说明没有亚硫酸钙,故加HCl目的是排除CaSO3干扰。
(7)持续通入SO2,黄绿色气体Cl2与二氧化硫发生反应,离子方程式为。
16. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 漂白性 SO2+2OH-=SO+H2O 试管里的溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色
【分析】(1)根据浓硫酸具有强氧化性,能氧化铜的性质书写反应方程式;
(2)根据二氧化硫具有漂白性,能使品红溶液褪色分析;
(3)根据二氧化硫为酸性氧化物的性质,书写二氧化硫和氢氧化钠反应的方程式;
(4)根据Cu与浓硫酸反应的特点,以及硫酸的稀释方法分析。
解析:(1)甲装置中是浓硫酸和铜在加热的条件下反应生成硫酸铜、二氧化硫和水,其反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(2)由于二氧化硫具有漂白性,能使品红溶液褪色,故漂白性;
(3)二氧化硫有毒,利用浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花放在试管口处,能吸收二氧化硫,防止二氧化硫污染空气,二氧化硫与氢氧化钠溶液反应的离子方程式为:SO2+2OH-=SO+H2O,故SO2+2OH-=SO+H2O;
(4)硫酸铜溶液为蓝色,Cu与浓硫酸反应,随着反应的进行,硫酸的浓度变小,而Cu与稀硫酸不反应,故甲装置的试管中反应后除了有硫酸铜外还有未反应的稀硫酸,故欲观察生成的硫酸铜溶液的颜色,应取甲装置中溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色,则证明反应生成了硫酸铜,故试管里的溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色。
五、元素或物质推断题
17.(1)
(2)
(3)
(4)通入品红溶液中,品红溶液褪色,加热后品红溶液又恢复红色
【分析】A是由两种元素组成的矿物,A与氧气在高温条件下得到红色固体B和无色气体D,B、D均为纯净物,B与稀盐酸反应后加入硫氰化钾溶液得到血红色溶液C,则B为Fe2O3,C为Fe(SCN)3,无色气体D加入足量FeCl3溶液得到溶液E,E与足量BaCl2溶液可得到白色沉淀F,则F为BaSO4,E为FeSO4,D为SO2,又2.4gA得到9.32g F(BaSO4),根据S元素守恒可得A中S元素的质量为,则A中Fe元素的质量为2.4g-1.28g=1.12g,因此A中Fe、S的原子个数比为,则A的化学式为FeS2,据此分析解答。
解析: (1)由分析可得,A的化学式为FeS2;
(2)根据分析,反应②为Fe2O3与稀盐酸反应,反应的化学方程式为;
(3)反应③为SO2与足量的FeCl3溶液发生氧化还原反应,反应的离子方程式为;
(4)由分析可知,D为SO2,具有漂白性,可将其通入品红溶液中,若品红溶液褪色,加热后品红溶液又恢复红色,说明是SO2。
一、单选题
1.下列“类比”合理的是
A.与反应生成,则与反应生成
B.在足量的中燃烧生成,则在足量的中燃烧生成
C.与水反应生成和,则与水反应生成和
D.与反应生成和,则与反应生成和
2.下图装置可用于检验木炭与浓硫酸反应的产物,下列说法正确的是
A.①③④②可以检出,检不出、
B.①④③②可以检出、、
C.①④②③可以检出、,检不出
D.①②③④可以检出,检不出、
3.向50mL18mol/L的浓硫酸中加入足量的铜片并加热,产生SO2(标准状况)6.72L,被还原的硫酸的物质的量为( )
A.0.9mol B.0.3mol C.0.6mol D.0.45mol
4.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.浓硫酸可用来干燥某些气体(脱水性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.在加热条件下铜与浓硫酸反应(氧化性、酸性)
5.S2Cl2常用于制作橡胶的粘结剂,S2Cl2分子中各原子最外层均有8个电子,S2Cl2遇水会产生淡黄色沉淀和无色刺激性气味气体,下列说法正确的是
A.S2Cl2可使品红溶液褪色
B.S2Cl2只做还原剂
C.S2Cl2结构式为Cl-S-Cl-S
D.1mol S2Cl2与水完全反应,转移电子的个数为2NA
6.下图是硫元素的常见化合价与部分含硫物质类别的对应关系图,下列说法正确的是
A.W的浓溶液使胆矾变白,说明W的浓溶液具有吸水性
B.X与Z反应时,氧化剂与还原剂物质的量之比为
C.Z具有漂白性,所以可以使酸性高锰酸钾溶液褪色
D.X、Z都可以被W的浓溶液氧化
7.下列各组物质反应时,只能发生一个反应的是( )
A.铁与硫 B.碳与氧气
C.二氧化硫和氢氧化钠溶液 D.氯化铝溶液和氢氧化钠溶液
8.对于下列实验现象的描述中,正确的是( )
A.铁丝在氧气中燃烧,生成四氧化三铁 B.碳在氧气中燃烧,有红色的火焰
C.硫在空气中燃烧,发出明亮的蓝紫色火焰 D.红磷在空气中燃烧,生成大量白烟
9.离子检验的常用方法有三种:
检验方法 沉淀法 显色法 气体法
含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
下列离子检验的方法不合理的是
A.CO32-—气体法 B.Cl-—沉淀法 C.Fe3+—显色法 D.SO42-—气体法
10.下列有关物质性质和用途具有对应关系的是
A.二氧化硅熔点高,可用于制光导纤维
B.浓硫酸具有脱水性,可用于干燥气体
C.二氧化硫有还原性,可用于漂白纸浆
D.稀硫酸具有酸性,可用于除去铁锈
二、填空题
11.矾是各种金属(如铜、铁、锌)的硫酸盐,在生活和生产中有着重要应用。
(1)蓝矾(CuSO4 5H2O)属于的物质类别有___________(填序号)。
a.混合物 b.电解质 c.氧化物 d.离子化合物
(2)绿矾(FeSO4 7H2O)溶于水后水溶液显___________性,绿矾水溶液在空气中久置出现红褐色沉淀,写出相关的离子方程式:___________。
(3)黄矾[FexS2Oy zH2O]中Fe,S的化合价分别为+3、+6,x=2时,y=___________,采用热重分析法测定该黄矾样品所含结晶水数,将样品加热到110℃时,只失掉3个结晶水,失重10.8%,黄矾的化学式为___________。
12.回答下列问题:
(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___________(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___________性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
通入Cl2后,集气瓶A中的现象是___________,集气瓶B中湿润的红色布条的现象可得出的结论是___________,最后的NaOH装置中发生的主要化学方程式是___________。
三、计算题
13.在加热条件下,6.4g铜与20mL 18mol/L硫酸(足量)反应,反应后稀释溶液至200mL。计算:
(1)生成气体的体积为_____(标准状况下)
(2)被还原的硫酸的物质的量为_____
(3)反应后溶液中硫酸根离子的物质的量浓度为_____
14.锌与100mL 18.4mol/L的浓硫酸充分反应后,锌完全溶解,同时生成混合气体31.36L (标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+ )=0.08mol/L。请计算:
(1)反应中共消耗Zn的质量为_______g;
(2)气体的物质的量之比为n____: n____=______。
四、实验题
15.某学生对与漂粉精的反应进行实验探究:
操作 现象
取4g漂粉精固体,加入100mL水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色
i.液面上方出现白雾;ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去
(1)和制取漂粉精的化学方程式是_______。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_______。
(3)向水中持续通入,未观察到白雾。推测现象i的白雾由小液滴形成,进行实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的溶液检验白雾,产生白色沉淀。
①实验a的目的是_______。
②由实验a、b不能判断白雾中含有,理由是_______。
(4)补充实验c,判断白雾中含有,实验方案是_______。
(5)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和发生反应。通过进一步实验确认了这种可能性,其实验方案是_______。
(6)检测A瓶中的白色沉淀,确认了的还原性。
i.将A瓶中混合物过滤、洗涤,得到沉淀X。向沉淀X中加入稀,无明显变化。
ii.取上层清液,加入溶液,产生白色沉淀。
加入稀HCl的目的是_______。
(7)用离子方程式解释现象iii中黄绿色褪去的原因:_______。
16.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)甲装置中发生的主要反应的化学方程式是____________。
(2)装置乙中的品红溶液褪色证明SO2具有_______性。
(3)在装置乙的试管口放有一团浸有碱液的棉花,棉花中通常浸有饱和碳酸钠溶液或氢氧化钠溶液,请写出SO2与NaOH溶液反应的离子方程式:_____________。
(4)欲观察生成的CuSO4溶液的颜色,应采取的操作是______________。
五、元素或物质推断题
17.A是由两种元素组成的矿物,测定A的组成流程如图:
已知:B、D均为纯净物。请回答:
(1)写出反应A的化学式:_______。
(2)写出反应②的化学方程式:_______。
(3)写出反应③的离子方程式:_______。
(4)检验无色气体D常用的方法是:_______。
【参考答案】
一、单选题
1.A
解析:A.与反应生成,与反应生成,A正确;
B.在足量的中燃烧生成,在足量的中燃烧生成,B错误;
C.与水反应生成和,与水反应生成和,C错误;
D.与反应生成和,与反应生成,D错误;
故选A。
2.B
解析:A.据分析,①③④②可以检出,可以检出,检验出的来源无法确定,A错误;
B.据分析,①④③②可以检出、、,B正确;
C.据分析,①④②③可以检出,检不出、,二者均能使澄清石灰水变浑浊,C错误;
D.据分析,①②③④检不出、、,、均被澄清石灰水吸收,D错误;
故选B。
3.B
解析:标准状况下6.72LSO2的物质的量为:=0.3mol,铜与浓硫酸的反应中,浓硫酸被还原生成SO2,则被还原的硫酸的物质的量等于SO2的物质的量,故被还原的硫酸的物质的量为0.3mol,故选:B。
4.D
解析:A.浓硫酸具有吸水性,在空气敞口久置吸收空气中的水分导致质量变大,与脱水性无关,故A错误;
B.浓硫酸具有吸水性,可以干燥某些气体,与脱水性无关,故B错误;
C.蔗糖与浓硫酸反应中有海绵状的碳生成,这是浓硫酸的脱水性导致,故C错误;
D.加热条件下铜与浓硫酸反应生成硫酸铜、水和二氧化硫,表现了浓硫酸的酸性和强氧化性,故D正确;
综上所述答案为D。
5.A
解析:A.由分析可知,S2Cl2与水反应生成硫、二氧化硫和氯化氢,生成二氧化硫具有漂白性,可使品红溶液褪色,故A正确;
B.由分析可知,S2Cl2与水反应时硫元素的化合价即升高被氧化又降低被还原,既是反应的氧化剂又是反应的还原剂,故B错误;
C.由分析可知,S2Cl2结构式为Cl—S—S—Cl,故C错误;
D.由反应的方程式可知,2molS2Cl2与水完全反应,转移电子3mol电子,则1mol S2Cl2与水完全反应,转移电子的个数为1.5NA,故D错误;
故选A。
6.A
解析:A.W为H2SO4,浓硫酸具有吸水性,能吸收胆矾中的结晶水,使胆矾变白,A项正确;
B.X为H2S,Z为SO2,H2S与SO2反应生成S和H2O,H2S中S元素的化合价由-2价升至0价,H2S为还原剂,SO2中S元素的化合价由+4价降至0价,SO2为氧化剂,根据得失电子守恒,氧化剂与还原剂物质的量之比为1∶2,B项错误;
C.Z为SO2,SO2使酸性高锰酸钾溶液褪色时发生反应5SO2+2+2H2O=5+2Mn2++4H+,SO2表现还原性、表示漂白性,C项错误;
D.X为H2S,Z为SO2,W为H2SO4,H2S能被浓硫酸氧化,但SO2与浓硫酸不反应,即SO2不能被浓硫酸氧化,D项错误;
答案选A。
7.A
解析:A.铁与硫反应生成硫化亚铁,只能发生一个反应, A符合题意;
B.碳与氧气反应,氧气足量生成二氧化碳,氧气不足生成一氧化碳,B不符合题意;
C.二氧化硫和氢氧化钠溶液,二氧化硫少量时生成亚硫酸钠和水,二氧化硫过量产物为亚硫酸氢钠和水,C不符合题意;
D.氯化铝溶液和氢氧化钠溶液,氢氧化钠少量生成氢氧化铝沉淀,氢氧化钠过量,产物为偏铝酸钠和水,D不符合题意;
故选:A。
8.D
解析:A.铁丝在氧气中燃烧,生成四氧化三铁,是实验结论而不是实验现象,故A错误;
B.碳在氧气中燃烧,发出白光,而不是红色的火焰,故B错误;
C.硫在空气中燃烧,产生淡蓝色火焰,故C错误;
D.红磷在空气中燃烧,产生大量的白烟,故D正确;
答案选D。
9.D
解析:A.CO32-的检验方法:取样品于试管中,加入稀盐酸,若产生无色无味且能使澄清石灰水变浑浊的气体,则含有CO32-,属于气体法,A选项正确;
B.检验Cl-利用的是生成AgCl白色沉淀,属于沉淀法,B选项正确;
C.Fe3+的检验方法是滴加KSCN溶液,若出现红色,则含有Fe3+,属于显色法,C选项正确;
D.SO42-的检验利用的是生成BaSO4白色沉淀,属于沉淀法,D选项错误;选D。
10.D
解析:A.二氧化硅晶体能对光产生全反射,能传递光信号,所以二氧化硅晶体可用于制光导纤维,与其熔点无关,A错误;
B.浓硫酸具有吸水性,可用作干燥剂,B错误;
C.二氧化硫有漂白性,可用于漂白纸浆,与其还原性无关,C错误;
D.铁锈的主要成分是,可用稀硫酸除去,D正确;
故选D。
二、填空题
11.(1)bd
(2) 酸
(3) 9 Fe2S2O9 10H2O
解析:(1)CuSO4 5H2O属于盐,为电解质、属于离子化合物,故选bd;
(2)FeSO4 7H2O溶于水产生Fe2+,亚铁离子水解使溶液显酸性;久置出现红褐色沉淀,说明亚铁离子被空气中的氧气氧化,生成氢氧化铁成,根据电子守恒、元素守恒可得离子方程式为
(3)各元素化合价之和为0,所以3x+6×2-2y=0,其中x=2,解得y=9;该物质的化学式为:Fe2S2O9 zH2O,将样品加热到110℃时,只失掉3个结晶水,失重10.8%,所以有×100%=10.8%,解得z=10,所以黄矾的化学式为:Fe2S2O9 10H2O。
12.(1)氧化剂
(2)漂白性
(3) 干燥的红布条不褪色 氯气和水反应的产物次氯酸具有漂白性
解析:(1)反应C+2H2SO4CO2↑+2SO2↑+2H2O,浓硫酸中S元素化合价由+6降低为+4,浓硫酸作氧化剂。
(2)SO2能够使品红溶液褪色,体现了二氧化硫的漂白性。
(3)氯气没有漂白性,通入Cl2后,集气瓶A中干燥的红布条不褪色,集气瓶B中湿润的红色布条褪色,可得出的结论是氯气和水反应的产物次氯酸具有漂白性;最后的NaOH溶液中氯气和氢氧化钠反应生成氯化钠、次氯酸钠、水,发生反应的主要化学方程式是。
三、计算题
13.24L 0.1mol 1.3mol/L
解析:(1) V(SO2)= 0.1mol×22.4L/mol=2.24L;
(2)根据硫元素化合价可知2mol硫酸参加反应时被还原的硫酸为1mol,则被还原的硫酸的物质的量为=0.1mol;
(3)反应时硫酸根减少的物质的量为生成的二氧化硫的物质的量,则反应后溶液中硫酸根离子的物质的量为0.36mol-0.1mol=0.26mol,浓度为=1.3mol/L。
14.2:5
解析:(1)生成气体的物质的量为,根据化学方程式可知生成1.4mol气体,消耗1.4mol Zn,Zn的质量为;
(2)溶液剩余硫酸的物质的量为,参加反应的,设反应生成SO2的物质的量为x mol,生成H2的物质的量为y mol,则生成SO2消耗H2SO4的物质的量为2x mol,生成H2消耗H2SO4的物质的量为y mol,则有,解得,所以。
四、实验题
15.(1)
(2)碱性、漂白性
(3) 检验白雾中是否含有,排除干扰 白雾中混有,可与酸化的反应产生白色沉淀
(4)将白雾通入足量的溶液中,过滤。向滤液中滴加至溶液呈酸性,滴入溶液,产生白色沉淀
(5)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
(6)排除的干扰
(7)
【分析】本题对SO2与漂粉精的反应进行实验探究,取4g漂粉精溶于水,部分固体溶解,次氯酸钙在水中溶解度较小,故有部分无法溶解。过滤测溶液的pH,pH试纸先因溶液呈碱性而变蓝,后被漂粉精漂白褪色。往漂粉精溶液中持续通入SO2,二氧化硫会与次氯酸钙反应生成硫酸钙、HCl和HClO,液面上方出现白雾,稍后出现浑浊,溶液变黄绿色,黄绿色气体为氯气,后产生大量白色沉淀,黄绿色褪去是因为氯气与过量的二氧化硫反应。
解析:(1)Cl2和Ca(OH)2制取漂粉精的化学方程式为
(2)pH试纸先变蓝,体现了漂粉精溶液的碱性,后褪色体现了漂粉精溶液漂白性。
(3)①向漂粉精溶液中通入二氧化硫,生成硫酸钙、HCl和HClO,而HCl和HClO反应会生成氯气,用湿润的碘化钾淀粉试纸检验白雾中是否含有Cl2,排除Cl2的干扰。②白雾中含有SO2,可以被硝酸氧化成硫酸,硫酸与AgNO3溶液反应产生硫酸银白色沉淀,故SO2可以使酸化的硝酸银溶液产生白色沉淀。
(4)要判断白雾中含有HCl,排除SO2的干扰即可,将白雾通入足量的Ba(OH)2溶液中,过滤,向滤液中滴加HNO3至溶液呈酸性,再滴入AgNO3溶液,产生白色沉淀即可证明白雾中含有HCl。
(5)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和氯离子发生反应,通过进一步实验确认了这种可能性,漂粉精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,故可向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色。
(6)亚硫酸钙也是白色沉淀,加入HCl如果是亚硫酸钙则会溶解,无明显变化说明没有亚硫酸钙,故加HCl目的是排除CaSO3干扰。
(7)持续通入SO2,黄绿色气体Cl2与二氧化硫发生反应,离子方程式为。
16. Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 漂白性 SO2+2OH-=SO+H2O 试管里的溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色
【分析】(1)根据浓硫酸具有强氧化性,能氧化铜的性质书写反应方程式;
(2)根据二氧化硫具有漂白性,能使品红溶液褪色分析;
(3)根据二氧化硫为酸性氧化物的性质,书写二氧化硫和氢氧化钠反应的方程式;
(4)根据Cu与浓硫酸反应的特点,以及硫酸的稀释方法分析。
解析:(1)甲装置中是浓硫酸和铜在加热的条件下反应生成硫酸铜、二氧化硫和水,其反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(2)由于二氧化硫具有漂白性,能使品红溶液褪色,故漂白性;
(3)二氧化硫有毒,利用浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花放在试管口处,能吸收二氧化硫,防止二氧化硫污染空气,二氧化硫与氢氧化钠溶液反应的离子方程式为:SO2+2OH-=SO+H2O,故SO2+2OH-=SO+H2O;
(4)硫酸铜溶液为蓝色,Cu与浓硫酸反应,随着反应的进行,硫酸的浓度变小,而Cu与稀硫酸不反应,故甲装置的试管中反应后除了有硫酸铜外还有未反应的稀硫酸,故欲观察生成的硫酸铜溶液的颜色,应取甲装置中溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色,则证明反应生成了硫酸铜,故试管里的溶液慢慢倒入预先盛有蒸馏水的烧杯中,溶液变蓝色。
五、元素或物质推断题
17.(1)
(2)
(3)
(4)通入品红溶液中,品红溶液褪色,加热后品红溶液又恢复红色
【分析】A是由两种元素组成的矿物,A与氧气在高温条件下得到红色固体B和无色气体D,B、D均为纯净物,B与稀盐酸反应后加入硫氰化钾溶液得到血红色溶液C,则B为Fe2O3,C为Fe(SCN)3,无色气体D加入足量FeCl3溶液得到溶液E,E与足量BaCl2溶液可得到白色沉淀F,则F为BaSO4,E为FeSO4,D为SO2,又2.4gA得到9.32g F(BaSO4),根据S元素守恒可得A中S元素的质量为,则A中Fe元素的质量为2.4g-1.28g=1.12g,因此A中Fe、S的原子个数比为,则A的化学式为FeS2,据此分析解答。
解析: (1)由分析可得,A的化学式为FeS2;
(2)根据分析,反应②为Fe2O3与稀盐酸反应,反应的化学方程式为;
(3)反应③为SO2与足量的FeCl3溶液发生氧化还原反应,反应的离子方程式为;
(4)由分析可知,D为SO2,具有漂白性,可将其通入品红溶液中,若品红溶液褪色,加热后品红溶液又恢复红色,说明是SO2。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
