第三章铁金属材料单元测试卷高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第三章铁金属材料单元测试卷高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 449.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 08:54:09 | ||
图片预览


文档简介
第三章 铁 金属材料 单元测试卷
一、单选题
1.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①②③。下列离子氧化性比较顺序正确的是
A. B.
C. D.
2.纳米级四氧化三铁是一种多功能磁性材料,在肿瘤的治疗、催化剂载体、磁流体、医药等领域均已有广泛的应用,利用废旧镀锌铁皮制备胶体粒子的流程如图,已知:性质类似于,溶于强碱时生成易溶于水的,下列有关说法不正确的是
A.用氢氧化钠溶液处理废旧镀锌铁皮,是为了过滤时分离铁和锌元素
B.“酸溶”的离子方程式为
C.加适量“氧化”后,溶液中主要存在的离子有:、、、
D.制得,胶体粒子反应过程中,持续通入的目的是将部分还原成
3.下列说法错误的是
A.常温下,将铁棒插入浓硝酸中无明显现象,说明常温下与浓硝酸不反应
B.石油的分馏为物理变化,而石油的裂化和裂解是化学变化
C.汽车尾气中含有的氮氧化物会造成“光化学烟雾”
D.液氨汽化时需要吸收大量的热,所以液氨可用作制冷剂
4.某溶液只大量含有下列离子:、、、、、、中的几种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
(1)取少量该溶液加过量稀硫酸溶液共热,观察到红棕色气体;
(2)取少量(1)所得的溶液,向溶液中加入过量氢氧化钠溶液,微热,生成刺激性气体,无沉淀生成。
根据上述实验,下列说法正确的是
A.不需要焰色试验检验的存在
B.取实验(1)后的溶液滴加淀粉溶液可能变蓝
C.原溶液中可能含有,一定不含
D.取少量原溶液加新制氯水,原溶液中可能有两种离子被氧化
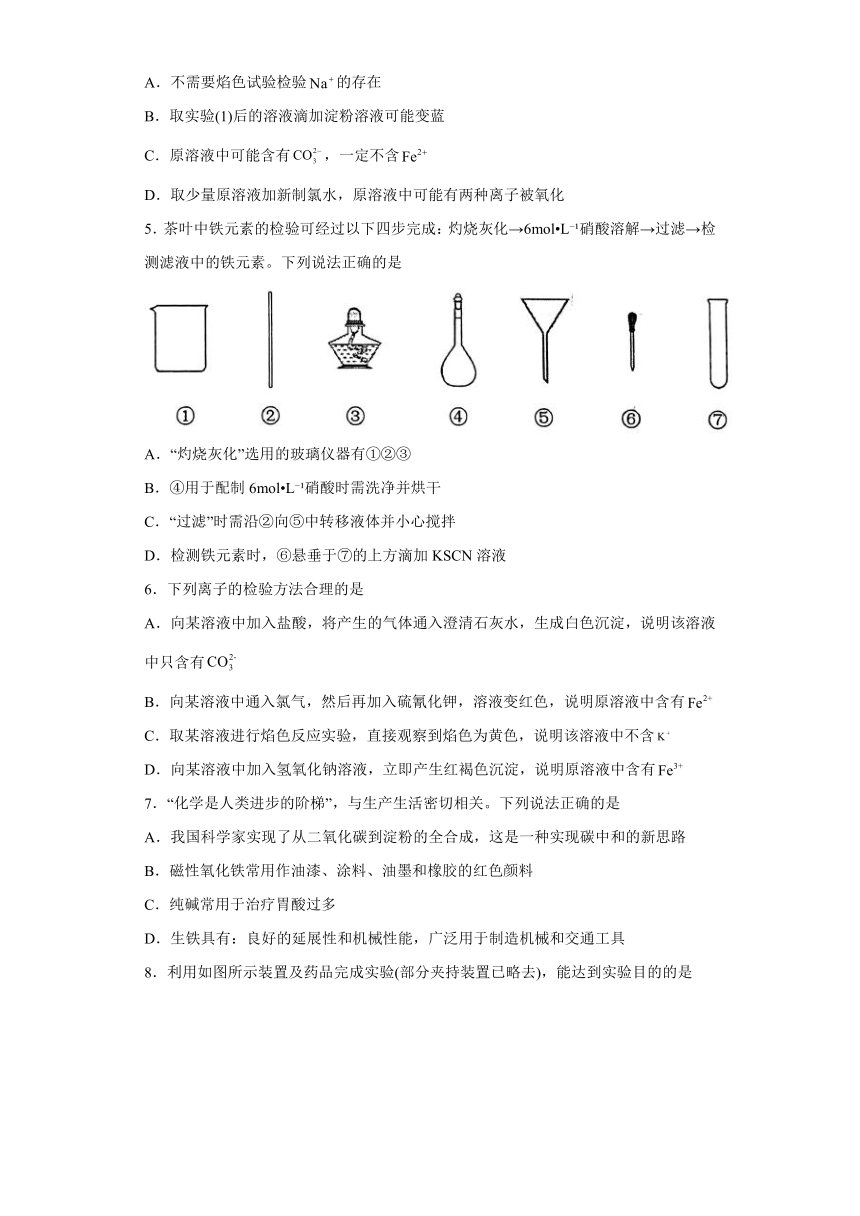
5.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化→6mol L 硝酸溶解→过滤→检测滤液中的铁元素。下列说法正确的是
A.“灼烧灰化”选用的玻璃仪器有①②③
B.④用于配制6mol L 硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌
D.检测铁元素时,⑥悬垂于⑦的上方滴加KSCN溶液
6.下列离子的检验方法合理的是
A.向某溶液中加入盐酸,将产生的气体通入澄清石灰水,生成白色沉淀,说明该溶液中只含有
B.向某溶液中通入氯气,然后再加入硫氰化钾,溶液变红色,说明原溶液中含有
C.取某溶液进行焰色反应实验,直接观察到焰色为黄色,说明该溶液中不含
D.向某溶液中加入氢氧化钠溶液,立即产生红褐色沉淀,说明原溶液中含有
7.“化学是人类进步的阶梯”,与生产生活密切相关。下列说法正确的是
A.我国科学家实现了从二氧化碳到淀粉的全合成,这是一种实现碳中和的新思路
B.磁性氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料
C.纯碱常用于治疗胃酸过多
D.生铁具有:良好的延展性和机械性能,广泛用于制造机械和交通工具
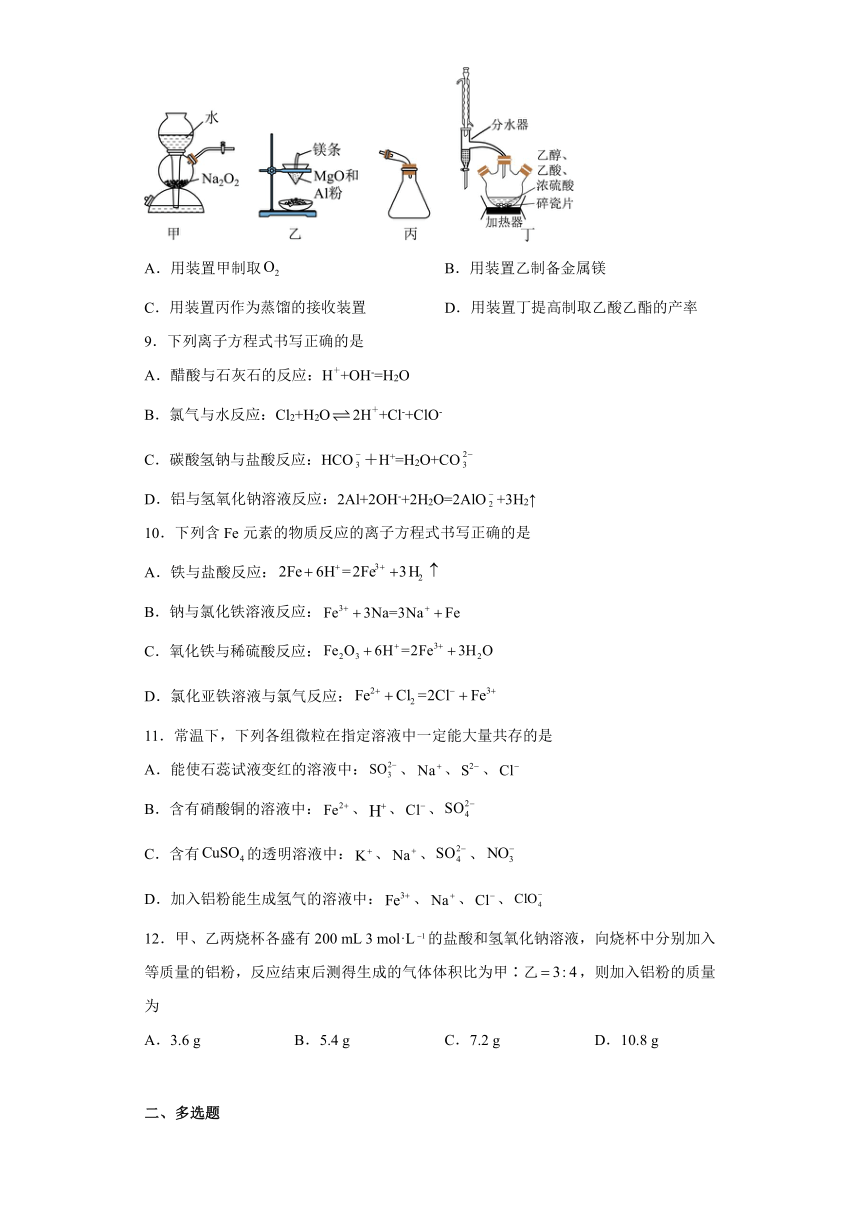
8.利用如图所示装置及药品完成实验(部分夹持装置已略去),能达到实验目的的是
A.用装置甲制取 B.用装置乙制备金属镁
C.用装置丙作为蒸馏的接收装置 D.用装置丁提高制取乙酸乙酯的产率
9.下列离子方程式书写正确的是
A.醋酸与石灰石的反应:H++OH-=H2O
B.氯气与水反应:Cl2+H2O2H++Cl-+ClO-
C.碳酸氢钠与盐酸反应:HCO+H+=H2O+CO
D.铝与氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO+3H2↑
10.下列含Fe元素的物质反应的离子方程式书写正确的是
A.铁与盐酸反应:
B.钠与氯化铁溶液反应:
C.氧化铁与稀硫酸反应:
D.氯化亚铁溶液与氯气反应:
11.常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.能使石蕊试液变红的溶液中:、、、
B.含有硝酸铜的溶液中:、、、
C.含有的透明溶液中:、、、
D.加入铝粉能生成氢气的溶液中:、、、
12.甲、乙两烧杯各盛有200 mL 3 mol·L的盐酸和氢氧化钠溶液,向烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙,则加入铝粉的质量为
A.3.6 g B.5.4 g C.7.2 g D.10.8 g
二、多选题
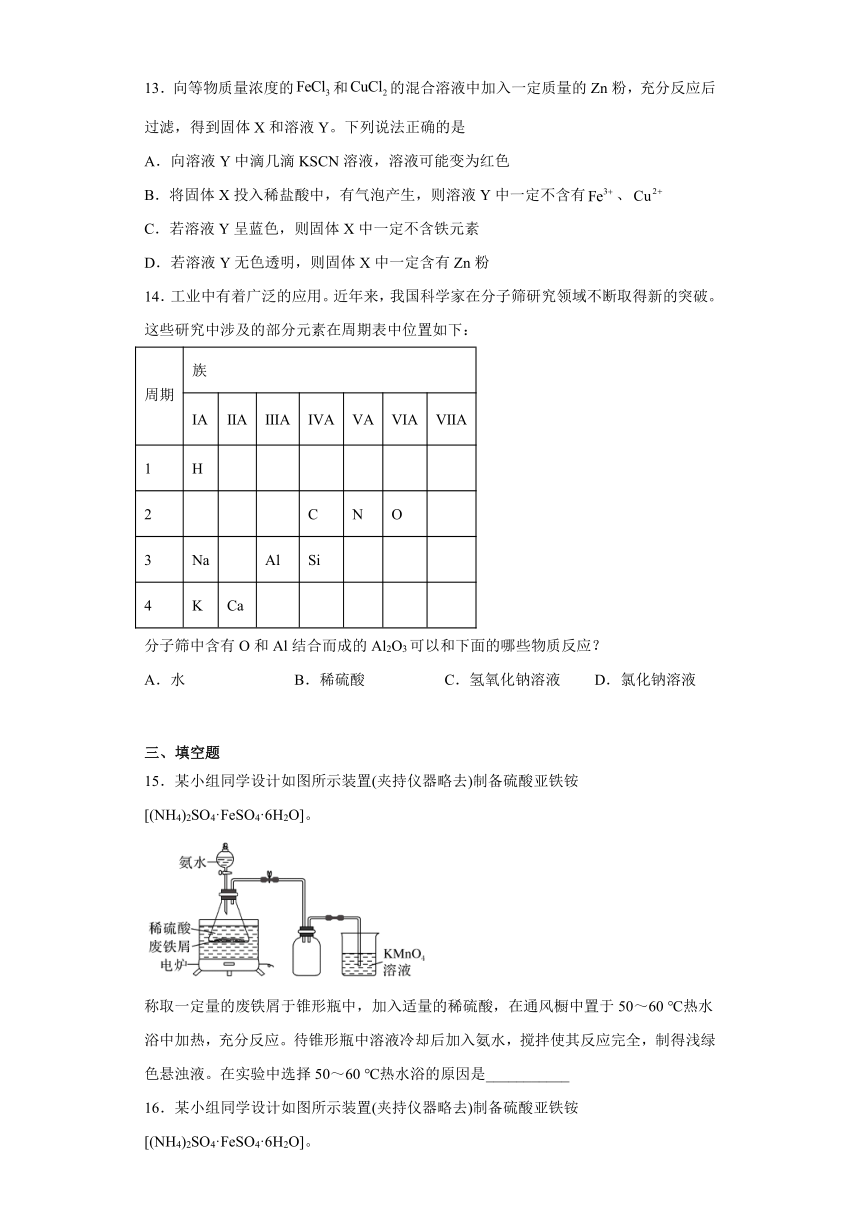
13.向等物质量浓度的和的混合溶液中加入一定质量的Zn粉,充分反应后过滤,得到固体X和溶液Y。下列说法正确的是
A.向溶液Y中滴几滴KSCN溶液,溶液可能变为红色
B.将固体X投入稀盐酸中,有气泡产生,则溶液Y中一定不含有、
C.若溶液Y呈蓝色,则固体X中一定不含铁元素
D.若溶液Y无色透明,则固体X中一定含有Zn粉
14.工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
1 H
2 C N O
3 Na Al Si
4 K Ca
分子筛中含有O和Al结合而成的Al2O3可以和下面的哪些物质反应?
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化钠溶液
三、填空题
15.某小组同学设计如图所示装置(夹持仪器略去)制备硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]。
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60 ℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液。在实验中选择50~60 ℃热水浴的原因是___________
16.某小组同学设计如图所示装置(夹持仪器略去)制备硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]。
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60 ℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液, KMnO4溶液的作用是_______
四、实验题
17.化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价___________。
请设计实验,证明丙同学的结论:___________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式___________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式___________;加入的指示剂是___________,判断滴定终点的现象为___________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH含量将___________(填“偏高”、“偏低”或“不变”)。
五、元素或物质推断题
18.如图为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀。据此回答下列问题:
(1)A、B的化学式为:A_______,B_______。
(2)过程②中的反应现象为_______。检验L中的金属阳离子的试剂是_______。
(3)反应①的化学方程式为_______,反应②的化学方程式为_______,反应③的离子方程式为_______。
参考答案:
1.C
【详解】反应①中Tl3+得电子为氧化剂,Ag失电子被氧化生成的Ag+为氧化产物,则氧化性Tl3+>Ag+,反应②中Ag+得电子为氧化剂,Fe2+失电子被氧化生成的Fe3+为氧化产物,则氧化性Ag+>Fe3+,反应③中Fe3+得电子为氧化剂,Fe失电子被氧化生成的Fe2+为氧化产物,氧化性Fe3+>Fe2+。因此氧化性Tl3+>Ag+>Fe3+>Fe2+,故答案选C。
2.D
【分析】由信息可知Zn能溶于强碱溶液,由流程可知,加入氢氧化钠溶液反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液含Na2ZnO2,分离出不溶物为Fe,加入稀硫酸与Fe反应生成硫酸亚铁,再加入适量过氧化氢,部分亚铁离子被氧化为铁离子,得到含Fe2+、Fe3+的溶液,再通入氮气排出空气防止亚铁离子被氧化,加入氢氧化钠溶液生成四氧化三铁胶体粒子,以此来解答。
【详解】A.Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-,Fe不和NaOH反应,氢氧化钠溶液起到溶解镀锌层的作用,可以分离铁和锌元素,故A正确;
B.“酸溶”的离子方程式为Fe+2H+=Fe2++H2↑,故B正确;
C.由流程可知酸溶生成硫酸亚铁溶液,加过氧化氢氧化部分亚铁离子,则“氧化”后溶液中所存在的离子有:、、、,故C正确;
D.最后一步“反应”中N2的作用是排出空气防止亚铁离子被氧化,故D错误;
故选D。
3.A
【详解】A.铁与浓硝酸反应生成一层致密的氧化膜,阻止了反应的继续进行,不是不反应,故A错误;
B.石油的分馏为物理变化,而石油的裂化和裂解是化学变化,故B正确;
C.光化学烟雾是氮的氧化物和碳氢化合物等在阳光的照射下、发生光化学反应而形成的污染物,汽车尾气中含有的氮氧化物会造成“光化学烟雾”,故C正确;
D.液氨可用作制冷剂,因为液氨汽化时需要吸收大量的热,故D正确;
故选A。
4.A
【分析】取少量该溶液加过量稀硫酸溶液共热,观察到红棕色气体,红棕色气体为NO2,则溶液中一定含有NO,Fe2+、I-至少一种;取少量(1)所得的溶液,向溶液中加入过量氢氧化钠溶液,微热,生成刺激性气体,刺激性气体为NH3,则溶液中一定含有,无沉淀生成,说明不含有Mg2+、Fe2+,一定含有I-,因为各离子的物质的量浓度相等,根据电荷守恒可知,溶液中一定含有Na+,不含,综上,一定含有、Na+、NO、I-。
【详解】A.由分析可知,一定含有Na+,不需要焰色实验检验Na+的存在,A正确;
B.实验(1)后的溶液中含有I2,滴加淀粉溶液一定会变蓝,B错误;
C.由分析可知一定不含和Fe2+,C错误;
D.取少量原溶液加新制氯水,只有I-被氧化,D错误;
故答案为:A。
5.D
【详解】A.将茶叶灼烧灰化,应在坩埚中加热进行,不能在①烧杯中进行灼烧,用到的仪器有②和③,缺少必要的坩埚,需要时还可用到三脚架或铁架台等,故A错误;
B.④容量瓶用于配制溶液时,洗干净即可,不要求烘干,故B错误;
C.“过滤”时需沿②玻璃棒向⑤漏斗中转移液体,待液体自然流下进行过滤,不能进行搅拌,以防戳破滤纸导致过滤失败,故C错误;
D.经过硝酸溶解后,滤液中的铁元素主要以Fe3+形式存在,检验滤液中的Fe3+,可用胶头滴管取少量滤液于小试管中,滴加KSCN溶液检验,使用胶头滴管时,需垂直悬在仪器上方进行滴加,故D正确;
故选:D。
6.D
【详解】A.能使澄清石灰水变浑浊的气体可以是二氧化碳或二氧化硫,故原溶液中可能含有:、、、等,故A错误;
B.氯气具有氧化性,可以将Fe2+氧化为Fe3+,向某溶液中通入氯气,然后再加入硫氰化钾,溶液变红色,不说明原溶液中含有,也可能原溶液中本来就含有Fe3+,故B错误;
C.某溶液做焰色反应,现象为黄色,说明该溶液中含有钠离子,但是不能判断是否存在K+,观察钾离子焰色反应的火焰颜色需要通过蓝色的钴玻璃观察,故C错误;
D.氢氧化铁为红褐色沉淀,则向某溶液中加入氢氧化钠溶液,立即产生红褐色沉淀,说明原溶液中含有,故D正确;
故选D。
7.A
【详解】A.我国科学家实现了从二氧化碳到淀粉的全合成,可以减少二氧化碳的排放,这是一种实现碳中和的新思路,故A正确;
B.氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料,故B错误;
C.常用小苏打治疗胃酸过多,纯碱碱性过强,小苏打更温和,故C错误;
D.生铁硬度大、抗压、性脆、可以铸造成型,是制造机座、管道的重要材料,钢具有良好的延展性和机械性能,广泛用于制造机械和交通工具,故D错误;
故选A。
8.D
【详解】A.Na2O2不是块状难溶于水的固体,与H2O剧烈反应生成NaOH和O2,同时放出大量的热,不能用启普发生器制备,故A错误;
B.Mg比Al活泼,不能通过铝热反应制备,故B错误;
C.锥形瓶不能密封,馏分难以流下,则蒸馏时锥形瓶不能用瓶塞,故C错误;
D.分水器可以将乙酸和乙醇酯化反应中生成的水分离出来,使平衡正向移动,可以提高制取乙酸乙酯的产率,故D正确;
故选D。
9.D
【详解】A.醋酸是弱酸、石灰石即碳酸钙为难溶物,均保留化学式,醋酸与石灰石反应的离子反应为2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑,故A错误;
B.氯气跟水反应生成次氯酸和盐酸,次氯酸是弱酸,不可拆,反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,离子方程式为H++ =CO2↑+H2O,故C错误;
D.铝与氢氧化钠溶液反应产物为偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2+3H2↑,故D正确;
故选:D。
10.C
【详解】A. 铁与盐酸反应生成氯化亚铁和氢气:,故A错误;
B. 钠与氯化铁溶液反应生成氢氧化铁、氯化钠和氢气:,故B错误;
C. 氧化铁与稀硫酸反应生成硫酸铁和水:,故C正确;
D. 氯化亚铁溶液与氯气反应生成氯化铁:,故D错误;
故选C。
11.C
【详解】A.能使石蕊试液变红的溶液为酸性溶液,酸性溶液中离子和硫离子会发生氧化还原反应,不能大量共存,故A错误;
B.含有硝酸铜的溶液中硝酸根离子与亚铁离子、氢离子发生氧化还原反应,不能大量共存,故B错误;
C.四种离子在含有硫酸铜的透明溶液中不发生任何反应,一定能大量共存,故C正确;
D.加入铝粉能生成氢气的溶液可能是酸溶液,也可能是碱溶液,碱溶液中铁离子与氢氧根离子反应生成氢氧化铁沉淀,酸溶液中不发生任何反应,则四种离子在加入铝粉能生成氢气的溶液中可能大量共存,故D错误;
故选C。
12.C
【详解】Al与HCl和NaOH反应的化学方程式分别为2Al+6HCl=2AlCl3+3H2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若酸和碱足量,则生成氢气体积应相同,现生成气体体积比为3:4,说明盐酸不足,则0.6molHCl完全反应生成氢气0.3mol,因此铝与NaOH反应生成氢气0.4mol,氢氧化钠过量,铝的物质的量为质量为7.2g,故答案选C。
13.BC
【详解】A.若有,锌、铁、铜都会和铁离子反应,则不可能得到固体,A错误;
B.将固体X投入稀盐酸中,有气泡产生,固体X中可能有Fe或Zn,则溶液Y中一定不含有、,B正确;
C.若溶液Y呈蓝色,有,铁会和铜离子反应,则固体X中一定不含铁元素,C正确;
D.若溶液Y无色透明,证明溶液Y中不含铁元素和铜元素,则固体X中可能含有过量的Zn粉,也可能锌粉恰好反应而不存在,D错误;
故选BC。
14.BC
【详解】氧化铝为两性氧化物,既能与酸反应又能与碱反应,不能与水反应,也不能与氯化钠溶液反应,故选BC。
15.使受热均匀,加快反应速率,防止温度过高,氨水挥发过多,原料利用率低
【详解】50~60℃热水浴可以使得实验装置受热均匀,且能适当加快反应速率,防止温度过高氨水挥发过多导致原料利用率低,故选择50~60℃热水浴。
16.吸收氨气、二氧化硫等杂质气体,防止污染空气
【详解】尾气中含有的二氧化硫、氨气等会污染空气,故KMnO4溶液的作用是吸收氨气、二氧化硫等杂质气体,防止污染空气。
17.(1) 既有+2价又有+3价 分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存在Fe3+;另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+
(2) (NH4)2Fe2(SO4)3+6NaOH2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O 甲基橙 滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色 偏低
【分析】滴定实验的步骤是:滴定前的准备:滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体→记体积→加指示剂;滴定:眼睛注视锥形瓶溶液颜色变化;终点判断:记录数据;数据处理:通过数据进行计算;
【详解】(1)Fe元素常见的化合价有+2价和+3价,甲同学认为铁可能只有+3价,乙同学认为铁可能只有+2价,则丙同学认为铁的化合价既有+2价又有+3价。
检验Fe3+用KSCN溶液,检验Fe2+用K3[Fe(CN)6]溶液,要证明丙同学结论的实验设计为:分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存在Fe3+;另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+。
(2)Ⅰ.步骤②中用酸性KMnO4溶液滴定Fe2+,酸性KMnO4将Fe2+氧化成Fe3+,KMnO4自身被还原成Mn2+,反应的离子方程式为。
Ⅱ. 根据步骤②和离子反应5Fe2++MnO+8H+=5Fe3++Mn2++4H2O,20.00mL溶液A中含n(Fe2+)=5n(MnO)=50.02mol/L0.04L=0.004mol;
根据步骤③,吸收NH3后过量的n(HCl)=n(NaOH)=0.10mol/L0.06L=0.006mol,吸收NH3的n(HCl)=0.10mol/L0.1L-0.006mol=0.004mol,根据反应NH3+HCl=NH4Cl,20.00mL溶液A中含n(NH)=n(NH3)=0.004mol;
根据电荷守恒n(NH)+2n(Fe2+)=2n(SO),20.00mL溶液A中n(SO)=0.006mol;则n(NH):n(Fe2+):n(SO)=x:y:m=0.004mol:0.004mol:0.006mol=2:2:3,(NH4)xFey(SO4)m的化学简式为(NH4)2Fe2(SO4)3。
向溶液A中加入足量NaOH溶液,NH、Fe2+都发生反应,反应的化学方程式为(NH4)2Fe2(SO4)3+6NaOH2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O。
由于用盐酸吸收NH3后的溶液中的溶质有NH4Cl和过量的HCl,用NaOH溶液滴定过量的HCl,为了防止NH4Cl与NaOH反应,应选用酸性范围内发生颜色变化的指示剂,加入的指示剂是甲基橙;终点的实验现象是:滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色;若滴定管在使用前未用NaOH标准溶液润洗,将导致消耗的NaOH溶液体积偏高,过量的HCl偏高,吸收NH3的HCl偏低,测得的NH4+含量将偏低。
18.(1) Fe Na2O2
(2) 生成的白色沉淀迅速变成灰绿色,最后变成红褐色 KSCN
(3) 2Na2O2+2H2O=4NaOH+O2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O
【分析】H为白色沉淀,J为红褐色沉淀,则H为Fe(OH)2、J为Fe(OH)3、K为Fe2O3、L为FeCl3。B为淡黄色粉末,C在常温下为无色液体,则B为Na2O2、C为H2O,F为NaOH、G为O2;E为FeCl2,A是生活生产中常用的一种金属单质,则A为Fe、D为H2。
【详解】(1)由分析可知,A、B的化学式为:A为Fe,B为Na2O2。答案为:Fe;Na2O2;
(2)过程②中,Fe(OH)2迅速被空气中的O2氧化,最后完全转化为Fe(OH)3,反应现象为:生成的白色沉淀迅速变成灰绿色,最后变成红褐色。检验L中的金属阳离子Fe3+时,通常使用硫氰化钾溶液,则加入试剂是KSCN。答案为:生成的白色沉淀迅速变成灰绿色,最后变成红褐色;KSCN;
(3)反应①中,Na2O2与水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,反应②为Fe(OH)2被O2氧化为Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应③为Fe2O3溶于酸生成Fe3+等,离子方程式为Fe2O3+6H+=2Fe3++3H2O。答案为:2Na2O2+2H2O=4NaOH+O2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe2O3+6H+=2Fe3++3H2O。
【点睛】Fe(OH)2被空气中O2氧化为Fe(OH)3的特征现象为:固体由白色迅速变为灰绿色,最后变为红褐色。
一、单选题
1.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①②③。下列离子氧化性比较顺序正确的是
A. B.
C. D.
2.纳米级四氧化三铁是一种多功能磁性材料,在肿瘤的治疗、催化剂载体、磁流体、医药等领域均已有广泛的应用,利用废旧镀锌铁皮制备胶体粒子的流程如图,已知:性质类似于,溶于强碱时生成易溶于水的,下列有关说法不正确的是
A.用氢氧化钠溶液处理废旧镀锌铁皮,是为了过滤时分离铁和锌元素
B.“酸溶”的离子方程式为
C.加适量“氧化”后,溶液中主要存在的离子有:、、、
D.制得,胶体粒子反应过程中,持续通入的目的是将部分还原成
3.下列说法错误的是
A.常温下,将铁棒插入浓硝酸中无明显现象,说明常温下与浓硝酸不反应
B.石油的分馏为物理变化,而石油的裂化和裂解是化学变化
C.汽车尾气中含有的氮氧化物会造成“光化学烟雾”
D.液氨汽化时需要吸收大量的热,所以液氨可用作制冷剂
4.某溶液只大量含有下列离子:、、、、、、中的几种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
(1)取少量该溶液加过量稀硫酸溶液共热,观察到红棕色气体;
(2)取少量(1)所得的溶液,向溶液中加入过量氢氧化钠溶液,微热,生成刺激性气体,无沉淀生成。
根据上述实验,下列说法正确的是
A.不需要焰色试验检验的存在
B.取实验(1)后的溶液滴加淀粉溶液可能变蓝
C.原溶液中可能含有,一定不含
D.取少量原溶液加新制氯水,原溶液中可能有两种离子被氧化
5.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化→6mol L 硝酸溶解→过滤→检测滤液中的铁元素。下列说法正确的是
A.“灼烧灰化”选用的玻璃仪器有①②③
B.④用于配制6mol L 硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌
D.检测铁元素时,⑥悬垂于⑦的上方滴加KSCN溶液
6.下列离子的检验方法合理的是
A.向某溶液中加入盐酸,将产生的气体通入澄清石灰水,生成白色沉淀,说明该溶液中只含有
B.向某溶液中通入氯气,然后再加入硫氰化钾,溶液变红色,说明原溶液中含有
C.取某溶液进行焰色反应实验,直接观察到焰色为黄色,说明该溶液中不含
D.向某溶液中加入氢氧化钠溶液,立即产生红褐色沉淀,说明原溶液中含有
7.“化学是人类进步的阶梯”,与生产生活密切相关。下列说法正确的是
A.我国科学家实现了从二氧化碳到淀粉的全合成,这是一种实现碳中和的新思路
B.磁性氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料
C.纯碱常用于治疗胃酸过多
D.生铁具有:良好的延展性和机械性能,广泛用于制造机械和交通工具
8.利用如图所示装置及药品完成实验(部分夹持装置已略去),能达到实验目的的是
A.用装置甲制取 B.用装置乙制备金属镁
C.用装置丙作为蒸馏的接收装置 D.用装置丁提高制取乙酸乙酯的产率
9.下列离子方程式书写正确的是
A.醋酸与石灰石的反应:H++OH-=H2O
B.氯气与水反应:Cl2+H2O2H++Cl-+ClO-
C.碳酸氢钠与盐酸反应:HCO+H+=H2O+CO
D.铝与氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO+3H2↑
10.下列含Fe元素的物质反应的离子方程式书写正确的是
A.铁与盐酸反应:
B.钠与氯化铁溶液反应:
C.氧化铁与稀硫酸反应:
D.氯化亚铁溶液与氯气反应:
11.常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.能使石蕊试液变红的溶液中:、、、
B.含有硝酸铜的溶液中:、、、
C.含有的透明溶液中:、、、
D.加入铝粉能生成氢气的溶液中:、、、
12.甲、乙两烧杯各盛有200 mL 3 mol·L的盐酸和氢氧化钠溶液,向烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙,则加入铝粉的质量为
A.3.6 g B.5.4 g C.7.2 g D.10.8 g
二、多选题
13.向等物质量浓度的和的混合溶液中加入一定质量的Zn粉,充分反应后过滤,得到固体X和溶液Y。下列说法正确的是
A.向溶液Y中滴几滴KSCN溶液,溶液可能变为红色
B.将固体X投入稀盐酸中,有气泡产生,则溶液Y中一定不含有、
C.若溶液Y呈蓝色,则固体X中一定不含铁元素
D.若溶液Y无色透明,则固体X中一定含有Zn粉
14.工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
1 H
2 C N O
3 Na Al Si
4 K Ca
分子筛中含有O和Al结合而成的Al2O3可以和下面的哪些物质反应?
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化钠溶液
三、填空题
15.某小组同学设计如图所示装置(夹持仪器略去)制备硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]。
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60 ℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液。在实验中选择50~60 ℃热水浴的原因是___________
16.某小组同学设计如图所示装置(夹持仪器略去)制备硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]。
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50~60 ℃热水浴中加热,充分反应。待锥形瓶中溶液冷却后加入氨水,搅拌使其反应完全,制得浅绿色悬浊液, KMnO4溶液的作用是_______
四、实验题
17.化合物(NH4)xFey(SO4)m是一种重要的化工原料。某实验小组为探究该物质的组成,进行如下实验:
(1)探究铁元素化合价
A.甲同学认为铁可能只有+3价;
B.乙同学认为铁可能只有+2价;
C.丙同学认为铁的化合价___________。
请设计实验,证明丙同学的结论:___________。
(2)三位同学通过实验证明,铁的化合价为+2价。为了进一步探究该化合物的组成,设计了如下实验:
①准确称取4.36g样品,配制成100.00mL溶液A;
②准确量取20.00mL溶液A,用0.0200 mol·L-1的酸性KMnO4标准溶液滴定其中的Fe2+离子,消耗标准溶液的体积为40.00 mL;
③测定NH的含量;另取20.00mL溶液A,加入足量的NaOH溶液并充分加热,用100mL0.10 mol/L的稀盐酸吸收,再用0.10mol/LNaOH标准溶液滴定吸收液,消耗NaOH的体积为60mL。
Ⅰ.写出步骤②中发生的离子方程式___________。
Ⅱ.步骤③中,加入NaOH溶液发生的化学反应方程式___________;加入的指示剂是___________,判断滴定终点的现象为___________,若滴定管在使用前未用NaOH标准溶液润洗,测得的NH含量将___________(填“偏高”、“偏低”或“不变”)。
五、元素或物质推断题
18.如图为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀。据此回答下列问题:
(1)A、B的化学式为:A_______,B_______。
(2)过程②中的反应现象为_______。检验L中的金属阳离子的试剂是_______。
(3)反应①的化学方程式为_______,反应②的化学方程式为_______,反应③的离子方程式为_______。
参考答案:
1.C
【详解】反应①中Tl3+得电子为氧化剂,Ag失电子被氧化生成的Ag+为氧化产物,则氧化性Tl3+>Ag+,反应②中Ag+得电子为氧化剂,Fe2+失电子被氧化生成的Fe3+为氧化产物,则氧化性Ag+>Fe3+,反应③中Fe3+得电子为氧化剂,Fe失电子被氧化生成的Fe2+为氧化产物,氧化性Fe3+>Fe2+。因此氧化性Tl3+>Ag+>Fe3+>Fe2+,故答案选C。
2.D
【分析】由信息可知Zn能溶于强碱溶液,由流程可知,加入氢氧化钠溶液反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液含Na2ZnO2,分离出不溶物为Fe,加入稀硫酸与Fe反应生成硫酸亚铁,再加入适量过氧化氢,部分亚铁离子被氧化为铁离子,得到含Fe2+、Fe3+的溶液,再通入氮气排出空气防止亚铁离子被氧化,加入氢氧化钠溶液生成四氧化三铁胶体粒子,以此来解答。
【详解】A.Zn溶于强碱时生成可溶于水的[Zn(OH)4]2-,Fe不和NaOH反应,氢氧化钠溶液起到溶解镀锌层的作用,可以分离铁和锌元素,故A正确;
B.“酸溶”的离子方程式为Fe+2H+=Fe2++H2↑,故B正确;
C.由流程可知酸溶生成硫酸亚铁溶液,加过氧化氢氧化部分亚铁离子,则“氧化”后溶液中所存在的离子有:、、、,故C正确;
D.最后一步“反应”中N2的作用是排出空气防止亚铁离子被氧化,故D错误;
故选D。
3.A
【详解】A.铁与浓硝酸反应生成一层致密的氧化膜,阻止了反应的继续进行,不是不反应,故A错误;
B.石油的分馏为物理变化,而石油的裂化和裂解是化学变化,故B正确;
C.光化学烟雾是氮的氧化物和碳氢化合物等在阳光的照射下、发生光化学反应而形成的污染物,汽车尾气中含有的氮氧化物会造成“光化学烟雾”,故C正确;
D.液氨可用作制冷剂,因为液氨汽化时需要吸收大量的热,故D正确;
故选A。
4.A
【分析】取少量该溶液加过量稀硫酸溶液共热,观察到红棕色气体,红棕色气体为NO2,则溶液中一定含有NO,Fe2+、I-至少一种;取少量(1)所得的溶液,向溶液中加入过量氢氧化钠溶液,微热,生成刺激性气体,刺激性气体为NH3,则溶液中一定含有,无沉淀生成,说明不含有Mg2+、Fe2+,一定含有I-,因为各离子的物质的量浓度相等,根据电荷守恒可知,溶液中一定含有Na+,不含,综上,一定含有、Na+、NO、I-。
【详解】A.由分析可知,一定含有Na+,不需要焰色实验检验Na+的存在,A正确;
B.实验(1)后的溶液中含有I2,滴加淀粉溶液一定会变蓝,B错误;
C.由分析可知一定不含和Fe2+,C错误;
D.取少量原溶液加新制氯水,只有I-被氧化,D错误;
故答案为:A。
5.D
【详解】A.将茶叶灼烧灰化,应在坩埚中加热进行,不能在①烧杯中进行灼烧,用到的仪器有②和③,缺少必要的坩埚,需要时还可用到三脚架或铁架台等,故A错误;
B.④容量瓶用于配制溶液时,洗干净即可,不要求烘干,故B错误;
C.“过滤”时需沿②玻璃棒向⑤漏斗中转移液体,待液体自然流下进行过滤,不能进行搅拌,以防戳破滤纸导致过滤失败,故C错误;
D.经过硝酸溶解后,滤液中的铁元素主要以Fe3+形式存在,检验滤液中的Fe3+,可用胶头滴管取少量滤液于小试管中,滴加KSCN溶液检验,使用胶头滴管时,需垂直悬在仪器上方进行滴加,故D正确;
故选:D。
6.D
【详解】A.能使澄清石灰水变浑浊的气体可以是二氧化碳或二氧化硫,故原溶液中可能含有:、、、等,故A错误;
B.氯气具有氧化性,可以将Fe2+氧化为Fe3+,向某溶液中通入氯气,然后再加入硫氰化钾,溶液变红色,不说明原溶液中含有,也可能原溶液中本来就含有Fe3+,故B错误;
C.某溶液做焰色反应,现象为黄色,说明该溶液中含有钠离子,但是不能判断是否存在K+,观察钾离子焰色反应的火焰颜色需要通过蓝色的钴玻璃观察,故C错误;
D.氢氧化铁为红褐色沉淀,则向某溶液中加入氢氧化钠溶液,立即产生红褐色沉淀,说明原溶液中含有,故D正确;
故选D。
7.A
【详解】A.我国科学家实现了从二氧化碳到淀粉的全合成,可以减少二氧化碳的排放,这是一种实现碳中和的新思路,故A正确;
B.氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料,故B错误;
C.常用小苏打治疗胃酸过多,纯碱碱性过强,小苏打更温和,故C错误;
D.生铁硬度大、抗压、性脆、可以铸造成型,是制造机座、管道的重要材料,钢具有良好的延展性和机械性能,广泛用于制造机械和交通工具,故D错误;
故选A。
8.D
【详解】A.Na2O2不是块状难溶于水的固体,与H2O剧烈反应生成NaOH和O2,同时放出大量的热,不能用启普发生器制备,故A错误;
B.Mg比Al活泼,不能通过铝热反应制备,故B错误;
C.锥形瓶不能密封,馏分难以流下,则蒸馏时锥形瓶不能用瓶塞,故C错误;
D.分水器可以将乙酸和乙醇酯化反应中生成的水分离出来,使平衡正向移动,可以提高制取乙酸乙酯的产率,故D正确;
故选D。
9.D
【详解】A.醋酸是弱酸、石灰石即碳酸钙为难溶物,均保留化学式,醋酸与石灰石反应的离子反应为2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑,故A错误;
B.氯气跟水反应生成次氯酸和盐酸,次氯酸是弱酸,不可拆,反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,离子方程式为H++ =CO2↑+H2O,故C错误;
D.铝与氢氧化钠溶液反应产物为偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2+3H2↑,故D正确;
故选:D。
10.C
【详解】A. 铁与盐酸反应生成氯化亚铁和氢气:,故A错误;
B. 钠与氯化铁溶液反应生成氢氧化铁、氯化钠和氢气:,故B错误;
C. 氧化铁与稀硫酸反应生成硫酸铁和水:,故C正确;
D. 氯化亚铁溶液与氯气反应生成氯化铁:,故D错误;
故选C。
11.C
【详解】A.能使石蕊试液变红的溶液为酸性溶液,酸性溶液中离子和硫离子会发生氧化还原反应,不能大量共存,故A错误;
B.含有硝酸铜的溶液中硝酸根离子与亚铁离子、氢离子发生氧化还原反应,不能大量共存,故B错误;
C.四种离子在含有硫酸铜的透明溶液中不发生任何反应,一定能大量共存,故C正确;
D.加入铝粉能生成氢气的溶液可能是酸溶液,也可能是碱溶液,碱溶液中铁离子与氢氧根离子反应生成氢氧化铁沉淀,酸溶液中不发生任何反应,则四种离子在加入铝粉能生成氢气的溶液中可能大量共存,故D错误;
故选C。
12.C
【详解】Al与HCl和NaOH反应的化学方程式分别为2Al+6HCl=2AlCl3+3H2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑,若酸和碱足量,则生成氢气体积应相同,现生成气体体积比为3:4,说明盐酸不足,则0.6molHCl完全反应生成氢气0.3mol,因此铝与NaOH反应生成氢气0.4mol,氢氧化钠过量,铝的物质的量为质量为7.2g,故答案选C。
13.BC
【详解】A.若有,锌、铁、铜都会和铁离子反应,则不可能得到固体,A错误;
B.将固体X投入稀盐酸中,有气泡产生,固体X中可能有Fe或Zn,则溶液Y中一定不含有、,B正确;
C.若溶液Y呈蓝色,有,铁会和铜离子反应,则固体X中一定不含铁元素,C正确;
D.若溶液Y无色透明,证明溶液Y中不含铁元素和铜元素,则固体X中可能含有过量的Zn粉,也可能锌粉恰好反应而不存在,D错误;
故选BC。
14.BC
【详解】氧化铝为两性氧化物,既能与酸反应又能与碱反应,不能与水反应,也不能与氯化钠溶液反应,故选BC。
15.使受热均匀,加快反应速率,防止温度过高,氨水挥发过多,原料利用率低
【详解】50~60℃热水浴可以使得实验装置受热均匀,且能适当加快反应速率,防止温度过高氨水挥发过多导致原料利用率低,故选择50~60℃热水浴。
16.吸收氨气、二氧化硫等杂质气体,防止污染空气
【详解】尾气中含有的二氧化硫、氨气等会污染空气,故KMnO4溶液的作用是吸收氨气、二氧化硫等杂质气体,防止污染空气。
17.(1) 既有+2价又有+3价 分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存在Fe3+;另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+
(2) (NH4)2Fe2(SO4)3+6NaOH2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O 甲基橙 滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色 偏低
【分析】滴定实验的步骤是:滴定前的准备:滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体→记体积→加指示剂;滴定:眼睛注视锥形瓶溶液颜色变化;终点判断:记录数据;数据处理:通过数据进行计算;
【详解】(1)Fe元素常见的化合价有+2价和+3价,甲同学认为铁可能只有+3价,乙同学认为铁可能只有+2价,则丙同学认为铁的化合价既有+2价又有+3价。
检验Fe3+用KSCN溶液,检验Fe2+用K3[Fe(CN)6]溶液,要证明丙同学结论的实验设计为:分别取少量待测液于2支试管中,一支加入KSCN溶液,若溶液变红,则存在Fe3+;另一支加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成则有Fe2+。
(2)Ⅰ.步骤②中用酸性KMnO4溶液滴定Fe2+,酸性KMnO4将Fe2+氧化成Fe3+,KMnO4自身被还原成Mn2+,反应的离子方程式为。
Ⅱ. 根据步骤②和离子反应5Fe2++MnO+8H+=5Fe3++Mn2++4H2O,20.00mL溶液A中含n(Fe2+)=5n(MnO)=50.02mol/L0.04L=0.004mol;
根据步骤③,吸收NH3后过量的n(HCl)=n(NaOH)=0.10mol/L0.06L=0.006mol,吸收NH3的n(HCl)=0.10mol/L0.1L-0.006mol=0.004mol,根据反应NH3+HCl=NH4Cl,20.00mL溶液A中含n(NH)=n(NH3)=0.004mol;
根据电荷守恒n(NH)+2n(Fe2+)=2n(SO),20.00mL溶液A中n(SO)=0.006mol;则n(NH):n(Fe2+):n(SO)=x:y:m=0.004mol:0.004mol:0.006mol=2:2:3,(NH4)xFey(SO4)m的化学简式为(NH4)2Fe2(SO4)3。
向溶液A中加入足量NaOH溶液,NH、Fe2+都发生反应,反应的化学方程式为(NH4)2Fe2(SO4)3+6NaOH2NH3↑+2Fe(OH)2↓+3Na2SO4+2H2O。
由于用盐酸吸收NH3后的溶液中的溶质有NH4Cl和过量的HCl,用NaOH溶液滴定过量的HCl,为了防止NH4Cl与NaOH反应,应选用酸性范围内发生颜色变化的指示剂,加入的指示剂是甲基橙;终点的实验现象是:滴入最后一滴NaOH标准溶液,溶液由红色变为橙色且在30s内不恢复原来的颜色;若滴定管在使用前未用NaOH标准溶液润洗,将导致消耗的NaOH溶液体积偏高,过量的HCl偏高,吸收NH3的HCl偏低,测得的NH4+含量将偏低。
18.(1) Fe Na2O2
(2) 生成的白色沉淀迅速变成灰绿色,最后变成红褐色 KSCN
(3) 2Na2O2+2H2O=4NaOH+O2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O
【分析】H为白色沉淀,J为红褐色沉淀,则H为Fe(OH)2、J为Fe(OH)3、K为Fe2O3、L为FeCl3。B为淡黄色粉末,C在常温下为无色液体,则B为Na2O2、C为H2O,F为NaOH、G为O2;E为FeCl2,A是生活生产中常用的一种金属单质,则A为Fe、D为H2。
【详解】(1)由分析可知,A、B的化学式为:A为Fe,B为Na2O2。答案为:Fe;Na2O2;
(2)过程②中,Fe(OH)2迅速被空气中的O2氧化,最后完全转化为Fe(OH)3,反应现象为:生成的白色沉淀迅速变成灰绿色,最后变成红褐色。检验L中的金属阳离子Fe3+时,通常使用硫氰化钾溶液,则加入试剂是KSCN。答案为:生成的白色沉淀迅速变成灰绿色,最后变成红褐色;KSCN;
(3)反应①中,Na2O2与水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,反应②为Fe(OH)2被O2氧化为Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应③为Fe2O3溶于酸生成Fe3+等,离子方程式为Fe2O3+6H+=2Fe3++3H2O。答案为:2Na2O2+2H2O=4NaOH+O2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe2O3+6H+=2Fe3++3H2O。
【点睛】Fe(OH)2被空气中O2氧化为Fe(OH)3的特征现象为:固体由白色迅速变为灰绿色,最后变为红褐色。
