专题9第二单元探究铁及其化合物的转化同步练习(含答案)2022——2023学年高一化学下学期苏教版(2019)必修第二册
文档属性
| 名称 | 专题9第二单元探究铁及其化合物的转化同步练习(含答案)2022——2023学年高一化学下学期苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 422.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 10:27:47 | ||
图片预览




文档简介
专题9第三单元探究铁及其化合物的转化同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.党的二十大报告指出我国已进入创新型国家行列。下列说法正确的是
A.“华龙一号”核电机组使用的氦气不存在分子
B.“奋斗者号”潜水器含钛合金,其强度、韧性高于纯钛金属
C.“祖冲之二号”中的半导体存储器主要成分为
D.“嫦娥五号”带回的月壤中含有磁铁矿,其主要成分为
2.我国的航空航天事业取得巨大成就,下列所述物质为金属材料的是
航空航天成果
物质 宇航服中的聚酯纤维 C919外壳中的铝锂合金 北斗卫星使用的氮化铝芯片 长征火箭使用的液氢燃料
选项 A B C D
A.A B.B C.C D.D
3.《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是
A.我国“硅—石墨烯—锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B.我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料
D.富勒烯、石墨烯都是含碳化合物
4.2022年12月4日,神舟十四号载人飞船返回舱在东风着陆场成功着陆。下列说法不正确的是
A.氧化铝陶瓷可作火箭腹部的隔热瓦,说明氧化铝熔点高
B.舱体表面的低密度烧蚀涂层中使用的苯基硅橡胶是有机高分子材料
C.飞船身上的“超薄皮肤”——铝合金蒙皮板的强度、硬度比金属铝小
D.空间站的能源为柔性砷化镓太阳能电池阵,砷化镓属于半导体材料
5.化学与环境、科技、社会等密切相关。下列说法正确的是
A.用于染料敏化太阳能电池的中钛属于过渡元素
B.用于激光器的的组成元素全部为短周期元素
C.用于激光制导弹的GaAs是一种新型金属材料
D.建设世界最高桥-北盘江大桥使用的水泥属于新型无机非金属材料
6.下列对某些问题的认识正确的是
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.Na能与水反应,因此不能利用钠的置换反应制备其他金属单质X
C.纯碱属于盐,其水溶液不宜用带玻璃塞的玻璃瓶盛放
D.铝合金、 不锈钢、足球烯(C60)都是重要的金属材料
7.材料对于促进生产发展、改善人类生活发挥着巨大作用。下列有关材料的说法正确的是
A.不锈钢中含有铬、镍等元素,具有很强的抗腐蚀能力
B.用来生产电闸、灯口等产品的酚醛树脂属于聚酯类化合物
C.汽车机盖上使用的碳纤维是一种新型有机高分子材料
D.在钢中加入某些稀土元素,可降低钢的韧性、塑性等
8.中华文明中有许多关于化学的记载,《吕氏春秋》中就有“金(即铜)柔锡柔,合两柔则刚”一说,下列关于合金的说法正确的是
A.熔点一般比原组成成分高 B.硬度一般比原组成成分大
C.密度比原组成成分都小 D.合金中至少有两种金属
9.下列说法正确的是
A.金属镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等
B.用四氯化碳萃取碘水,振荡静置分层,上层棕黄色褪色,下层溶液变为紫黑色
C.向胆矾晶体滴加浓硫酸,晶体由蓝色变为白色最后变为黑色
D.二氧化硫具有漂白性,可作为食品添加剂、食物漂白剂、杀菌消毒剂
10.下列关于合金的说法中,正确的是
A.在我国最早使用的合金是钢 B.稀土金属可以用于生产合金
C.合金的熔点一定比各成分金属的低 D.钢是含碳量高于生铁的铁碳合金
11.衣食住行与化学密切相关。下列说法或做法错误的是
A.棉衬衫和丝质衣服的主要原料均为高分子化合物
B.碳酸氢钠可作为面制食品的膨松剂
C.84消毒液与洁厕灵混合后用于消毒卫生间
D.汽车轮毂用密度小强度大的镁合金制造
12.下列对物质认识的有关说法中,正确的是
A.添加Cr、Ni元素的铁合金,比纯铁硬度大、耐磨耐腐蚀、韧性更好
B.只由一种元素组成的物质是纯净物
C.能否产生丁达尔效应是胶体和蔗糖溶液的本质区别
D.2022年北京冬奥会所用保暖围巾是由石墨烯材料制成的,石墨烯属于化合物
13.铝土矿中主要含有Al2O3,还有少量Fe2O3,SiO2杂质,从铝土矿中冶炼金属铝方法如图所示(步骤①、②、③中每步反应结束后经过过滤才进行下一步反应)。下列有关说法不正确的是
A.电解熔融氧化铝制取金属铝时加入冰晶石的作用是降低氧化铝熔融所需的温度
B.步骤②的作用是除去母液1中的Fe3+的H+
C.步骤③生成沉淀的离子反应方程式为AlO+CO2+2H2O=HCO+Al(OH)3↓
D.将步骤①和步骤②顺序颠倒,再通入足量CO2也能得到氢氧化铝沉淀
14.下列材料说法错误的是
A.建筑上的材料花岗岩属于无机非金属材料
B.故宫琉璃瓦和光导纤维属于主要成分相同的一种无机非金属材料
C.冬奥会火炬“飞扬”使用的碳纤维不属于有机高分子材料
D.北京冬奥会“同心”金属奖牌属于合金材料
15.10月31日15时37分,中国空间站梦天实验舱在海南文昌航天发射场由长征五号B运载火箭发射升空。中科院金属所钛合金氢泵涡轮、高温合金管材和锻件、镁合金表面处理技术应用于此次梦天实验舱任务中。下列关于合金的说法中错误的是
A.合金具有许多优良的物理、化学和机械性能
B.一般来说,合金的熔点比它的成分金属的低
C.钛合金、镁合金硬度大,耐酸碱
D.钢是用量最大、用途最广的合金
二、实验题
16.铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
A.不易生锈 B.导电性好 C.密度小 D.硬度大
(2)铝元素在周期表中的位置是_______。写出与稀硫酸反应的离子方程式_______。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______。
(4)现有仪器和药品:试管和胶头滴管,溶液、酸性溶液、溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试管中滴入几滴溶液。 _______
第二步 _______ _______;若无明显变化,则说明不含。
17.某同学在实验室做实验时的记录如表:
实验步骤 实验操作 实验现象
1 向酸性FeCl2溶液中滴加少量KSCN溶液 无明显现象
2 再向溶液中逐滴滴加H2O2至过量 溶液先变红,后褪色,并有无色气体产生
现对产生现象的原因进行探究。
【提出假设】
假设一:产生的气体是O2。
假设二:产生的气体是N2、SO2、CO2等气体。
(1)H2O2与FeCl2溶液反应的离子方程式为___。
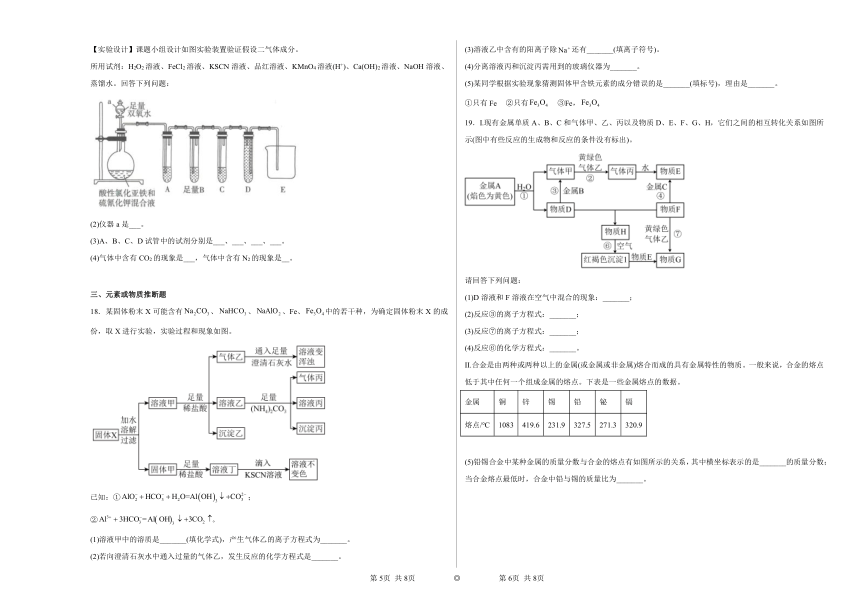
【实验设计】课题小组设计如图实验装置验证假设二气体成分。
所用试剂:H2O2溶液、FeCl2溶液、KSCN溶液、品红溶液、KMnO4溶液(H+)、Ca(OH)2溶液、NaOH溶液、蒸馏水。回答下列问题:
(2)仪器a是___。
(3)A、B、C、D试管中的试剂分别是___、___、___、___。
(4)气体中含有CO2的现象是___,气体中含有N2的现象是__。
三、元素或物质推断题
18.某固体粉末X可能含有、、、Fe、中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
已知:①;
②。
(1)溶液甲中的溶质是_______(填化学式),产生气体乙的离子方程式为_______。
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是_______。
(3)溶液乙中含有的阳离子除还有_______(填离子符号)。
(4)分离溶液丙和沉淀丙需用到的玻璃仪器为_______。
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是_______(填标号),理由是_______。
①只有Fe ②只有 ③Fe,
19.I.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:_______;
(2)反应③的离子方程式:_______;
(3)反应⑦的离子方程式:_______;
(4)反应⑥的化学方程式:_______。
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
金属 铜 锌 锡 铅 铋 镉
熔点/℃ 1083 419.6 231.9 327.5 271.3 320.9
(5)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_______的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______。
(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
A.20~40℃ B.60~80℃ C.230~250℃ D.300~320℃
(7)青铜器的主要成分是铜锡合金。崭新的青铜器呈土黄色。当青铜器长期埋在地下,逐渐形成了绿色的铜绿[主要成分Cu2(OH)2CO3],从其化学式可知铜绿是铜与_______(填物质的化学式)长期作用的结果。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.氦气是氮原子分子,故A错误;
B.钛合金为合金材料,硬度大,其强度、韧性高于纯钛金属,故B正确;
C.“祖冲之二号”中的半导体存储器主要成分为Si,故C错误;
D.磁铁矿主要成分为,故D错误。
综上所述,答案为B。
2.B
【详解】A.聚酯纤维为有机高分子材料,A项不符合题意;
B.铝锂合金为金属材料,B项符合题意;
C.氮化铝为新型无机非金属材料,C不符合题意;
D.液氢燃料为无机非金属材料,D不符合题意;
故选B。
3.D
【详解】A.C、Si、Ge都是主族元素,故A正确;
B.光纤的主要成分是SiO2,故B正确;
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料,故C正确;
D.富勒烯和石墨烯都是碳元素的单质,故D错误;
故选D。
4.C
【详解】A.火箭腹部有高热量区,使用氧化铝陶瓷作隔热瓦,说明氧化铝熔点高,A正确;
B.苯基硅橡胶属于有机高分子材料,B正确;
C.合金的强度和硬度一般都比组成它的各成分金属大,C错误;
D.砷化镓可用于制备柔性砷化镓太阳能电池阵,说明砷化镓能导电,类比硅可用于制造太阳能电池,可知其为半导体材料,D正确;
故选C。
【点睛】合金的强度和硬度一般都比组成它的各成分金属大,这是因为一种金属原子或非金属原子在其他金属原子的晶体结构中占据了一定位置,会造成金属晶体结构的变形,从而使金属晶体在发生错位时阻力上升、形变困难,导致其强度、硬度增大。
5.A
【详解】A.Ti位于周期表中第四周期第IVB族,属于过渡元素,A正确;
B.KH2PO4中,K位于第四周期,属于长周期元素,B错误;
C.金属材料包括纯金属和合金,CaAs是化合物,不属于金属材料,C错误;
D.水泥是传统无机非金属材料,D错误;
故选A。
6.C
【详解】A.浓硫酸的密度大于水,故用等体积的水稀释后,溶液的质量小于原溶液的2倍,溶液的质量分数大于原来的一半,故质量分数大于49%,A错误;
B.通常钠不能从盐溶液中置换出金属,若盐为熔融状态,钠可以置换出较不活泼的金属,如钠可以和熔融的四氯化钛反应制取钛,B错误;
C.纯碱属于盐,但是其水解显碱性,可以和玻璃中的二氧化硅反应,故其水溶液不宜用带玻璃塞的玻璃瓶盛放,C正确;
D.铝合金、不锈钢是重要的金属材料,足球烯(C60)属于无机非金属材料,D错误;
故选C。
7.A
【详解】A.不锈钢中含有铬、镍元素,能改变金属的内部结构,使铁合金具有很强的抗腐蚀能力,A项正确;
B.酚醛树脂是由酚类和醛类聚合而成的,不属于聚酯,B项错误;
C.碳纤维属于碳单质,不是新型有机高分子材料,C项错误;
D.在钢中加入某些稀土元素形成的合金,可增强钢的韧性、塑性等,D项错误;
故选A。
8.B
【详解】A. 合金的熔点一般比原组成成分低,A错误;
B. 合金的硬度通常比原组成成分大、强度比原组成成分高,B正确;
C.因合金的组成很复杂,合金的密度比组成的纯金属密度会大,也会小,无必然联系,C错误;
D.合金是一种金属与另一种或几种金属或非金属经过熔合而成的具有金属特性的物质,合金中至少有一种金属,D错误;
答案选B。
9.A
【详解】A.镁合金具有密度小,硬度大特点,因此镁合金用于制造飞机机身、发动机零件等,故A正确;
B.用四氯化碳萃取碘水,振荡静置分层,上层棕黄色褪色,下层溶液变为紫红色,故B错误;
C.向胆矾晶体滴加浓硫酸,晶体由蓝色变为白色,最后不会变为黑色,故C错误;
D.在严格控制用量的情况下,二氧化硫可被添加到食品中作漂白剂、防腐剂和抗氧化剂,故D错误。
综上所述,答案为A。
10.B
【详解】A.在我国最早使用的合金是铜合金,即青铜,A错误;
B.稀土金属可以改善合金的性能,可以用作生产合金,B正确;
C.一般情况下,合金的熔点比其成分金属的低,但不一定比成分金属低,C错误;
D.钢中含碳量比生铁低,D错误;
选项是B。
11.C
【详解】A.棉衬衫主要原料是纤维素,丝质衣服主要原料为蛋白质,纤维素、蛋白质均为高分子化合物,故A说法正确;
B.碳酸氢钠不稳定受热易分解生成二氧化碳,且也能与酸反应生成二氧化碳,所以碳酸氢钠可作为制作糕点的膨松剂,故B说法正确;
C.84消毒液有效成分是NaClO,洁厕灵的主要成分是盐酸,两者混合可以生成有毒的氯气,因此两溶液不能混合使用,故C说法错误;
D.镁合金具有密度小,强度高、散热好、消震性好等特点,可以制作汽车轮毂,故D说法正确;
答案为C。
12.A
【详解】A.铁合金中添加Cr、Ni,形成的合金比纯铁硬度大、耐磨耐腐蚀、有很好的韧性,故A正确;
B.只由一种元素组成的物质可能是混合物,如氧气和臭氧,故B错误;
C.胶体和溶液的本质区别是分散质粒子直径大小,故C错误;
D.石墨烯是单层石墨结构,属于单质,故D错误;
故选:A。
13.D
【分析】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,因Al2O3、SiO2与NaOH溶液反应,Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3均与盐酸反应;结合流程可知,步骤①中,用盐酸浸取铝土矿井过滤得到母液1,母液1含有AlCl3、FeCl3;向母液1中加入过量烧碱除去H+、Fe3+,并将Al3+转化为,过滤得到母液2,母液2中含有NaAlO2;向母液2中通入过量二氧化碳,得到Al(OH)3;加热Al(OH)3分解得到Al2O3,再电解氧化铝可得到Al。
【详解】A.氧化铝熔点较高,需要加入冰晶石,降低氧化铝熔融所需的温度,A项正确;
B.步骤②中加入过量NaOH溶液,作用是除去、,B项正确;
C.通入足量二氧化碳与偏铝酸根反应:,C项正确;
D.将步骤①和步骤②顺序颠倒,母液2中含有、Fe3+,再通入足量CO2能得不到氢氧化铝沉淀,D项错误;
故选D。
14.B
【详解】A.花岗岩的主要成分是石英、云母、长石等矿物,属于无机非金属材料,故A正确;
B.琉璃其化学成份是硅酸盐,属于无机硅酸盐产物;制作光导纤维的材料为二氧化硅,光导纤维属于新型无机非金属材料,B错误;
C.碳纤维指的是含碳量在90%以上的高强度高模量纤维,属于无机非金属材料,故C正确;
D.金属奖牌属于合金材料,故D正确;
故选:B。
15.C
【详解】A.之所以把金属制造为合金,就是因为合金具有许多优良的物理、化学和机械性能,A正确;
B.一般来说合金熔点比它的成分金属的低,B正确;
C.钛合金、镁合金硬度大,合金的化学性质为成分金属的性质总和,如镁合金能与酸反应,C错误;
D.目前钢是用量最大、用途最广、产量最大的合金,D正确;
故答案为:C。
16.(1)B
(2) 第3周期第ⅢA族 Fe3O4
(3) 0.9NA
(4) 若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+ 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 若高锰酸钾溶液紫红色褪去,说明含Fe2+
【分析】铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点;铝元素核电荷数为13,核外电子层数三个,最外层电子数3个,周期序数=电子层数,主族族序数=原子最外层电子数,据此判断在周期表中的位置,Al(OH)3与稀硫酸反应生成硫酸铝和水,铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,以此解题。
【详解】(1)A.不易生锈,用作建筑装潢材料,美观,A正确;
B.导电性好,与装潢无关,B错误;
C.密度小,有利于用作建筑装潢材料,C正确;
D.强度高,用作建筑装潢材料,坚固耐用,D正确;
故选B;
(2)铝是13号元素,在周期表中的位置是:第3周期第ⅢA族;与稀硫酸反应生成硫酸铝和水,离子方程式为:;铁粉与水蒸气在高温条件下反应生成Fe3O4和氢气;
(3)3.36L氮气的物质的量为0.15mol,根据方程式,上述反应中氮元素化合价- 3价升高到0价,生成3mol氮气,电子转移总数18mole-,当生成0.15mol氮气时,转移的电子数;,有同学认为,该反应产物中不应该有Fe生成,他的理由是铁和氯化铁反应生成氯化亚铁,反应的化学方程式为:;
(4)铁离子能和硫氰化钾溶液反应生成络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,如果向溶液中滴加硫氰化钾溶液,溶液变为血红色就说明含有铁离子,否则不含铁离子如果向溶液中滴加酸性高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,就说明含有亚铁离子,否则不含亚铁离子,故答案为:若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+;取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液;若高锰酸钾溶液紫红色褪去,说明含Fe2+。
17. 2Fe2++H2O2+2H+=2Fe3++2H2O 分液漏斗 品红溶液 KMnO4溶液(H+) Ca(OH)2溶液 NaOH溶液 B中的酸性KMnO4溶液颜色变浅,而C中Ca(OH)2溶液变浑浊 D中NaOH溶液排入E中
【详解】(1)与溶液反应,元素的化合价由+2升高至+3,O元素的化合价由-1降低至-2,根据氧化还原反应化合价升降守恒、电荷守恒以及原子守恒可知反应离子方程式为;
(2)由图可知,仪器为分液漏斗;
(3)CO2和SO2能使澄清石灰水变浑浊,因此需要先检验SO2,然后将SO2除尽,然后将气体通入澄清石灰水中,因此A中为品红溶液,可检验二氧化硫气体,B中为酸性高锰酸钾溶液,可除去二氧化硫,C中为溶液,可检验二氧化碳,D中为溶液以除去二氧化碳,防止对N2检验干扰;
(4)二氧化碳可使澄清石灰水变浑浊,则气体中含有的现象是B中的酸性溶液颜色变浅(除去SO2,防止SO2进入C中使澄清石灰水变浑浊),而C中溶液浑浊,氮气不溶于溶液,气体中含有N2的现象是D中溶液排入E中。
18.(1) 、
(2)
(3)、
(4)玻璃棒、烧杯、漏斗(普通漏斗)
(5) ②; 如果只有,向溶液丁中滴入KSCN溶液后,溶液一定变红
【分析】固体粉末X可能含有,固体X加水过滤,得到溶液甲和固体甲,则溶液甲中可能有,固体甲中可能有,固体甲加入足量盐酸,滴入溶液,溶液不变色,说明没有,固体甲可以为Fe或Fe,,则溶液丁溶液;溶液甲加入稀盐酸,得到气体乙和溶液乙,气体乙能使澄清石灰石变浑浊,则气体乙为;同时溶液乙和碳酸氢铵反应可以得到溶液丙,气体乙()和沉淀丙,其中,,则溶液乙中含有过量的盐酸、NaCl和AlCl3,溶液甲一定含有,不含有,则溶液甲含有。
【详解】(1)根据分析可知溶液甲为;产生气体乙是由于H+和反应,离子方程式为:;
(2)由分析可知,气体乙为CO2,过量的CO2和澄清石灰水反应的方程式为:;
(3)根据分析可知溶液乙中含有过量的盐酸、NaCl和AlCl3,阳离子为Na+、Al3+和H+;
(4)分离溶液丙和沉淀丙的操作是过滤,过滤用到的玻璃仪器为玻璃棒、烧杯、漏斗(普通漏斗);
(5)Fe和稀盐酸反应产生FeCl2;Fe3O4和稀盐酸反应产生FeCl2和FeCl3;Fe可以和FeCl3反应产生FeCl2;向固体甲加入足量盐酸,滴入溶液,溶液不变色,说明没有,则固体甲可能含有Fe或Fe,;故错误的是②。
19.(1)生成白色沉淀,迅速变成灰绿色,最后变为红褐色
(2)2Al+2OH-+2H2O=+3H2↑
(3)Cl2+2Fe2+=2Cl-+2Fe3+
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3
(5) 锡 2:3
(6)B
(7)O2、CO2、H2O
【分析】金属焰色反应为黄色证明A为Na,与水反应生成气体甲为H2,D为NaOH,金属B和氢氧化钠溶液反应,说明B为A1,黄绿色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D和物质F反应生成H为Fe(OH)2,Fe(OH)2在空气中被氧化生成红褐色沉淀I为Fe(OH)3,G为FeC13,推断物质F为FeCl2,判断C为Fe。
【详解】(1)根据分析,D为NaOH,F为FeCl2,二者反应生成Fe(OH)2,Fe(OH)2容易被氧化,现象为生成白色沉淀,迅速变成灰绿色,最后变为红褐色;
(2)根据分析,反应③为Al与NaOH溶液的反应,离子方程式为2Al+2OH-+2H2O=+3H2↑;
(3)根据分析,反应⑦为FeCl2与Cl2的反应,离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;
(4)根据分析,反应⑥为Fe(OH)2在空气中被氧化生成Fe(OH)3的反应,方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(5)横坐标质量分数为零时熔点要比质量分数为1时熔点高,因为铅的熔点比锡的熔点高,所以横坐标表示锡的质量分数;合金熔点最低时锡占60%,所以铅占40%,合金中铅与锡的质量比为40%:60%=2:3;
(6)合金的熔点比它的组成成分熔点要低,铋、铅、锡、镉这四种物质熔点最低的是231.9,所以要选择熔点比231.9低,且不能很低,必须要高于室温,所以选择B;
(7)根据质量守恒定律可知反应前后元素种类不变,根据Cu2(OH)2CO3可知由铜、氧、氢、碳四种元素组成,所以是铜与O2、CO2、H2O三种物质作用的结果。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.党的二十大报告指出我国已进入创新型国家行列。下列说法正确的是
A.“华龙一号”核电机组使用的氦气不存在分子
B.“奋斗者号”潜水器含钛合金,其强度、韧性高于纯钛金属
C.“祖冲之二号”中的半导体存储器主要成分为
D.“嫦娥五号”带回的月壤中含有磁铁矿,其主要成分为
2.我国的航空航天事业取得巨大成就,下列所述物质为金属材料的是
航空航天成果
物质 宇航服中的聚酯纤维 C919外壳中的铝锂合金 北斗卫星使用的氮化铝芯片 长征火箭使用的液氢燃料
选项 A B C D
A.A B.B C.C D.D
3.《流浪地球2》向观众展示了太空电梯、行星发动机、超级计算机550W等超前的科技幻想,探讨了数字生命、人工智能等科技伦理问题。它们与化学有着密切联系,下列说法不正确的是
A.我国“硅—石墨烯—锗高速晶体管”技术获重大突破,C、Si、Ge都是主族元素
B.我国提出网络强国战略,光纤线路总长超过三千万公里,光纤的主要成分是SiO2
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料
D.富勒烯、石墨烯都是含碳化合物
4.2022年12月4日,神舟十四号载人飞船返回舱在东风着陆场成功着陆。下列说法不正确的是
A.氧化铝陶瓷可作火箭腹部的隔热瓦,说明氧化铝熔点高
B.舱体表面的低密度烧蚀涂层中使用的苯基硅橡胶是有机高分子材料
C.飞船身上的“超薄皮肤”——铝合金蒙皮板的强度、硬度比金属铝小
D.空间站的能源为柔性砷化镓太阳能电池阵,砷化镓属于半导体材料
5.化学与环境、科技、社会等密切相关。下列说法正确的是
A.用于染料敏化太阳能电池的中钛属于过渡元素
B.用于激光器的的组成元素全部为短周期元素
C.用于激光制导弹的GaAs是一种新型金属材料
D.建设世界最高桥-北盘江大桥使用的水泥属于新型无机非金属材料
6.下列对某些问题的认识正确的是
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.Na能与水反应,因此不能利用钠的置换反应制备其他金属单质X
C.纯碱属于盐,其水溶液不宜用带玻璃塞的玻璃瓶盛放
D.铝合金、 不锈钢、足球烯(C60)都是重要的金属材料
7.材料对于促进生产发展、改善人类生活发挥着巨大作用。下列有关材料的说法正确的是
A.不锈钢中含有铬、镍等元素,具有很强的抗腐蚀能力
B.用来生产电闸、灯口等产品的酚醛树脂属于聚酯类化合物
C.汽车机盖上使用的碳纤维是一种新型有机高分子材料
D.在钢中加入某些稀土元素,可降低钢的韧性、塑性等
8.中华文明中有许多关于化学的记载,《吕氏春秋》中就有“金(即铜)柔锡柔,合两柔则刚”一说,下列关于合金的说法正确的是
A.熔点一般比原组成成分高 B.硬度一般比原组成成分大
C.密度比原组成成分都小 D.合金中至少有两种金属
9.下列说法正确的是
A.金属镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等
B.用四氯化碳萃取碘水,振荡静置分层,上层棕黄色褪色,下层溶液变为紫黑色
C.向胆矾晶体滴加浓硫酸,晶体由蓝色变为白色最后变为黑色
D.二氧化硫具有漂白性,可作为食品添加剂、食物漂白剂、杀菌消毒剂
10.下列关于合金的说法中,正确的是
A.在我国最早使用的合金是钢 B.稀土金属可以用于生产合金
C.合金的熔点一定比各成分金属的低 D.钢是含碳量高于生铁的铁碳合金
11.衣食住行与化学密切相关。下列说法或做法错误的是
A.棉衬衫和丝质衣服的主要原料均为高分子化合物
B.碳酸氢钠可作为面制食品的膨松剂
C.84消毒液与洁厕灵混合后用于消毒卫生间
D.汽车轮毂用密度小强度大的镁合金制造
12.下列对物质认识的有关说法中,正确的是
A.添加Cr、Ni元素的铁合金,比纯铁硬度大、耐磨耐腐蚀、韧性更好
B.只由一种元素组成的物质是纯净物
C.能否产生丁达尔效应是胶体和蔗糖溶液的本质区别
D.2022年北京冬奥会所用保暖围巾是由石墨烯材料制成的,石墨烯属于化合物
13.铝土矿中主要含有Al2O3,还有少量Fe2O3,SiO2杂质,从铝土矿中冶炼金属铝方法如图所示(步骤①、②、③中每步反应结束后经过过滤才进行下一步反应)。下列有关说法不正确的是
A.电解熔融氧化铝制取金属铝时加入冰晶石的作用是降低氧化铝熔融所需的温度
B.步骤②的作用是除去母液1中的Fe3+的H+
C.步骤③生成沉淀的离子反应方程式为AlO+CO2+2H2O=HCO+Al(OH)3↓
D.将步骤①和步骤②顺序颠倒,再通入足量CO2也能得到氢氧化铝沉淀
14.下列材料说法错误的是
A.建筑上的材料花岗岩属于无机非金属材料
B.故宫琉璃瓦和光导纤维属于主要成分相同的一种无机非金属材料
C.冬奥会火炬“飞扬”使用的碳纤维不属于有机高分子材料
D.北京冬奥会“同心”金属奖牌属于合金材料
15.10月31日15时37分,中国空间站梦天实验舱在海南文昌航天发射场由长征五号B运载火箭发射升空。中科院金属所钛合金氢泵涡轮、高温合金管材和锻件、镁合金表面处理技术应用于此次梦天实验舱任务中。下列关于合金的说法中错误的是
A.合金具有许多优良的物理、化学和机械性能
B.一般来说,合金的熔点比它的成分金属的低
C.钛合金、镁合金硬度大,耐酸碱
D.钢是用量最大、用途最广的合金
二、实验题
16.铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
A.不易生锈 B.导电性好 C.密度小 D.硬度大
(2)铝元素在周期表中的位置是_______。写出与稀硫酸反应的离子方程式_______。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______。
(4)现有仪器和药品:试管和胶头滴管,溶液、酸性溶液、溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试管中滴入几滴溶液。 _______
第二步 _______ _______;若无明显变化,则说明不含。
17.某同学在实验室做实验时的记录如表:
实验步骤 实验操作 实验现象
1 向酸性FeCl2溶液中滴加少量KSCN溶液 无明显现象
2 再向溶液中逐滴滴加H2O2至过量 溶液先变红,后褪色,并有无色气体产生
现对产生现象的原因进行探究。
【提出假设】
假设一:产生的气体是O2。
假设二:产生的气体是N2、SO2、CO2等气体。
(1)H2O2与FeCl2溶液反应的离子方程式为___。
【实验设计】课题小组设计如图实验装置验证假设二气体成分。
所用试剂:H2O2溶液、FeCl2溶液、KSCN溶液、品红溶液、KMnO4溶液(H+)、Ca(OH)2溶液、NaOH溶液、蒸馏水。回答下列问题:
(2)仪器a是___。
(3)A、B、C、D试管中的试剂分别是___、___、___、___。
(4)气体中含有CO2的现象是___,气体中含有N2的现象是__。
三、元素或物质推断题
18.某固体粉末X可能含有、、、Fe、中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
已知:①;
②。
(1)溶液甲中的溶质是_______(填化学式),产生气体乙的离子方程式为_______。
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是_______。
(3)溶液乙中含有的阳离子除还有_______(填离子符号)。
(4)分离溶液丙和沉淀丙需用到的玻璃仪器为_______。
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是_______(填标号),理由是_______。
①只有Fe ②只有 ③Fe,
19.I.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)D溶液和F溶液在空气中混合的现象:_______;
(2)反应③的离子方程式:_______;
(3)反应⑦的离子方程式:_______;
(4)反应⑥的化学方程式:_______。
II.合金是由两种或两种以上的金属(或金属或非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于其中任何一个组成金属的熔点。下表是一些金属熔点的数据。
金属 铜 锌 锡 铅 铋 镉
熔点/℃ 1083 419.6 231.9 327.5 271.3 320.9
(5)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是_______的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______。
(6)保险丝由铋、铅、锡、镉等金属组成,其熔点约为_______。
A.20~40℃ B.60~80℃ C.230~250℃ D.300~320℃
(7)青铜器的主要成分是铜锡合金。崭新的青铜器呈土黄色。当青铜器长期埋在地下,逐渐形成了绿色的铜绿[主要成分Cu2(OH)2CO3],从其化学式可知铜绿是铜与_______(填物质的化学式)长期作用的结果。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.氦气是氮原子分子,故A错误;
B.钛合金为合金材料,硬度大,其强度、韧性高于纯钛金属,故B正确;
C.“祖冲之二号”中的半导体存储器主要成分为Si,故C错误;
D.磁铁矿主要成分为,故D错误。
综上所述,答案为B。
2.B
【详解】A.聚酯纤维为有机高分子材料,A项不符合题意;
B.铝锂合金为金属材料,B项符合题意;
C.氮化铝为新型无机非金属材料,C不符合题意;
D.液氢燃料为无机非金属材料,D不符合题意;
故选B。
3.D
【详解】A.C、Si、Ge都是主族元素,故A正确;
B.光纤的主要成分是SiO2,故B正确;
C.新型陶瓷碳化硅(SiC)可作耐高温结构材料,故C正确;
D.富勒烯和石墨烯都是碳元素的单质,故D错误;
故选D。
4.C
【详解】A.火箭腹部有高热量区,使用氧化铝陶瓷作隔热瓦,说明氧化铝熔点高,A正确;
B.苯基硅橡胶属于有机高分子材料,B正确;
C.合金的强度和硬度一般都比组成它的各成分金属大,C错误;
D.砷化镓可用于制备柔性砷化镓太阳能电池阵,说明砷化镓能导电,类比硅可用于制造太阳能电池,可知其为半导体材料,D正确;
故选C。
【点睛】合金的强度和硬度一般都比组成它的各成分金属大,这是因为一种金属原子或非金属原子在其他金属原子的晶体结构中占据了一定位置,会造成金属晶体结构的变形,从而使金属晶体在发生错位时阻力上升、形变困难,导致其强度、硬度增大。
5.A
【详解】A.Ti位于周期表中第四周期第IVB族,属于过渡元素,A正确;
B.KH2PO4中,K位于第四周期,属于长周期元素,B错误;
C.金属材料包括纯金属和合金,CaAs是化合物,不属于金属材料,C错误;
D.水泥是传统无机非金属材料,D错误;
故选A。
6.C
【详解】A.浓硫酸的密度大于水,故用等体积的水稀释后,溶液的质量小于原溶液的2倍,溶液的质量分数大于原来的一半,故质量分数大于49%,A错误;
B.通常钠不能从盐溶液中置换出金属,若盐为熔融状态,钠可以置换出较不活泼的金属,如钠可以和熔融的四氯化钛反应制取钛,B错误;
C.纯碱属于盐,但是其水解显碱性,可以和玻璃中的二氧化硅反应,故其水溶液不宜用带玻璃塞的玻璃瓶盛放,C正确;
D.铝合金、不锈钢是重要的金属材料,足球烯(C60)属于无机非金属材料,D错误;
故选C。
7.A
【详解】A.不锈钢中含有铬、镍元素,能改变金属的内部结构,使铁合金具有很强的抗腐蚀能力,A项正确;
B.酚醛树脂是由酚类和醛类聚合而成的,不属于聚酯,B项错误;
C.碳纤维属于碳单质,不是新型有机高分子材料,C项错误;
D.在钢中加入某些稀土元素形成的合金,可增强钢的韧性、塑性等,D项错误;
故选A。
8.B
【详解】A. 合金的熔点一般比原组成成分低,A错误;
B. 合金的硬度通常比原组成成分大、强度比原组成成分高,B正确;
C.因合金的组成很复杂,合金的密度比组成的纯金属密度会大,也会小,无必然联系,C错误;
D.合金是一种金属与另一种或几种金属或非金属经过熔合而成的具有金属特性的物质,合金中至少有一种金属,D错误;
答案选B。
9.A
【详解】A.镁合金具有密度小,硬度大特点,因此镁合金用于制造飞机机身、发动机零件等,故A正确;
B.用四氯化碳萃取碘水,振荡静置分层,上层棕黄色褪色,下层溶液变为紫红色,故B错误;
C.向胆矾晶体滴加浓硫酸,晶体由蓝色变为白色,最后不会变为黑色,故C错误;
D.在严格控制用量的情况下,二氧化硫可被添加到食品中作漂白剂、防腐剂和抗氧化剂,故D错误。
综上所述,答案为A。
10.B
【详解】A.在我国最早使用的合金是铜合金,即青铜,A错误;
B.稀土金属可以改善合金的性能,可以用作生产合金,B正确;
C.一般情况下,合金的熔点比其成分金属的低,但不一定比成分金属低,C错误;
D.钢中含碳量比生铁低,D错误;
选项是B。
11.C
【详解】A.棉衬衫主要原料是纤维素,丝质衣服主要原料为蛋白质,纤维素、蛋白质均为高分子化合物,故A说法正确;
B.碳酸氢钠不稳定受热易分解生成二氧化碳,且也能与酸反应生成二氧化碳,所以碳酸氢钠可作为制作糕点的膨松剂,故B说法正确;
C.84消毒液有效成分是NaClO,洁厕灵的主要成分是盐酸,两者混合可以生成有毒的氯气,因此两溶液不能混合使用,故C说法错误;
D.镁合金具有密度小,强度高、散热好、消震性好等特点,可以制作汽车轮毂,故D说法正确;
答案为C。
12.A
【详解】A.铁合金中添加Cr、Ni,形成的合金比纯铁硬度大、耐磨耐腐蚀、有很好的韧性,故A正确;
B.只由一种元素组成的物质可能是混合物,如氧气和臭氧,故B错误;
C.胶体和溶液的本质区别是分散质粒子直径大小,故C错误;
D.石墨烯是单层石墨结构,属于单质,故D错误;
故选:A。
13.D
【分析】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,因Al2O3、SiO2与NaOH溶液反应,Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3均与盐酸反应;结合流程可知,步骤①中,用盐酸浸取铝土矿井过滤得到母液1,母液1含有AlCl3、FeCl3;向母液1中加入过量烧碱除去H+、Fe3+,并将Al3+转化为,过滤得到母液2,母液2中含有NaAlO2;向母液2中通入过量二氧化碳,得到Al(OH)3;加热Al(OH)3分解得到Al2O3,再电解氧化铝可得到Al。
【详解】A.氧化铝熔点较高,需要加入冰晶石,降低氧化铝熔融所需的温度,A项正确;
B.步骤②中加入过量NaOH溶液,作用是除去、,B项正确;
C.通入足量二氧化碳与偏铝酸根反应:,C项正确;
D.将步骤①和步骤②顺序颠倒,母液2中含有、Fe3+,再通入足量CO2能得不到氢氧化铝沉淀,D项错误;
故选D。
14.B
【详解】A.花岗岩的主要成分是石英、云母、长石等矿物,属于无机非金属材料,故A正确;
B.琉璃其化学成份是硅酸盐,属于无机硅酸盐产物;制作光导纤维的材料为二氧化硅,光导纤维属于新型无机非金属材料,B错误;
C.碳纤维指的是含碳量在90%以上的高强度高模量纤维,属于无机非金属材料,故C正确;
D.金属奖牌属于合金材料,故D正确;
故选:B。
15.C
【详解】A.之所以把金属制造为合金,就是因为合金具有许多优良的物理、化学和机械性能,A正确;
B.一般来说合金熔点比它的成分金属的低,B正确;
C.钛合金、镁合金硬度大,合金的化学性质为成分金属的性质总和,如镁合金能与酸反应,C错误;
D.目前钢是用量最大、用途最广、产量最大的合金,D正确;
故答案为:C。
16.(1)B
(2) 第3周期第ⅢA族 Fe3O4
(3) 0.9NA
(4) 若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+ 取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液 若高锰酸钾溶液紫红色褪去,说明含Fe2+
【分析】铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点;铝元素核电荷数为13,核外电子层数三个,最外层电子数3个,周期序数=电子层数,主族族序数=原子最外层电子数,据此判断在周期表中的位置,Al(OH)3与稀硫酸反应生成硫酸铝和水,铁粉与水蒸气在高温条件下反应,生成四氧化三铁和氢气,铁离子能和硫氰化钾溶液反应络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,以此解题。
【详解】(1)A.不易生锈,用作建筑装潢材料,美观,A正确;
B.导电性好,与装潢无关,B错误;
C.密度小,有利于用作建筑装潢材料,C正确;
D.强度高,用作建筑装潢材料,坚固耐用,D正确;
故选B;
(2)铝是13号元素,在周期表中的位置是:第3周期第ⅢA族;与稀硫酸反应生成硫酸铝和水,离子方程式为:;铁粉与水蒸气在高温条件下反应生成Fe3O4和氢气;
(3)3.36L氮气的物质的量为0.15mol,根据方程式,上述反应中氮元素化合价- 3价升高到0价,生成3mol氮气,电子转移总数18mole-,当生成0.15mol氮气时,转移的电子数;,有同学认为,该反应产物中不应该有Fe生成,他的理由是铁和氯化铁反应生成氯化亚铁,反应的化学方程式为:;
(4)铁离子能和硫氰化钾溶液反应生成络合物而使溶液呈血红色,亚铁离子和硫氰化钾溶液不反应,亚铁离子能被酸性高锰酸钾氧化而使酸性高锰酸钾溶液褪色,铁离子不能被酸性高锰酸钾溶液氧化,如果向溶液中滴加硫氰化钾溶液,溶液变为血红色就说明含有铁离子,否则不含铁离子如果向溶液中滴加酸性高锰酸钾溶液,如果酸性高锰酸钾溶液褪色,就说明含有亚铁离子,否则不含亚铁离子,故答案为:若溶液呈血红色,则说明含,Fe3+若不显血红色,证明没有Fe3+;取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液;若高锰酸钾溶液紫红色褪去,说明含Fe2+。
17. 2Fe2++H2O2+2H+=2Fe3++2H2O 分液漏斗 品红溶液 KMnO4溶液(H+) Ca(OH)2溶液 NaOH溶液 B中的酸性KMnO4溶液颜色变浅,而C中Ca(OH)2溶液变浑浊 D中NaOH溶液排入E中
【详解】(1)与溶液反应,元素的化合价由+2升高至+3,O元素的化合价由-1降低至-2,根据氧化还原反应化合价升降守恒、电荷守恒以及原子守恒可知反应离子方程式为;
(2)由图可知,仪器为分液漏斗;
(3)CO2和SO2能使澄清石灰水变浑浊,因此需要先检验SO2,然后将SO2除尽,然后将气体通入澄清石灰水中,因此A中为品红溶液,可检验二氧化硫气体,B中为酸性高锰酸钾溶液,可除去二氧化硫,C中为溶液,可检验二氧化碳,D中为溶液以除去二氧化碳,防止对N2检验干扰;
(4)二氧化碳可使澄清石灰水变浑浊,则气体中含有的现象是B中的酸性溶液颜色变浅(除去SO2,防止SO2进入C中使澄清石灰水变浑浊),而C中溶液浑浊,氮气不溶于溶液,气体中含有N2的现象是D中溶液排入E中。
18.(1) 、
(2)
(3)、
(4)玻璃棒、烧杯、漏斗(普通漏斗)
(5) ②; 如果只有,向溶液丁中滴入KSCN溶液后,溶液一定变红
【分析】固体粉末X可能含有,固体X加水过滤,得到溶液甲和固体甲,则溶液甲中可能有,固体甲中可能有,固体甲加入足量盐酸,滴入溶液,溶液不变色,说明没有,固体甲可以为Fe或Fe,,则溶液丁溶液;溶液甲加入稀盐酸,得到气体乙和溶液乙,气体乙能使澄清石灰石变浑浊,则气体乙为;同时溶液乙和碳酸氢铵反应可以得到溶液丙,气体乙()和沉淀丙,其中,,则溶液乙中含有过量的盐酸、NaCl和AlCl3,溶液甲一定含有,不含有,则溶液甲含有。
【详解】(1)根据分析可知溶液甲为;产生气体乙是由于H+和反应,离子方程式为:;
(2)由分析可知,气体乙为CO2,过量的CO2和澄清石灰水反应的方程式为:;
(3)根据分析可知溶液乙中含有过量的盐酸、NaCl和AlCl3,阳离子为Na+、Al3+和H+;
(4)分离溶液丙和沉淀丙的操作是过滤,过滤用到的玻璃仪器为玻璃棒、烧杯、漏斗(普通漏斗);
(5)Fe和稀盐酸反应产生FeCl2;Fe3O4和稀盐酸反应产生FeCl2和FeCl3;Fe可以和FeCl3反应产生FeCl2;向固体甲加入足量盐酸,滴入溶液,溶液不变色,说明没有,则固体甲可能含有Fe或Fe,;故错误的是②。
19.(1)生成白色沉淀,迅速变成灰绿色,最后变为红褐色
(2)2Al+2OH-+2H2O=+3H2↑
(3)Cl2+2Fe2+=2Cl-+2Fe3+
(4)4Fe(OH)2+2H2O+O2=4Fe(OH)3
(5) 锡 2:3
(6)B
(7)O2、CO2、H2O
【分析】金属焰色反应为黄色证明A为Na,与水反应生成气体甲为H2,D为NaOH,金属B和氢氧化钠溶液反应,说明B为A1,黄绿色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D和物质F反应生成H为Fe(OH)2,Fe(OH)2在空气中被氧化生成红褐色沉淀I为Fe(OH)3,G为FeC13,推断物质F为FeCl2,判断C为Fe。
【详解】(1)根据分析,D为NaOH,F为FeCl2,二者反应生成Fe(OH)2,Fe(OH)2容易被氧化,现象为生成白色沉淀,迅速变成灰绿色,最后变为红褐色;
(2)根据分析,反应③为Al与NaOH溶液的反应,离子方程式为2Al+2OH-+2H2O=+3H2↑;
(3)根据分析,反应⑦为FeCl2与Cl2的反应,离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;
(4)根据分析,反应⑥为Fe(OH)2在空气中被氧化生成Fe(OH)3的反应,方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(5)横坐标质量分数为零时熔点要比质量分数为1时熔点高,因为铅的熔点比锡的熔点高,所以横坐标表示锡的质量分数;合金熔点最低时锡占60%,所以铅占40%,合金中铅与锡的质量比为40%:60%=2:3;
(6)合金的熔点比它的组成成分熔点要低,铋、铅、锡、镉这四种物质熔点最低的是231.9,所以要选择熔点比231.9低,且不能很低,必须要高于室温,所以选择B;
(7)根据质量守恒定律可知反应前后元素种类不变,根据Cu2(OH)2CO3可知由铜、氧、氢、碳四种元素组成,所以是铜与O2、CO2、H2O三种物质作用的结果。
答案第1页,共2页
答案第1页,共2页
