3.3.2 离子晶体 课件(共26张PPT)2022-2023学年人教版高中化学选择性必修二
文档属性
| 名称 | 3.3.2 离子晶体 课件(共26张PPT)2022-2023学年人教版高中化学选择性必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:09:37 | ||
图片预览






文档简介
(共26张PPT)
第三节 金属晶体和离子晶体
第三章 晶体结构和性质
第二课时
离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
学习目标
1、掌握离子晶体的概念,能识别NaCl、CsCl、CaF2的晶胞结构。
2、认识离子晶体的物理性质与晶体结构的关系。
核心素养
1、结合常见的离子化合物实例,认识这些物质的构成微粒、微粒间相互作用与物质性质的关系,培养宏观辨识与微观探析的核心素养。
2、借助离子晶体模型认识晶体的结构特点,预测物质的性质,形成证据推理与模型认知的核心素养。
第2课时 离子晶体
离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(2)特征:
(3)影响因素:
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越 ,离子半径越 ,
(1)概念:
多
小
离子键越强。
Na+
Cl-
旧知回顾
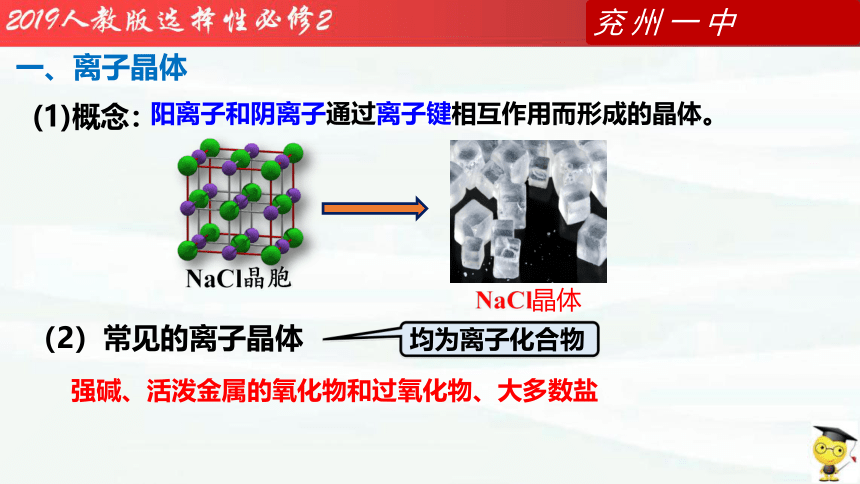
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
阳离子和阴离子通过离子键相互作用而形成的晶体。
(2)常见的离子晶体
(1)概念:
均为离子化合物
NaCl晶胞
NaCl晶体
二、常见离子晶体的结构
1. NaCl晶胞
NaCl晶胞的球棍模型
NaCl晶胞的空间填充模型
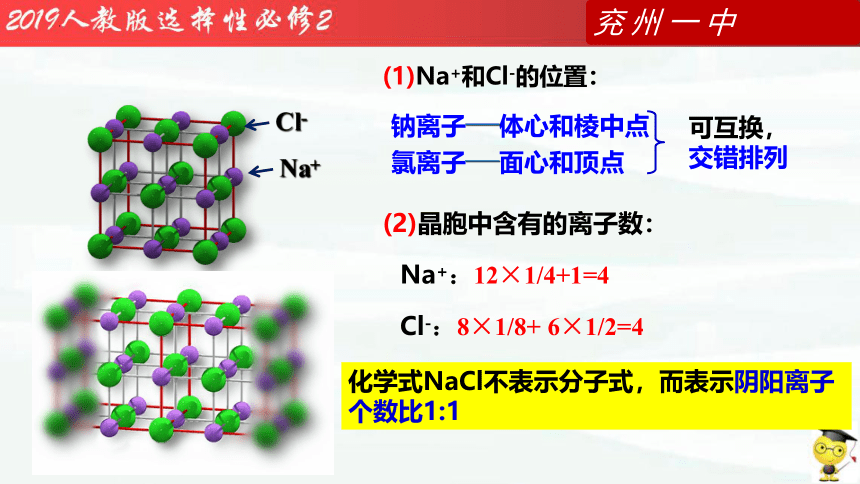
思考:(1)Na+和Cl-的位置:
(2)晶胞中含有的Na+和Cl-的数目
Na+
(2)晶胞中含有的离子数:
钠离子——体心和棱中点
氯离子——面心和顶点
(1)Na+和Cl-的位置:
可互换,
交错排列
化学式NaCl不表示分子式,而表示阴阳离子个数比1:1
Cl-
Na+:12×1/4+1=4
Cl-:8×1/8+ 6×1/2=4
乳山市银滩高中
问题组一
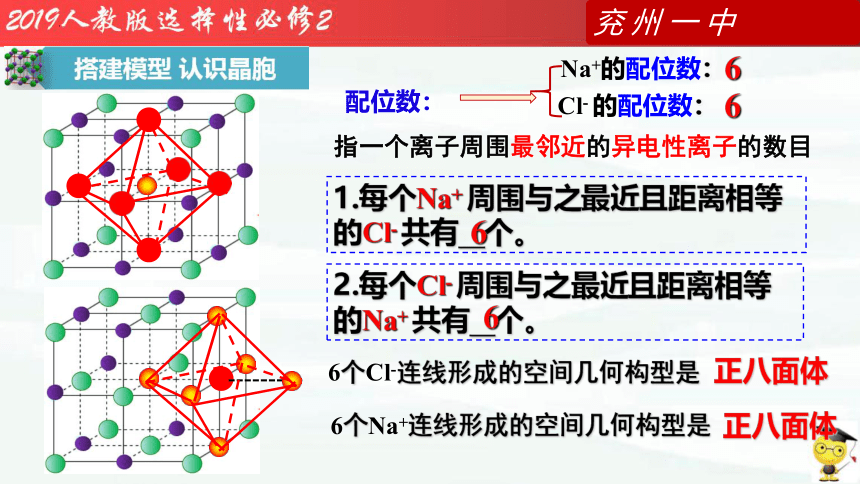
1.每个 Na+周围最近且距离相等的 Cl- 有 个。
2.每个 Cl- 周围最近且距离相等的 Na+ 有 个。
3.每个 Na+周围最近且距离相等的 Na+有 个。
4.每个 Cl- 周围最近且距离相等的Cl-有 个。
2.每个Cl- 周围与之最近且距离相等的Na+ 共有 个。
6
6个Cl-连线形成的空间几何构型是
正八面体
1.每个Na+ 周围与之最近且距离相等的Cl- 共有 个。
6个Na+连线形成的空间几何构型是
正八面体
6
配位数:
Na+的配位数:
Cl- 的配位数:
6
6
指一个离子周围最邻近的异电性离子的数目
3. 每个Na+周围最近的Na+有 个。
4. 每个 Cl-周围最近的Cl-有 个。
12
12
Cl-
Na+
小结NaCl的微观结构特征
(1) 每个NaCl晶胞中含Na+和的Cl-数目:
(2) Na+ 的配位数:
Cl- 的配位数:
6
6
(3) Na+ 周围最近的Na+ 数:
Cl- 周围最近的Cl- 数:
12
12
4个Na+和4个Cl-
(1) 粒子位置
Cl- ——顶点
Cs+ ——体心
或者反之;交错排列
2. CsCl晶胞
CsCl型
1.一个晶胞中Cs+和Cl-的个数:
2. Cs+的配位数:
Cl- 的配位数:
3. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
问题组二
CsCl型
1.一个晶胞中Cs+和Cl-的个数:
2. Cs+的配位数:
Cl-的配位数:
Cl-
Cs+
问题组二
8
8
1
1
2
4
3
7
6
5
以Cs+在晶胞的顶点为例
8
6
CsCl晶胞
3. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
6
小结CsCl的微观结构特征
(1) 每个CsCl晶胞中含Cs+和Cl-的数目:
(2) Cs+的配位数:
Cl- 的配位数:
8
8
(3) Cs+周围最近的Cs+数:
Cl-周围最近的Cl-数:
6
6
Cl-
Cs+
Cl-
Cs+
1个Cs+和1个Cl-
1. 粒子位置:
2. 微粒数:
3. 阴阳离子配位数比:
Ca2+——顶点和面心
F- ——立方体内
4个Ca2+,8个F-
1:2
3、CaF2晶胞
F- 配位数:
配位Ca2+的几何图形:
Ca2+配位数:
配位F-的几何图形:
8
正方体
4
正四面体
=
阳离子数
阴离子数
阴离子的配位数
阳离子的配位数
问题组三
讨论:CuSO4·5H2O 晶体内部存在哪些类型的作用力?
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成
微粒
离子键、共价键
氢键、范德华力
作用力
注意:贯穿整个晶体的主要作用力仍是阴、阳离子之间的作用力。
三、离子晶体的物理性质
1、一般熔沸点较高,硬度较大。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
离子晶体 NaCl CsCl
熔点/℃ 801 645
沸点/℃ 1413 1290
说明NaCl晶体中的离子键比CsCl晶体中的离子键强。
比较不同离子晶体的熔点,能得出什么结论?
【思考与讨论】
物质 熔点/℃ 物质 熔点/℃
CaO 2613 Na2SO 4 884
KCl 770 Ca2SiO4 2130
NH4NO3 169.6 Na3PO4 340
BaSO4 1580 CH3COOCs 194
LiPF6 200(分解) NaNO2 270
结论:
离子晶体的熔、沸点差异也比较大。
2、难挥发难压缩,
3、水溶液或者熔融状态下导电。
4、大多易溶于极性溶剂H2O,难溶于非极性溶剂(汽油、苯、CCl4等)
三、离子晶体的物理性质:
1、熔沸点较高,硬度较大。
注:判断离子晶体,可根据其熔融状态能否导电进行
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
应 用:作溶剂。用作电化学研究的电解质;有机合成的溶剂和催化剂,等
科学 技术 社会——离子液体
离子液体:
室温或稍高于室温时呈液态的离子化合物
引入有机基团可降低离子化合物的熔点,如C2H5NH3NO3的熔点只有12℃,比NH4NO3低了158℃!
性 质:难挥发、有良好的导电性。
课 堂 小 结
1、正误判断
(1)离子晶体中一定含有金属元素( )
(2)由金属元素和非金属元素组成的晶体一定是离子晶体( )
(3)有些离子晶体中除含离子键外还存在共价键( )
(4)离子晶体的熔点一定低于共价晶体的熔点( )
(5)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(6)某些离子晶体受热失去结晶水,属于物理变化( )
×
×
×
×
×
√
课堂达标
NH4Cl
AlCl3
NH4Cl
CuSO4·5H2O
CuSO4
2、下列有关离子晶体的叙述中,不正确的是
A.1 mol氯化钠晶体中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个
C.醋酸钠属于离子晶体,含非极性键
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
A
3、MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )
A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
B
第三节 金属晶体和离子晶体
第三章 晶体结构和性质
第二课时
离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
下列晶体构成微粒有什么共同点?
微粒之间存在哪种相同的作用力?
学习目标
1、掌握离子晶体的概念,能识别NaCl、CsCl、CaF2的晶胞结构。
2、认识离子晶体的物理性质与晶体结构的关系。
核心素养
1、结合常见的离子化合物实例,认识这些物质的构成微粒、微粒间相互作用与物质性质的关系,培养宏观辨识与微观探析的核心素养。
2、借助离子晶体模型认识晶体的结构特点,预测物质的性质,形成证据推理与模型认知的核心素养。
第2课时 离子晶体
离子键
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(2)特征:
(3)影响因素:
离子键没有方向性和饱和性。
一般说来,阴、阳离子的电荷数越 ,离子半径越 ,
(1)概念:
多
小
离子键越强。
Na+
Cl-
旧知回顾
一、离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
阳离子和阴离子通过离子键相互作用而形成的晶体。
(2)常见的离子晶体
(1)概念:
均为离子化合物
NaCl晶胞
NaCl晶体
二、常见离子晶体的结构
1. NaCl晶胞
NaCl晶胞的球棍模型
NaCl晶胞的空间填充模型
思考:(1)Na+和Cl-的位置:
(2)晶胞中含有的Na+和Cl-的数目
Na+
(2)晶胞中含有的离子数:
钠离子——体心和棱中点
氯离子——面心和顶点
(1)Na+和Cl-的位置:
可互换,
交错排列
化学式NaCl不表示分子式,而表示阴阳离子个数比1:1
Cl-
Na+:12×1/4+1=4
Cl-:8×1/8+ 6×1/2=4
乳山市银滩高中
问题组一
1.每个 Na+周围最近且距离相等的 Cl- 有 个。
2.每个 Cl- 周围最近且距离相等的 Na+ 有 个。
3.每个 Na+周围最近且距离相等的 Na+有 个。
4.每个 Cl- 周围最近且距离相等的Cl-有 个。
2.每个Cl- 周围与之最近且距离相等的Na+ 共有 个。
6
6个Cl-连线形成的空间几何构型是
正八面体
1.每个Na+ 周围与之最近且距离相等的Cl- 共有 个。
6个Na+连线形成的空间几何构型是
正八面体
6
配位数:
Na+的配位数:
Cl- 的配位数:
6
6
指一个离子周围最邻近的异电性离子的数目
3. 每个Na+周围最近的Na+有 个。
4. 每个 Cl-周围最近的Cl-有 个。
12
12
Cl-
Na+
小结NaCl的微观结构特征
(1) 每个NaCl晶胞中含Na+和的Cl-数目:
(2) Na+ 的配位数:
Cl- 的配位数:
6
6
(3) Na+ 周围最近的Na+ 数:
Cl- 周围最近的Cl- 数:
12
12
4个Na+和4个Cl-
(1) 粒子位置
Cl- ——顶点
Cs+ ——体心
或者反之;交错排列
2. CsCl晶胞
CsCl型
1.一个晶胞中Cs+和Cl-的个数:
2. Cs+的配位数:
Cl- 的配位数:
3. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
问题组二
CsCl型
1.一个晶胞中Cs+和Cl-的个数:
2. Cs+的配位数:
Cl-的配位数:
Cl-
Cs+
问题组二
8
8
1
1
2
4
3
7
6
5
以Cs+在晶胞的顶点为例
8
6
CsCl晶胞
3. Cs+周围最近且距离相等的Cs+个数:
Cl- 周围最近且距离相等的Cl-个数:
6
小结CsCl的微观结构特征
(1) 每个CsCl晶胞中含Cs+和Cl-的数目:
(2) Cs+的配位数:
Cl- 的配位数:
8
8
(3) Cs+周围最近的Cs+数:
Cl-周围最近的Cl-数:
6
6
Cl-
Cs+
Cl-
Cs+
1个Cs+和1个Cl-
1. 粒子位置:
2. 微粒数:
3. 阴阳离子配位数比:
Ca2+——顶点和面心
F- ——立方体内
4个Ca2+,8个F-
1:2
3、CaF2晶胞
F- 配位数:
配位Ca2+的几何图形:
Ca2+配位数:
配位F-的几何图形:
8
正方体
4
正四面体
=
阳离子数
阴离子数
阴离子的配位数
阳离子的配位数
问题组三
讨论:CuSO4·5H2O 晶体内部存在哪些类型的作用力?
离子晶体
阴、阳离子
(单原子或多原子)
电中性分子
构成
微粒
离子键、共价键
氢键、范德华力
作用力
注意:贯穿整个晶体的主要作用力仍是阴、阳离子之间的作用力。
三、离子晶体的物理性质
1、一般熔沸点较高,硬度较大。
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
离子晶体 NaCl CsCl
熔点/℃ 801 645
沸点/℃ 1413 1290
说明NaCl晶体中的离子键比CsCl晶体中的离子键强。
比较不同离子晶体的熔点,能得出什么结论?
【思考与讨论】
物质 熔点/℃ 物质 熔点/℃
CaO 2613 Na2SO 4 884
KCl 770 Ca2SiO4 2130
NH4NO3 169.6 Na3PO4 340
BaSO4 1580 CH3COOCs 194
LiPF6 200(分解) NaNO2 270
结论:
离子晶体的熔、沸点差异也比较大。
2、难挥发难压缩,
3、水溶液或者熔融状态下导电。
4、大多易溶于极性溶剂H2O,难溶于非极性溶剂(汽油、苯、CCl4等)
三、离子晶体的物理性质:
1、熔沸点较高,硬度较大。
注:判断离子晶体,可根据其熔融状态能否导电进行
一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大
应 用:作溶剂。用作电化学研究的电解质;有机合成的溶剂和催化剂,等
科学 技术 社会——离子液体
离子液体:
室温或稍高于室温时呈液态的离子化合物
引入有机基团可降低离子化合物的熔点,如C2H5NH3NO3的熔点只有12℃,比NH4NO3低了158℃!
性 质:难挥发、有良好的导电性。
课 堂 小 结
1、正误判断
(1)离子晶体中一定含有金属元素( )
(2)由金属元素和非金属元素组成的晶体一定是离子晶体( )
(3)有些离子晶体中除含离子键外还存在共价键( )
(4)离子晶体的熔点一定低于共价晶体的熔点( )
(5)离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(6)某些离子晶体受热失去结晶水,属于物理变化( )
×
×
×
×
×
√
课堂达标
NH4Cl
AlCl3
NH4Cl
CuSO4·5H2O
CuSO4
2、下列有关离子晶体的叙述中,不正确的是
A.1 mol氯化钠晶体中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围距离最近且相等的Cl-共有6个
C.醋酸钠属于离子晶体,含非极性键
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
A
3、MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )
A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
B
