3.4.1 配合物 课件(共17张PPT)2022-2023学年人教版高中化学选择性必修二
文档属性
| 名称 | 3.4.1 配合物 课件(共17张PPT)2022-2023学年人教版高中化学选择性必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:10:19 | ||
图片预览



文档简介
(共17张PPT)
§3-4 配合物与超分子
第一课时 配合物
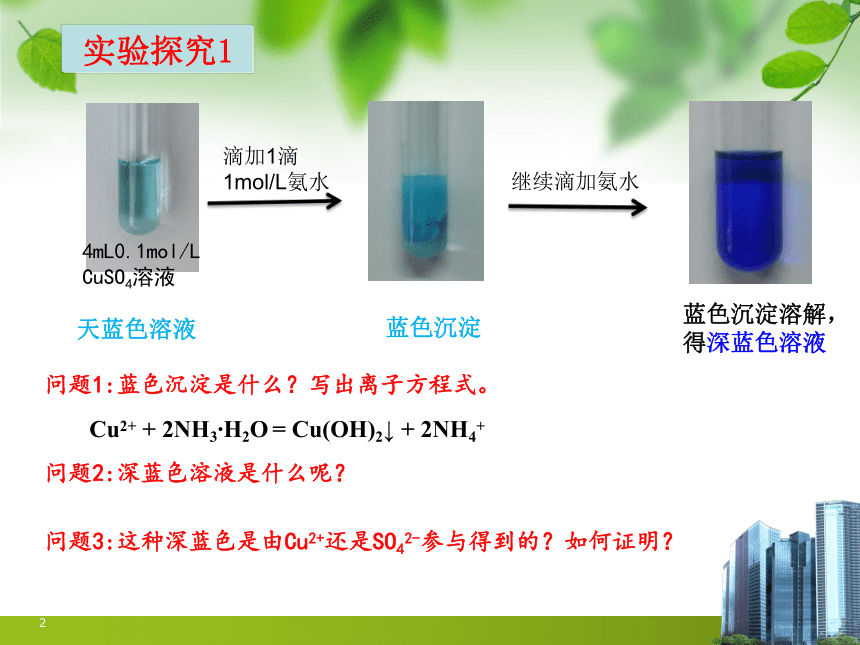
实验探究1
2
4mL0.1mol/LCuSO4溶液
滴加1滴1mol/L氨水
继续滴加氨水
问题1:蓝色沉淀是什么?写出离子方程式。
天蓝色溶液
蓝色沉淀
蓝色沉淀溶解,得深蓝色溶液
问题2:深蓝色溶液是什么呢?
问题3:这种深蓝色是由Cu2+还是SO42-参与得到的?如何证明?
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
实验探究2
3
目的 方案 现象 结论
滴入几滴BaCl2溶液
有白色沉淀生成,混合物仍为蓝色
SO42-未参与深蓝色物质生成
加入乙醇,并用玻璃棒摩擦试管壁
Cu2+参与深蓝色物质的生成
溶液变浑浊,有晶体析出
在水中易溶,在乙醇中难溶,该晶体是离子化合物
[Cu(NH3)4]2+
检验SO42-
制备晶体
[Cu(NH3)4]SO4 H2O
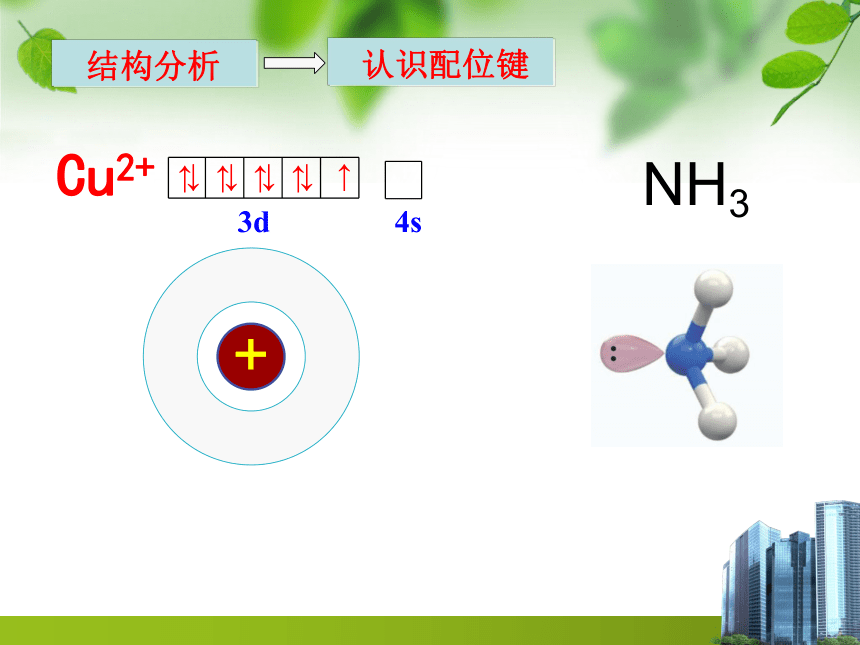
Cu2+
NH3
3d 4s
↓ ↓ ↓ ↓ ↑
↑ ↑ ↑ ↑
+
结构分析
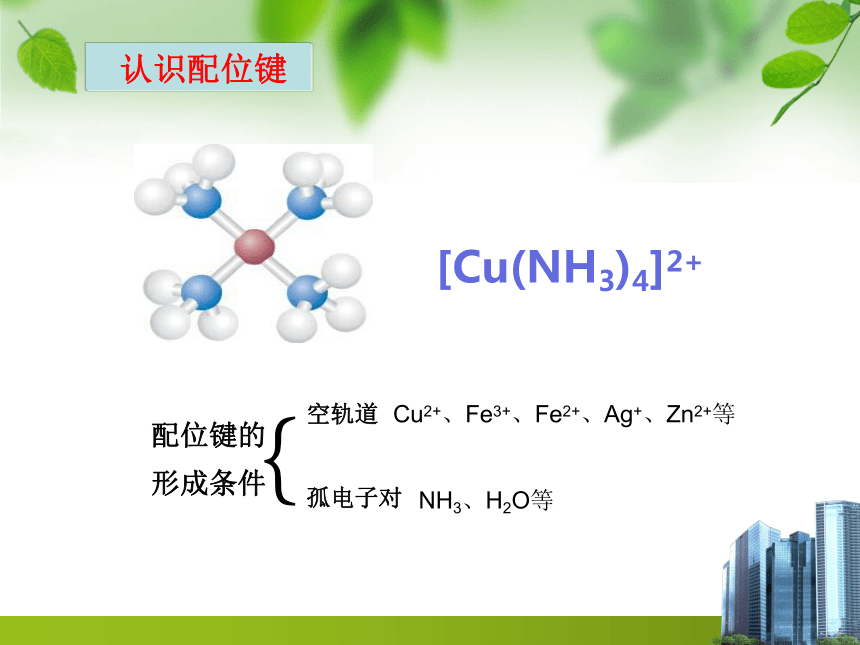
认识配位键
配位键的形成条件
{
空轨道
孤电子对
Cu2+、Fe3+、Fe2+、Ag+、Zn2+等
NH3、H2O等
[Cu(NH3)4]2+
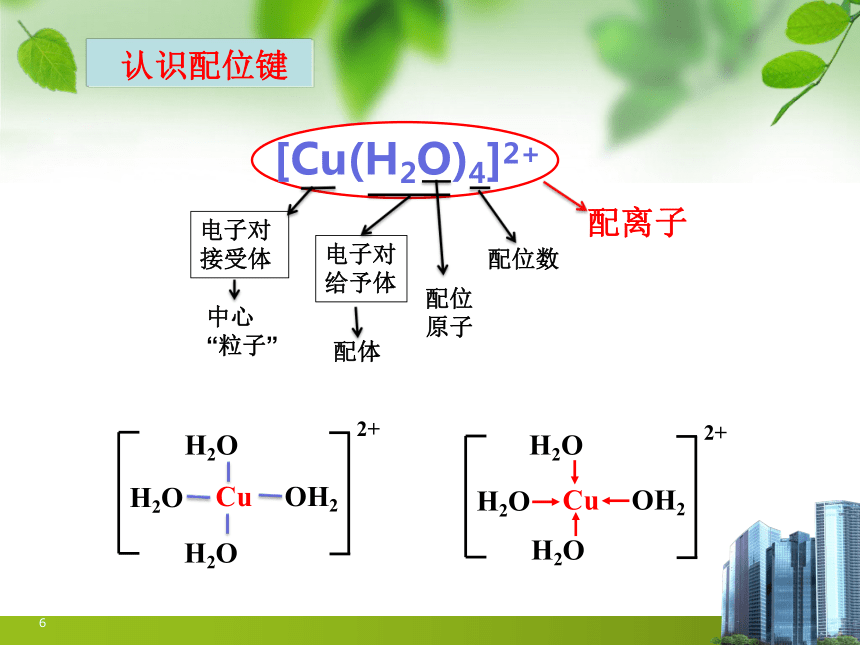
认识配位键
6
2+
Cu
H2O
H2O
OH2
H2O
2+
Cu
H2O
H2O
OH2
H2O
[Cu(H2O)4]2+
中心“粒子”
配位原子
配体
配位数
配离子
电子对接受体
电子对给予体
认识配位键
实验探究1
7
4mL0.1mol/LCuSO4溶液
滴加几滴1mol/L氨水
继续滴加氨水
问题1:蓝色沉淀是什么?写出离子方程式。
天蓝色溶液
蓝色沉淀
蓝色沉淀溶解,得深蓝色溶液
问题2:深蓝色溶液是什么?写出离子方程式。
问题3:这种深蓝色是由Cu2+还是SO42-参与得到的?如何证明?
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
8
认识配合物
[Cu(NH3)4]SO4= +
[Cu(NH3)4]2+
SO42-
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
9
练习
请根据给出的配合物完成下表
无外界
中心“粒子”也可以是金属原子
中心“粒子”也可以是主族金属
1个配体可存在多个配位原子
同种中心粒子可以结合多种配体
配体不同时,配合物的颜色就不同
配体可以是中性分子
也可以是离子
双齿配体
+ 4Cl- + 4H2O
=
[CuCl4]2-
黄色
[Cu(H2O)4]2+
天蓝色
揭秘时刻
实验探究3
步骤 现象 原理解释
向盛有少量0.1mol/L FeCl3溶液中逐滴滴加0.1mol/L KSCN溶液
溶液中Fe3+的检验
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
Fe3+ + SCN- Fe(SCN)2+
…………
Fe(SCN)5 + SCN- Fe(SCN)6
2-
3-
Fe(SCN)2+ + SCN- Fe(SCN)2
+
步骤 现象 原理解释
向盛有少量0.1mol/L NaCl溶液的试管里滴几滴0.1mol/L AgNO3溶液
继续滴入1mol/L氨水并振荡试管
有白色沉淀生成
白色沉淀溶解,得无色溶液
Ag+ + Cl- = AgCl ↓
AgCl+ 2NH3 =[Ag(NH3)2]+ + Cl-
实验探究4
银氨溶液的制备
配位键和配合物在生命体中大量存在,对于生命活动具有重要意义。
叶绿素
维生素B12
血红蛋白
第二代铂类抗癌药--碳铂
抗结剂
资料卡片
配位键的强度有大有小,有的配合物很稳定,有的很不稳定。许多过渡金属元素的离子对多种配体都有很强的结合力,所以过渡金属配合物远比主族金属配合物要多。
预设目标:
1、知道配位键的特点。
2、认识简单的配位化合物的成键特征。
3、了解配位化合物的存在及应用。
4、学生必做实验:简单配合物的制备
瑞士化学家维尔纳
(1866-1919)
中国化学家戴安邦
(1901-1999)
作业:
1、学案上相应的习题。
2、试从结构的角度分析,NH3与H2O谁的配位能力强? 如何用实验证明?
§3-4 配合物与超分子
第一课时 配合物
实验探究1
2
4mL0.1mol/LCuSO4溶液
滴加1滴1mol/L氨水
继续滴加氨水
问题1:蓝色沉淀是什么?写出离子方程式。
天蓝色溶液
蓝色沉淀
蓝色沉淀溶解,得深蓝色溶液
问题2:深蓝色溶液是什么呢?
问题3:这种深蓝色是由Cu2+还是SO42-参与得到的?如何证明?
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
实验探究2
3
目的 方案 现象 结论
滴入几滴BaCl2溶液
有白色沉淀生成,混合物仍为蓝色
SO42-未参与深蓝色物质生成
加入乙醇,并用玻璃棒摩擦试管壁
Cu2+参与深蓝色物质的生成
溶液变浑浊,有晶体析出
在水中易溶,在乙醇中难溶,该晶体是离子化合物
[Cu(NH3)4]2+
检验SO42-
制备晶体
[Cu(NH3)4]SO4 H2O
Cu2+
NH3
3d 4s
↓ ↓ ↓ ↓ ↑
↑ ↑ ↑ ↑
+
结构分析
认识配位键
配位键的形成条件
{
空轨道
孤电子对
Cu2+、Fe3+、Fe2+、Ag+、Zn2+等
NH3、H2O等
[Cu(NH3)4]2+
认识配位键
6
2+
Cu
H2O
H2O
OH2
H2O
2+
Cu
H2O
H2O
OH2
H2O
[Cu(H2O)4]2+
中心“粒子”
配位原子
配体
配位数
配离子
电子对接受体
电子对给予体
认识配位键
实验探究1
7
4mL0.1mol/LCuSO4溶液
滴加几滴1mol/L氨水
继续滴加氨水
问题1:蓝色沉淀是什么?写出离子方程式。
天蓝色溶液
蓝色沉淀
蓝色沉淀溶解,得深蓝色溶液
问题2:深蓝色溶液是什么?写出离子方程式。
问题3:这种深蓝色是由Cu2+还是SO42-参与得到的?如何证明?
Cu2+ + 2NH3 H2O = Cu(OH)2↓ + 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH-
8
认识配合物
[Cu(NH3)4]SO4= +
[Cu(NH3)4]2+
SO42-
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
9
练习
请根据给出的配合物完成下表
无外界
中心“粒子”也可以是金属原子
中心“粒子”也可以是主族金属
1个配体可存在多个配位原子
同种中心粒子可以结合多种配体
配体不同时,配合物的颜色就不同
配体可以是中性分子
也可以是离子
双齿配体
+ 4Cl- + 4H2O
=
[CuCl4]2-
黄色
[Cu(H2O)4]2+
天蓝色
揭秘时刻
实验探究3
步骤 现象 原理解释
向盛有少量0.1mol/L FeCl3溶液中逐滴滴加0.1mol/L KSCN溶液
溶液中Fe3+的检验
Fe3+ + nSCN- [Fe(SCN)n]3-n(n=1~6)
Fe3+ + SCN- Fe(SCN)2+
…………
Fe(SCN)5 + SCN- Fe(SCN)6
2-
3-
Fe(SCN)2+ + SCN- Fe(SCN)2
+
步骤 现象 原理解释
向盛有少量0.1mol/L NaCl溶液的试管里滴几滴0.1mol/L AgNO3溶液
继续滴入1mol/L氨水并振荡试管
有白色沉淀生成
白色沉淀溶解,得无色溶液
Ag+ + Cl- = AgCl ↓
AgCl+ 2NH3 =[Ag(NH3)2]+ + Cl-
实验探究4
银氨溶液的制备
配位键和配合物在生命体中大量存在,对于生命活动具有重要意义。
叶绿素
维生素B12
血红蛋白
第二代铂类抗癌药--碳铂
抗结剂
资料卡片
配位键的强度有大有小,有的配合物很稳定,有的很不稳定。许多过渡金属元素的离子对多种配体都有很强的结合力,所以过渡金属配合物远比主族金属配合物要多。
预设目标:
1、知道配位键的特点。
2、认识简单的配位化合物的成键特征。
3、了解配位化合物的存在及应用。
4、学生必做实验:简单配合物的制备
瑞士化学家维尔纳
(1866-1919)
中国化学家戴安邦
(1901-1999)
作业:
1、学案上相应的习题。
2、试从结构的角度分析,NH3与H2O谁的配位能力强? 如何用实验证明?
