【金版学案】2014-2015学年高中化学 第二章 本章归纳整合 新人教版选修5
文档属性
| 名称 | 【金版学案】2014-2015学年高中化学 第二章 本章归纳整合 新人教版选修5 | 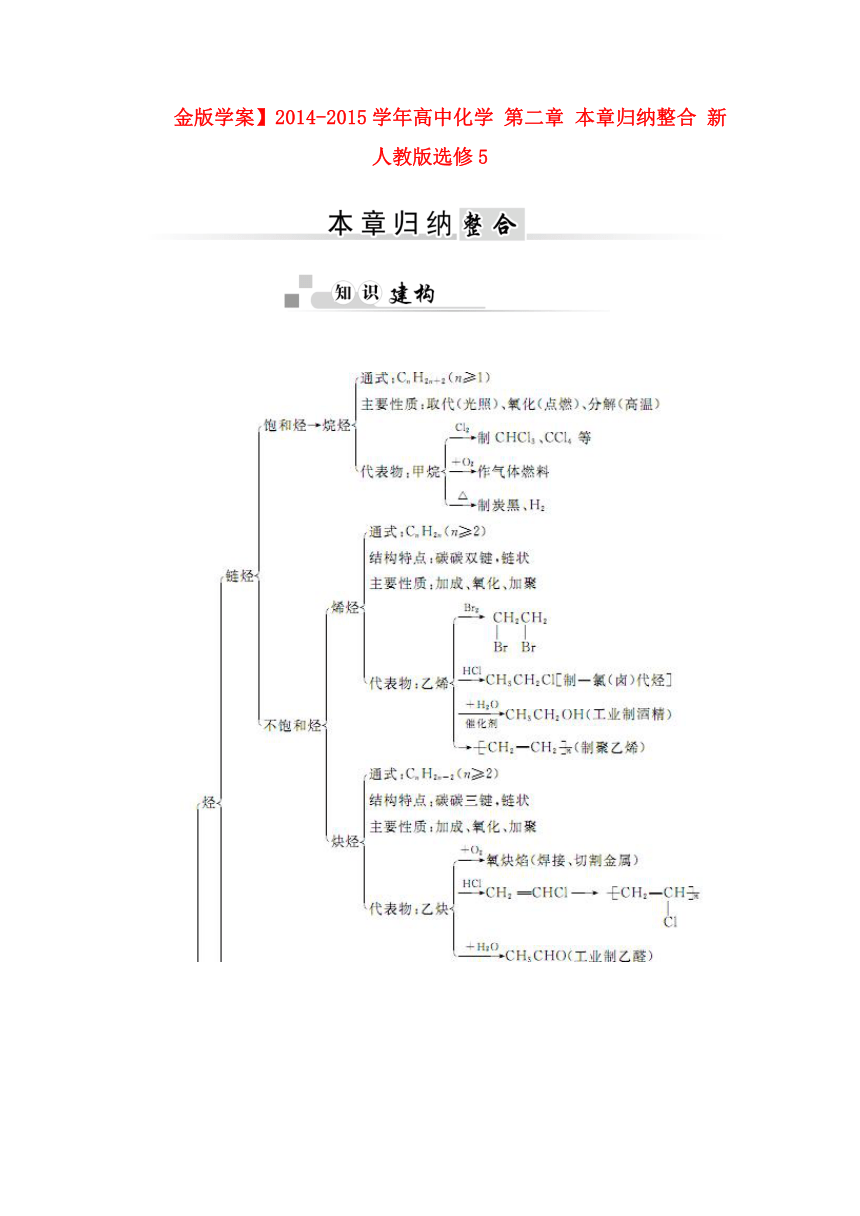 | |
| 格式 | zip | ||
| 文件大小 | 279.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-09-28 10:55:32 | ||
图片预览



文档简介
金版学案】2014-2015学年高中化学 第二章 本章归纳整合 新人教版选修5
( http: / / www.21cnjy.com )
( http: / / www.21cnjy.com )
专题一 烃的燃烧规律
1.气态烃(包括混合物)燃烧后体积或压强变化规律。
根据烃的燃烧通式CxHy+O2xCO2+H2O,设烃的物质的量为1 mol,可知:
(1)当温度低于100 ℃时,气态烃燃烧前后气体总体积变化为。
(2)当温度在100 ℃以上时,气态烃燃烧前后气体总体积变化为。
①若充分燃烧后,总体积不变,则-1=0,y=4,所以此烃的分子式可能为CH4、C2H4、C3H4。
②若充分燃烧后,总物质的量减少,则-1<0,y<4,则此烃只能是C2H2。
③若充分燃烧后,总物质的量增加,则-1>0,y>4,则所有氢原子数大于4的烃均有可能。
2.等量烃完全燃烧时耗氧的计算及规律。
(1)等物质的量的烃完全燃烧时耗氧量的计算。
①对于等物质的量(1 mol)的烃CxHy完全燃烧时,消耗氧气的物质的量为mol。若的值越大,消耗氧气的物质的量也越大。
②总物质的量不变,以任意比例混合的有机物 ( http: / / www.21cnjy.com ),当产生二氧化碳相同时,则有机物分子中所含碳的原子数相同;当产生水相同时,则有机物分子中所含的氢原子数相同。
③等物质的量烃燃烧时,每增加1个C(或4个H)多消耗1个O2。
(2)等质量的烃完全燃烧时耗氧量的计算。
①等质量的烃CxHy完全燃烧时,若烃分子中氢元素的质量分数越大,其耗氧量也越大。即若y/x的值越大,则该烃完全燃烧的耗氧量也越大。
②总质量不变,以任意质量比混合的有机物,当 ( http: / / www.21cnjy.com )产生二氧化碳相同时,则有机物分子中C%相同;当产生水相同时,则有机物分子中H%相同。最简式相同的有机物无论以何种比例混合,只要总质量相同,生成的CO2和H2O的量均相同。
③等质量的烃燃烧时,因1个C(或4个H)消耗1个O2,所以C%越大消耗氧气的量越小;H%越大消耗氧气的量越大。
(双选)下列各组物质中,只要总质量一定,不论以何种比例混合,完全燃烧,生成的二氧化碳和水的质量也总是定值的是( )
A.丙烷和丙烯 B.乙烯和环丙烷
C.乙烯和丁烯 D.甲烷和乙烷
解析:最简式相同的有机物无论以何种比例混合 ( http: / / www.21cnjy.com ),只要总质量相同,生成的二氧化碳和水的质量均是定值。丙烷的分子式为C3H8,丙烯的分子式为C3H6,乙烯的分子式为C2H4,环丙烷的分子式为C3H6,丁烯的分子式为C4H8,甲烷的分子式为CH4,乙烷的分子式为C2H6。故只有B、C中两者的最简式相同。
答案:BC
专题二 有机物分子中原子共线、共面问题
1.基本空间结构。
(1)甲烷。
( http: / / www.21cnjy.com ) 正四面体结构,碳原子居于四面体的中心,分子中的5个原子中任意4个不在同一平面上。
(2)乙烯。
( http: / / www.21cnjy.com ) 平面结构,分子中的6个原子处于同一平面内,键角都为120°。
(3)乙炔。
直线结构,分子中的4个原子处于同一直线上。
(4)苯。
平面结构,分子中的12个原子都处于同一平面内。
2.主体结构的推演。
以上四种分子中的H原子如果被其他原子所取代,取代后的分子构型基本不变。
(1)甲烷结构。
①CCl4:正四面体结构。
②环己烷:6个碳原子不可能共面。
③丙烷(CH3CH2CH3):3个碳原子不可能共线。
(2)乙烯结构。
①:6个碳原子共面。
②CH2===CH—CH===CH2:4个碳原子共面,所有原子也共面。
③:4个碳原子共面,所有原子也共面,3个碳原子共线。
(3)乙炔结构。
:4个碳原子共线。
(4)苯结构。
①:7个碳原子共面。
②:8个碳原子可能共面。
③:5个碳原子共线,9个碳原子可能共面。
④:所有原子共面。
下列有机分子中,所有原子不可能处于同一平面的是( )
A.CH2===CH—CN
B.CH2===CH—CH===CH2
C.C6H5—CH===CH2
D.CH2===C(CH3)—CH===CH2
解析:根据双键和苯环的结构 ( http: / / www.21cnjy.com )特点可知,A项中所有原子处于同一平面内;B项与A项相似,是典型的共轭双键结构,且没有任何支链,所有原子都处于同一平面内;C项中苯环是平面结构,碳碳双键也是平面结构,两者结合可能处于同一平面;D项中有一个甲基,甲基是非平面结构,所有原子不可能处于同一平面。
答案:D
专题三 烃的分子式的确定
1.基本方法总结。
(1)若题目给出元素的质量分数、相对密 ( http: / / www.21cnjy.com )度等,可先求实验式,再根据相对分子质量确定分子式。也可根据相对分子质量、元素的质量分数求出分子中各元素的原子个数,再求分子式。
(2)由相对分子质量和组成通式求分子式。
(3)由烃燃烧方程式CxHy+O2xCO2+H2O计算、推理、讨论、确定分子式(差量法、讨论法、守恒法)。
(4)商除法求分子式。
借助各类烃的通式,由相对分子质量求烃的分子式可采用如下“商值通式”的判断法。
假设某烃的相对分子质量为Mr,则有:
①Mr/14能整除,可推知为烯烃或环烷烃,其商为碳原子数。
②Mr/14余2能除尽,可推知为烷烃,其商为碳原子数。
③Mr/14差2能除尽,可推知为炔烃或二烯烃,其商为碳原子数。
④Mr/14差6能除尽,可推知为苯或苯的同系物,其商为碳原子数。
(5)由实验式(CaHb)讨论分子式。
①若<,该烃必为烷烃,设分子式为CnH2n+2,=,求n即可。
②若=,需知道相对分子质量,再求分子式。
③若<<1,则该烃可能为CnH2n-2、CnH2n-6等,可直接求分子式,用CnH2n-2或CnH2n-6分别代入验证即可。
2.混合烃组成的确定方法。
(1)当烃为混合物时,一般是设平均 ( http: / / www.21cnjy.com )分子式,结合反应式和体积求出平均组成,利用平均值的含义确定各种可能混合烃的分子式。有时也利用平均式量来确定可能的组成,此时用十字交叉法计算较为简捷。
(2)两混合烃,若其平均式量小于或等于26,则该烃中必含甲烷。
(3)两混合气态烃,充分燃烧后,生 ( http: / / www.21cnjy.com )成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必含CH4;若生成水的物质的量小于2倍的原混合烃的物质的量,则必含C2H2。
(4)气体混合烃与足量的氧气充分燃烧后,若总 ( http: / / www.21cnjy.com )体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,氢原子平均数大于4;若体积缩小,氢原子平均数小于4,即必含C2H2(温度在100 ℃以上)。
(双选)25 ℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25 ℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为( )
A.C2H4 B.C2H6
C.C3H6 D.C3H8
解析:设该烃的分子式为CxHy,则
CxHy+O2xCO2+H2O,由题意可知,烃和O2的物质的量之和为CO2物质的量的2倍,即1+=2x,解得x=1+。当y=4时,x=2;当y=6时,x=2.5,不合题意;当y=8时,x=3。
答案:AD
( http: / / www.21cnjy.com )
( http: / / www.21cnjy.com )
专题一 烃的燃烧规律
1.气态烃(包括混合物)燃烧后体积或压强变化规律。
根据烃的燃烧通式CxHy+O2xCO2+H2O,设烃的物质的量为1 mol,可知:
(1)当温度低于100 ℃时,气态烃燃烧前后气体总体积变化为。
(2)当温度在100 ℃以上时,气态烃燃烧前后气体总体积变化为。
①若充分燃烧后,总体积不变,则-1=0,y=4,所以此烃的分子式可能为CH4、C2H4、C3H4。
②若充分燃烧后,总物质的量减少,则-1<0,y<4,则此烃只能是C2H2。
③若充分燃烧后,总物质的量增加,则-1>0,y>4,则所有氢原子数大于4的烃均有可能。
2.等量烃完全燃烧时耗氧的计算及规律。
(1)等物质的量的烃完全燃烧时耗氧量的计算。
①对于等物质的量(1 mol)的烃CxHy完全燃烧时,消耗氧气的物质的量为mol。若的值越大,消耗氧气的物质的量也越大。
②总物质的量不变,以任意比例混合的有机物 ( http: / / www.21cnjy.com ),当产生二氧化碳相同时,则有机物分子中所含碳的原子数相同;当产生水相同时,则有机物分子中所含的氢原子数相同。
③等物质的量烃燃烧时,每增加1个C(或4个H)多消耗1个O2。
(2)等质量的烃完全燃烧时耗氧量的计算。
①等质量的烃CxHy完全燃烧时,若烃分子中氢元素的质量分数越大,其耗氧量也越大。即若y/x的值越大,则该烃完全燃烧的耗氧量也越大。
②总质量不变,以任意质量比混合的有机物,当 ( http: / / www.21cnjy.com )产生二氧化碳相同时,则有机物分子中C%相同;当产生水相同时,则有机物分子中H%相同。最简式相同的有机物无论以何种比例混合,只要总质量相同,生成的CO2和H2O的量均相同。
③等质量的烃燃烧时,因1个C(或4个H)消耗1个O2,所以C%越大消耗氧气的量越小;H%越大消耗氧气的量越大。
(双选)下列各组物质中,只要总质量一定,不论以何种比例混合,完全燃烧,生成的二氧化碳和水的质量也总是定值的是( )
A.丙烷和丙烯 B.乙烯和环丙烷
C.乙烯和丁烯 D.甲烷和乙烷
解析:最简式相同的有机物无论以何种比例混合 ( http: / / www.21cnjy.com ),只要总质量相同,生成的二氧化碳和水的质量均是定值。丙烷的分子式为C3H8,丙烯的分子式为C3H6,乙烯的分子式为C2H4,环丙烷的分子式为C3H6,丁烯的分子式为C4H8,甲烷的分子式为CH4,乙烷的分子式为C2H6。故只有B、C中两者的最简式相同。
答案:BC
专题二 有机物分子中原子共线、共面问题
1.基本空间结构。
(1)甲烷。
( http: / / www.21cnjy.com ) 正四面体结构,碳原子居于四面体的中心,分子中的5个原子中任意4个不在同一平面上。
(2)乙烯。
( http: / / www.21cnjy.com ) 平面结构,分子中的6个原子处于同一平面内,键角都为120°。
(3)乙炔。
直线结构,分子中的4个原子处于同一直线上。
(4)苯。
平面结构,分子中的12个原子都处于同一平面内。
2.主体结构的推演。
以上四种分子中的H原子如果被其他原子所取代,取代后的分子构型基本不变。
(1)甲烷结构。
①CCl4:正四面体结构。
②环己烷:6个碳原子不可能共面。
③丙烷(CH3CH2CH3):3个碳原子不可能共线。
(2)乙烯结构。
①:6个碳原子共面。
②CH2===CH—CH===CH2:4个碳原子共面,所有原子也共面。
③:4个碳原子共面,所有原子也共面,3个碳原子共线。
(3)乙炔结构。
:4个碳原子共线。
(4)苯结构。
①:7个碳原子共面。
②:8个碳原子可能共面。
③:5个碳原子共线,9个碳原子可能共面。
④:所有原子共面。
下列有机分子中,所有原子不可能处于同一平面的是( )
A.CH2===CH—CN
B.CH2===CH—CH===CH2
C.C6H5—CH===CH2
D.CH2===C(CH3)—CH===CH2
解析:根据双键和苯环的结构 ( http: / / www.21cnjy.com )特点可知,A项中所有原子处于同一平面内;B项与A项相似,是典型的共轭双键结构,且没有任何支链,所有原子都处于同一平面内;C项中苯环是平面结构,碳碳双键也是平面结构,两者结合可能处于同一平面;D项中有一个甲基,甲基是非平面结构,所有原子不可能处于同一平面。
答案:D
专题三 烃的分子式的确定
1.基本方法总结。
(1)若题目给出元素的质量分数、相对密 ( http: / / www.21cnjy.com )度等,可先求实验式,再根据相对分子质量确定分子式。也可根据相对分子质量、元素的质量分数求出分子中各元素的原子个数,再求分子式。
(2)由相对分子质量和组成通式求分子式。
(3)由烃燃烧方程式CxHy+O2xCO2+H2O计算、推理、讨论、确定分子式(差量法、讨论法、守恒法)。
(4)商除法求分子式。
借助各类烃的通式,由相对分子质量求烃的分子式可采用如下“商值通式”的判断法。
假设某烃的相对分子质量为Mr,则有:
①Mr/14能整除,可推知为烯烃或环烷烃,其商为碳原子数。
②Mr/14余2能除尽,可推知为烷烃,其商为碳原子数。
③Mr/14差2能除尽,可推知为炔烃或二烯烃,其商为碳原子数。
④Mr/14差6能除尽,可推知为苯或苯的同系物,其商为碳原子数。
(5)由实验式(CaHb)讨论分子式。
①若<,该烃必为烷烃,设分子式为CnH2n+2,=,求n即可。
②若=,需知道相对分子质量,再求分子式。
③若<<1,则该烃可能为CnH2n-2、CnH2n-6等,可直接求分子式,用CnH2n-2或CnH2n-6分别代入验证即可。
2.混合烃组成的确定方法。
(1)当烃为混合物时,一般是设平均 ( http: / / www.21cnjy.com )分子式,结合反应式和体积求出平均组成,利用平均值的含义确定各种可能混合烃的分子式。有时也利用平均式量来确定可能的组成,此时用十字交叉法计算较为简捷。
(2)两混合烃,若其平均式量小于或等于26,则该烃中必含甲烷。
(3)两混合气态烃,充分燃烧后,生 ( http: / / www.21cnjy.com )成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必含CH4;若生成水的物质的量小于2倍的原混合烃的物质的量,则必含C2H2。
(4)气体混合烃与足量的氧气充分燃烧后,若总 ( http: / / www.21cnjy.com )体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,氢原子平均数大于4;若体积缩小,氢原子平均数小于4,即必含C2H2(温度在100 ℃以上)。
(双选)25 ℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25 ℃,此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空。该烃的分子式可能为( )
A.C2H4 B.C2H6
C.C3H6 D.C3H8
解析:设该烃的分子式为CxHy,则
CxHy+O2xCO2+H2O,由题意可知,烃和O2的物质的量之和为CO2物质的量的2倍,即1+=2x,解得x=1+。当y=4时,x=2;当y=6时,x=2.5,不合题意;当y=8时,x=3。
答案:AD
