第二章海水中的重要元素——钠和氯检测题高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第二章海水中的重要元素——钠和氯检测题高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 657.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:17:38 | ||
图片预览




文档简介
第二章《海水中的重要元素——钠和氯》检测题
一、单选题
1.向滴有酚酞溶液的水中加入一块绿豆大的钠,下列实验现象描述错误的是
A.钠沉入水底 B.钠熔成小球 C.发出“嘶嘶”声音 D.溶液变红
2.对下列图片中的变化解释正确的是
A B C D
向Ba(OH)2溶液中加入硫酸铜溶液,溶液导电能力变化 CuCl2溶液导电 Na在Cl2中燃烧 将氯气通入如图装置
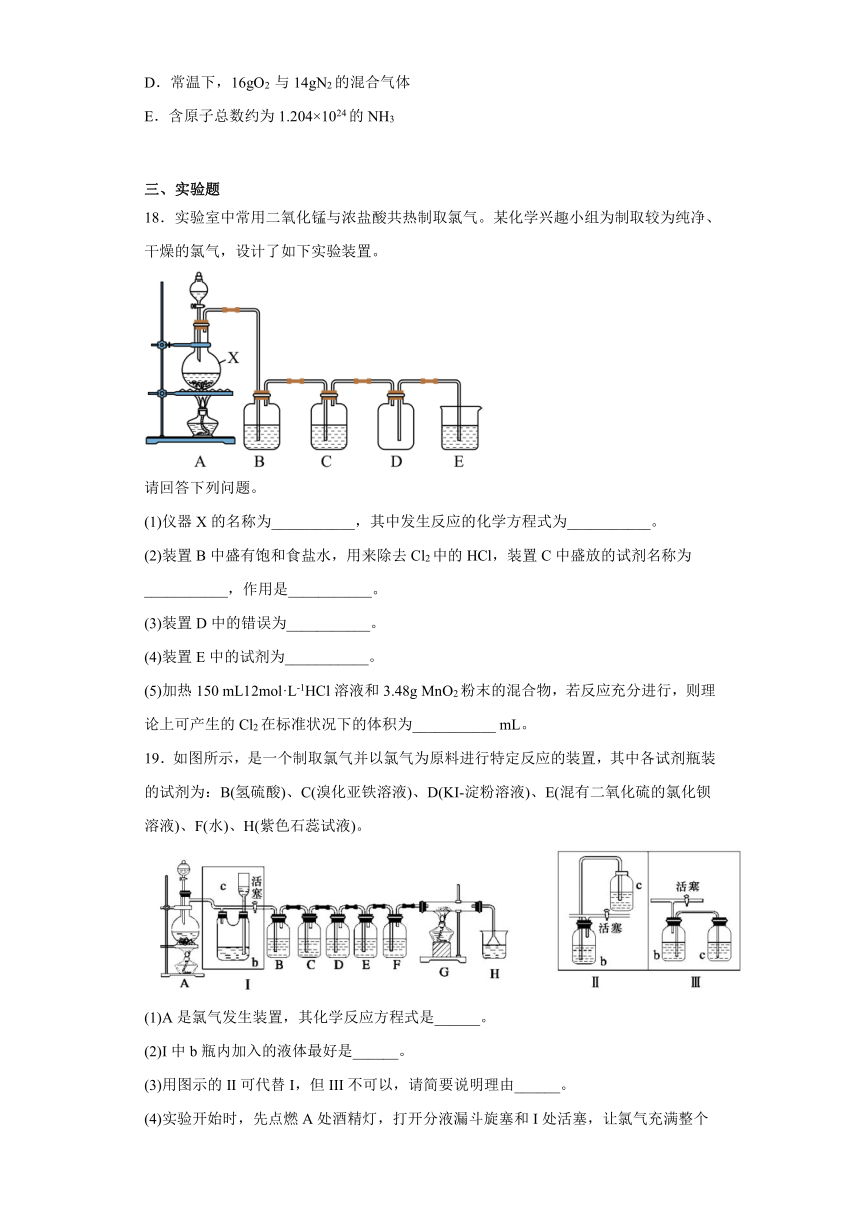
B点时没有自由移动的离子 CuCl2电离方程式: 单线桥表示电子转移过程: 证明Cl2无漂白性,HClO有漂白性
A.A B.B C.C D.D
3.VL浓度0.5mol/L的盐酸,欲使其浓度增大1倍,可采取的措施是( )
A.通入标准状况下的HCl气体11.2L
B.加入10mol/L的盐酸0.1VL,再稀释至1.5VL
C.将溶液加热浓缩到0.5VL
D.加入2mol/L的盐酸VL混合均匀
4.将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2 B.H+、ClO-、Cl- C.HCl、ClO-、Cl- D.H+、HClO、Cl2
5.利用海水资源能达到相关目标的是
A.用潮汐发电,将化学能转化为电能 B.不需富集,直接提取海水中的溴
C.用海水中的NaCl制取烧碱和纯碱 D.只需使海水中的碘升华就能得到碘单质
6.下列关于容量瓶及其使用方法的表述中不正确的是
A.容量瓶上标有温度和容积
B.容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失
C.容量瓶不能加热、溶解固体、稀释;使用完毕,应洗净、晾干
D.可以用250mL的容量瓶配制50mL溶液
7.下列关于和的叙述不正确的是
A.二者均可由金属与氧气反应得到
B.二者在常温下均为固体,但颜色不同
C.二者均能溶解于水,反应后溶液均呈碱性
D.二者都不能与氧气反应
8.向烧杯中加入水和石蜡油(密度为0.86 ~0.91g/cm3)各50mL。将一小块钠(密度为0.97g/cm3)放入烧杯中,观察到的现象可能有( )
A.钠在水层中反应并四处游动
B.钠停留在石蜡油层中不发生反应
C.钠在石蜡油的液面上反应并四处游动
D.钠在水与石蜡油的交界处反应并上下跳动
9.若表示阿伏加德罗常数的值,下列说法正确的是
A.的体积是22.4 L
B.标准状况下,中含有个水分子
C.的摩尔质量是
D.溶液中含有
10.能使石蕊试液变红,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色的是
A.SO2 B.H2S C.Cl2 D.CO
11.下列有关物质的量概念的叙述, 正确的是
A.摩尔是国际单位制中七个基本单位之一
B.物质的量是表示物质质量的物理量
C.6.021023叫做阿伏加德罗常数
D.水的摩尔质量为18g
12.用40gNaOH固体配成2L溶液,其物质的量浓度为
A.0.5 mol L-1 B.5 mol L-1
C.10 mol L-1 D.20 mol L-1
13.设为阿伏加 德罗常数的值,下列叙述正确的是
A.中含有共价键总数为
B.晶体中阳离子和阴离子总数为
C.溶液中含氧原子数为
D.适量与反应,生成标准状况下时,转移的电子数为
14.在标准状况下,如果V升氨气中由n个原子,则阿伏加德罗常数为
A.Vn/22.4 B.22.4n/V C.Vn/5.6 D.5.6n/V
15.设NA为阿伏加 德罗常数的数值。下列说法不正确的是
A.过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2NA
B.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
C.32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5NA
二、填空题
16.化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾可用作净水剂,其化学式是_______________________ ,漂白粉的有效成分是________________(填化学式)。光导纤维在强碱性条件下容易发生“断路”,试用离子方程式解释其原因_________________________________________________。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是___________________________________________________(用化学方程式表示)。
(3)驰名世界的中国瓷器通常是由粘土经高温烧结而成。粘土的主要成分为Al2Si2O5(OH)x,式中x=__________,若以氧化物形式表示粘土的组成,应写为:_______________________
(4)洁厕灵(强酸性,含盐酸)与84消毒液(含NaClO)混用可产生一种黄绿色有毒气体,请写出该反应的离子方程式 _________________________________________。
17.下列所含分子数由多到少的排列顺序是 _________
A.标准状况下33.6L H2
B.物质的量为4mol的H2
C. 20℃,45gH2O
D.常温下,16gO2 与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
三、实验题
18.实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置。
请回答下列问题。
(1)仪器X的名称为___________,其中发生反应的化学方程式为___________。
(2)装置B中盛有饱和食盐水,用来除去Cl2中的HCl,装置C中盛放的试剂名称为___________,作用是___________。
(3)装置D中的错误为___________。
(4)装置E中的试剂为___________。
(5)加热150 mL12mol·L-1HCl溶液和3.48g MnO2粉末的混合物,若反应充分进行,则理论上可产生的Cl2在标准状况下的体积为___________ mL。
19.如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(溴化亚铁溶液)、D(KI-淀粉溶液)、E(混有二氧化硫的氯化钡溶液)、F(水)、H(紫色石蕊试液)。
(1)A是氯气发生装置,其化学反应方程式是______。
(2)I中b瓶内加入的液体最好是______。
(3)用图示的II可代替I,但III不可以,请简要说明理由______。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和I处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①凭什么实验现象证明氯气已充满了整个装置______。
②下列装置中的现象是C______;D______;E______;F______。
(5)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式:______。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______。
四、计算题
20.143gNa2CO3·10H2O中所含Na+的物质的量是___________,Na+数目是___________,所含水分子数目是___________。
21.在标准状况下,88g CO2的体积为________。
参考答案:
1.A
【详解】A.由于钠的密度比水的小,故钠块应该浮在水面,A错误;
B.由于钠与水的反应放热,且钠的熔点低,故钠熔成小球,B正确;
C.由于钠与水的反应会生成氢气,从而引发空气震动,产生嘶嘶声,C正确;
D.由于钠与水的反应生成氢氧化钠,溶液显碱性,酚酞遇到碱溶液变为红色,D正确;
故本题选A。
2.D
【详解】A.向Ba(OH)2溶液中加入硫酸铜溶液发生反应,B点时导电性几乎为0,说明B点恰好反应,溶液中自由移动的离子浓度很小,故A错误;
B.电离不需要通电,CuCl2电离方程式为CuCl2=Cu2++2Cl-,故B错误;
C.单线桥表示电子转移过程,故C错误;
D.干燥的氯气不能使干燥的红布条褪色,干燥的氯气能使潮湿的红布条褪色,证明氯气没有漂白性,次氯酸有漂白性,次氯酸由氯气和水反应生成,故D正确;
选D。
3.B
【详解】A项,标准状况下的11.2LHCl气体物质的量是0.5mol,向溶液中通入0.5molHCl后,溶液体积未知,所以溶液浓度不确定会增大一倍,A错误;
B项,VL浓度为0.5mol L-1的盐酸溶液中,溶质的物质的量是0.5Vmol,10mol L-1的盐酸溶液0.1VL,溶质的物质的量是Vmol,两者混合再稀释至1.5VL,则混合后物质的量浓度为:=1 mol/L,故B正确;
C项,加热浓缩盐酸溶液会造成溶质挥发,浓度不会增大为原来的一倍,故C错误;
D项,两种不同浓度的溶液混合后体积未知,无法计算浓度,故D错误;
故选B。
【点睛】本题考查物质的量浓度的有关计算,注意:①混合溶液浓度的计算方法:C=;②密度不同的溶液混合后,溶液的体积不能直接相加。
4.D
【分析】由图中颜色变化可知,紫色石蕊试液中通入氯气,溶液变红色,表明溶液表现出酸性;溶液变为无色,表明溶液表现出强氧化性;溶液变为浅黄绿色,表明溶液中溶解了有色的物质。
【详解】氯气与水反应生成HCl、HClO,HCl具有酸性,HClO具有漂白性,则将氯气持续通入紫色石蕊试液中先变红后褪色,最后形成饱和氯水溶液显浅黄绿色为溶解的氯气分子,关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是D;
故选:D。
【点睛】氯气溶于水,发生如下反应:Cl2+H2OHCl+HClO,反应产物中,HCl显酸性,HClO表现强氧化性。
5.C
【详解】A.潮汐发电是将海水在运动时所具有的动能和势能转化为电能的过程,没有化学反应过程,A错误;
B.海水中溴离子的浓度比较小,所以提取之前应先富集,B错误;
C.电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,是氯碱工业,2NaCl+2H2O=2NaOH+Cl2↑+H2↑,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,碳酸氢钠受热分解制备纯碱,2NaHCO3=Na2CO3+CO2↑+H2O,故C正确;
D.海水中碘元素是以碘离子的形式存在的,通过氧化剂氧化可以得到碘单质,D错误;
答案选C。
6.D
【详解】A.容量瓶为玻璃仪器,瓶身标有温度、容积和刻度线,故A正确;
B.容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失,故B正确;
C.容量瓶属于精量的玻璃仪器,不能加热、溶解固体、稀释浓溶液;使用完毕,应洗净、晾干,故C正确;
D.根据“大而近”的原则,配制50mL溶液应选择50mL容量瓶,故D错误;
故选D。
7.D
【详解】A.与氧气在常温下反应生成,在加热或点燃条件下反应生成,A项正确;
B.常温下为白色固体,而为淡黄色固体,B项正确;
C.、溶于水均有生成,C项正确;
D.在加热条件下可与氧气反应生成,而不能与氧气反应,D项不正确;
故选D。
8.D
【详解】钠的密度介于水和石蜡油之间,将钠放入盛有石蜡油和水的烧杯中,钠会进入石蜡油和水的交界处和水反应,由于生成了氢气,氢气会推动钠向上游动,进入石蜡油层,反应停止,氢气逸出后,钠受到重力作用回落到石蜡油和水的交界处,重复上述过程,故钠在水与石蜡油的交界处反应并上下跳动,故选D。
9.C
【详解】A.二氧化碳气体的体积无标准状态,不能计算,A错误;
B.标准状况下,H2O不是气态,不能用气体摩尔体积计算,B错误;
C.NH3的摩尔质量是17g mol 1,C正确;
D.BaCl2溶液只有浓度而无体积,无法计算氯离子的物质的量,D错误;
答案选C。
10.A
【分析】能使石蕊试液变红说明有酸生成,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色,说明有强还原性,据此分析;
【详解】A.二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,亚硫酸具有酸性,能够使石蕊变红,二氧化硫具有还原性,能够还原高锰酸钾和溴水,使二者溶液褪色,故A正确;
B.硫化氢与酸性高锰酸钾发生氧化还原反应生成硫单质,溶液变浑浊,故B错误;
C.氯气不具有还原性,不能与酸性高锰酸钾、溴水反应,不能使二者褪色,故C错误;
D.一氧化碳不溶于水,不能是品红溶液褪色,故D错误;
答案选A。
11.A
【详解】A.摩尔是物质的量的单位,物质的量是国际单位制中七个基本物理量之一,所以摩尔是国际单位制中七个基本单位之一,A正确;
B.物质的量是表示物质所含微粒集合体数目多少的物理量,B不正确;
C.NA叫做阿伏加德罗常数,它约等于6.02×1023mol-1,C不正确;
D.摩尔质量的单位为g/mol,水的摩尔质量为18g/mol,D不正确;
故选A。
12.A
【详解】40gNaOH固体的物质的量n(NaOH)=40g÷40g/mol=1mol,则配成2L溶液时,溶液的物质的量浓度c(NaOH)=1mol÷2L=0.5mol/L,故合理选项是A。
13.A
【详解】A. 的物质的量为0.1mol,分子中含有9个碳碳单键,22个碳氢键,共含有31个共价键,所以中含有共价键总数为,选项A正确;
B.12.0g NaHSO4晶体物质的量为0.1mol,含阳离子Na+和阴离子HSO4-的总数为0.2NA,选项B错误;
C.1.0L 1.0mo1/L的Na2CO3水溶液中含有溶质碳酸钠1mol,1mol碳酸钠中含有3mol氧原子,由于溶剂水中含有氧原子,所以溶液中含有氧原子的物质的量大于3mol,溶液中含有的氧原子数大于3NA,选项C错误;
D.Na2O2与CO2反应,生成1molO2 时,转移电子2 mol,现生成4.48LO2(即0.2 mol)时,转移电子为0.4NA,选项D错误;
答案选A。
【点睛】本题考查阿伏加 德罗常数的综合应用,试题有利于培养学生的逻辑推理能力,提高学生的灵活应用能力,注意掌握好以物质的量为中心的各化学量与阿伏加 德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系。
14.D
【详解】标准状况下,VL氨气的物质的量为,每个NH3分子含有4个原子,故原子的物质的量为,故n=×NA,解得NA=,故选:D。
15.D
【详解】A.过量MnO2与浓盐酸反应产生1molCl2,Cl的化合价由-1变为0价,则转移的电子数目为2NA,A正确;
B.Na2S和Na2O2的摩尔质量相等,15.6g由Na2S和Na2O2组成的混合物的物质的量为0.2mol,含有的阴离子数目为0.2NA,B正确;
C.32.5g锌与一定量浓硫酸恰好完全反应,无论生成二氧化硫,还是氢气,均与锌的物质的量相等,则生成气体的分子数为0.5NA,C正确;
D.23gCH3CH2OH与30gCH3COOH反应,即均为0.5mol,反应为可逆反应,则生成CH3COOCH2CH3的分子数小于0.5NA,D错误;
答案为D。
【点睛】乙醇与乙酸在浓硫酸加热的条件下反应生成乙酸乙酯和水,此反应为可逆反应。
16. KAl(SO4)2·12H2O Ca(ClO)2 SiO2+2OH-==SiO32-+H2O NaHCO3+HCl==NaCl+H2O+CO2↑ 4 Al2O3·SiO2·2H2O Cl-+ClO-+2H+===H2O+Cl2↑
【详解】(1)明矾可用作净水剂,其化学式是KAl(SO4)2·12H2O,漂白粉的有效成分是Ca(ClO)2。光导纤维在强碱性条件下容易发生“断路”,原因是二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,原因是反应生成气体,会导致胃穿孔,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑。
(3)粘土的主要成分为Al2Si2O5(OH)x,根据化合价代数和为0可知式中x=3×2+4×2-2×5=4,若以氧化物形式表示粘土的组成,应写为Al2O3·SiO2·2H2O;
(4)洁厕灵(强酸性,含盐酸)与84消毒液(含NaClO)混用可产生一种黄绿色有毒气体,气体是氯气,该反应的离子方程式为Cl-+ClO-+2H+=H2O+Cl2↑。
17.BCADE
【分析】物质的量和分子数成正比,据此进行分析。
【详解】A、=1.5mol;
B、n(H2)=4mol;
C、n(H2O)=mol=2.5mol;
D、混合气体的物质的量为(+)mol=1mol;
E、设氨气的物质的量为n(NH3),n(NH3)×4×6.02×1023=1.204×1024,n(NH3)=0.5mol;
结合以上分析可知,数值比较大小是BCADE。
18. 圆底烧瓶 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 浓硫酸 除去Cl2中的水蒸气 D中左边进气导管太短,而右边出气导管太长 NaOH溶液 896
【分析】图中X为圆底烧瓶,二氧化锰与浓盐酸反应生成氯气,装置B中盛有饱和食盐水,用来除去Cl2中的HCl,装置B中盛有饱和食盐水,用来除去Cl2中的HCl,氯气密度大于空气密度,应用向上排气法收集,氯气有毒,直接排放引起空气污染,应用氢氧化钠溶液吸收过来的氯气,以此解答。
【详解】(1)图中X为圆底烧瓶;二氧化锰与浓盐酸反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;故答案为:圆底烧瓶;MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)装置B中盛有饱和食盐水,用来除去Cl2中的HCl,水蒸气受热挥发,所以氯气中还含有水蒸气,装置C的作用是除去Cl2中的水蒸气,浓硫酸具有吸水性,可以吸收氯气中的水蒸气;故答案为:浓硫酸;除去Cl2中的水蒸气;
(3)氯气密度大于空气密度,应用向上排气法收集,应长进短出;故答案为:D中左边进气导管太短,而右边出气导管太长;
(4)氯气有毒,直接排放引起空气污染,应用氢氧化钠溶液吸收过来的氯气;故答案为:NaOH溶液;
(5)二氧化锰的物质的量为=0.04mol;氯化氢的物质的量为:0.150L×12mol/L=1.8mol;根据化学反应方程式:MnO2+4HClMnCl2+Cl2↑+2H2O,可知氯化氢过量,则生成氯气的物质量依据二氧化锰计算,
标况下氯气的体积为:0.04mol×22.4L/mol=0.896L=896ml;故答案为:896。
19. MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 饱和食盐水 Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险 观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置 溶液由浅绿色变为深红棕色 溶液变蓝 生成白色沉淀 水溶液呈淡黄绿色 C+2H2O+2Cl2CO2+4HCl 生成HCl使紫色石蕊溶液变红色,剩余的氯气又与水反应生成HClO,HClO起漂白作用,使红色褪去
【分析】分析反应装置可知,A实验中制备氯气利用的是二氧化锰和浓盐酸的加热反应;I中b,氯气能溶于水,可排饱和食盐水收集,减少氯气损耗;Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,气体不能流通,存在安全隐患,故不能代替Ⅰ;氯气通过B为硫化氢溶液,发生氧化还原反应生成硫单质,C溴化亚铁溶液氧化亚铁离子和溴离子为铁离子,溶液由浅绿色变为深红棕色;通入D碘化钾淀粉溶液生成碘单质遇淀粉变蓝;通入E混有二氧化硫的氯化钡溶液,氧化二氧化硫为硫酸,生成白色沉淀,F是提供水蒸气,氯气溶解于水中,溶液呈淡黄绿色;G根据元素守恒可知,反应物除氯气和碳外,还有水,产物为二氧化碳和氯化氢,H为紫色石蕊溶液,盐酸能使紫色石蕊溶液变红,未参加反应的氯气与水反应生成盐酸和次氯酸,次氯酸起漂白作用。
【详解】(1)在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气和水,离子方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
(2)常利用排饱和食盐水收集氯气,Ⅰ中b瓶内加入的液体最好是饱和食盐水,故答案为:饱和食盐水;
(3)Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,气体不能流通,存在安全隐患,故不能代替Ⅰ,故答案为:Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险;
(4)①氯气是黄绿色气体,观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置,故答案为:观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置;
②b氯气通过B为硫化氢溶液,发生氧化还原反应生成硫单质,C溴化亚铁溶液氧化亚铁离子和溴离子为铁离子,溶液由浅绿色变为深红棕色;通入D碘化钾淀粉溶液生成碘单质遇淀粉变蓝;通入E混有二氧化硫的氯化钡溶液,氧化二氧化硫为硫酸,生成白色沉淀,F是提供水蒸气,氯气溶解于水中,溶液呈淡黄绿色;故答案为:溶液由浅绿色变为深红棕色;溶液变蓝;生成白色沉淀;水溶液呈淡黄绿色;
(5)根据元素守恒可知,反应物除氯气和碳外,还有水,产物为二氧化碳和氯化氢,反应的化学方程式为C+2H2O+2Cl2CO2+4HCl;反应物除氯气和碳外还有水,所以装置F的作用是为G提供水蒸气。故答案为:C+2H2O+2Cl2CO2+4HCl;
(6)H为紫色石蕊溶液,盐酸能使紫色石蕊溶液变红,未参加反应的氯气与水反应生成盐酸和次氯酸,次氯酸起漂白作用,故答案为:生成HCl使紫色石蕊溶液变红色,剩余的氯气又与水反应生成HClO,HClO起漂白作用,使红色褪去。
20. 1mol 6.02×1023 3.01×1024
【详解】n(Na2CO3·10H2O)==0.5mol,n(Na+)=2 n(Na2CO3·10H2O)=0.5mol×2=1mol,N(Na+)=1mol×6.02×1023mol-1=6.02×1023,N(H2O)=0.5mol×10×6.02×1023=3.01×1024。
21.44.8L
【分析】根据m=n·M计算CO2的物质的量,然后根据V=n·Vm计算气体在标准状况下的体积。
【详解】88g CO2的物质的量n==2mol,在标准状况下,Vm=22.4L/mol,则2mol CO2在标准状况下的体积V=n Vm=2mol×22.4L/mol=44.8L。
一、单选题
1.向滴有酚酞溶液的水中加入一块绿豆大的钠,下列实验现象描述错误的是
A.钠沉入水底 B.钠熔成小球 C.发出“嘶嘶”声音 D.溶液变红
2.对下列图片中的变化解释正确的是
A B C D
向Ba(OH)2溶液中加入硫酸铜溶液,溶液导电能力变化 CuCl2溶液导电 Na在Cl2中燃烧 将氯气通入如图装置
B点时没有自由移动的离子 CuCl2电离方程式: 单线桥表示电子转移过程: 证明Cl2无漂白性,HClO有漂白性
A.A B.B C.C D.D
3.VL浓度0.5mol/L的盐酸,欲使其浓度增大1倍,可采取的措施是( )
A.通入标准状况下的HCl气体11.2L
B.加入10mol/L的盐酸0.1VL,再稀释至1.5VL
C.将溶液加热浓缩到0.5VL
D.加入2mol/L的盐酸VL混合均匀
4.将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2 B.H+、ClO-、Cl- C.HCl、ClO-、Cl- D.H+、HClO、Cl2
5.利用海水资源能达到相关目标的是
A.用潮汐发电,将化学能转化为电能 B.不需富集,直接提取海水中的溴
C.用海水中的NaCl制取烧碱和纯碱 D.只需使海水中的碘升华就能得到碘单质
6.下列关于容量瓶及其使用方法的表述中不正确的是
A.容量瓶上标有温度和容积
B.容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失
C.容量瓶不能加热、溶解固体、稀释;使用完毕,应洗净、晾干
D.可以用250mL的容量瓶配制50mL溶液
7.下列关于和的叙述不正确的是
A.二者均可由金属与氧气反应得到
B.二者在常温下均为固体,但颜色不同
C.二者均能溶解于水,反应后溶液均呈碱性
D.二者都不能与氧气反应
8.向烧杯中加入水和石蜡油(密度为0.86 ~0.91g/cm3)各50mL。将一小块钠(密度为0.97g/cm3)放入烧杯中,观察到的现象可能有( )
A.钠在水层中反应并四处游动
B.钠停留在石蜡油层中不发生反应
C.钠在石蜡油的液面上反应并四处游动
D.钠在水与石蜡油的交界处反应并上下跳动
9.若表示阿伏加德罗常数的值,下列说法正确的是
A.的体积是22.4 L
B.标准状况下,中含有个水分子
C.的摩尔质量是
D.溶液中含有
10.能使石蕊试液变红,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色的是
A.SO2 B.H2S C.Cl2 D.CO
11.下列有关物质的量概念的叙述, 正确的是
A.摩尔是国际单位制中七个基本单位之一
B.物质的量是表示物质质量的物理量
C.6.021023叫做阿伏加德罗常数
D.水的摩尔质量为18g
12.用40gNaOH固体配成2L溶液,其物质的量浓度为
A.0.5 mol L-1 B.5 mol L-1
C.10 mol L-1 D.20 mol L-1
13.设为阿伏加 德罗常数的值,下列叙述正确的是
A.中含有共价键总数为
B.晶体中阳离子和阴离子总数为
C.溶液中含氧原子数为
D.适量与反应,生成标准状况下时,转移的电子数为
14.在标准状况下,如果V升氨气中由n个原子,则阿伏加德罗常数为
A.Vn/22.4 B.22.4n/V C.Vn/5.6 D.5.6n/V
15.设NA为阿伏加 德罗常数的数值。下列说法不正确的是
A.过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2NA
B.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
C.32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5NA
二、填空题
16.化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾可用作净水剂,其化学式是_______________________ ,漂白粉的有效成分是________________(填化学式)。光导纤维在强碱性条件下容易发生“断路”,试用离子方程式解释其原因_________________________________________________。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是___________________________________________________(用化学方程式表示)。
(3)驰名世界的中国瓷器通常是由粘土经高温烧结而成。粘土的主要成分为Al2Si2O5(OH)x,式中x=__________,若以氧化物形式表示粘土的组成,应写为:_______________________
(4)洁厕灵(强酸性,含盐酸)与84消毒液(含NaClO)混用可产生一种黄绿色有毒气体,请写出该反应的离子方程式 _________________________________________。
17.下列所含分子数由多到少的排列顺序是 _________
A.标准状况下33.6L H2
B.物质的量为4mol的H2
C. 20℃,45gH2O
D.常温下,16gO2 与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
三、实验题
18.实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置。
请回答下列问题。
(1)仪器X的名称为___________,其中发生反应的化学方程式为___________。
(2)装置B中盛有饱和食盐水,用来除去Cl2中的HCl,装置C中盛放的试剂名称为___________,作用是___________。
(3)装置D中的错误为___________。
(4)装置E中的试剂为___________。
(5)加热150 mL12mol·L-1HCl溶液和3.48g MnO2粉末的混合物,若反应充分进行,则理论上可产生的Cl2在标准状况下的体积为___________ mL。
19.如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(溴化亚铁溶液)、D(KI-淀粉溶液)、E(混有二氧化硫的氯化钡溶液)、F(水)、H(紫色石蕊试液)。
(1)A是氯气发生装置,其化学反应方程式是______。
(2)I中b瓶内加入的液体最好是______。
(3)用图示的II可代替I,但III不可以,请简要说明理由______。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和I处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①凭什么实验现象证明氯气已充满了整个装置______。
②下列装置中的现象是C______;D______;E______;F______。
(5)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式:______。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______。
四、计算题
20.143gNa2CO3·10H2O中所含Na+的物质的量是___________,Na+数目是___________,所含水分子数目是___________。
21.在标准状况下,88g CO2的体积为________。
参考答案:
1.A
【详解】A.由于钠的密度比水的小,故钠块应该浮在水面,A错误;
B.由于钠与水的反应放热,且钠的熔点低,故钠熔成小球,B正确;
C.由于钠与水的反应会生成氢气,从而引发空气震动,产生嘶嘶声,C正确;
D.由于钠与水的反应生成氢氧化钠,溶液显碱性,酚酞遇到碱溶液变为红色,D正确;
故本题选A。
2.D
【详解】A.向Ba(OH)2溶液中加入硫酸铜溶液发生反应,B点时导电性几乎为0,说明B点恰好反应,溶液中自由移动的离子浓度很小,故A错误;
B.电离不需要通电,CuCl2电离方程式为CuCl2=Cu2++2Cl-,故B错误;
C.单线桥表示电子转移过程,故C错误;
D.干燥的氯气不能使干燥的红布条褪色,干燥的氯气能使潮湿的红布条褪色,证明氯气没有漂白性,次氯酸有漂白性,次氯酸由氯气和水反应生成,故D正确;
选D。
3.B
【详解】A项,标准状况下的11.2LHCl气体物质的量是0.5mol,向溶液中通入0.5molHCl后,溶液体积未知,所以溶液浓度不确定会增大一倍,A错误;
B项,VL浓度为0.5mol L-1的盐酸溶液中,溶质的物质的量是0.5Vmol,10mol L-1的盐酸溶液0.1VL,溶质的物质的量是Vmol,两者混合再稀释至1.5VL,则混合后物质的量浓度为:=1 mol/L,故B正确;
C项,加热浓缩盐酸溶液会造成溶质挥发,浓度不会增大为原来的一倍,故C错误;
D项,两种不同浓度的溶液混合后体积未知,无法计算浓度,故D错误;
故选B。
【点睛】本题考查物质的量浓度的有关计算,注意:①混合溶液浓度的计算方法:C=;②密度不同的溶液混合后,溶液的体积不能直接相加。
4.D
【分析】由图中颜色变化可知,紫色石蕊试液中通入氯气,溶液变红色,表明溶液表现出酸性;溶液变为无色,表明溶液表现出强氧化性;溶液变为浅黄绿色,表明溶液中溶解了有色的物质。
【详解】氯气与水反应生成HCl、HClO,HCl具有酸性,HClO具有漂白性,则将氯气持续通入紫色石蕊试液中先变红后褪色,最后形成饱和氯水溶液显浅黄绿色为溶解的氯气分子,关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是D;
故选:D。
【点睛】氯气溶于水,发生如下反应:Cl2+H2OHCl+HClO,反应产物中,HCl显酸性,HClO表现强氧化性。
5.C
【详解】A.潮汐发电是将海水在运动时所具有的动能和势能转化为电能的过程,没有化学反应过程,A错误;
B.海水中溴离子的浓度比较小,所以提取之前应先富集,B错误;
C.电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,是氯碱工业,2NaCl+2H2O=2NaOH+Cl2↑+H2↑,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,碳酸氢钠受热分解制备纯碱,2NaHCO3=Na2CO3+CO2↑+H2O,故C正确;
D.海水中碘元素是以碘离子的形式存在的,通过氧化剂氧化可以得到碘单质,D错误;
答案选C。
6.D
【详解】A.容量瓶为玻璃仪器,瓶身标有温度、容积和刻度线,故A正确;
B.容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失,故B正确;
C.容量瓶属于精量的玻璃仪器,不能加热、溶解固体、稀释浓溶液;使用完毕,应洗净、晾干,故C正确;
D.根据“大而近”的原则,配制50mL溶液应选择50mL容量瓶,故D错误;
故选D。
7.D
【详解】A.与氧气在常温下反应生成,在加热或点燃条件下反应生成,A项正确;
B.常温下为白色固体,而为淡黄色固体,B项正确;
C.、溶于水均有生成,C项正确;
D.在加热条件下可与氧气反应生成,而不能与氧气反应,D项不正确;
故选D。
8.D
【详解】钠的密度介于水和石蜡油之间,将钠放入盛有石蜡油和水的烧杯中,钠会进入石蜡油和水的交界处和水反应,由于生成了氢气,氢气会推动钠向上游动,进入石蜡油层,反应停止,氢气逸出后,钠受到重力作用回落到石蜡油和水的交界处,重复上述过程,故钠在水与石蜡油的交界处反应并上下跳动,故选D。
9.C
【详解】A.二氧化碳气体的体积无标准状态,不能计算,A错误;
B.标准状况下,H2O不是气态,不能用气体摩尔体积计算,B错误;
C.NH3的摩尔质量是17g mol 1,C正确;
D.BaCl2溶液只有浓度而无体积,无法计算氯离子的物质的量,D错误;
答案选C。
10.A
【分析】能使石蕊试液变红说明有酸生成,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色,说明有强还原性,据此分析;
【详解】A.二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,亚硫酸具有酸性,能够使石蕊变红,二氧化硫具有还原性,能够还原高锰酸钾和溴水,使二者溶液褪色,故A正确;
B.硫化氢与酸性高锰酸钾发生氧化还原反应生成硫单质,溶液变浑浊,故B错误;
C.氯气不具有还原性,不能与酸性高锰酸钾、溴水反应,不能使二者褪色,故C错误;
D.一氧化碳不溶于水,不能是品红溶液褪色,故D错误;
答案选A。
11.A
【详解】A.摩尔是物质的量的单位,物质的量是国际单位制中七个基本物理量之一,所以摩尔是国际单位制中七个基本单位之一,A正确;
B.物质的量是表示物质所含微粒集合体数目多少的物理量,B不正确;
C.NA叫做阿伏加德罗常数,它约等于6.02×1023mol-1,C不正确;
D.摩尔质量的单位为g/mol,水的摩尔质量为18g/mol,D不正确;
故选A。
12.A
【详解】40gNaOH固体的物质的量n(NaOH)=40g÷40g/mol=1mol,则配成2L溶液时,溶液的物质的量浓度c(NaOH)=1mol÷2L=0.5mol/L,故合理选项是A。
13.A
【详解】A. 的物质的量为0.1mol,分子中含有9个碳碳单键,22个碳氢键,共含有31个共价键,所以中含有共价键总数为,选项A正确;
B.12.0g NaHSO4晶体物质的量为0.1mol,含阳离子Na+和阴离子HSO4-的总数为0.2NA,选项B错误;
C.1.0L 1.0mo1/L的Na2CO3水溶液中含有溶质碳酸钠1mol,1mol碳酸钠中含有3mol氧原子,由于溶剂水中含有氧原子,所以溶液中含有氧原子的物质的量大于3mol,溶液中含有的氧原子数大于3NA,选项C错误;
D.Na2O2与CO2反应,生成1molO2 时,转移电子2 mol,现生成4.48LO2(即0.2 mol)时,转移电子为0.4NA,选项D错误;
答案选A。
【点睛】本题考查阿伏加 德罗常数的综合应用,试题有利于培养学生的逻辑推理能力,提高学生的灵活应用能力,注意掌握好以物质的量为中心的各化学量与阿伏加 德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系。
14.D
【详解】标准状况下,VL氨气的物质的量为,每个NH3分子含有4个原子,故原子的物质的量为,故n=×NA,解得NA=,故选:D。
15.D
【详解】A.过量MnO2与浓盐酸反应产生1molCl2,Cl的化合价由-1变为0价,则转移的电子数目为2NA,A正确;
B.Na2S和Na2O2的摩尔质量相等,15.6g由Na2S和Na2O2组成的混合物的物质的量为0.2mol,含有的阴离子数目为0.2NA,B正确;
C.32.5g锌与一定量浓硫酸恰好完全反应,无论生成二氧化硫,还是氢气,均与锌的物质的量相等,则生成气体的分子数为0.5NA,C正确;
D.23gCH3CH2OH与30gCH3COOH反应,即均为0.5mol,反应为可逆反应,则生成CH3COOCH2CH3的分子数小于0.5NA,D错误;
答案为D。
【点睛】乙醇与乙酸在浓硫酸加热的条件下反应生成乙酸乙酯和水,此反应为可逆反应。
16. KAl(SO4)2·12H2O Ca(ClO)2 SiO2+2OH-==SiO32-+H2O NaHCO3+HCl==NaCl+H2O+CO2↑ 4 Al2O3·SiO2·2H2O Cl-+ClO-+2H+===H2O+Cl2↑
【详解】(1)明矾可用作净水剂,其化学式是KAl(SO4)2·12H2O,漂白粉的有效成分是Ca(ClO)2。光导纤维在强碱性条件下容易发生“断路”,原因是二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,原因是反应生成气体,会导致胃穿孔,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑。
(3)粘土的主要成分为Al2Si2O5(OH)x,根据化合价代数和为0可知式中x=3×2+4×2-2×5=4,若以氧化物形式表示粘土的组成,应写为Al2O3·SiO2·2H2O;
(4)洁厕灵(强酸性,含盐酸)与84消毒液(含NaClO)混用可产生一种黄绿色有毒气体,气体是氯气,该反应的离子方程式为Cl-+ClO-+2H+=H2O+Cl2↑。
17.BCADE
【分析】物质的量和分子数成正比,据此进行分析。
【详解】A、=1.5mol;
B、n(H2)=4mol;
C、n(H2O)=mol=2.5mol;
D、混合气体的物质的量为(+)mol=1mol;
E、设氨气的物质的量为n(NH3),n(NH3)×4×6.02×1023=1.204×1024,n(NH3)=0.5mol;
结合以上分析可知,数值比较大小是BCADE。
18. 圆底烧瓶 MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 浓硫酸 除去Cl2中的水蒸气 D中左边进气导管太短,而右边出气导管太长 NaOH溶液 896
【分析】图中X为圆底烧瓶,二氧化锰与浓盐酸反应生成氯气,装置B中盛有饱和食盐水,用来除去Cl2中的HCl,装置B中盛有饱和食盐水,用来除去Cl2中的HCl,氯气密度大于空气密度,应用向上排气法收集,氯气有毒,直接排放引起空气污染,应用氢氧化钠溶液吸收过来的氯气,以此解答。
【详解】(1)图中X为圆底烧瓶;二氧化锰与浓盐酸反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;故答案为:圆底烧瓶;MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)装置B中盛有饱和食盐水,用来除去Cl2中的HCl,水蒸气受热挥发,所以氯气中还含有水蒸气,装置C的作用是除去Cl2中的水蒸气,浓硫酸具有吸水性,可以吸收氯气中的水蒸气;故答案为:浓硫酸;除去Cl2中的水蒸气;
(3)氯气密度大于空气密度,应用向上排气法收集,应长进短出;故答案为:D中左边进气导管太短,而右边出气导管太长;
(4)氯气有毒,直接排放引起空气污染,应用氢氧化钠溶液吸收过来的氯气;故答案为:NaOH溶液;
(5)二氧化锰的物质的量为=0.04mol;氯化氢的物质的量为:0.150L×12mol/L=1.8mol;根据化学反应方程式:MnO2+4HClMnCl2+Cl2↑+2H2O,可知氯化氢过量,则生成氯气的物质量依据二氧化锰计算,
标况下氯气的体积为:0.04mol×22.4L/mol=0.896L=896ml;故答案为:896。
19. MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 饱和食盐水 Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险 观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置 溶液由浅绿色变为深红棕色 溶液变蓝 生成白色沉淀 水溶液呈淡黄绿色 C+2H2O+2Cl2CO2+4HCl 生成HCl使紫色石蕊溶液变红色,剩余的氯气又与水反应生成HClO,HClO起漂白作用,使红色褪去
【分析】分析反应装置可知,A实验中制备氯气利用的是二氧化锰和浓盐酸的加热反应;I中b,氯气能溶于水,可排饱和食盐水收集,减少氯气损耗;Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,气体不能流通,存在安全隐患,故不能代替Ⅰ;氯气通过B为硫化氢溶液,发生氧化还原反应生成硫单质,C溴化亚铁溶液氧化亚铁离子和溴离子为铁离子,溶液由浅绿色变为深红棕色;通入D碘化钾淀粉溶液生成碘单质遇淀粉变蓝;通入E混有二氧化硫的氯化钡溶液,氧化二氧化硫为硫酸,生成白色沉淀,F是提供水蒸气,氯气溶解于水中,溶液呈淡黄绿色;G根据元素守恒可知,反应物除氯气和碳外,还有水,产物为二氧化碳和氯化氢,H为紫色石蕊溶液,盐酸能使紫色石蕊溶液变红,未参加反应的氯气与水反应生成盐酸和次氯酸,次氯酸起漂白作用。
【详解】(1)在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气和水,离子方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;
(2)常利用排饱和食盐水收集氯气,Ⅰ中b瓶内加入的液体最好是饱和食盐水,故答案为:饱和食盐水;
(3)Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,气体不能流通,存在安全隐患,故不能代替Ⅰ,故答案为:Ⅱ与Ⅰ原理相同,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险;
(4)①氯气是黄绿色气体,观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置,故答案为:观察当整个装置内充满黄绿色气体时,说明氯气已充满整个装置;
②b氯气通过B为硫化氢溶液,发生氧化还原反应生成硫单质,C溴化亚铁溶液氧化亚铁离子和溴离子为铁离子,溶液由浅绿色变为深红棕色;通入D碘化钾淀粉溶液生成碘单质遇淀粉变蓝;通入E混有二氧化硫的氯化钡溶液,氧化二氧化硫为硫酸,生成白色沉淀,F是提供水蒸气,氯气溶解于水中,溶液呈淡黄绿色;故答案为:溶液由浅绿色变为深红棕色;溶液变蓝;生成白色沉淀;水溶液呈淡黄绿色;
(5)根据元素守恒可知,反应物除氯气和碳外,还有水,产物为二氧化碳和氯化氢,反应的化学方程式为C+2H2O+2Cl2CO2+4HCl;反应物除氯气和碳外还有水,所以装置F的作用是为G提供水蒸气。故答案为:C+2H2O+2Cl2CO2+4HCl;
(6)H为紫色石蕊溶液,盐酸能使紫色石蕊溶液变红,未参加反应的氯气与水反应生成盐酸和次氯酸,次氯酸起漂白作用,故答案为:生成HCl使紫色石蕊溶液变红色,剩余的氯气又与水反应生成HClO,HClO起漂白作用,使红色褪去。
20. 1mol 6.02×1023 3.01×1024
【详解】n(Na2CO3·10H2O)==0.5mol,n(Na+)=2 n(Na2CO3·10H2O)=0.5mol×2=1mol,N(Na+)=1mol×6.02×1023mol-1=6.02×1023,N(H2O)=0.5mol×10×6.02×1023=3.01×1024。
21.44.8L
【分析】根据m=n·M计算CO2的物质的量,然后根据V=n·Vm计算气体在标准状况下的体积。
【详解】88g CO2的物质的量n==2mol,在标准状况下,Vm=22.4L/mol,则2mol CO2在标准状况下的体积V=n Vm=2mol×22.4L/mol=44.8L。
